Principes, cadre d'analyse et leviers d'action à l’échelle de l’élevage pour une gestion intégrée de la santé chez les animaux monogastriques (Full text available in English)
Chapeau
Favoriser la construction de la santé des animaux tout au long de leur vie permettra de poursuivre la réduction de l’utilisation des antibiotiques et des antiparasitaires en élevage et ainsi limiter le développement de résistances à ces molécules. Nous présentons ici les leviers qui sont disponibles en élevage pour y contribuer. Pour autant, le développement de systèmes d’élevage en phase avec les demandes sociétales (respect du bien-être animal, circuits courts et locaux, accès à l’extérieur) pose de nouveaux défis pour une gestion intégrée de la santé animale.
Introduction
Maîtriser la santé animale (encadré 1) demeure fondamental en élevage et répond à un triple enjeu : optimiser le cycle de production et réduire les pertes (enjeu économique), contribuer au bien-être des animaux en en prenant soin (enjeu éthique) et limiter l'émergence de zoonoses (enjeu de santé publique). Depuis leur découverte dans les années 1930, les antibiotiques et les antiparasitaires, qui permettent respectivement de lutter contre les maladies infectieuses d'origine bactérienne et les parasites, ont été des éléments essentiels de la gestion de la santé animale en élevage. Chez les animaux de rente, ils sont utilisés pour traiter un animal infecté (traitement individuel curatif) ou pour traiter un groupe, lorsqu'une proportion du lot est malade (métaphylaxie ; Lhermie et al., 2015). En octobre 2018, le Parlement européen s'est prononcé contre l'usage préventif des antibiotiques, c'est-à-dire avant l'apparition de la maladie, en traitant l'ensemble des animaux d'un lot pour lequel la probabilité de survenue de la maladie est considérée comme élevée. En effet, leur utilisation massive en élevage (Anses, 2020) a contribué à l'apparition de résistances qui réduit leur efficacité sur les animaux et peuvent être transmises à l'humain, soit par le biais d'une proximité homme-animal, soit via la chaîne alimentaire. C'est pourquoi, la lutte contre l'antibiorésistance est devenue un défi mondial de santé publique qui s'est traduit par deux plans d'actions nationaux (EcoAntibio : 2012-2017 et 2017-2021 ; https://agriculture.gouv.fr/le-plan-ecoantibio-2-2017-2021)
Encadré 1. Santé animale, maladie et bien-être.
Bien qu'il existe de multiples définitions de la santé animale (Gunnarsson, 2006), aucune ne fait consensus pour les animaux de rente. Traditionnellement, la santé des animaux d'élevage a été définie par opposition à la maladie, étant entendue comme une altération de la santé, et étaient fréquemment évaluée par les traits dits de production (croissance, reproduction… ; Villemin, 1981). Pourtant, dès 1946, l'OMS a défini la santé de manière plus englobante comme « un état de complet bien-être physique, mental et social, [qui] ne consiste pas seulement en une absence de maladie ou d'infirmité ».
D'un point de vue physique, la maladie survient suite à un dépassement des capacités d'adaptation permettant de faire face à i) l'action d'agents pathogènes (bactéries, virus, parasites, champignons), ii) l'exposition à des substances toxiques (mycotoxines, xénobiotiques) et iii) des conditions de vie inadaptées aux besoins de l'animal (climat, ambiance, stress, milieu de vie appauvris…). En plus des maladies infectieuses strictes, les maladies dites « de production » sont des maladies multifactorielles, infectieuses ou non, qui affectent la santé et le bien-être des animaux et limitent leur productivité et celle des élevages. Elles ont également été définies comme persistant et augmentant avec l'intensification de l'élevage (Le Floc'h et al., 2021).
Ainsi, la santé animale n'est pas seulement l'absence de maladie, mais une forme de résilience en tant que capacité de l'animal à maintenir un équilibre physiologique et psycho émotionnel dans un environnement, y compris microbien (« vivre avec ses pathogènes »), impermanent et parfois éprouvant (Döring et al., 2015). La santé psychosociale des animaux reste largement à explorer avec la prise en compte des capacités cognitives et des besoins des animaux, y compris les besoins sociaux. Mais le lien entre un état de stress et la physiologie des animaux est aujourd'hui démontré (Fraser et al., 2013).
L'Anses (2018)1 défini le bien-être animal comme « l'état mental et physique positif lié à la satisfaction de ses besoins physiologiques et comportementaux, ainsi que de ses attentes. Cet état varie en fonction de la perception de la situation par l'animal ». Santé et bien-être sont donc deux notions dont les périmètres se chevauchent sans toutefois se confondre.
Au final, la santé est à la fois un état d'homéostasie qui permet la réalisation optimale des fonctions biologiques, et un processus de maintien ou de restauration de cette homéostasie face aux évolutions du milieu de vie. Elle se définit et s'évalue au niveau d'un individu ou d'un groupe d'individus.
URL : https://www.anses.fr/fr/glossaire/1535. Consulté le 08 Juin 2021.
Les espèces animales monogastriques sont particulièrement concernées par ces questions. Elles sont aujourd'hui majoritairement élevées dans des systèmes très rationnalisés où la densité animale est élevée et le milieu de vie artificialisé et leurs élevages sont de forts utilisateurs d'antibiotiques (Anses, 2020). Dans ce même numéro, Paul et al. (2021) font le point sur l'évolution de l'usage des antibiotiques dans les filières monogastriques et présentent les approches développées pour le réduire. De manière complémentaire, l'objectif du présent article est de définir les principes, de proposer un cadre d'analyse et d'identifier les leviers d'action disponibles à l'échelle de l'animal et du système d'élevage pour une gestion intégrée de la santé chez les animaux monogastriques, principalement porcs, lapins et volailles. Nous illustrons ces propos en montrant comment divers leviers peuvent être combinés pour atteindre cet objectif et terminons en montrant certaines limites des systèmes conventionnels actuels et les défis auxquels ils vont être confrontés pour poursuivre la démédicalisation.
1. Définition et principes de la gestion intégrée de la santé animale
1.1. Définition et finalité
La gestion intégrée de la santé animale est un concept relativement récent. Décrite par Dumont et al. (2013), elle peut être définie comme l'ensemble des connaissances et pratiques mobilisées par l'homme de manière coordonnée afin de construire, préserver ou retrouver la santé de l'animal ou du troupeau au sein du système d'élevage (système d'élevage : encadré 2). Si l'éleveur en est un élément central, cette coordination peut également être le fruit d'un collectif de travail impliqué de façon directe ou indirecte dans l'élevage (vétérinaire, conseiller, salarié etc. ; Manoli et al., 2021 ; Gotti et al., 2021a). La gestion intégrée de la santé animale renvoie à une approche globale de la santé, i.e. une vision multifactorielle, issue des travaux d'écopathologie (Ganiere et al., 1991). Celle-ci se base sur un suivi régulier de l'élevage et des animaux qui le composent : audit de la conduite d'élevage, analyse des pratiques à risques, mise en place de plans de gestion des risques et réajustements. Il s'agit de maintenir et/ou de restaurer l'équilibre sanitaire du troupeau.
La gestion intégrée de la santé animale a pour finalité i) de favoriser la construction de la santé des animaux afin qu'ils aient une trajectoire de vie harmonieuse et soient en état de bien-être et ii) de limiter l'apparition des maladies pour pouvoir diminuer l'utilisation des intrants médicamenteux (antimicrobiens, antihelminthiques…). Contribuer au bien-être des animaux est lié à cette finalité (encadré 1). Du point de vue des éleveurs, l'intérêt est d'optimiser le cycle de production et de réduire les pertes (économiques et vies animales) en élevage liées aux maladies. D'un point de vue plus global, il s'agit de préserver la santé humaine (zoonoses et antibiorésistances) et celle des écosystèmes (concept One Health ; Hickman et al., 2021).
La gestion intégrée de la santé animale comporte une phase initiale de conception du système d’élevage suivie de phases continues et itératives d’évaluation de la santé (individu et groupes d’animaux) et d’adaptation du fonctionnement du système d’élevage au cours du temps pour atteindre l’objectif d’avoir des animaux en bonne santé (équilibre sanitaire).
La conception porte sur les choix fondateurs qui tiennent compte des ressources disponibles et des contraintes structurelles du système d’élevage. La dimension et l’organisation des bâtiments, l’aménagement du milieu de vie des animaux et le type génétique des animaux, le choix de mécanisation et/ou d’automatisation sont des choix qui engagent sur le long terme. Ils conditionnent le travail en élevage et le fonctionnement du système biotechnique et doivent être cohérents entre eux et adaptés aux objectifs du système. L’évaluation de la santé animale est une démarche systémique (https://dicoagroecologie.fr/encyclopedie/ecopathologie/), basée sur l’observation de l’animal ou du groupe d’animaux dans son milieu de vie. Elle vise l’identification des troubles physiques, physiologiques ou comportementaux, de leurs causes et des pratiques à risque dans le but de ne pas rester centré sur le traitement des effets de la maladie (identifier la cause plutôt que traiter les symptômes). Elle peut aller jusqu’au diagnostic des maladies basé sur l’examen clinique et l’observation comportementale de l’animal ou du troupeau ou d’observation du milieu de vie. La phase d’adaptation consiste à revisiter les pratiques d’élevage (stratégies d’alimentation, rythmes de reproduction, prophylaxie, critères de réforme) afin d’obtenir des effets à court ou moyen terme, voire à modifier certains éléments de conception du système (choix de la génétique, du mode de logement…) si cela est nécessaire. Cette phase est conditionnée par les objectifs de production et de métier de l’éleveur, à relier aux conditions structurelles, économiques et techniques de l’exploitation (encadré 2).
Encadré 2. La notion de système d’élevage.
Un système d'élevage est « un ensemble d'éléments en interaction dynamique, organisé par l'homme en fonction de ses objectifs, pour faire produire (lait, viande, cuirs et peaux, travail, fumure...) et se reproduire un collectif d'animaux domestiques en valorisant et renouvelant différentes ressources » (Dedieu et al., 2008). Il est composé d'un système décisionnel (l'éleveur ou un collectif de travail) qui pilote un système biotechnique (le.s atelier.s d'élevage éventuellement associé.s à un système fourrager ou de grandes cultures). Les systèmes d'élevage de porcs, lapins et volailles actuels sont, majoritairement, qualifiés d'hors sol car l'alimentation des animaux n'est pas produite sur place. Dans cette situation, le système biotechnique piloté par l'éleveur est réduit aux ateliers de production animale, eux-mêmes spatialement réduits aux bâtiments d'élevage si les animaux n'ont pas ou peu d'accès à l'extérieur.
Un atelier d'élevage est un « ensemble d'animaux dans leur milieu d'élevage fournissant un produit de même nature et conduits de la même façon » (Menjon et d'Orgeval, 1983). Par exemple, en élevage porcin ou cunicole de type naisseur-engraisseur, on peut distinguer l‘atelier des femelles reproductrices et celui des animaux en croissance. En élevage avicole, l'atelier des poules pondeuses est distinct de celui des reproductrices de poulets de chair (multiplication), et l'atelier accouvage (incubation des œufs et éclosion des poussins) est lui-même séparé de celui de l'élevage.
L'éleveur (ou le collectif de travail) met en cohérence ses objectifs (économiques, environnementaux, sociaux, services de production et autres services) et le pilotage de son système d'élevage. Ce pilotage est réalisé à partir des informations provenant des ateliers d'élevage (par exemple performances de production ou la santé des animaux). Les pratiques d'élevage sont les révélateurs des décisions de l'éleveur. Le couplage entre système biotechnique et décisionnel se fait de façon dynamique en imbriquant différents pas de temps selon les aléas survenant dans l'environnement du système (Dedieu et Ingrand, 2010): les choix peuvent être tactiques, à l'échelle annuelle ou du cycle de production, ou plus stratégiques, à des échelles de temps plus longues entrainant des reconfigurations du système plus fortes.
Les éleveurs agissent sous l'influence de nombreux facteurs. Leur activité est ainsi régie par des contraintes économiques et la réglementation environnementale mais aussi par normes sociales produites par le monde professionnel dans lequel ils évoluent : leurs pairs éleveurs et d'autres acteurs de la filière de production (techniciens, vétérinaires, commerciaux) qui définissent ce que sont les « bonnes pratiques », par exemple de gestion de la santé animale, ou la façon d'améliorer les rendements de leurs élevages (Darré et al., 2004 ; Compagnone). Des facteurs tels que l'aversion au risque ont également une influence forte sur les pratiques de gestion de la santé et l'usage des antibiotiques (Ducrot et al., 2018 ; Paul et al., 2021).
Dans la pratique, la gestion intégrée de la santé se fonde sur la mobilisation conjointe de trois principes (P) complémentaires: prévenir l’apparition des maladies (prophylaxie et biosécurité) (Prévenir, P1), si le contact avec les éléments nuisibles ne peut pas être évité, utiliser des animaux résistants ou développer leurs capacités adaptatives afin qu’ils y soient tolérants (Résister ou tolérer, P2), et si la maladie survient malgré tout, traiter les animaux de façon raisonnée (Traiter, P3). Ces 3 principes sont développés ci-dessous.
1.2. Prévenir (Principe 1)
La prévention consiste à éviter les situations à risques, c’est-à-dire celles qui sont de nature à dépasser les capacités adaptatives de animaux (contact avec les agents pathogènes, inconfort, agression…). L’adéquation du milieu de vie et des pratiques aux besoins physiologiques, comportementaux et aux attentes des animaux est un élément essentiel de la prévention des maladies. Concrètement en élevage, divers leviers d’action sont disponibles pour atteindre cet objectif (voir section 3.1).
La prophylaxie désigne l'ensemble des moyens mis en œuvre pour surveiller l'état de santé d'un individu ou d'une population et prévenir l'apparition, la propagation ou l'aggravation des maladies. Elle comprend notamment un ensemble de pratiques de surveillance des individus et du troupeau en réalisant des analyses et en utilisant des outils de monitoring de la santé. Pour les maladies infectieuses transmissibles, la prophylaxie repose également sur l'application des principes de biosécurité i) externe, qui vise à empêcher et/ou à limiter l'introduction de nouvelles souches microbiennes, virales ou parasitaires dans l'élevage. Cela est réalisé par le contrôle sanitaire des animaux à leur entrée dans l'élevage et la mise en place de barrières physiques ou de pièges qui permettent d'empêcher la présence de vecteurs (insectes, rongeurs…) et ii) interne, constituée de mesures visant à réduire la propagation des germes à l'intérieur de l'élevage (Corrégé et Hémonic, 2018). L'isolement et/ou l'élimination des animaux infectés et potentiellement contagieux (malades ou non), l'organisation de la circulation permet de limiter la diffusion des pathogènes au sein de l'élevage, et les protocoles d'hygiène et de désinfection des bâtiments et du matériel d'élevage permettent de limiter la présence de pathogènes. Pour autant, la plupart des microorganismes présents dans l'environnement ou hébergés par les animaux (microbiote digestif, cutané…) ne sont pas pathogènes. Au contraire, les microorganismes symbiotiques ou commensaux peuvent contribuer à limiter le développement des agents pathogènes pour les animaux (Ducarmon et al., 2019). L'orientation du microbisme environnemental est une stratégie qui peut contribuer à réduire les risques d'apparition des maladies. Au-delà des risques biotiques, les risques abiotiques (qualité de l'air, poussière, température…) doivent également être maitrisés pour prévenir les problèmes de santé. Les problématiques et les moyens d'action sont néanmoins très différents suivant qu'il s'agit d'élevage confiné ou bien avec accès à l'extérieur. Le confort thermique est plus facilement maitrisable dans les élevages en bâtiments mais cela a un coût non négligeable. Les troubles respiratoires liés à la ventilation et à la qualité de l'air sont moins fréquents en élevage avec accès à l'extérieur.
1.3. Résister et/ou tolérer (Principe 2)
Schneider et Ayres (2008) ont défini la résistance comme la capacité d'un organisme à limiter la charge en agents pathogènes, et la tolérance comme la capacité d'un organisme à limiter les effets d'un pathogène sur la santé. Ces définitions ont été établies dans le cas d'infections mais peuvent également s'appliquer à d'autres conditions comme des stress thermiques (Berry et López-Martínez, 2020). Råberg et al. (2007) suggèrent que la résistance implique un processus de coévolution antagoniste entre hôte et pathogène. La tolérance résulterait plutôt des mécanismes de régulation des dommages causés par les agents pathogènes à l'hôte par le système immunitaire. La robustesse quant à elle se réfère à la capacité d'un animal à maintenir ses fonctions physiologiques et un état de santé jugé acceptable dans une grande variété d'environnements (disponibilité des ressources, conditions climatiques... ; Blanc et al., 2013).
L'utilisation de génotypes robustes (Friggens et al., 2017) ou l'utilisation de lignées sélectionnées sur la résistance aux maladies (Ducos et al., 2021) sont deux stratégies pertinentes dans le cadre de la gestion intégrée de la santé animale. La résistance génétique peut être spécifique (salmonelles chez le poulet ; Tran et al., 2012) ou plus large (Gunia et al., 2018) mais aucune espèce n'est résistante à l'ensemble des maladies. Stimuler les capacités adaptatives des animaux, vis-à-vis des agents biologiques ou des variations de l'environnement est donc une stratégie complémentaire indispensable pour préserver la santé des animaux. Lorsqu'elle est disponible, la vaccination permet de protéger les animaux contre des agents pathogènes spécifiques (myxomatose ou VHD chez le lapin, maladies de Marek, Gumboro ou bronchite infectieuse chez la volaille, circovirus de type 2 chez le porc). À la différence de l'immunité innée, la maturation de la réponse immunitaire adaptative des animaux peut également être stimulée en exposant, dès le plus jeune âge, les animaux à un environnement microbien riche (Round and Mazmanian, 2009). Cela participe à la diversité du microbiote digestif et contribue au développement du système immunitaire associé à l'intestin et notamment à la diversification du répertoire des anticorps (Lanning et al., 2000). Ce levier d'action est en interaction forte avec l'alimentation des animaux et notamment les apports de fibres alimentaires et prébiotiques qui sont les substrats permettant le développement d'un microbiote digestif bénéfique à son hôte. L'équilibre en apport d'acides aminés, des macro et micronutriments dans l'alimentation est également essentiel pour maintenir la balance d'oxydo-réduction cellulaire des animaux et éviter la génération d'un stress oxydant et d'une inflammation chronique pouvant conduire à des problèmes de santé (Durand et al., 2021). Au final, résistance et tolérance font partie des caractéristiques à piloter conjointement pour optimiser la construction de la santé des animaux.
1.4. Traiter de façon raisonnée (Principe 3)
L'application des principes précédents n'est pas toujours suffisante pour prévenir l'apparition des maladies. De ce fait, soigner les animaux en traitant les symptômes ou en combattant les agents infectieux se révèlent nécessaires. Dans le cas des maladies non infectieuses (maladies métaboliques, troubles comportementaux, toxicité des xénobiotiques), le soin des animaux visera avant tout la mise en place de conditions d'élevage propice à la guérison (alimentation adaptée, isolement ou au contraire socialisation, conditions d'ambiance, adaptation du milieu de vie…) et la prise en charge des blessures. Pour traiter les maladies infectieuses, certains élevages, notamment en système « biologique », priorisent l'utilisation des traitements alternatifs aux médicaments vétérinaires (Hellec et al., 2021), telles que la phytothérapie (Blanco-Penedo et al., 2018) ou l'aromathérapie (Zhai et al., 2018) avant de mettre en œuvre des traitements allopathiques. Ces stratégies visent à éviter l'exposition précoce à des antibiotiques qui modifie le microbiote digestif, le système nerveux entérique et le métabolisme à long terme (Foong et al., 2020). D'autres préconisent une intervention allopathique précoce pour enrayer rapidement l'aggravation de la maladie et sa propagation au sein d'un groupe. Lorsque les traitements allopathiques sont jugés indispensables, il est primordial de privilégier les médicaments spécifiques (réalisation d'antibiogramme ou de coprocultures préalablement au traitement) plutôt qu'interspécifiques (spectre large) et de respecter le protocole prescrit (dose, population cible, durée du traitement et délai d'attente) afin de réduire au strict nécessaire les quantités utilisées. Le vétérinaire reste le seul intervenant en élevage habilité à réaliser des prescriptions médicamenteuses.
Dans les élevages d’animaux monogastriques, la gestion de la santé est plus souvent réalisée à l’échelle du groupe d’animaux qu’à l’échelle de l’individu. Cela est expliqué par les modalités d’élevage collectifs (case) et par la valeur économique parfois modeste d’un individu et la taille importante du groupe à gérer. C’est pourquoi, dans ces espèces, la mobilisation des 2 premiers principes de la gestion intégrée de la santé est essentielle pour réduire le volume d’utilisation des intrants médicamenteux.
Dans la suite de cet article, nous nous focaliserons sur les pratiques mobilisables à l'échelle du système d'élevage pour la gestion intégrée de la santé des animaux. D'autres leviers sont applicables à une échelle plus englobante, telle que le territoire (ex : circulation ou échanges d'animaux ou de matériel au sein d'une zone, surveillance de la santé des animaux au sein d'un territoire ; Madderm et al., 2012) ou de la filière de production (ex : traçabilité ou pratiques cohérentes entre les maillons d'une filière, rôles différenciés de divers acteurs du conseil vétérinaire) mais ne seront pas abordées ici. En complément, Paul et al. (2021) ont analysé la mobilisation et les actions concrètes mises en œuvre sur le terrain pour contribuer à réduire l'usage des antibiotiques.
2. Un cadre conceptuel de représentation de la santé animale
2.1. Les composantes de la santé animale
Afin de pouvoir raisonner la gestion intégrée de la santé des animaux monogastriques au-delà des particularités d'espèces, le consortium RIMEL (Fortun-Lamothe et al., 2017) a proposé une représentation conceptuelle des différentes composantes de la santé animale telle que définie précédemment (encadré 1). Elle a pour objectif d'identifier les éléments structuraux contribuant à la construction de la santé d'un animal d'élevage pour l'intégrer dans les connaissances indispensables à une gestion intégrée. Cette représentation mobilise les dimensions physique et psychosociale, elles-mêmes subdivisées en 11 composantes (figure 1). La dimension physique de la santé comprend les barrières physiques qui jouent un rôle d'interface avec le milieu extérieur (téguments, muqueuses et microbiotes) et le système de défense constitué par les systèmes immunitaire, nerveux et endocrinien. La dimension psychosociale intègre les liens sociaux entre individus (mère-jeune, entre congénères), l'expression des comportements innés et le respect du rythme circadien. Ces composantes interagissent entre elles et avec les organes responsables des grandes fonctions biologiques (voir 2.2).
Figure 1. Représentation conceptuelle des composantes de la santé animale.
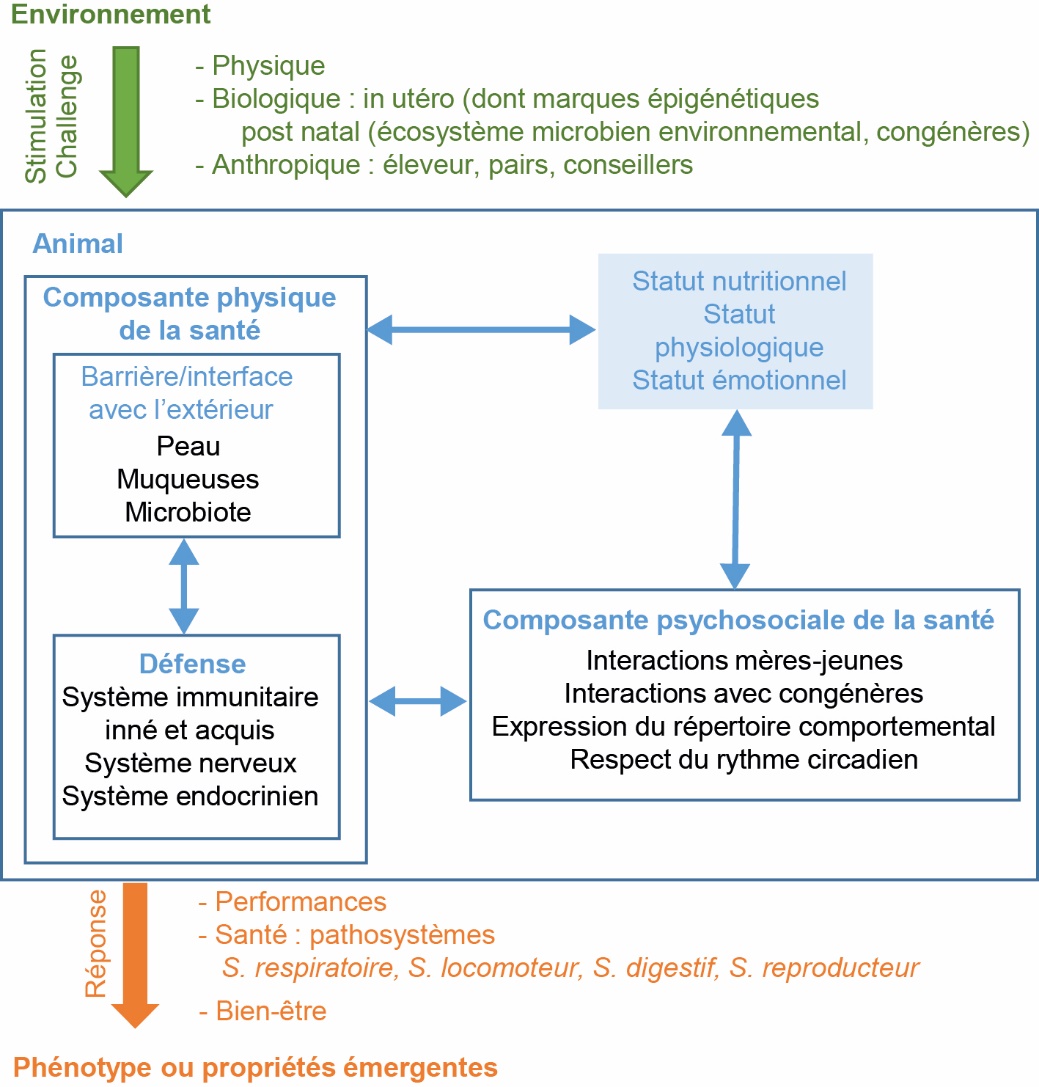
Des périodes, propres à chaque espèce, ont été identifiées comme critiques pour la santé (ex : période périnatale, sevrage) car elles correspondent à des périodes clés d'exposition des animaux à des aléas importants à un moment où le développement de certaines composantes peuvent ne pas être achevé. Par exemple, la plupart des espèces animales naissent avec un système immunitaire immature et doivent composer, dans les premières phases de la vie, avec l'immunité maternelle (via le vitellus, le placenta ou les sécrétions lactées) pour faire face à l'exposition aux multiples agresseurs biotiques et abiotiques du milieu environnant (Brambell, 1970). De même, la maturation du système immunitaire adaptatif des mammifères n'est généralement achevée qu'après le sevrage (Weström et al., 2020). Cet évènement, qui se traduit par un changement d'alimentation, une séparation d'avec la mère et parfois un changement de milieu de vie, représente un risque. Les capacités d'adaptation des jeunes animaux peuvent donc être facilement dépassées. Même en dehors de ces périodes à risque, les composantes de la santé sont influencées par des facteurs intrinsèques à l'animal (génétique, statut nutritionnel, physiologique et émotionnel) eux-mêmes en lien avec l'environnement (composantes biotique, abiotique et anthropique). Ces facteurs extrinsèques peuvent agir positivement ou négativement sur la construction de la santé et parfois de manière différente selon la dynamique de développement des composantes de la santé (voir point 2.3). La gestion intégrée de la santé vise notamment à agir sur ces facteurs selon les Principes 1 et 2 décrits précédemment et illustrés dans la section 3. L'éleveur n'est pas toujours en mesure d'agir sur certains facteurs (par exemple les aléas climatiques en élevage plein air). Dans ces situations, la gestion intégrée de la santé implique une notion de précaution (ex : fourniture d'abri) ou d'anticipation qui font partie de la gestion intégrée de la santé.
2.2. Des interactions entre composantes
Les différentes composantes de la santé animale sont en interactions permanentes. Ainsi, le système immunitaire se développe en étroite interaction avec les muqueuses de l'organisme et leurs microbiotes associés. Par exemple, la colonisation de l'intestin par le microbiote digestif est essentielle pour la mise en place des capacités digestives et la maturation du système immunitaire associé à la muqueuse intestinale (Weström et al., 2020). De même, il existe des interactions fortes entre le microbiote digestif et le système nerveux central et entérique (Foong et al., 2020) ou le système endocrinien. Ainsi, les métabolites du microbiote peuvent agir sur le système neuroendocrinien par différentes voies (Rabot, 2015) et inversement la stimulation de l'axe corticotrope observée au moment du sevrage contribue à façonner le microbiome intestinal et modifie le métabolome des porcelets (Jiang et al., 2020). Une étude récente suggère que le comportement de picage chez les poules impliquerait l'interaction entre le microbiote intestinal et le système sérotoninergique central ainsi que la modulation du système immunitaire via le système cholinergique (Falker-Gieske et al., 2020). De plus, le lien entre la composante psychosociale et le système endocrinien peut être utilisé par les pathogènes qui ont la capacité de produire ou d'utiliser des neuromédiateurs et d'influencer le comportement des animaux infectés (Lyte, 2013). Chez le porc, le transport et le stress social sont associés à la réactivation et à la propagation de l'infection par Salmonella Typhimurium par le biais de la norépinéphrine, une catécholamine impliquée dans la réponse au stress, qui activerait la croissance et l'expression des facteurs de virulence chez Salmonella (Pullinger et al., 2010). Enfin, l'interaction entre le rythme circadien et le microbiote peut se traduire par une différence d'implantation du microbiote intestinal des poussins selon le régime photopériodique des bâtiments dans lesquels ils sont élevés (Hieke et al., 2019).
2.3. Une vision dynamique de la construction de la santé
Le concept DoHAD (Developmental origin of Health And Diseases) soutient l'idée que la santé se construit selon un processus dynamique débutant lors de la gamétogenèse, inclut toute la période de développement fœtal et postnatal et s'achève autour de la maturité sexuelle (Suzuki, 2018). Ainsi, le milieu de vie des parents influence la santé de leurs descendants, au travers du développement des gamètes et de l'environnement maternel pendant la gestation et l'allaitement (Nilsson et al., 2018). Par exemple, une restriction alimentaire chez la poule a un effet sur l'immunité de ses descendants (Bowling et al., 2018). De même, en élevage conventionnel cunicole, les lapines sont simultanément gestantes et allaitantes. La superposition de la lactation et de la gestation impacte la croissance fœtale (Fortun-Lamothe et al., 1999) et le développement des lapereaux à naitre (Fortun-Lamothe et al., 2000).
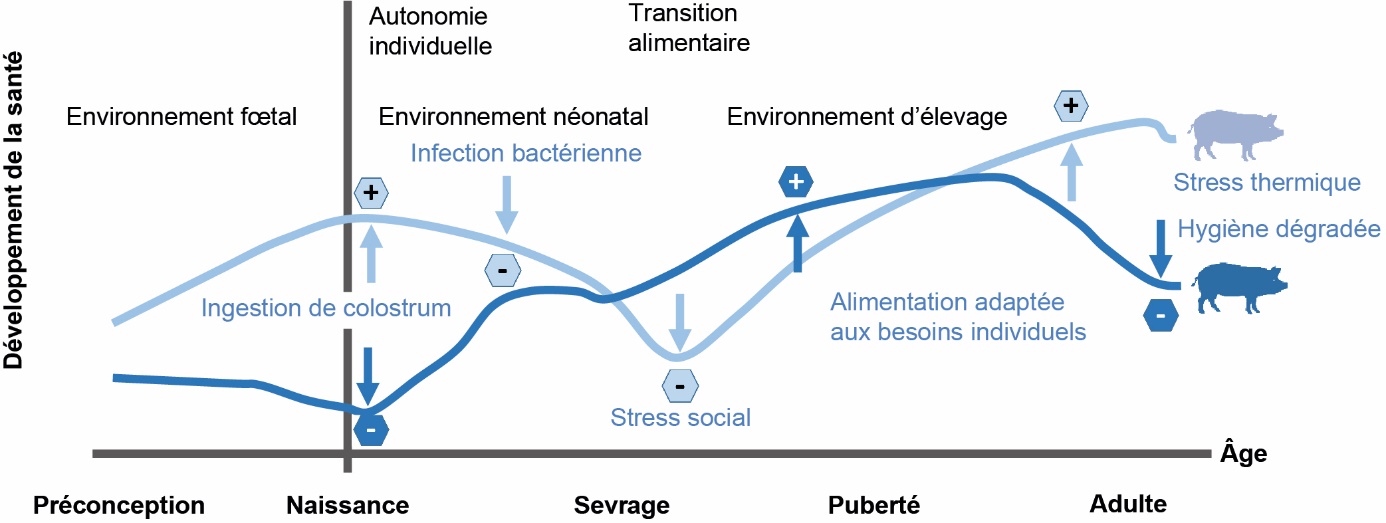
Au-delà de l'empreinte parentale, l'exposition à des situations bénéfiques ou défavorables au cours du développement varie pour chaque individu et constitue une trajectoire unique de renforcement ou bien au contraire d'affaiblissement de l'état de santé (figure 2 ; Halfon et al., 2014). Hertzman et Power (2011) proposent 3 types de modélisation des influences du parcours de vie sur la santé dont deux semblent pertinents pour les animaux d'élevage. Le modèle latent met en avant les relations entre une exposition à un moment donné de la vie et l'état de santé des années plus tard. En élevage, ce modèle s'applique à la programmation précoce des phénotypes. Par exemple, la température d'incubation des œufs modifie la tolérance à la chaleur des poulets (Loyau et al., 2015). Aussi, les heures qui suivent l'éclosion/la naissance et la phase de démarrage/d'allaitement doivent être considérées comme essentielles pour assurer la santé ultérieure (Guilloteau et al., 2019 ; Foury et al., 2020). Le modèle cumulatif stipule des effets combinatoires d'expositions multiples au cours de la vie sur la santé. C'est le cas des porcs qui développent une réponse vaccinale plus élevée lorsque leur immunité a été stimulée par les conditions d'hygiène du logement (Chatelet et al., 2018). Au final, les connaissances disponibles montrent que la construction de la santé d'un animal est un processus actif impliquant des mécanismes d'adaptation distincts à différents moments du développement qui coordonnent les interactions entre toutes les composantes de la santé d'un organisme.
Figure 2. Trajectoires individuelles de construction de la santé sous l'influence de divers évènements survenant à différentes périodes de la vie de l'animal (adapté de Halfon et al., 2014).
3. Les leviers d’action disponibles à l’échelle de l’atelier d’élevage
3.1. Divers leviers d’action mobilisables en élevage
Les différents leviers d’action disponibles se déclinent en 6 dimensions. Les 5 premières dimensions sont d’ordre biotechnique et concernent : 1-le milieu de vie (tableau 1) : sa structure et son organisation et la mise en place des règles d’hygiène et de biosécurité; 2-la gestion et la conduite de la reproduction (tableau 2): gestion et conduite ; 3-la gestion des troupeaux (tableau 3) : leur constitution et leur conduite; 4- les pratiques sur les animaux eux-mêmes (tableau 4) : le choix de leur type génétique, la gestion de leur intégrité physique et la mise en œuvre de la prophylaxie; et 5-l’alimentation (tableau 5) : composition de l’aliment, mode de présentation, mode et rythme de distribution et individualisation (alimentation de précision). Nous listons dans les Tableaux 1 à 5 des exemples concrets de pratiques utilisables sur le terrain pour améliorer la santé dans les systèmes d’élevage porcins, cunicoles et avicoles en mentionnant le principe de gestion intégrée de la santé auxquelles elles se rapportent (P1 : prévenir ou P2 : résister/tolérer). La 6ème dimension est en lien avec le système décisionnel (tableau 6) : l’acquisition des connaissances nécessaires à la mise en œuvre d’une gestion intégrée de la santé (biologie, maladie, règles de biosécurité, usage des antibiotiques…), la mobilisation des compétences autour de la santé des animaux, l’acquisition des informations sur la santé au sein de l’élevage, les équipements et l’organisation du travail et l’insertion dans les réseaux.
Tableau 1. Exemples de leviers d’action concernant le milieu de vie pour une gestion intégrée de la santé des animaux monogastriques à l’échelle de l’élevage (P : porc, L : lapin, V : volailles).
Dimensions |
Illustrations d’effet positif sur la santé |
Principes |
|---|---|---|
Structure |
Mettre à disposition des logements de surface et de hauteur suffisante |
P1 |
Enrichir le milieu de vie des animaux (matériaux à ronger, à creuser |
P1 |
|
Utiliser des sols adaptés pour limiter les blessures |
P1 |
|
Mettre à disposition des litières propres et en quantité suffisante pour limiter |
P1 |
|
Utiliser des bâtiments mobiles sur les parcours pour limiter la concentration |
P1 |
|
Permettre l’accès à un parcours extérieur herbagé pour satisfaire le besoin |
P1 |
|
Donner accès à de la lumière naturelle afin d’améliorer la fixation |
P1 |
|
Utiliser des matériaux adaptés pour éviter les blessures (P, L, V) |
P1 |
|
Limites identifiées : La surveillance et la manipulation des animaux est plus |
||
Biosécurité, |
Optimiser la ventilation, l’hygrométrie et la température d’élevage pour limiter |
P1 et P2 |
Pratiquer un nettoyage et/ou un vide sanitaire régulier pour éliminer ou limiter |
P1 et P2 |
|
Lutter contre les nuisibles pour éviter la transmission de pathogènes (P, L, V) |
P1 |
|
Disposer un pédiluve à l’entrée du site d’élevage, des bâtiments ou des salles |
P1 |
|
Utiliser des chaussures et vêtements spécifiques pour chaque bâtiment |
P1 |
|
Disposer de lavabos et douches à l’entrée sur le site pour éviter l’introduction |
||
Réaliser des purges et des désinfections régulières des conduites d’eau |
P1 et P2 |
|
Limites identifiées : Perte de l’effet barrière et impact environnemental |
a Principes de gestion intégrée de la santé animale (voir section 1). P1 : éviter les situations à risques et le contact avec les éléments nuisibles ; P2 : résister aux éléments nuisibles ou les tolérer
Tableau 2. Exemples de leviers d’action concernant la reproduction pour une gestion intégrée de la santé des animaux monogastriques à l’échelle de l’élevage (P : porc, L : lapin, V : volailles).
Dimension |
Exemples |
Principes |
|---|---|---|
Gestion |
Sevrer les jeunes à un âge tardif (> 30 j) pour limiter les troubles digestifs post |
P1 |
Utiliser un rythme de reproduction semi-intensif (IAb 11 j après la MBb) ou extensif |
P1 |
|
Éviter un âge des femelles à la première mise à la reproduction trop précoce pour |
P1 |
|
Conduite |
Pratiquer l’insémination artificielle plutôt que la saillie naturelle pour limiter |
P1 |
Réaliser un allaitement contrôlé pour limiter les blessures sur les jeunes lapereaux |
P1 |
|
Pratiquer l’auto-renouvèlement des reproducteurs ou disposer d’un troupeau |
P1 |
|
Limites identifiées : En conduite en bande tous les animaux sont potentiellement |
a Principes de gestion intégrée de la santé animale (voir section 1). P1 : éviter les situations à risques et le contact avec les éléments nuisibles ; P2 : résister aux éléments nuisibles ou les tolérer
bIA : insémination artificielle ; MB : mise bas
Dimension |
Exemples |
Principes |
|---|---|---|
Constitution |
Gérer (observer, éviter, avancer, retarder, etc.) les entrées et les sorties d’animaux |
P1 |
Éviter le passage d’animaux reproducteurs entre bandes pour limiter la transmission |
P1 |
|
Conduire les animaux en bande pour utiliser des stratégies alimentaires |
P1 |
|
Conduire les animaux en bande pour réaliser un nettoyage et un vide sanitaire entre |
P1 et P2 |
|
Limites identifiées : La conduite en bande unique peut imposer des périodes |
||
Conduite |
Homogénéiser la taille des portées à la naissance par adoption entre portées |
P1 |
Limiter les densités animales pour limiter les agressions et les blessures et favoriser |
P1 |
|
Management de l’incubation et du démarrage, éclosion en bâtiment (V) |
P1 |
a Principes de gestion intégrée de la santé animale (voir section 1). P1 : éviter les situations à risques et le contact avec les éléments nuisibles ; P2 : résister aux éléments nuisibles ou les tolérer
Tableau 3. Exemples de leviers d’action concernant la gestion des troupeaux pour une gestion intégrée de la santé des animaux monogastriques à l’échelle de l’élevage (P : porc, L : lapin, V : volailles).
Tableau 4. Exemples de leviers d’action concernant les animaux eux-mêmes pour une gestion intégrée de la santé des animaux monogastriques à l’échelle de l’élevage (P : porc, L : lapin, V : volailles).
Dimension |
Exemples |
Principes |
|---|---|---|
Race ou type |
Sélectionner sur la résistance aux maladies (P, L, V) |
P2 |
Choisir des animaux provenant de lignées plus robustes (P, L, V) |
P2 |
|
Utiliser des souches à croissance intermédiaire à lente pour limiter les troubles |
P1 et P2 |
|
Intégrité |
Proscrire l’épointage du bec pour limiter la douleur (V) |
P1 |
Proscrire la caudectomie pour limiter la douleur et les infections (P) |
P1 |
|
Castrer les animaux pour limiter la monte et l’agressivité entre les animaux (P) |
P1 |
|
Remarques ou limites identifiées : L’anesthésie est obligatoire à compter |
||
Prophylaxie : |
Vacciner contre la myxomatose et la VHD (L), contre les maladies de Marek, |
P1 et P2 |
Utiliser huiles essentielles contre les troubles digestifs ou respiratoires (P, L), |
P1 |
|
Utiliser des extraits de plantes pour soutenir la fonction hépatique autour |
P1 |
|
Remarques ou limites identifiées : attention au suivi des contaminations |
a Principes de gestion intégrée de la santé animale (voir section 1). P1 : éviter les situations à risques et le contact avec les éléments nuisibles ; P2 : résister aux éléments nuisibles ou les tolérer
Tableau 5. Exemples de leviers d’action concernant l’alimentation pour une gestion intégrée de la santé des animaux monogastriques à l’échelle de l’élevage (P : porc, L : lapin, V : volailles).
Dimension |
Exemples |
Principes mobilisésa |
|---|---|---|
Composition |
Utiliser des aliments formulés pour répondre aux besoins nutritionnels des animaux |
P1 |
Utiliser des aliments à faible concentration en protéines très digestibles et équilibrés |
P1 |
|
Incorporer des matières premières riches en phénol (sainfoin) pour lutter/prévenir |
P1 et P2 |
|
Supplémenter les aliments en pré- et prob-biotiques, huiles essentiellesb, |
P1 et P2 |
|
Supplémenter les aliments en micronutriments (vitamines, minéraux) et antioxydants |
P1 |
|
Limites identifiées : L’aliment peut aussi être source de contaminants (mycotoxines, |
||
Mode de |
Augmenter la taille des particules pour limiter le risque d’ulcère (P) |
P1 |
Distribuer du fourrage sec à tiges longues pour limiter les troubles digestifs (L) |
P1 |
|
Mettre à disposition du fourrages secs sous forme de bloc compressé pour permettre |
P1 |
|
Mettre à disposition des plantes ou extraits en accès libre en bâtiment |
P1 |
|
Mode et rythme |
Pratiquer une restriction alimentaire post sevrage pour réduire la fréquence |
P1 et P2 |
Pratique l’alimentation pré-sevrage pour stimuler le développement des capacités |
P1 et P2 |
|
Passer d’une alimentation libre à des repas pour préparer les animaux au gavage (V) |
P1 |
|
Limites identifiées : Risque d’amaigrissement des femelles : 1 seule mangeoire pour |
||
Individualisation |
Réaliser une alimentation de précision pour limiter l’engraissement excessif |
P1 |
a Principes de gestion intégrée de la santé animale (voir section 1). P1 : éviter les situations à risques et le contact avec les éléments nuisibles ; P2 : résister aux éléments nuisibles ou les tolérer
b l’aliment est un support d’administration de substances ayant un intérêt pour la santé des animaux
Tableau 6. Les leviers d'actions concernant le pilotage de l'élevage pour une gestion intégrée de la santé des animaux monogastriques (Gotti et al., 2021b).
Leviers d’action |
|---|
Connaissances |
Se former pour mieux connaître la biologie, la physiologie et le comportement des animaux |
Savoir identifier le bon/mauvais état de santé physique et de bien-être des animaux |
Mieux connaître les maladies des animaux que l’on élève |
Mieux connaître les règles de biosécurité et de prophylaxie |
Se former à la manipulation des animaux que l’on élève |
Se former à l’usage raisonné des antibiotiques |
Se former à la détection des maladies et des risques sanitaires en élevage |
Mobiliser les compétences d’un collectif de travail et d’experts |
Faire des bilans de santé réguliers avec des professionnels extérieurs |
Développer les connaissances de tout le collectif de travail |
Avoir une stratégie de répartition des rôles au sein du collectif de travail |
Communiquer au sein du collectif de travail sur la santé animale |
Acquérir des informations sur la santé de ses animaux et de ses troupeaux |
Organiser un système d’information et d’enregistrement des données sur la santé de son troupeau |
Observer et s’outiller en complément de l’observation |
S’équiper pour enregistrer les performances en élevage et détecter l’apparition de troubles |
Équipements et organisation du travail |
Optimiser l’organisation du travail en élevage pour maximiser le respect des règles de biosécurité |
S’équiper ou optimiser l’organisation du travail en élevage pour disposer de temps pour l’observation sanitaire des |
Insertion dans les réseaux |
Accompagnement à la prise de risque lors de changements entrainant la reconfiguration du système |
Accompagnement économique pour les pertes de productivité entrainées par la désintensification de l’élevage |
3.2. Temporalité d’action des leviers utilisables en élevage
Les leviers d'action utilisés pour une gestion intégrée de la santé animale peuvent agir selon différentes temporalités (figure 3). Ainsi, on peut distinguer les leviers d'action ayant : i) un effet direct : par exemple, l'alimentation protéique des porcelets autour du sevrage a un effet sur leur santé digestive (Liao, 2021) ; ii) un effet différé : par exemple, la température d'incubation des œufs modifie la tolérance à la chaleur des poulets en fin d'élevage (Loyau et al., 2015), la consommation d'huiles essentielles pendant le démarrage des poussins modifie durablement le transcriptome des poulets selon leur vécu postnatal (Foury et al., 2020) ; iii) un effet transmis entre génération : par exemple, chez le canard, la supplémentation maternelle en acides gras omega-3 peut limiter le phénomène de picage chez les descendants (Baéza et al., 2017).
Figure 3. Temporalité d’action des leviers agissant sur la santé animale : effets directs (A), effets différés (B), effets transmis entre générations (C).
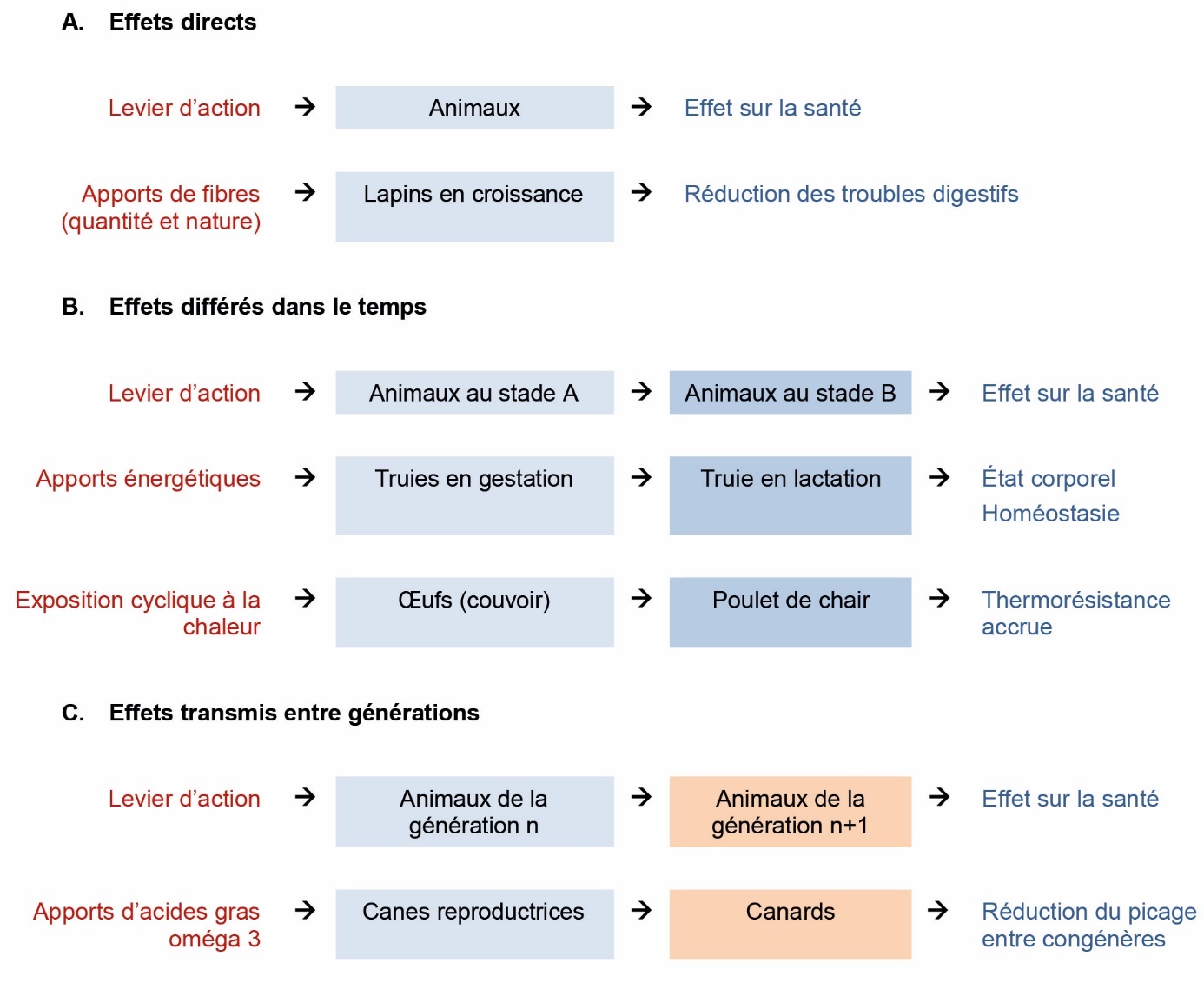
Intégrer cette temporalité d'action encourage à avoir une vision à long terme de la gestion de la santé animale et à mieux raisonner le lien entre les différents ateliers de production animale au sein du système d'élevage, ou entre les maillons d'une filière de production (élevage des reproducteurs vs des animaux en croissance ; pratiques au couvoir vs en élevage). Par exemple, en élevage de volailles, les travaux de Van der Waaij et al. (2011) préconisent des conditions d'élevage similaires pour les reproducteurs et leurs descendants. Cependant, aujourd'hui dans la filière poulet de chair, les reproducteurs sont soumis à une restriction alimentaire afin de maximiser leurs performances reproduction alors que leurs descendants sont nourris à volonté pour maximiser leur croissance. Cette restriction alimentaire des reproducteurs affecte leur bien-être et leur statut immunitaire (Decuypere et al., 2010) et limite la croissance de leurs descendants (Bowling et al., 2018).
4. Intégration des leviers et santé des animaux monogastriques dans les systèmes actuels
Les leviers d’actions disponibles à l’échelle du système d’élevage pour une gestion intégrée de la santé chez les monogastriques ne doivent être raisonnés séparément mais conjointement dans une logique de « gestion intégrée de la santé ». Cette notion d’intégration signifie que c’est la coordination des pratiques qui contribue à construire la santé des animaux afin de tendre vers et/ou maintenir l’état d’équilibre. Il s’agit notamment des actions coordonnées de prévention et de développement des capacités d’adaptation des animaux. De manière réciproque, les troubles de la santé, lorsqu’ils ne sont pas spécifiques d’un agent pathogène comme dans le cas des maladies dites de production, sont généralement d’origine multifactorielle et surviennent parce que divers éléments se conjuguent et entrainent un dépassement des capacités d’adaptation des animaux (tableau 7). Dans les sections ci-dessous, nous allons décrire comment est raisonnée cette cohérence dans les élevages porcins, avicoles et cunicoles. Il est important de noter qu’une partie des leviers, mobilisés pour leurs effets bénéfiques sur la santé des animaux contribuent aussi à maintenir la productivité.
Tableau 7. Multi factorialité des diverses catégories de leviers d’action dans l’émergence de troubles de la santé fréquents en élevage de lapin (A), de porc (B) ou de volaille (C et D). Les 5 catégories de leviers sont décrites dans les Tableaux 1 à 5.
Leviers d’action ayant une influence : milieu de vie ; reproduction ; gestion des troupeaux ; |
|
|---|---|
Troubles |
Âge au sevrage ; Type génétique des animaux ; Apports de fibres ; Maitrise des ingérés ; |
Troubles |
Confort (sol et température); Âge au sevrage ; composition de l’aliment dont apports |
C. Myopathies |
Surface disponible ; densité animale ; âge à l’abattage ; type génétique des animaux ; |
D. Picage chez la |
Absence d’enrichissement ; litière ; densité animale ; type génétique des animaux ; |
aDes interactions entre leviers sont possibles. Par exemple, dans le cas des myopathies chez le poulet de chair, l'âge d'abattage et de la densité énergétique de l'aliment n'ont un poids majeur que dans les génétiques à croissance rapide.
4.1. La gestion du sevrage en élevage porcin
Dans le modèle d'élevage conventionnel les porcelets sont sevrés entre 3 et 4 semaines d'âge alors que leurs systèmes digestif et immunitaire sont encore immatures. La séparation d'avec la mère, le passage d'une alimentation lactée à un aliment solide d'origine végétale et un nouvel environnement microbien et social concourent à déstabiliser la physiologie des porcelets et peuvent conduire à des troubles digestifs. Divers leviers peuvent être mobilisés pour limiter l'apparition et/ou la gravité de ces troubles: i) un sevrage plus tardif ; ii) une alimentation des porcelets sous la mère (creep-feeding) ; iii) un accès adapté à l'eau de boisson pendant la lactation ; iv) l'utilisation d'un aliment dit de post-sevrage appétant, à faible teneur en protéines et équilibrés en acides aminés indispensables, contenant des sources de protéines et d'énergie hautement digestibles, des fibres pour le développement du microbiote intestinal, et des additifs (probiotiques, acides organiques, argile…) permettant de préserver la physiologie digestive et le microbiote (Pluske et al., 2018), v) un logement visant à favoriser le confort thermique des animaux, leur nettoyage et désinfection ainsi que la régulation de la circulation du personnel au sein de l'élevage afin de limiter la présence et la transmission de bactéries pathogènes (Corrégé et Hémonic, 2018) et vi) la vaccination des porcelets contre les principaux pathogènes responsables des diarrhées infectieuses (Melkebeek et al., 2013).
4.2. Cohérence entre les ateliers d’un élevage cunicole
En élevage cunicole, divers leviers sont actionnés de manière cohérente sur les 4 catégories d’animaux présents (lapereaux allaités, lapins en croissance, femelles futures reproductrices, femelles en reproduction) pour réaliser une gestion intégrée de la santé animale.
Après la mise bas, les éleveurs pratiquent l'homogénéisation de la taille des portées par élimination des lapereaux ayant un poids vif inférieur à 35 g et adoption croisée en vue de l'égalisation de la taille entre portées. Cette stratégie réduit la compétition entre les lapereaux pour l'accès au lait et améliore leur thermorégulation (accès à la chaleur du nid) ce qui favorise leur survie et leur développement (Rödel et al., 2008). Elle favorise aussi le maintien d'une condition corporelle adéquate des mères (maigreur si les portées sont surnuméraires) ce qui améliore leur longévité. La stratégie d'alimentation des femelles cible la gestion du compromis entre la satisfaction des besoins nutritionnels importants pendant la lactation (aliment riche en énergie au début de la lactation) et la maturation du système digestif des lapereaux (aliment riche en fibres et pauvre en amidon avant leur sevrage ; Gidenne et Fortun-Lamothe, 2002). Par ailleurs, les jeunes femelles et les reproductrices sont vaccinées contre la maladie hémorragique virale (VHD) et la myxomatose. Après le sevrage, l'utilisation de régimes riches en fibres (Gidenne et al., 2010) et la maitrise des ingérés (Gidenne et al., 2012) permettent de limiter l'apparition des troubles digestifs non spécifiques chez les lapins en croissance. Ces stratégies sont conjuguées à des protocoles stricts d'hygiène à l'entrée dans les salles d'élevage et de nettoyages complets réguliers permis par la conduite en bande. Par ailleurs, cette conduite en bande permet de conserver les portées après le sevrage ce qui limite le stress social. Les femelles futures reproductrices arrivent généralement à l'âge de 1-2 jour dans les élevages commerciaux et sont adoptées par les femelles reproductrices déjà en place ce qui leur permet de s'adapter aux conditions d'élevage (conditions d'ambiance, environnement microbien, etc.) et de limiter l'entrée d'agents pathogènes dans l'élevage, notamment Pasteurella multocida, agent responsable de la principale maladie respiratoire chez les femelles (Coudert et al., 1999). De plus, pour gérer la pasteurellose chez les lapines reproductrices (formes respiratoire et abcédative), la maîtrise des conditions d'ambiance (température, hygrométrie et vitesse de l'air) est conjuguée à l'élimination des animaux présentant des signes cliniques pour prévenir la diffusion au sein de l'atelier élevage. La sélection d'animaux résistants à cet agent pathogène très problématique est possible (Shrestha et al., 2020), mais reste à déployer dans les centres de sélection.
4.3. Diversification des systèmes en filière avicole
En élevage avicole, les maladies infectieuses sont gérées à l'aide de plusieurs leviers complémentaires. La vaccination permet de protéger les animaux contre la bronchite infectieuse et les maladies de Marek et Gumboro (poulet de chair), les salmonelles ou les coccidies (poules pondeuses). Le respect strict des règles de biosécurité (désinfection et le contrôle des entrées et sorties sur l'élevage), l'élimination des animaux malades et la réalisation de vides sanitaires entre chaque bande visent à limiter l'entrée et la concentration en pathogènes dans l'élevage. Par ailleurs, le contrôle fin des conditions de ventilation, d'hygrométrie et de température en bâtiment et le maintien des litière propres et sèches, permet de limiter les atteintes aux aplombs des animaux (pododermatites, brûlures des tarses…). Soutenir les capacités d'adaptation des animaux aux variations environnementales potentiellement stressantes et impactantes sur la santé est un levier fortement investi en élevage avicole. Cela se traduit par l'utilisation d'une alimentation à forte valeur santé (micro-nutriments, antioxydants, probiotiques, extraits de plantes, huiles essentielles…) tout en maintenant les performances de production attendues des volailles (Bhagwat et al., 2021 ; Abd El-Hack et al., 2020).
Toutefois, l'élevage en claustration totale, dans des logements de petite taille et sans enrichissement du milieu de vie avec des densités animales fortes (allant jusqu'à 42 kg/m2 en élevage de poulet de chair), a été fortement critiqué pour ses effets négatifs sur le bien-être des animaux. Ainsi, l'enrichissement du milieu de vie semble un élément essentiel pour limiter les agressions entre les animaux (Rodenburg et al., 2013). Toutefois, ce levier n'est pas toujours suffisant pour maintenir les animaux en bonne santé et ce mode d'élevage est aujourd'hui critiqué pour sa trop faible prise en compte du bien-être animal. C'est pourquoi, des systèmes alternatifs se sont fortement développés récemment. L'accès des animaux à un parcours permet une diversification du répertoire comportemental (composante psycho-sociale de la santé) et l'utilisation de souches à faible vitesse de croissance permet une réduction des troubles musculo-squelettiques, dont les myopathies musculaires. Dans ces systèmes alternatifs, les animaux sont plus exposés aux parasites et aux pathogènes transmis par la faune sauvage. Aussi, l'utilisation de bâtiments mobiles pourrait limiter la pression sanitaire sur le parcours ainsi que l'implantation de plantes à vertus médicinales. La phytothérapie et l'aromathérapie pourraient y être plus généralement mise en œuvre par l'aliment ou l'eau de boisson (Travel et al., 2021) ou en permettant l'automédication grâce à des plantes cultivées sur le parcours ou mises à disposition en bâtiment (Guilloteau et al., 2019 ; Foury et al., 2020). Pour autant, l'accès aux parcours peut aussi être momentanément interdit pour protéger la santé des animaux, par exemple pendant les épisodes d'influenza aviaire. Enfin, des systèmes intermédiaires, qui donnent accès aux animaux à des jardins d'hiver ou des espaces grillagés ou recouverts de filets, se développent pour que les animaux bénéficient d'un espace leur permettant d'exprimer leurs besoins comportementaux et sociaux et tout en étant peu exposés à des pathogènes environnementaux et ou des contaminations par la faune sauvage.
5. Limites des stratégies actuelles et pistes d’évolution
D’une manière générale, au cours des dernières décennies, la gestion de la santé dans les élevages d’animaux monogastriques a surtout privilégié la prise en compte de la santé physique des animaux et la recherche d’une augmentation de la productivité animale pour des raisons économiques. Certains choix techniques sont aujourd’hui à l’origine de problèmes de santé et de bien-être (ex : logement en cages grillagées et pododermatites chez les lapins reproductrices). De plus, ces choix ont été souvent fait au détriment de la santé psychosociale des animaux (ex : densité animale élevée, milieu de vie inapproprié et picage chez les poules pondeuses ; limitation du répertoire comportemental des lapins élevés en cages ; stéréotypies chez les truies en fin de gestation - boxées).
Nous présentons ci-dessous des limites identifiées pour les élevages porcins, cunicoles et avicoles ainsi que des stratégies techniques d'évolution possibles. Ces verrous ne sont pas seulement techniques mais également humains et sociaux (besoin de sécurité, accompagnement à de nouvelles pratiques, tension sur le temps de travail), économiques (investissements, rentabilité de l'élevage) ou encore scientifiques (sélection génétique, diagnostic précoce des troubles ; Ducrot et al., 2018 ; Piel et al., 2019).
En élevage porcin conventionnel, la gestion de la santé des porcelets au moment du sevrage sans avoir recours à l'utilisation d'antibiotique reste difficile dans certains élevages. Une des raisons invoquées est l'âge au sevrage. La Directive européenne 2008/120/CE établissant les normes minimales relatives à la protection des porcs recommande « qu'aucun porcelet ne doit être séparé de sa mère avant d'avoir atteint l'âge de 28 jours ». Pourtant, la pratique du sevrage à 21 jours s'est fortement développée en France ces dernières années, dans le but de favoriser un retour rapide en chaleur et maximiser la productivité numérique des truies. Des études réalisées sur le continent Américain (Faccin et al., 2020) et Européen (Postma et al., 2017) ont montré qu'un âge de sevrage plus tardif (35 jours) était associé à un moindre usage d'antibiotiques, probablement du fait de la plus grande maturité des porcelets. D'autres pistes de progrès sont évoquées mais elles représentent des défis scientifiques et techniques importants. Il s'agit par exemple de i) la mise à disposition de fourrage, qui outre le fait d'habituer les animaux à la prise d'aliment solide et de favoriser le développement du microbiote, leur fournit un substrat de jeu, ii) la conduite des truies favorisant leur bien-être durant la gestation ou encore iii) le mélange des porcelets avant le sevrage afin de promouvoir les interactions sociales entre les animaux de différentes portées (Blavi et al., 2021).
La perspective de retarder l'âge au sevrage est soutenue par l'exemple des élevages sous cahier des charges agriculture biologique, qui impose un sevrage après 42 jours pour se rapprocher des conditions naturelles (90-120 jours), et qui fournit des pistes intéressantes pour améliorer la santé des porcelets sans altérer le retour à la reproduction des truie (Ferchaud et al., données non publiées). L'utilisation d'animaux résistants aux principaux pathogènes impliqués dans les diarrhées, résilients vis-à-vis du sevrage, efficients du point de vue alimentaire et adaptés à des conditions d'élevages variées et variables serait une avancée majeure (Le Roy et al., 2019). Sa mise en pratique dépend d'avancées scientifiques et d'évolution dans les programmes de sélection. Enfin, les conditions de logement actuelles des truies en lactation et des porcelets ne sont pas toujours propices à l'expression des comportements naturels, à des relations mère-jeunes positives, à l'apprentissage alimentaire ni aux interactions entre porcelets de différentes portées. L'évolution des modes de logement est souvent freinée par le coût économique des investissements (Bertin et Ramonet, 2016).
En élevage cunicole, le logement des animaux en cages à fond grillagé est justifié pour gérer l’infestation parasitaire en limitant le contact des animaux avec leurs déjections. Pour autant, les coccidies sont présentes dans la majorité des élevages conventionnels (protozoaires du genre Eimeria ; Licois, 2009) et l’utilisation d’anticoccidiens, majoritairement la robénidine®, reste très fréquente et pose aujourd’hui des problèmes de résistance. Parallèlement, ce mode de logement entraine des pododermatites chez les femelles reproductrices (prévalence : 5 à 15 % ; Rosell et De la Fuente, 2013) malgré la présence de fond « repose pattes » en plastique. C’est pourquoi, l’élevage cunicole s’oriente vers un élevage des lapins en croissance en parcs, souvent avec sol en caillebotis, et en grand groupes (plus 20 animaux). Cette évolution entraine des interactions sociales plus importantes (à minima en termes de nombre de congénères) qui peuvent modifier les dynamiques de dissémination des pathogènes, notamment si la densité animale n’est pas réduite (aujourd’hui limité à 45 kg/m² à 70 j d'âge pour les lapins en croissance). Il conviendra donc de revisiter 1) l’aménagement du milieu de vie pour ne pas perturber ces interactions sociales par rapport aux attentes de l’animal et 2) la mise en œuvre des protocoles d’hygiène et de prophylaxie pour limiter la dissémination des agents pathogènes au sein de ces grands groupes. Cette évolution du logement pourrait empêcher le maintien de logements polyvalents entre lapines reproductrices et lapins croissance et entrainer l’abandon de la gestion sanitaire du type tout-plein tout-vide pratiquée aujourd’hui dans la moitié des élevages français. Ce mode de conduite présente pourtant l’avantage de permettre un nettoyage/désinfection du bâtiment et des logements entre chaque lot d’animaux. Pour autant, cette stratégie peut aussi favoriser la dissémination des agents pathogènes car les animaux qui sont présents dans ce milieu confiné, sont tous au même stade physiologique, et donc exposées à un même niveau de risque. De plus, le microbiote étant impliqué dans la maturation du système immunitaire, une hygiène excessive pourrait au final être préjudiciable pour la santé des animaux. La gestion de la mixité des animaux de différents stades physiologiques, pratique antérieure à la conduite en bande, mériterait d’être à nouveau étudiée dans les nouveaux modes de productions.
Concernant les femelles reproductrices, on peut déplorer la persistance des problèmes respiratoires malgré les moyens déployés pour la maitrise des conditions d'ambiance. L'utilisation d'animaux résistants semble la voie la plus prometteuse, mais reste à mettre en œuvre. Par ailleurs, il a été montré qu'une réduction du rythme de reproduction (par exemple, une insémination toutes les 7 semaines au lieu de 6 semaines actuellement) permet de réduire la sollicitation nutritionnelle des femelles donc d'améliorer leur état corporel et d'augmenter leur longévité. Néanmoins, cette pratique est aujourd'hui peu répandue et souvent limitée à la période estivale pour des raisons économiques (réduction de la productivité annuelle). Enfin, le logement individuel des femelles est contesté par les défenseurs de la cause animale car le lapin est un animal grégaire qui vit en colonie. Le logement en groupe de femelles familières (sœurs biologiques ou de lait) est possible jusqu'à la première mise bas (Laclef et al., 2021). Mais ensuite les lapines se bagarrent et se blessent gravement en cherchant à instaurer une hiérarchie sociale. Un système permettant un compromis satisfaisant entre performances de reproduction, santé et expression des comportements reste à trouver.
En élevage avicole, une limitation majeure à la santé et au bien-être des animaux est le cloisonnement entre maillons de la chaîne de production (élevage des reproducteurs, couvoir, élevage des poulets ou poulettes, atelier ponte pour les systèmes de production d'œufs, transport vers l'abattoir). Ce cloisonnement entraine des phases d'attente et de transport, notamment entre le couvoir et l'élevage, qui représentent une source de stress considérable pour les animaux. Après avoir été manipulés (tri et sexage), ceux-ci sont maintenus sans eau et sans aliment pendant plusieurs heures, et possiblement soumis pendant le transport à des variations de température, d'hygrométrie, ainsi que des vibrations voire des aléas de conduite. Il a été montré que cette situation affecte durablement leurs santés physique (hypothermie post natale, métabolisme modifié, retard de croissance ; Guilloteau et al., 2019, Beauclercq et al., 2019 ; Foury et al., 2020) et psychosociale (Hollemans et al., 2018) ultérieures. L'accès à l'eau et à l'aliment dès l'éclosion est nécessaire et peut être réalisé par la fourniture d'aliment hydraté à l'éclosoir et/ou dans les boîtes de transport ou encore par une éclosion à la ferme (Van de Ven et al., 2011 ; Leterrier, données non publiées). De plus, implanter précocement un microbiote de barrière naturel (provenant ou en présence de poules adultes) ou sélectionné (microflore intestinale, probiotiques), limite le portage de salmonelles et d'autres enteropathogènes (Schneitz, 2005), faciliterait la maturation du système immunitaire et aiderait à limiter le taux de mortalité qui reste élevé en phase de démarrage.
L'utilisation de souches génétiques très spécialisées dont le métabolisme est orienté majoritairement vers les fonctions biologiques visées (croissance ou production d'œuf) affecte aussi la santé des animaux. Ainsi, les poules pondeuses qui sont sélectionnées pour la production d'œufs ont un squelette fragilisé au-delà de 70 semaines. Cette situation est exacerbée par les conditions d'élevage qui n'offre pas aux animaux des possibilités de mouvement suffisantes. D'autre part, les poulets qui sont sélectionnés pour une croissance rapide et une forte efficacité alimentaire présentent des rendements en muscle pectoral supérieurs à 20 %, mais ont des capacités de thermorégulation affaiblies (Piestun et al., 2008) et sont sujets à des myopathies musculaires fréquentes telles que les stries blanches, dureté anormale du filet (wooden breast) ou muscle spaghetti (Praud et al., 2020). L'utilisation de souches à vitesse de croissance plus lente ou de souches mixtes à la fois destinées à la production d'œuf et de viande pourrait permettre d'éviter l'apparition de ces troubles.
Enfin, le picage des plumes chez les poules pondeuses reste un problème de santé important qui est aujourd'hui géré par des atteintes à l'intégrité physique (épointage du bec). Ces pratiques pourraient être évitées par l'alimentation (aliments riches en fibres) l'enrichissement du milieu vie (litière adaptée, pierre ou blocs à picorer), la sélection génétique (contrôle des niveaux de peur et de stress) et la réduction des densités en élevage (Rodenburg et al., 2013 ; Zepp et al., 2018).
6. Des défis à venir
Aujourd’hui, une partie des consommateurs européens souhaitent une meilleure prise en compte du bien-être animal. Ils ne soutiennent pas les pratiques qui portent atteintes à l’intégrité physique des animaux (castration sans anesthésie, meulage des dents, épointage du bec…), désapprouvent l’élevage des animaux en cage et souhaitent que les animaux puisent se mouvoir librement. Suite à une initiative citoyenne «End the Cage Age » (https://www.endthecageage.eu/), la commission Européenne s’est engagée à proposer un cadre d’évolution législative qui impose l’arrêt de l’élevage en cage pour la fin de 2023 et évoque une entrée en vigueur en 2027. Les ateliers d’élevage d’animaux monogastriques sont particulièrement visés par cette initiative : animaux reproducteurs et lapins en croissance, etc.
Les systèmes d'élevage d'animaux monogastriques vont ainsi devoir évoluer fortement et la gestion de la santé devra être repensée en conséquence. Il est à noter qu'une meilleure prise en compte du bien-être peut parfois avoir des conséquences négatives sur la santé des animaux dans ces systèmes d'élevage. C'est le cas des lapines (Szendrö et al., 2019) ou des truies élevées en groupe. Leur donner la possibilité d'avoir des interactions sociales avec des congénères se traduit par des combats fréquents et un taux de blessure très élevée jusqu'à l'établissement de la hiérarchie sociale. Des travaux ont également montré que si les animaux qui ont un accès à l'extérieur semblent moins affectés par des maladies respiratoires que les animaux élevés en bâtiments fermés, ils sont plus concernés par des problématiques de mortalité périnatale et de reproduction que dans les systèmes en claustration (Delsart et al., 2020). Cela est expliqué notamment par une faible maîtrise des conditions lumineuses et thermiques. La gestion de la santé dans ces systèmes devra donc intégrer une aide à l'adaptabilité des animaux aux variations climatiques (brise vent, abris, refuge ; Skuce et al., 2013), une capacité à prévoir ces variations (accès à des données ou alertes climatiques) pour anticiper la mise à l'abri des animaux et l'aménagement des surfaces extérieures (arbres, haies coup vents, barrières de protection…). De plus, les animaux ayant un accès à l'extérieur sont plus exposés aux parasites et à d'autres agents infectieux non rencontrés en bâtiment (via l'aliment, le sol, les contacts avec de la faune sauvage). Un agencement du milieu de vie ou des pratiques innovantes devront être réfléchis pour gérer ces nouveaux enjeux. Les expériences acquises dans les élevages qui respectent le cahier des charges de l'agriculture biologique pourront être précieuses (Vaarst et Alroe, 2012). Quoi qu'il en soit, ces évolutions conduiront probablement à une augmentation de la diversité des systèmes d'élevage, à une augmentation de la variabilité de l'état de santé et de bien-être entre les animaux. De tels changements nécessiteront sans doute des modes de suivi et de gestion du comportement et de paramètres de santé plus individualisés qui pourraient bénéficier d'applications numériques (Grosse-Kleimann et al., 2021).
Conclusion
La santé animale, à la fois état et processus, se construit tout au long de la vie des animaux. Dans les élevage porcins, cunicoles et avicoles, de nombreux leviers d’actions sont disponibles et doivent être mobilisés de manière cohérente dans une logique de gestion intégrée de la santé des animaux. Ils ont principalement pour objectif de favoriser la construction de la santé, de prévenir le contact avec les éléments biotiques et abiotiques nuisibles et de soutenir les capacités adaptatives des animaux afin qu’ils soient tolérants à ces éléments. Pourtant, dans ces élevages, l’utilisation d’antibiotiques et anti-parasitaires reste aujourd’hui non négligeable. Cette situation est expliquée notamment par des choix techniques ou organisationnels, motivés par des raisons économiques, qui aboutissent à des situations qui dépassent les capacités d’adaptation des animaux. C’est le cas en élevage porcin où l’immaturité digestive et immunitaire des porcelets au moment du sevrage est un facteur de risque de troubles digestifs. C’est aussi le cas en élevage avicole, où les conditions de transport des animaux entre le couvoir et l’élevage génèrent un stress qui affecte de manière durable la santé des animaux et où la sélection génétique orientée sur la fonction de production affaiblie les capacités d’adaptation des animaux.
Certains de ces choix, notamment ceux concernant le logement, sont aujourd'hui critiqués par la société car jugés non respectueux du bien-être animal. Ces critiques font émerger de nouveaux systèmes d'élevage qui posent des questions inédites concernant la santé des animaux. L'accès des animaux à l'extérieur modifie également les frontières et la dynamique des flux (matière, xénobiotique, agent pathogène, individu, gènes) entre l'élevage et la faune sauvage d'une part, et les milieux à forte anthropisation d'autre part. En référence au concept « One Health », la plus grande proximité des vecteurs, des réservoirs d'agents pathogènes ou des xénobiotiques présents dans les milieux sauvages ou anthropisés avec les élevages, représente un défi pour la gestion intégrée de la santé (Esther et al., 2016).
Remerciements
Les auteurs remercient Catherine Schouler pour sa contribution aux réflexions et sa relecture, Cécile Berri sa contribution expertes relative aux troubles musculaires aviaires et Agnès Girard pour son aide dans les recherches bibliographiques.
Références
- Abd El-Hack M.E., El-Saadony M.T., Shafi M.E., Qattan S.Y.A., Batiha G.E., Khafaga A.F., Abdel-Moneim A.E., Alagawany M., 2020. Probiotics in poultry feed: A comprehensive review. J. Anim. Physiol. Anim. Nutr., 104, 1835-1850. doi:10.1111/jpn.13454
- Anses, 2020. Suivi des ventes de médicaments vétérinaires contenant des antibiotiques en France en 2019, Anses-ANMV, France, novembre 2020, rapport, 97p. https://www.anses.fr/system/files/ANMV-Ra-Antibiotiques2019.pdf consulté le 04/08/2021
- Baéza E., Chartrin P., Bordeau T., Lessire M., Thoby J.M., Gigaud V., Blanchet M., Alinier A., Leterrier C., 2017. Effet des acides gras Polyinsaturés N-3 apportés au cours du développement embryonnaire et des périodes de démarrage et croissance sur le comportement de picage des canards de Barbarie. Journées Rech. Avicoles, 12, 423-427.
- Beauclercq S., Lefèvre A., Montigny F., Collin A., Tesseraud S., Leterrier C., Emond P., Guilloteau L.A., 2019. A multiplatform metabolomic approach to characterize fecal signatures of negative postnatal events in chicks: a pilot study. J. Anim. Sci., Biotechnol., 9, 21. doi:10.1186/s40104-019-0335-8
- Berry R., López-Martínez G., 2020. A dose of experimental hormesis: When mild stress protects and improves animal performance. Comparative Biochemistry and Physiology Part A: Mol. Integr. Physiol., 242, 110658. doi:10.1016/j.cbpa.2020.110658
- Bertin C., Ramonet Y., 2016. État des lieux des bâtiments d’élevage de porcs en Bretagne chez les naisseurs-engraisseurs en 2015. Journées Rech. Porcine, 48, 1-7.
- Bhagwat V.G., Balamurugan E., Rangesh P., 2021.Cocktail of chelated minerals and phytogenic feed additives in the poultry industry: A review. Vet. World., 4, 364-371. doi:10.14202/vetworld
- Blanc F., Ollion E., Puillet L., Delaby L., Ingrand S., Tichit M., Friggens N., 2013. Évaluation quantitative de la robustesse des animaux et du troupeau : quels principes retenir ? Renc. Rech. Rum., Paris, France, 20, 365-272.
- Blanco-Penedo I., Fernández González C., Tamminen L.M., Sundrum A., Emanuelson U., 2018. Priorities and Future Actions for an Effective Use of Phytotherapy in Livestock—Outputs from an Expert Workshop. Front. Vet. Sci., 22. doi:10.3389/fvets.2017.00248
- Blavi L., Solà-Oriol D., Llonch P., López-Vergé S., Martín-Orúe S.M., Pérez J.F., 2021. Management and feeding strategies in early life to increase piglet performance and welfare around weaning: A Review. Animals, 11, 302. doi:10.3390/ani11020302
- Bowling M., Forder R., Hughes R.J., Weaver S., Hynd P.I., 2018. Effect of restricted feed intake in broiler breeder hens on their stress levels and the growth and immunology of their offspring. Transl. Anim. Sci., 2, 263-271. doi:10.1093/tas/txy064
- Brambell F.W.R., 1970. The Transmission of Passive Immunity from Mother to Young. Amsterdam: North-Holland Research Monographs Frontiers of Biol. 18, 385p.
- Chatelet A., Gondret F., Merlot E., Gilbert H., Friggens N.C., Le Floc'h N., 2018. Impact of hygiene of housing conditions on performance and health of two pig genetic lines divergent for residual feed intake. Animal, 12, 350-358. doi:10.1017/S1751731117001379
- Corrégé I., Hémonic A., 2018. La biosécurité en élevage de porcs : enjeux, observance, freins et perspectives de progrès. Journées Rech. Porcine, 50, 177-188.
- Coudert P., Rideaud P., Kpodékon M., 1999. Le point sur les pasteurelloses du lapin : Rapport de synthèse. Journées Rech. Cunicole, 8, 3-12 Paris, France,
- Darré J.P., Mathieu A., Lasseur J., 2004. Le sens des pratiques. Conceptions d'agriculteurs et 43 modèles d'agronomes. Inra Éditions, Coll. Science Update, 320p.
- Decuypere E., Bruggeman V., Everaert N., Li Y., BoonenR., De Tavernier J., Janssens S., Buys N., 2010. The broiler breeder paradox: ethical, genetic and physiological perspectives, and suggestions for solutions. Br. Poultry Sci., 51, 569-579. doi:10.1080/00071668.2010.519121
- Dedieu B., Ingrand S., 2010. Incertitude et adaptation : cadres théoriques et application à l’analyse de la dynamique des systèmes d’élevage. INRA Prod. Anim., 23, 81-90. doi:10.20870/productions-animales.2010.23.1.3289
- Dedieu B., Faverdin P., Dourmad J.Y., Gibon A., 2008. Système d'élevage, un concept pour raisonner les transformations de l'élevage. INRA Prod. Anim., 21, 45-58. doi:10.20870/productions-animales.2008.21.1.3374
- Delsart M., Pol F., Dufour B., Rose, N., Fablet C., 2020. Pig Farming in Alternative Systems: Strengths and Challenges in Terms of Animal Welfare, Biosecurity, Animal Health and Pork Safety. Agriculture-Basel, 10, article 261. doi:10.3390/agriculture10070261
- Döring T.F., Vieweger A., Pautasso, M., Vaarst, M., Finkh, M.R., Wolfe, M.S., 2015. Resilience as a universal criterion of health. J. Sci. Food Agric., 95, 455-465. doi:10.1002/jsfa.6539
- Ducarmon Q.R., Zwittink R.D., Hornung B.V.H., van Schaik W., Young V.B., Kuijper E.J., 2019. Gut microbiota and colonization resistance against bacterial enteric infection. Microbiol. Mol. Biol. Rev., 83, e00007-19. doi:10.1128/MMBR.00007-19
- Ducos A., Douhard F., Savietto D., Sautier M., Fillon V., Gunia M., Rupp R., Moreno-Romieux C., Mignion-Grasteau S., Gilbert, H., Fortun-Lamothe L., 2021. Contributions de la génétique animale à la transition agroécologique des systèmes d’élevage. INRAE Prod. Anim., 34, 79-96. doi:10.20870/productions-animales.2021.34.2.4773
- Ducrot C., Adam C., Beaugrand F., Belloc C., Bluhm J., Chauvin C., Cholton M., Collineau L., Faisnel J., Fortané N., Hellec F., Hémonic A., Jloy N., Lhermie G., Magne M.A., Paul M., Poizat A., Raboisson D., Rousset N., 2018. Apport de la sociologie à l’étude de la réduction d’usage des antibiotiques. INRAE Prod. Anim., 31, 307-324. doi:10.20870/productions-animales.2018.31.4.2395
- Dumont B., Fortun-Lamothe L., Jouven M., Thomas M., Tichit M., 2013. Prospects from agroecology and industrial ecology for animal production in the 21st century. Animal, 7, 1028-1043. doi:10.1017/S1751731112002418
- Durand D., Collin A., Merlot E., Baéza E., Guilloteau L.A., Le Floc’h N., Thomas A., Fontagné-Dicharry S., Gondret F., 2021. Review: Implication of redox imbalance in animal health and performance at critical periods, insights from different farm species. Animal, 16, 100543. doi:10.1016/j.animal.2022.100543
- Faccin J.E.G., Tokach M.D., Allerson M.W., Woodworth J.C., DeRouchey J.M., Dritz S.S., Bortolozzo F.P., Goodband R.D., 2020. Relationship between weaning age and antibiotic usage on pig growth performance and mortality. J. Anim. Sci., 98, 1-10. doi:10.1093/jas/skaa363
- Falker-Gieske C., Mott A., Preu S., Franzenburg S0, Bessei W0, Bennewitz J., Tetens J., 2020. Analysis of the brain transcriptome in lines of laying hens divergently selected for feather pecking. B.M.C. Genomics, 21, 595. doi:10.1186/s12864-020-07002-1
- Foong J.P.P, Hung L.Y., Poon S., Savidge T.C., Bornstein J.C., 2020. Early life interaction between the microbiota and the enteric nervous system. Am. J. Phys. Gastro. Liver Phys., 319, G541-G548. doi:10.1152/ajpgi.00288.2020
- Fortun-Lamothe L., Prunier A., Bolet G., Lebas F., 1999. Physiological mechanisms involved in the effects of concurrent pregnancy and lactation on fœtal growth and survival in the rabbit. Livest. Prod. Sci., 60, 229-241. doi:10.1016/S0301-6226(99)00096-2
- Fortun-Lamothe L., Collet P.S., Read A.K., Mariana J.C., 2000. Effects of concurrent pregnancy and lactation in rabbit does on the growth of follicles in daughters’ ovaries. World Rabbit Sci. 8, 33-40. doi:10.4995/wrs.2000.415
- Fortun-Lamothe L., Combes S., Balmisse E., Collin A., Ferchaud S., Germain K., Pinard-Van Der Laan M. H., Schouler C., Le Floc'h N., 2017. A conceptual framework to promote integrated health management in monogastrics. In Proc. 68th EAAP Ann. Meet., Tallinn, Estonia, 28 August to 1 September, p245.
- Foury A., Collin A., Helbling J.C., Leterrier C., Moisan M.P., Guilloteau L.A., 2020. Spontaneous intake of essential oils after a negative postnatal experience has long-term effects on blood transcriptome in chickens. Sci. Rep. 10, 20702. doi:10.1038/s41598-020-77732-5
- Fraser D., Duncan I.J., Edwards S.A., Grandin T., Gregory N.G., Guyonnet V., Hemsworth P.H., Huertas S.M., Huzzey J.M., Mellor D.J., Mench J.A., Spinka M., Whay H.R., 2013. General Principles for the welfare of animals in production systems: the underlying science and its application. Vet. J., 198, 19-27. https://doi/10.1016/j.tvjl.2013.06.028
- Friggens N.C., Blanc F., Berry D.P., Puillet L., 2017. Review: Deciphering animal robustness. A synthesis to facilitate its use in livestock breeding and management. Animal, 11, 2237-2251. doi:10.1017/S175173111700088X
- Ganiere J.P., Andre-Fontaine G., Drouin P., Faye B., Madec F., Rosnere G., Fourichon C., Wang B. Tillon J.P., 1991. L’écopathologie : une méthode d’approche de la santé en élevage. INRA Prod. Anim., 4, 247-256. doi:10.20870/productions-animales.1991.4.3.4339
- Gidenne T., Fortun-Lamothe L., 2002. Feeding strategy for young rabbits around weaning: A review of digestive capacity and nutritional needs. Anim. Sci., 75, 169-184. doi:10.1017/S1357729800052942
- Gidenne T., García J., Lebas F., Licois D., 2010. Nutrition and feeding strategy: interactions with pathology. In book: Nutrition of the Rabbit. de Blas C., Wiseman J. (Eds). 10, 179-199 CAB International. doi:10.1079/9781845936693.0179
- Gotti V., Manoli C., Dedieu B., 2021a. Work organization and integrated management of animal health: What connections do they have? ISWA, 2nd Intern. Symp. Work in Agriculture: Thinking the future of work in agriculture, Clermont-Ferrand, France.
- Gotti V., Manoli C., Dedieu B., 2021b. Exploration of health practices in dairy farms: links with the farming system and work organization. 72nd Ann. Meeting Eur. Fed. Anim. Sci., (EAAP), Davos, Switzerland.
- Grosse-Kleimann J., Plate H., Meyer H., Gerhardy H., Heucke C.E., Kreienbrock L., 2021. Health monitoring of finishing pigs by secondary data use - a longitudinal analysis. Porcine Health Manag., 7. doi:10.1186/s40813-021-00197-z
- Guilloteau L.A., Collin A., Koch A., Leterrier C., 2019. Spontaneous Intake and Long-Term Effects of Essential Oils After a Negative Postnatal Experience in Chicks. Front. Vet. Sci., 6. doi:10.3389/fvets.2019.00072
- Gunia M., David I., Hurtaud J., Maupin M., Gilbert H., Garreau H., 2018. Genetic parameters for resistance to non-specific diseases and production traits measured in challenging and selection environments; Application to a Rabbit Case. Front. Genet., 9, 467. doi:10.3389/fgene.2018.00467
- Gunnarsson S., 2006. "The conceptualisation of health and disease in veterinary medicine." Acta Vet. Scand., 48, 20. doi:10.1186/1751-0147-48-20
- Halfon N., Larson K., Lu M., Tullis E., Russ E., 2014. Lifecourse Health Development: Past, Present and Future. Matern. Child Health J., 18, 344-365. doi:10.1007/s10995-013-1346-2
- Hellec F., Manoli C., De Joybert M., 2021. Alternative medicines on the farm: a study of dairy farmers' experiences in France. Front Vet. Sci., 8, n° 563957. doi:10.3389/fvets.2021.563957
- Hertzman C., Power C., 2011. Health and human development: Understandings from life-course research. Dev. Neuropsy., 719-744. doi:10.1080/87565641.2003.9651917
- Hickman R.A., Leangapichart T., LunhaK., Jiwakanon J., AngkititrakulS., MagnussonU., SundeM., JarhultJ.D., 2021. Exploring the Antibiotic Resistance Burden in Livestock, Livestock Handlers and Their Non-Livestock Handling Contacts: A One Health Perspective. Front. Microbiol., 12, n°651461. doi:10.3389/fmicb.2021.651461
- Hieke A.C., Hubert S.M., Athrey G., 2019. Circadian disruption and divergent microbiota acquisition under extended photoperiod regimens in chicken. PeerJ., 7, e6592. doi:10.7717/peerj.6592.
- Hollemans M.S., de Vries S., Lammers A., Clouard C., 2018. Effects of early nutrition and transport of 1-day-old chickens on production performance and fear response. Poultry Sci., 97, 2534-2542. doi:10.3382/ps/pey106
- Jiang X., Lu N., Zhao H., Yuan H., Xia D., Lei H., 2020. The Microbiome-Metabolome Response in the Colon of Piglets Under the Status of Weaning Stress. Front Microbiol., 11, 2055. doi:10.3389/fmicb.2020.02055
- Laclef E., Savietto D., Warin L., Huang Y., Bonnemère J.M., Combes S., Gidenne T., Fortun-Lamothe L., 2021. Part-time group housing if familiar rabbit does in large partitioned space: effects on performance and behaviour. 12th World Rabbit Congress, 3-5 November 2021, Nantes, France.
- Lanning D., Sethupathi P., Rhee K.J., Zhai S.K., Knight K.L., 2000. Intestinal microflora and diversification of the rabbit antibody repertoire. J. Immunol., 165, 2012-2019. doi:10.4049/jimmunol.165.4.2012
- Le Floc'h N., Boudon A., Montagne A., Gilbert H., Gondret F., Lebret B., Lefaucheur L., Louveau I., Merlot E., Père M.C., Meunier-Salaün M.C., Prunier A., Quesnel H., 2021. Santé et bien-être de la truie gestante et du porc en croissance. INRAE Prod. Anim., 34, 211-226. doi:10.20870/productions-animales.2021.34.3.4879
- Le Roy P., Ducos A., Phocas F., 2019. Quelles performances pour les animaux de demain ? Objectifs et méthodes de sélection. INRAE Prod. Anim., 32, 233-246. doi:10.20870/productions-animales.2019.32.2.2466
- Lhermie G., Raboisson D., Krebs S., Dupraz P., 2015. Facteurs déterminants et leviers de réduction de l’usage des antibiotiques en productions animales. Economie rurale, 348. doi:10.4000/economierurale
- Liao S.F., 2021. Maintain or Improve Piglet Gut Health around Weanling: The Fundamental Effects of Dietary Amino Acids. Animals, 11, 1110. doi:10.3390/ani11041110
- Licois D., 2009. Pathologie d’origine bactérienne et parasitaire chez le lapin : apports de la dernière décennie. In Journées Rech. Cunicole, 13, 17-18 novembre 2009. Le Mans, France
- Loyau T., Bedrani L., Berri C., Métayer-Coustard S., Praud C., Coustham V., Mignon-Grasteau S., Duclos M.J., Tesseraud S., Rideau N., Hennequet-Antier C., Everaert N., Yahav S., Collin A., 2015. Cyclic variations in incubation conditions induce adaptive responses to later heat exposure in chickens: a review. Animal, 9, 76-85. doi:10.1017/S1751731114001931
- Lyte M., 2013. Microbial endocrinology in the microbiome-gut-brain axis: how bacterial production and utilization of neurochemicals influence behavior. PLoS Pathog., 9, e1003726. doi:10.1371/journal.ppat.1003726
- Madderm J.G., Walkers J., Van Rooyen D., Knobel E., Vandamme E., Berkvens D., Vanwambeke S.O., De Clerc E.M., 2012. e-Surveillance in Animal Health: use and evaluation of mobile tools. Parasitol., 139, 1831-1842. https://doi/10.1017/S0031182012000571
- Manoli C., Gambara T., Di Bianco S., Bareille N., Kaufmann P., Dufay-Lefort A.C., Poissonnet A., Wache A., 2021. How are animal health monitoring tools used? The point of view of french livestock farmers. 72nd Ann. Meet. Europ. Fed. Anim. Sci., (EAAP), 30th August - 3rd September 2021, Davos, Switzerland.
- Melkebeek V., Goddeeris B.M., Cox E., 2013. ETEC vaccination in pigs. Vet. Immunol. Immunopathol., 152, 37-42. https://doi/10.1016/j.vetimm.2012.09.024
- Menjon P., d’Orgeval R., 1983. Entre atelier et filière : le système d’élevage. Agriscope, I (1), « L’exploitation agricole, une approche globale », 42-53.
- Nilsson E.E., Sadler-Riggleman I., Skinner M.K., 2018. Environmentally induced epigenetic transgenerational inheritance of disease. Environ. Epigenetics, 4, doi:10.1093/eep/dvy016
- Paul M., Belloc C., Rousset N., Hemonic A., Margueries J., Le Coz P., Le Normand B., Hercule J., Roguet C., Leblanc-Maridor M., Chauvin C., Ducrot C., 2021. Évolution de l’usage des antibiotiques en filières monogastriques : état d’avancement et perspectives. INRAE Prod. Anim., 32, 291-304. doi:10.20870/productions-animales.2019.32.2.2485
- Piel Y., Le Gall A., Belloc C., Leblanc-Maridor M., 2019. Pratiques et perceptions de l’usage des antibFacciotiques chez les éleveurs porcins. Journées Rech. Porcine, 51, 283-288.
- Piestun Y., Shinder D., Ruzal M., Halevy O., Brake J., Yahav S., 2008. Thermal manipulations during broiler embryogenesis: Effect on the acquisition of thermotolerance. Poultry Sci., 87, 1516-1525. doi:10.3382/ps.2008-00030
- Pluske J.R., Turpin D.L., Kim J.C., 2018. Gastrointestinal tract (gut) health in the young pig. Anim. Nutr., 4,187-196. doi:10.1016/j.aninu.2017.12.004
- Postma M., Vanderhaeghen W., Sarrazin S., Maes D., Dewulf J., 2017. Reducing Antimicrobial Usage in Pig Production without Jeopardizing Production Parameters. Zoonoses Public Health, 64, 63-74. doi:10.1111/zph.12283
- Praud C., Jimenez J., Pampouille E., Courousse N., Godet E., Le Bihan-Duval E., Berri C., 2020. Molecular Phenotyping of White Striping and Wooden Breast Myopathies in Chicken. Front. Physiol., 11, n°633. doi:10.3389/fphys.2020.00633
- Pullinger G.D., van Diemen P.M., Carnell S.C., Davies H., Lyte M., Stevens M.P., 2010. 6-hydroxydopamine-mediated release of norepinephrine increases faecal excretion of Salmonella enterica serovar Typhimurium in pigs. Vet. Res.,41, 68. doi:10.1051/vetres/2010040
- Råberg L., Sim D., Read A.F., 2007. Disentangling genetic variation for resistance and tolerance to infectious diseases in animals. Sci., 318, 812-814. doi:10.1126/science.1148526
- Rabot S., 2015. Axe intestin cerveau : comment le microbiote intestinal influence la répons eau stress. Bull. Acad. Vét. France.168, 267-273. doi:10.4267/2042/57938
- Rödel H.G., Bautista A., Hudson R., 2008. Why do heavy littermates grow better than lighter ones? A study in wild and domestic European rabbits. J. Phys. Behav., 95, 441-448. doi:10.1016/j.physbeh.2008.07.011
- Rodenburg T.B., van Krimpen M.M., de Jong I. C., de Haas E.N., Kops, M.S., Riedstra B.J., Nordquist R.E., Wagenaar J.P., Bestman M., Nicol C.J, 2013. The prevention and control of feather pecking in laying hens: identifying the underlying principles. Worlds Poultry Sci. J., 69, 361-373. doi:10.1017/S0043933913000354
- Rosell J.M., De la Fuente L., 2013. Assessing ulcerative pododermatitis of breeding rabbits. Animals, 3, 318-326. doi:10.3390/ani3020318
- Round J., Mazmanian S., 2009. The gut microbiota shapes intestinal immune responses during health and disease. Nat. Rev. Immunol., 9, 313-323. doi:10.1038/nri2515
- Schneider D., Ayres J., 2008. Two ways to survive infection: what resistance and tolerance can teach us about treating infectious diseases. Nat. Rev. Immunol., 8, 889-895. doi:10.1038/nri2432
- Schneitz C., 2005. Competitive exclusion in poultry––30 years of research. Food Control 16, 657-667. doi:10.1038/nri2432
- Shrestha M., Garreau H., Balmisse E., Bed’hom B., David I., Guitton E., Helloin E., Lenoir G., Maupin M., Robert R., Lantier F., Gunia M., 2020. Genetic parameters of resistance to pasteurellosis using novel response traits in rabbits. Gen. Sel. Evol., 52, 14p., doi:10.1186/s12711-020-00552-8
- Skuce P.J., Morgan E.R., van Dijk J. Mitchell M., 2013. Animal health aspects of adaptation to climate change: beating the heat and parasites in a warming Europe. Animal, 7, 333-345. doi:10.1017/S175173111300075X
- Suzuki K., 2018. The developing world of DOHaD. J. Dev. Orig. Health Dis., 9, 266-269. doi:10.1017/S2040174417000691Szendrö Z., Trocino A., Hoy S., Xiccato G., Villagrá A., Maertens L., 2019. A review of recent research outcomes on the housing of farmed domestic rabbits: reproducing does. World Rabbit Sci., 27, 1-14. doi:10.4995/wrs.2019.10599
- Tran T.S., Beaumont C., Salmon N., Fife M., Kaiser P., Le Bihan-Duval E., Vignal A., Velge P., Calenge F., 2012. A maximum likelihood QTL analysis reveals common genome regions controlling resistance to Salmonella colonization and carrier-state. BMC Genom., 13, 198. doi:10.1186/1471-2164-13-198
- Travel A., Petit A., Barat P., Collin A., Bourrier-Clairat C., Pertusa M., Skiba F., Crochet S., Cailleau-Audouin E., Chartrin P., Guillory V., Bellenot D., Guabiraba R., Guilloteau L., 2021. Methodologies to assess the bioactivity of a plant extract on redox balance, inflammation, health, welfare and performance in the chicken: the case of Melissa officinalis L. extract. Front. Vet. Sci., doi:10.3389/fvets.2021.759456
- Vaarst M., Alroe H.F., 2012. Concepts of animal health and welfare in organic livestock systems. J. Agric. Environ. Ethics 25, 333-347. doi:10.1007/s10806-011-9314-6
- Van de Ven L.J., van Wagenberg A.V., Debonne M., Decuypere E., Kemp B., van den Brand H., 2011. Hatching system and time effects on broiler physiology and posthatch growth. Poult Sci., 90,1267-75. doi:10.3382/ps.2010-00876
- Van der Waaij E.H., Van den Brand H., Van Arendonk J.A.M., Kemp B., 2011. Effect of match or mismatch of maternal-offspring nutritional environment on the development of offspring in broiler chickens. Animal, 5, 741-748. doi:10.1017/S1751731110002387
- Villemin M., 1981. La santé animale. Essai de définition tenant compte de la santé publique et de l’économie agricole. Bull. Acad. Vét. de France, 54, l385-392.
- Weström B., Arévalo Sureda E., Pierzynowska K., Pierzynowski S.G., Pérez-Cano F.J., 2020. The Immature Gut Barrier and Its Importance in Establishing Immunity in Newborn Mammals. Front. Immunol. 11. doi:10.3389/fimmu.2020.01153
- Zepp M., Louton H., Erhard M., Schmidt P., Helmer F., Schwarzer A., 2018. The influence of stocking density and enrichment on the occurrence of feather pecking and aggressive pecking behavior in laying hen chicks. J. Vet. Behav.-Clin. Appl. Res., 24, 9-18. doi:10.1016/j.jveb.2017.12.005
- Zhai H.X., Liu, H., Wang S.K., Wu J.L., Kluenter A.M., 2018. Potential of essential oils for poultry and pigs. Anim. Nutr., 4, 179-186. doi:10.1016/j.aninu.2018.01.005
Résumé
La gestion intégrée de la santé animale peut être définie comme l’ensemble des connaissances et pratiques mobilisées par l’homme de manière coordonnée afin de favoriser la construction, préserver ou retrouver la santé des individus ou du troupeau au sein du système d'élevage. Elle a pour finalité d’optimiser la santé animale et le cycle de production tout en réduisant l’utilisation des antibiotiques et des antiparasitaires qui pose des problèmes de résistance chez les animaux et les humains. Elle se fonde sur la mobilisation conjointe de trois principes complémentaires : (P1) prévenir l’apparition des maladies en limitant les situations à risques et le contact avec les éléments nuisibles (agents pathogènes, éléments toxiques), (P2) utiliser des animaux résistants ou développer leurs capacités adaptatives, (P3) soigner les animaux de façon ciblée (molécule, dose, durée). La santé se construit tout au long de la vie de l’animal pour garantir un développement harmonieux et l’intégrité physique des individus. De nombreux leviers d’action, regroupés en six dimensions (1-milieu de vie des animaux, 2-gestion de la reproduction, 3-gestion des troupeaux, 4-choix et pratiques avec les animaux, 5-alimentation et 6-pilotage de l’élevage) ont été identifiés pour atteindre cet objectif. Ces leviers peuvent avoir sur la santé un effet direct, différé, ou bien intergénérationnel. Une mobilisation cohérente de nombreux leviers a permis de réduire fortement l’usage des antibiotiques au cours des dernières années mais une marge de progrès est encore possible pour les systèmes d’élevages des monogastriques. De plus, le développement de systèmes d’élevage en phase avec les demandes sociétales (respect du bien-être animal, circuits courts et locaux, accès à l’extérieur) pose de nouveaux défis pour une gestion intégrée de la santé animale.
Pièces jointes
Pas de document complémentaire pour cet articleStatistiques de l'article
 Vues: 5938
Vues: 5938
Téléchargements
 PDF: 577
PDF: 577
 XML: 147
XML: 147
Articles les plus lus par le même auteur ou la même autrice
- Sylvie COMBES, Thierry GIDENNE, Samuel BOUCHER, Laurence FORTUN-LAMOTHE, Gérard BOLET, Gérard COUREAUD, Pour des lapereaux plus robustes au sevrage : des bases biologiques aux leviers d’action en élevage , INRAE Productions Animales: Vol. 31 No 2 (2018)
- Marie-Angélina MAGNE, Marie-Odile NOZIÈRES-PETIT, Sylvie COURNUT, Émilie OLLION, Laurence PUILLET, David RENAUDEAU, Laurence FORTUN-LAMOTHE, Gérer la diversité animale dans les systèmes d’élevage : laquelle, comment et pour quels bénéfices ? , INRAE Productions Animales: Vol. 32 No 2 (2019): Volume 32 Numéro 2 : Numéro spécial. De grands défis et des solutions pour l'élevage
- Alain DUCOS, Frédéric DOUHARD, Davi SAVIETTO, Marion SAUTIER, Valérie FILLON, Mélanie GUNIA, Rachel RUPP, Carole MORENO-ROMIEUX, Sandrine MIGNON-GRASTEAU, Hélène GILBERT, Laurence FORTUN-LAMOTHE, Contributions de la génétique animale à la transition agroécologique des systèmes d’élevage , INRAE Productions Animales: Vol. 34 No 2 (2021)
- Hervé GARREAU, Mélanie GUNIA, La génomique du lapin : avancées, applications et perspectives , INRAE Productions Animales: Vol. 31 No 1 (2018)
- Thierry GIDENNE, Davi SAVIETTO, Laurence FORTUN-LAMOTHE, Yayu HUANG, Cuniculture au pâturage et sous certification Agriculture Biologique en France : fonctionnement des systèmes, performances et règlementation , INRAE Productions Animales: Vol. 35 No 3 (2022)
- Christelle KNUDSEN, Cécile BONNEFONT, Laurence FORTUN-LAMOTHE, Karine RICAUD, Xavier FERNANDEZ, L'engraissement spontané du foie ches les palmipèdes : état des lieux et perspectives de recherche , INRAE Productions Animales: Vol. 31 No 2 (2018)
- Joanna LITT, Christine LETERRIER, Laurence FORTUN-LAMOTHE, Conditions d’élevage des palmipèdes à foie gras : des demandes sociétales à une démarche de progrès , INRAE Productions Animales: Vol. 33 No 3 (2020)
- Nathalie LE FLOC’H, Anne BOUDON, Lucile MONTAGNE, Hélène GILBERT, Florence GONDRET, Bénédicte LEBRET, Louis LEFAUCHEUR, Isabelle LOUVEAU, Élodie MERLOT, Marie-Christine PÈRE, Marie-Christine MEUNIER-SALAÜN, Armelle PRUNIER, Hélène QUESNEL, Santé et bien-être de la truie gestante et du porc en croissance , INRAE Productions Animales: Vol. 34 No 3 (2021)
- Anne COLLIN, Vincent COUSTHAM, Jacob Kokou TONA, Sophie TESSERAUD, Sandrine MIGNON-GRASTEAU, Bertrand MÉDA, Anaïs VITORINO CARVALHO, Yann GUYOT, Sandrine LAGARRIGUE, Frédérique PITEL, Tatiana ZERJAL, Face au changement climatique, quelles stratégies d’atténuation et d’adaptation pour les productions avicoles ? , INRAE Productions Animales: Vol. 37 No 1 (2024)
- Vincent COUSTHAM, Charlotte ANDRIEUX, Chloé CERUTTI, Anne COLLIN, Ingrid DAVID, Julie DEMARS, Guillaume DEVAILLY, Mireille MORISSON, Marianne HOUSSIER, Sandrine LAGARRIGUE, Sonia MÉTAYER-COUSTARD, Sandrine MIGNON-GRASTEAU, Stéphane PANSERAT, Angélique PETIT, Anaïs VITORINO CARVALHO, Tatiana ZERJAL, Frédérique PITEL, Epigénétique, gènes et environnement : quelle importance pour les pratiques d’élevage et les méthodes de sélection des volailles ? , INRAE Productions Animales: Vol. 36 No 4 (2023)

