Vers une meilleure gestion de la douleur des mammifères et poissons destinés à la consommation humaine – Partie 2 : Prise en charge
Au cours de leur vie, les animaux de production destinés à l’alimentation humaine sont confrontés un jour ou l’autre à la douleur. Celle-ci doit être prise en charge pour des raisons éthiques, médicales, réglementaires mais aussi économiques. Cet article multidisciplinaire dresse un état des lieux des connaissances scientifiques de la prise en charge des différentes douleurs pouvant affecter les mammifères (ruminants et monogastriques) et les poissons. Les volailles ne seront pas traitées ici, par manque de données disponibles.
Introduction
Au cours de leur vie, les animaux de production*
1. L’approche 3S
En 1959, Russel et Burch publient un texte fondateur sur le traitement éthique des animaux de laboratoire où ils exposent pour la première fois le concept dit des 3R (Replace, Reduce, Refine) (Russell & Burch, 1959). Ils proposent ainsi une démarche fondée sur le remplacement des animaux dans la recherche, la réduction du nombre d’animaux utilisés et le raffinement des expériences, c’est-à-dire l’amélioration des conditions de leur réalisation. Lors de l’expertise scientifique collective menée par INRAE sur les douleurs animales en 2009, une démarche de même nature a été proposée pour améliorer la situation des animaux d’élevage face à la douleur (Le Neindre et al., 2009).
Cette démarche est fondée sur la règle des « 3S » (figure 1) : Supprimer, Substituer, Soulager en analogie aux « 3R ». Elle préconise ainsi de mettre tout d’abord en œuvre des solutions visant à supprimer certaines pratiques à l’origine de douleur ; puis dans un deuxième temps, s’il n’est pas possible de supprimer la source de douleur, il s’agit d’améliorer ces pratiques ou de les substituer par d’autres pratiques moins douloureuses ; enfin, il est souhaitable d’avoir recours à des solutions visant à soulager la douleur lorsque celle-ci n’est pas évitable. Une traduction possible des « 3S » en anglais est « suppress, substitute and soothe » (Guatteo et al., 2012 ; Prunier et al., 2013).
La réalisation d’une intervention d’élevage ou vétérinaire dans les meilleures conditions possibles pour l’animal doit prendre en compte sa faisabilité (technique, matériel, temps…) dans le système de production envisagé, sa compatibilité avec la réglementation (par exemple, autorisation de mise sur le marché (AMM) et limite maximale de résidus (LMR) en cas d’utilisation d’un médicament), les risques éventuels pour l’éleveur et enfin le coût de leur mise en œuvre. Un exemple d’approche 3S dans le cas de l’écornage chez les bovins est présenté dans l’encadré 1.
Pour la suite, nous nous placerons dans le cas de figure où les approches de suppression et de substitution ont été appliquées et nous nous focaliserons sur les méthodes visant à soulager la douleur qui ne pourrait être évitée.
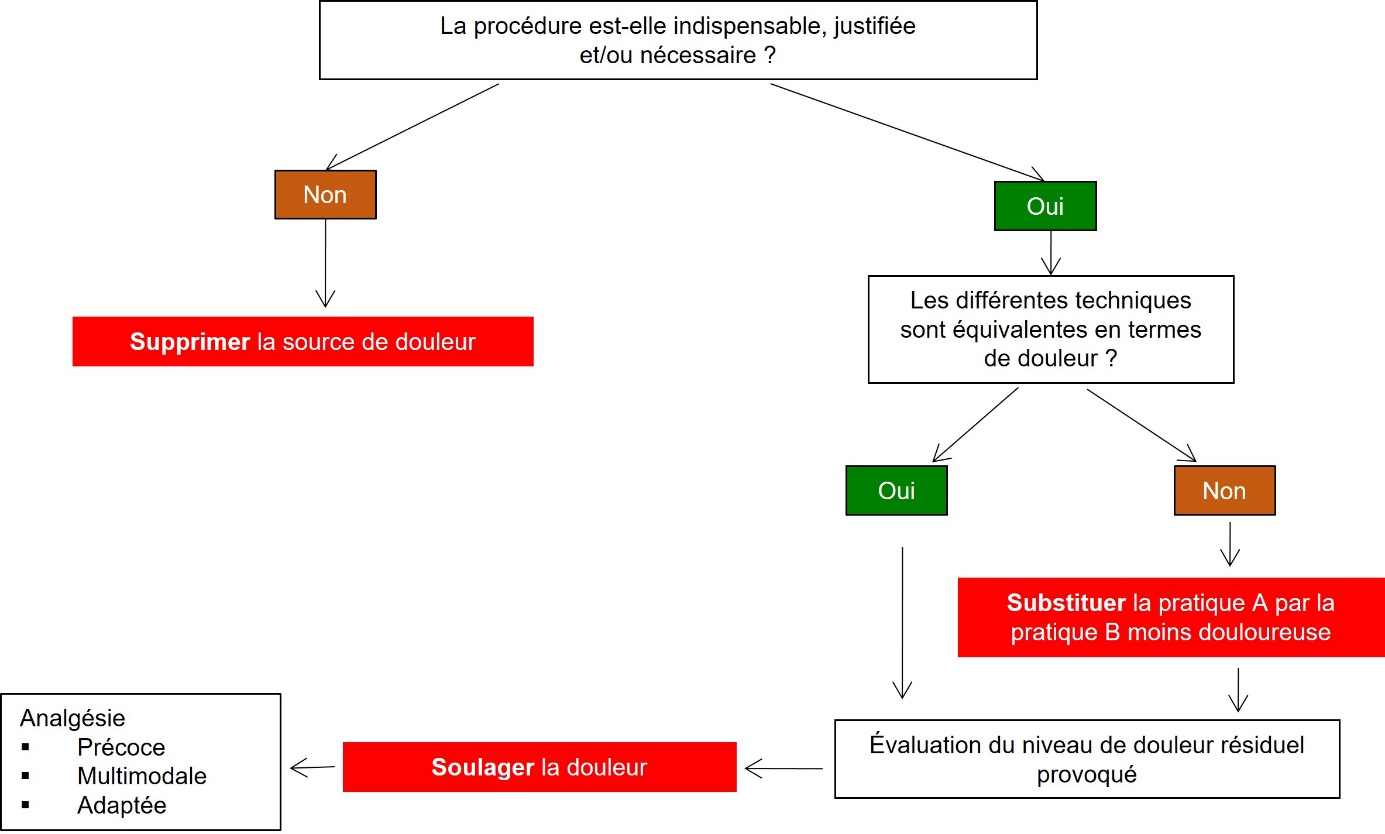
Figure 1. Démarche des 3S, adapté de Guatteo et al. (2012).
Pourquoi avoir des bovins sans cornes ?
Les cornes des bovins sont sources de blessures, à la fois entre congénères, mais aussi pour l’éleveur et les intervenants d’élevages (techniciens, vétérinaires) (Alcasde, 2009 ; Kling-Eveillard et al., 2009). En système extensif, où l’espace permet aux bovins de s’éloigner en cas de conflit, les cornes ne posent pas de problème. En stabulation entravée, les bovins étant attachés, le risque de blessure est faible. En revanche, en espace plus restreint, comme c’est le cas souvent en stabulation libre par exemple, il est plus difficile pour un animal de s’éloigner en cas de conflit et les cornes peuvent provoquer des blessures graves (éventration par exemple). Cependant, l’élimination des cornes constitue un acte très douloureux. Ainsi, la première étape consiste à remettre en cause nos pratiques douloureuses.
Supprimer la source de douleurs
Une première solution pour éviter d’avoir à écorner les bovins est d’adapter les bâtiments et les équipements d’élevage pour élever des animaux avec des cornes en toute sécurité. Une autre solution, d’ores et déjà mise en œuvre, est d’avoir recours à de la semence de taureaux porteurs du gène acère. Les descendants sont ainsi dépourvus de cornes. Ainsi, la sélection génétique contrôlée peut offrir des solutions pour réduire l'incidence des situations douloureuses chez les animaux de production.
Toutefois, deux obstacles majeurs se heurtent actuellement à la généralisation de cette méthode : le nombre de reproducteurs disponibles aujourd’hui trop faible pour permettre un choix assez large et la faible acceptabilité sociétale par les consommateurs et les éleveurs de vaches sans cornes car l’image de l’animal et de la production peut être affectée.
Substituer des pratiques par d’autres moins douloureuses
Les différentes techniques utilisables pour écorner les bovins ne sont pas équivalentes en termes de douleur. L’écornage de bovins adultes, qui consiste à couper la corne avec une scie (scie fil ou scie hydraulique) est source d’une douleur très importante et peut provoquer des complications (hémorragie, infection des sinus…) car la corne est un prolongement de l’os du crâne. Il est donc préférable de détruire le bourgeon cornual (amas de cellules qui formeront la corne) présent chez les veaux en deçà de deux mois d’âge. Lorsque l’on détruit ce bourgeon, on parle d’ébourgeonnage. Cette pratique est beaucoup moins invasive que l’écornage de bovins adultes et doit donc être privilégiée. De nombreuses études rapportent que l’ébourgeonnage par cautérisation à l’aide d’un fer chaud ou d’un fer électrique est moins douloureux que celui pratiqué à l’aide d’enduits ou de crayons chimiques (NaOH), et lui-même l’est moins que l’écornage à l’aide d’une cisaille. Ainsi, une revue assez récente conclut que la cautérisation thermique serait la méthode d’ébourgeonnage à privilégier (Stafford & Mellor, 2005). On sait également qu’il faut privilégier un écornage dès le plus jeune âge, idéalement avant quatre semaines d’âge et avant deux mois dans tous les cas (Alcasde, 2009).
Soulager la douleur inévitable
Lorsque la douleur est inévitable, il convient d’adopter le principe d’une analgésie* précoce, multimodale et adaptée à l’animal et à la procédure. Une fois la technique la moins douloureuse retenue, il convient de choisir le protocole permettant l’analgésie la plus efficace. Il apparaît par exemple qu’une anesthésie du nerf cornual par administration d’anesthésique local diminue notablement la douleur pendant l’ébourgeonnage et la période de post-ébourgeonnage immédiate (2 heures) lorsqu’il est pratiqué par la méthode de cautérisation. Si cette anesthésie précède un écornage réalisé par d’autres méthodes, la douleur est diminuée de façon moindre mais fortement réduite en comparaison à l’absence d’anesthésie locale* (Stilwell et al., 2010). Compte tenu du fait que l’analgésie procurée par le bloc du nerf cornual ne dure au plus que quelques heures, le recours à d’autres substances analgésiques en complément se justifie. Ainsi, le protocole analgésique idéal est la combinaison d’une administration préopératoire d’un anti-inflammatoire non stéroïdien (AINS), d’une sédation à l’aide d’alpha2-agonistes (xylazine) et d’une anesthésie locale du nerf cornual avant l’ébourgeonnage (Herskin & Nielsen, 2018). L’administration préopératoire d’AINS est en ligne avec le concept d’analgésie précoce : au plus tôt la douleur est prévenue et combattue, meilleurs sont les résultats, et moindres sont les doses à utiliser. Le recours à plusieurs voies d’administration (blocs, voie intraveineuse ou intramusculaire…) et à différentes molécules à activité et durée d’action complémentaires correspond au concept d’analgésie multimodale : utiliser l’ensemble de l’arsenal disponible par toutes les voies possibles. Encore une fois, la mise en œuvre de la procédure la plus adaptée peut se heurter à des contraintes réglementaires (exemple de la pratique de l’anesthésie du nerf cornual par l’éleveur) ou pratiques comme la formation indispensable des intervenants.
2. Soulager : approche éthologique
En médecine humaine, l’état attentionnel et le contexte émotionnel de l’individu altèrent la perception et la transmission de la douleur au niveau du système nerveux central (Villemure & Bushnell, 2002). Il est possible de mobiliser ces aspects pour la gestion de la douleur chez les animaux, y compris les animaux de production.
2.1. Modulation de la douleur par des facteurs attentionnels
L’effet de l’attention sur la manière dont le patient perçoit la douleur a été étudié chez l’être humain. Une simple distraction peut avoir un impact sur la perception de la douleur (Villemure & Bushnell, 2002). Dans la plupart des études, la distraction est obtenue en demandant au sujet de centrer son attention sur une autre modalité sensitive, par exemple un stimulus visuel (Bushnell et al., 1999), auditif (Miron et al., 1989) ou tactile (Rode et al., 2001). Lorsque les patients se concentrent sur le stimulus, ils déclarent percevoir la douleur moins intensément. Les mécanismes nerveux sous-jacents à la modulation de la douleur par l’attention ne sont pas complètement connus ; ils semblent impliquer plusieurs zones du système nerveux central et ne seront pas décrits ici (Villemure & Bushnell, 2002). À notre connaissance, aucune étude s’intéressant uniquement à l’effet de l’attention sur la modulation de la douleur n’a été conduite chez les animaux de production.
2.2. Modulation de la douleur par des facteurs émotionnels
Des facteurs psychologiques autres que l’attention, tel que l’état émotionnel du patient, modifient sa perception de la douleur (Villemure & Bushnell, 2002). Trois grands types d’études ont été menées chez l’être humain : des études reposant sur des journaux de bord, des études où les sujets sont confrontés à des stimuli de valences variées, et des études où l’environnement de vie de l’humain est modifié. Chez l’animal, seuls les deux derniers types d’études ont été conduits.
a. Études utilisant la confrontation à un stimulus avec diverses valences
En contexte expérimental, des sujets (humains ou animaux) sont par exemple confrontés à des stimuli visuels ou olfactifs de valence positive ou négative, puis sont ensuite soumis à des tests visant à caractériser leur réponse lors de l’application d’un stimulus froid ou d’une électrostimulation (soit la composante sensitive de la douleur). La douleur est évaluée par des indicateurs comportementaux, physiologiques ou, pour les humains, par une échelle visuelle analogique. Chez la souris, l’exposition à des odeurs familières positives réduit les réactions de défense lors de tests d’électrostimulation, alors que des odeurs familières négatives les augmentent (Jahangeer et al., 1997).
b. Études faisant varier l’environnement de vie du sujet
Le concept d’enrichissement environnemental fait référence à un large éventail de modifications de l'environnement des animaux en captivité ou en élevage qui offrent une stimulation adéquate et facilitent l'expression d'un comportement hautement motivé, favorisant ainsi les émotions positives et améliorant le bien-être de l'animal. Les enrichissements environnementaux peuvent être classés en cinq catégories (non exclusives) : physique (complexité de l’enclos et mise à disposition d’éléments supplémentaires comme des cachettes), occupationnel (qui favorise les activités physiques et psychologiques en offrant la possibilité de faire de l’exercice ou de s’engager dans des tâches cognitives), sensoriel (conçu pour stimuler un ou plusieurs sens de l’animal), alimentaire (qui favorise le comportement de recherche de nourriture et d’alimentation en fournissant des aliments nouveaux ou variés ; ou des méthodes et outils de distribution de l’aliment), relationnel (contacts sociaux, développement d’un sentiment de sécurité, facilitation sociale ou apprentissage dans diverses situations et des liens spécifiques avec des congénères ou des individus d’autres espèces) (EURCAW, 2023). Chez les rats, l’enrichissement du milieu de vie pendant trois semaines avant une situation douloureuse (par exemple lésion inflammatoire induite par une injection de carraghénine dans un genou) permet de réduire la durée de la douleur (Gabriel et al., 2010a, 2010b). Après cette même intervention douloureuse, des rats élevés dans des milieux enrichis connaissent une réduction plus rapide de la douleur que des rats élevés dans un milieu standard (Gabriel et al., 2009). De même chez la souris, l’enrichissement du milieu de vie réduit l’hypersensibilité douloureuse après une lésion nerveuse (Abramov et al., 2009).
Chez les animaux de production, quelques études ont évalué l’effet de l’environnement physique et social sur leur réponse à la douleur. Des vaches exposées momentanément à la séparation d’avec leurs congénères réagissaient plus rapidement à une stimulation thermique par laser, douloureuse, que des vaches maintenues dans leur groupe (Rushen et al., 1999). Chez les ovins, des agneaux ayant été caudectomisés et placés dans un environnement enrichi avec présence de paille et de congénères, présentaient moins de réponses traduisant de la douleur (postures couchées anormales et sécrétion de cortisol) que des agneaux caudectomisés et élevés en milieu ne comportant pas ces enrichissements (Larrondo et al., 2021). Ces résultats suggèrent qu’il est possible d’agir sur l’environnement des animaux pour favoriser l’émergence d’émotions positives qui viendraient atténuer l’expérience douloureuse.
Enfin, plusieurs études sur les rongeurs suggèrent que l’enrichissement du milieu permet de potentialiser les effets de certains analgésiques. Par exemple, lors d’un test évaluant le seuil de sensibilité douloureuse, des rats ayant été élevés en milieu enrichi sur le plan social et environnemental étaient plus sensibles à l’effet de différents opioïdes que des rats élevés dans un milieu standard (Smith et al., 2003, 2005). À notre connaissance aucune étude de ce type n’a été conduite chez des animaux de production.
2.3. Entraîner les animaux à coopérer pour certaines interventions entraînant une douleur légère
L’entraînement (« training » en anglais) vise à obtenir la coopération des animaux pour des gestes du quotidien (ex. : venir au cornadis, rentrer dans une cage de contention…) ou des procédures vétérinaires basiques (examen clinique, administration de médicaments, prélèvements) dont certaines peuvent générer une douleur légère (une injection par exemple).
Une fois acquis, l’entraînement permet de réaliser le geste souhaité avec une contrainte réduite au minimum pour l’animal, évitant ainsi le recours à une contention coercitive et le risque d’une blessure liée à une réaction brusque. Il réduit également le stress* de l’animal, ce qui évite de majorer une douleur par cette autre émotion négative.
L’entrainement repose sur les théories de l’apprentissage et mobilise des techniques spécifiques. L’animal devient acteur et coopère pour la réalisation de gestes. L’entrainement des animaux aux soins s’est développé dans le cadre des parcs animaliers (Ramirez, 2012), pour les animaux de compagnie (Pryor, 2002 ; Yin, 2009) et plus récemment les chevaux (Roche, 2013, 2023 ; Pearson, 2015a, 2015b). En recherche, il est mis en place pour certaines espèces utilisées à des fins scientifiques telles que les primates non humains (Perlman et al., 2012 ; Graham, 2017) et les mini-porcs (Glerup et al., 2010). Chez les animaux de production, cette démarche est, à ce jour, peu utilisée sur le terrain que ce soit pour des interventions de routine ou dans le cadre des soins, alors que les bovins, ovins, porcins, caprins ont de très bonnes capacités d’apprentissage (Houpt, 2018) et qu’un tel entrainement est déjà utilisé avec succès pour la préparation aux concours (Garcia, 2023). Des travaux récents sur ovins (Pluchot et al., 2024) et bovins (de Boyer des Roches et al., 2025a) offrent des pistes intéressantes dans ce sens. Ainsi, les animaux peuvent être entraînés à coopérer pour des interventions complexes (de Boyer des Roches et al., 2025a). Pour chacune, il est indispensable de définir les étapes nécessaires pour la réalisation du geste final. Voici quelques exemples documentés chez les herbivores : venue volontaire de bovins dans un dispositif de contention (Heinsius et al., 2023), entrainement à une injection chez des bovins (Lomb et al., 2021) et des chevaux (Pearson, 2015a, 2015b), manipulation des yeux chez des chevaux (de Boyer des Roches et al., 2021) et des bovins (Dumoulin, 2022 ; de Boyer des Roches et al., 2025a), entrainement à diverses interventions vétérinaires chez des bovins (Dumoulin, 2022 ; de Boyer des Roches et al., 2025a), administration de médicaments per os chez des chevaux (Pearson, 2015b), ou à un examen d’imagerie chez des ovins (Pluchot et al., 2024).
Réaliser un entrainement aux gestes potentiellement stressants ou douloureux les plus fréquents rencontrés par un animal prend du temps et nécessite de l’anticipation mais les résultats obtenus sont généralement très gratifiants pour les personnes en charge de ces animaux et réduisent nettement le temps nécessaire et les risques de blessure et d’échec pour ces interventions. Ce bénéfice nous amène à recommander aux acteurs des filières (en particulier : éleveurs, techniciens, auxiliaires vétérinaires et vétérinaires) de s’initier à cette pratique dans le cadre de la gestion des actes douloureux chez les animaux de production.
3. Soulager la douleur : approche pharmacologique
Nous adoptons ici le terme analgésie au sens anglo-saxon pour désigner toutes les méthodes permettant de réduire ou supprimer une douleur et nous considérons donc ici tous les médicaments capables de directement éviter ou soulager une douleur disposant d’une preuve de leur efficacité dans la littérature scientifique (de Boyer des Roches et al., 2025b ; dans ce numéro, pour la définition des termes).
En plus des molécules agissant directement dans le traitement de la douleur dans le système nerveux central, nous incluons donc ici dans les analgésiques les anti-inflammatoires non stéroïdiens (parfois désignés par le terme d’antalgiques* en français) et les anesthésiques locaux, dont le mécanisme d’action passe par une suppression de toutes les sensations dans le territoire concerné (figure 2).
3.1. Médicaments réglementairement autorisés chez les animaux de production
a. Cadre réglementaire
La très grande majorité des molécules utilisables pour la prise en charge de la douleur chez les animaux (voir § 3.2) est disponible sous forme de médicaments au sens de l’article 4 du règlement (UE) 2019/6, puisque ce sont des molécules ayant pour but de « restaurer, corriger ou modifier des fonctions physiologiques en exerçant une action pharmacologique [...] ». Les médicaments vétérinaires sont soumis à l’obtention d’une Autorisation de mise sur le marché (AMM) délivrée par l’Agence nationale du médicament vétérinaire (Anses-ANMV) ou l’Agence européenne du médicament (EMA) (Rostang et al., 2022). Ces AMM sont obtenues après avoir démontré pour le médicament considéré i) sa qualité pharmaceutique, ii) son efficacité au regard de l’indication visée, iii) sa sécurité à la fois vis-à-vis de l’animal traité (données toxicologiques) mais aussi vis-à-vis du consommateur éventuel des denrées issues de l’animal traité (résidus). Sauf dérogation, les médicaments vétérinaires sont tous soumis à prescription vétérinaire au moyen d’une ordonnance après un examen clinique.
L’une des contraintes principales lors de l’utilisation des médicaments vétérinaires chez les animaux de production est de garantir une absence d’effets pharmacologiques ou toxicologiques pour les consommateurs de ces denrées (lait, viande, œufs). C’est la raison pour laquelle des Limites maximales de résidus (LMR) à ne pas dépasser dans ces denrées sont définies et régulièrement actualisées (Annexe 1 du règlement (UE) no 37/2010 ou « tableau 1 des substances autorisées chez les animaux de production
Afin de garantir le respect de ces LMR, il est nécessaire que les laboratoires qui commercialisent les médicaments vétérinaires définissent une durée minimale après un traitement avant de pouvoir consommer les denrées. C’est ce que l’on nomme le temps d’attente et qui correspond au temps nécessaire entre la dernière administration du médicament et le moment où la commercialisation des denrées devient possible. Puisque les différentes espèces éliminent ou métabolisent souvent à des vitesses différentes les molécules, ces temps d’attente sont spécifiques de l’espèce traitée et de la denrée considérée. À titre d’illustration, l’Inflacam® 20 mg/ml est une solution injectable de méloxicam avec une AMM pour la prise en charge de la douleur chez les bovins, porcins et chevaux. La notice de ce médicament indique un temps d’attente pour la viande et les abats de 15 jours pour les bovins mais de seulement cinq jours pour les porcins ou les chevaux. Le temps d’attente pour le lait est quant à lui de cinq jours pour les bovins.
Ainsi, tous les médicaments vétérinaires à destination des animaux de production mentionnent un temps d’attente que le vétérinaire inscrit sur l’ordonnance lors de la prescription et que l’éleveur doit respecter avant l’abattage de l’animal ou la commercialisation du lait ou des œufs.
b. Le règlement dit de « la cascade »
Compte tenu de la très grande diversité des espèces de production et de leurs affections, il est compréhensible qu’il n’existe pas un médicament pour traiter chacune des espèces ou des maladies. Il existe donc une possibilité réglementaire (article 112 du règlement (UE) 2019/6) qui autorise le vétérinaire, en l’absence de médicament disponible pour l’espèce et/ou l’indication visée, à utiliser un médicament vétérinaire autorisé pour une autre espèce de production. À défaut, le vétérinaire pourra se tourner vers un médicament vétérinaire autorisé chez les animaux non producteurs de denrée ou, en dernier recours vers un médicament à usage humain, voire une préparation magistrale, c’est-à-dire un médicament fabriqué par un pharmacien ou par un vétérinaire en vue du traitement d’un animal donné ou d’un petit groupe d’animaux.
Ce règlement, dit de « la cascade », permet donc au vétérinaire une très grande liberté de prescription, sous sa responsabilité personnelle directe. La contrainte principale reste néanmoins que tous les médicaments utilisés dans le cadre de « la cascade » ne peuvent être administrés aux animaux producteurs de denrées que si leurs principes actifs sont autorisés chez les animaux de production, c’est-à-dire s’ils figurent sur la liste des substances autorisées à l’annexe 1 du règlement (UE) no 37/2010. En d’autres termes, cela signifie que « la cascade » n’est applicable que pour les médicaments contenant une substance disposant d’une LMR.
Tous les médicaments utilisés en dehors des termes de l’AMM disposent d’un temps d’attente maximisé pour protéger le consommateur des denrées (1,5 fois le temps d’attente initial s’il existe ou, à défaut, un temps d’attente très long dit « forfaitaire », par exemple sept jours pour le lait et les œufs et 28 jours pour la viande).
c. État des lieux des médicaments analgésiques autorisés chez les animaux de production
La principale contrainte réglementaire à l’utilisation des différents médicaments analgésiques chez les animaux de production est liée à leur inscription ou non à l’annexe 1 du règlement (UE) no 37/2010.
La plupart des anti-inflammatoires non stéroïdiens (AINS) disponibles en médecine vétérinaire disposent d’une LMR et peuvent donc être réglementairement utilisés chez les animaux de production, à l’exception d’un groupe relativement récent, les coxibs (en dehors des équidés).
Le seul anesthésique local disposant d’une AMM chez les bovins et les porcins est la procaïne, même si la lidocaïne dispose aussi d’une AMM chez les équidés et peut être utilisée chez les bovins et les porcins dans le cadre de la cascade (voir infra).
Le principal manque dans l’arsenal thérapeutique pour la prise en charge de la douleur chez les animaux de production concerne les opioïdes comme la morphine ou la buprénorphine. Seul le butorphanol est autorisé chez les espèces de production mais son bénéfice analgésique est aujourd’hui démontré comme étant très limité. Comme détaillé plus loin, la classe thérapeutique des opioïdes constitue pourtant l’une des pierres angulaires de la prise en charge de la douleur en médecine vétérinaire. En l’absence de LMR disponible, il n’est aujourd’hui malheureusement pas possible de les utiliser chez les animaux de production.
3.2. Analgésiques disponibles
Plusieurs familles d’analgésiques sont disponibles en médecine vétérinaire (tableau 1, figure 2). Nous évoquerons ici les options pertinentes pour les animaux de production, qu’elles soient autorisées ou non actuellement en Europe. Trois familles sont adaptées en particulier à la gestion des douleurs chirurgicales : les opioïdes, les alpha2-agonistes et les anesthésiques locaux. Les AINS présentent quant à eux un intérêt majeur dans le contrôle de la douleur postopératoire et inflammatoire chronique. Chaque famille agit sur certaine(s) étape(s) des circuits de la douleur (figure 2). L’encadré 2 détaille les analgésiques disponibles pour les poissons et nous développons ci-après les options disponibles pour les mammifères.
Molécules | Autorisations de mise sur le marché (AMM) selon les mammifères | ||||||
Cheval | Bovins | Ovins | Caprins | Porcins | Autres espèces | ||
Opioïdes | |||||||
Famille des opioïdes forts | Morphine | Humain | |||||
Fentanyl | Chien | ||||||
Méthadone | Chien, chat | ||||||
Famille des opioïdes agonistes partiels | Buprénorphine | Oui | Chien, chat | ||||
Butorphanol | Oui | Chien, chat | |||||
Alpha2-agonistes | |||||||
Xylazine | Oui | Oui | Chien, chat | ||||
Détomidine | Oui | Oui | |||||
Romifidine | Oui | ||||||
Anesthésiques locaux | |||||||
Procaïne | Oui | Oui | Oui | Oui | Chien, chat | ||
Lidocaïne | Oui | Chien, chat | |||||
Bupivacaïne | ATU | Humain | |||||
Anti-inflammatoires non stéroïdiens | |||||||
Famille des salicylés | Acide salicylique | Oui | Oui | Oui | Poules, dindes | ||
Acide acétylsalicylique | Oui | Oui | Oui | Oui | Oui | Volailles | |
Famille des pyrazolés | Phénylbutazone | Oui | Chien | ||||
Métamizole (ou dipyrone) | Oui | Oui | Oui | Chien, chat | |||
Famille des propioniques | Kétoprofène | Oui | Oui | Oui | |||
Carprofène | Oui | Chien, chat | |||||
Famille des fénamates | Flunixine | Oui | Oui | Oui | |||
Acide tolfénamique | Oui | Oui | Chien, chat | ||||
Famille des oxicams | Méloxicam | Oui | Oui | Oui | Chien, chat, cochon d'Inde | ||
Famille des coxibs | Firocoxib | Oui | Chien | ||||
En italique, la disponibilité en médecine humaine lorsqu’elle n’existe pas en médecine vétérinaire.
Le mot « Oui » indique que la molécule dispose d’une AMM pour l’espèce, une case blanche correspond à une absence d’AMM dans cette espèce à ce jour (Source : https://www.ircp.anmv.anses.fr/).
ATU : Autorisation temporaire d'utilisation
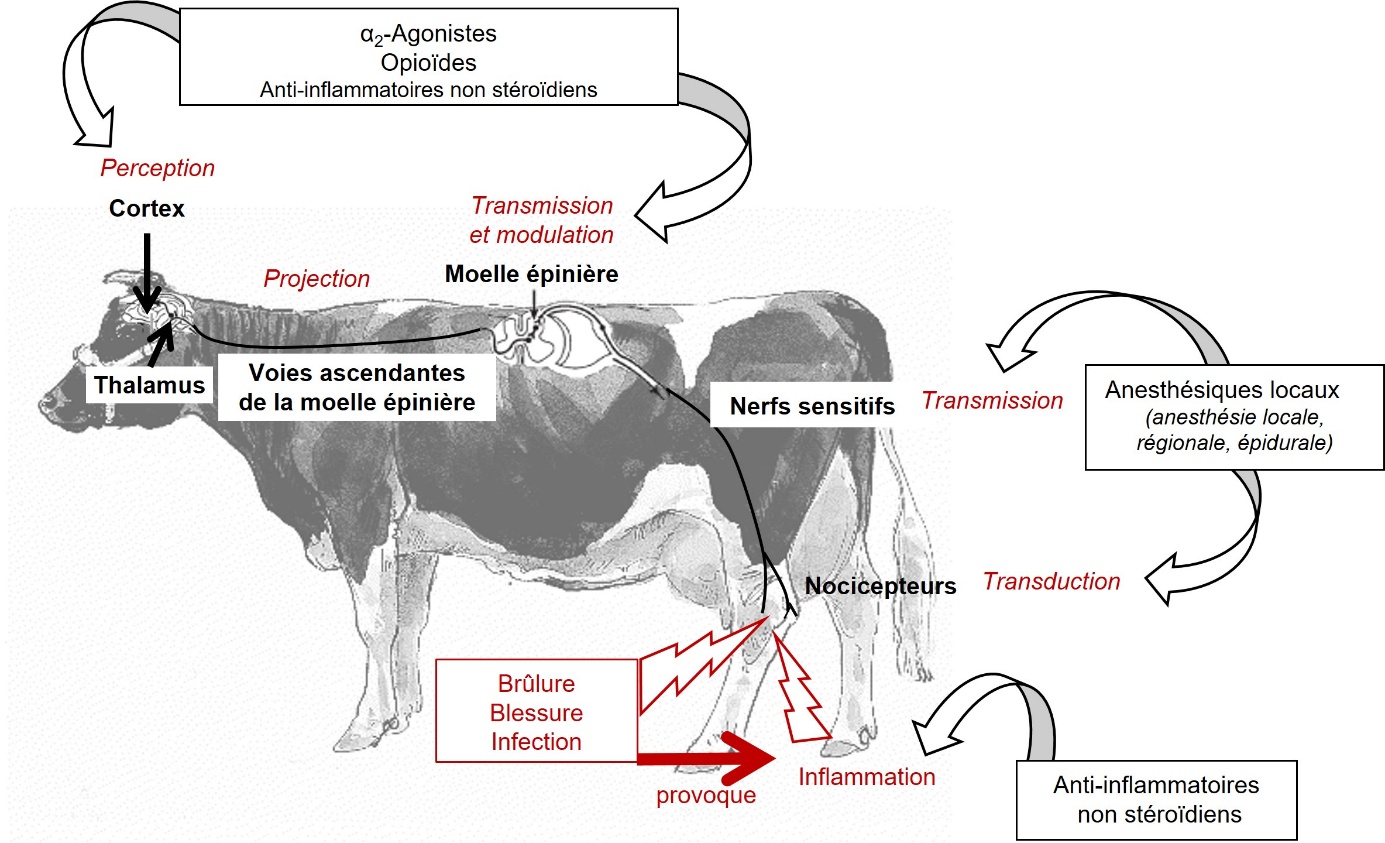
Figure 2. Sites d’action des principaux analgésiques chez les animaux de production, adapté de Gaynor & Muir (2015).
Afin de réduire le stress occasionné par les manipulations et certains gestes expérimentaux, différents agents chimiques anesthésiques sont couramment utilisés, les plus courants étant l’eugenol, la benzocaïne, le méthanesulfonate de tricaïne (additionné de bicarbonate de sodium pour tamponner le milieu acidifié par la tricaïne) et la lidocaïne. Ces anesthésiques, bien qu’appartenant à la famille des anesthésiques locaux chez les animaux terrestres, ont une action sur le système nerveux central des poissons lorsqu’ils sont utilisés en balnéation. En revanche, leur pouvoir analgésique est débattu et n’a été que peu étudié aux doses anesthésiques courantes (Zahl et al., 2012). Il a même été démontré que chez le pacu (Colossoma macropomum), l’eugenol pouvait être à l’origine d’une hyperexcitabilité neuronale malgré une immobilisation apparente totale de l’animal (Barbas et al., 2021). Pour toutes ces raisons, il est communément admis que lors de procédures invasives ou potentiellement douloureuses, une prise en charge multimodale est nécessaire, l’analgésique permettant souvent de réduire les doses d’anesthésique à employer (Chatigny et al., 2018).
Bien que de plus en plus de publications voient le jour, les conclusions qui peuvent en être tirées restent encore insuffisantes pour conclure à des protocoles efficaces de prise en charge de la douleur chez les poissons (Chatigny et al., 2018). De nombreux agents analgésiques ont tout de même été testés, à la fois des opioïdes puisque les poissons possèdent des récepteurs aux opioïdes (morphine, buprénorphine, butorphanol, tramadol) (Díaz-Rúa et al., 2022), des anti-inflammatoires non stéroïdiens (aspirine, carprofène, kétoprofène, ibuprofène) et des anesthésiques locaux comme la lidocaïne. Les résultats peuvent cependant varier de façon assez forte entre les espèces, possiblement du fait de leurs différences physiologiques mais aussi de la difficulté à établir une liste d’indicateurs interprétables et fiables chez les différentes espèces (Martins et al., 2019). L’étendue des voies d’administration possible (balnéation ou différentes voies d’injection) et ce, pour la même molécule, rajoute une variable non négligeable dans l’interprétation de la littérature. À l’heure actuelle, les opioïdes semblent présenter le maximum d’effet analgésique, en particulier la morphine. Des effets positifs ont été notés pour toutes les espèces chez lesquelles elle a été testée (truite, saumon, carpe, plie rouge), mais les doses testées sont extrêmement variables (de 3 à 300 mg/kg) et ne se recoupent pas entre les différentes espèces. De plus, des effets secondaires cardiaques ou comportementaux ont parfois été notés. Les autres opioïdes présentent aussi des effets variables selon les espèces. Ainsi, le butorphanol a montré des effets positifs chez la carpe et le poisson rouge mais pas chez les poissons cartilagineux et le poisson-zèbre. La buprénorphine, elle, a montré des effets positifs chez le poisson-zèbre mais incohérents sur la truite. Il en va de même pour tous les AINS testés, avec des effets dépendants de l’espèce, aucune molécule n’étant démontrée comme efficace pour toutes les espèces chez lesquelles elle a été testée (Sneddon, 2012 ; Chatigny et al., 2018 ; Martins et al., 2019). La lidocaïne présente, elle aussi, des résultats positifs (bien que variables entre les études) et ce, même par balnéation.
Comme chez les mammifères, il a été montré qu’une prise en charge multimodale permettait d’améliorer la prise en charge de la douleur chez le poisson-zèbre, avec une analgésie supérieure lors de l’utilisation d’une association propofol-lidocaïne comparativement à de la tricaïne seule (Valentim et al., 2016). La prise en charge de la douleur est donc une nécessité et en l’absence de données supplémentaires, sont à privilégier les molécules ayant une balance bénéfice-risque positive, en particulier la morphine et les autres opioïdes ainsi que la lidocaïne (Schroeder & Sneddon, 2017).
a. Opioïdes
Les opioïdes sont des analgésiques centraux car leurs sites d’action se situent principalement dans la moelle épinière et l’encéphale (figure 2), où ils inhibent la transmission des informations nociceptives (Riviere & Papich, 2018 ; Brunton & Knollmann, 2023). Ils peuvent agir sur trois récepteurs opioïdergiques, nommés mu, delta et kappa, et se scindent en deux groupes, selon que leur action agoniste sur ces récepteurs présente la même efficacité que la morphine, qui est l’opioïde de référence, ou une efficacité moindre. Dans le premier cas, on parle d’agonistes purs ou opioïdes forts, dans le second, d’agonistes partiels ou opioïdes faibles (Riviere & Papich, 2018 ; Brunton & Knollmann, 2023). L’action analgésique des opioïdes est particulièrement efficace sur les douleurs nociceptives, aiguës ou chroniques, notamment d’origine traumatique ou inflammatoire. Les opioïdes présentent par contre une action limitée sur les douleurs neuropathiques (Riviere & Papich, 2018 ; Brunton & Knollmann, 2023).
Le risque majeur associé à l’utilisation des opioïdes forts est celui d’une dépression respiratoire, en particulier au cours d’une anesthésie générale. Ils peuvent également inhiber la motricité digestive (Riviere & Papich, 2018 ; Brunton & Knollmann, 2023). En plus de leur action analgésique, les opioïdes peuvent provoquer une excitation ou une sédation selon les espèces. Chez toutes les espèces, ils procurent par ailleurs une sensation de bien-être, sauf pour les agonistes du récepteur kappa, tels que le butorphanol, qui induisent au contraire une sensation de mal-être (dysphorie) (Ritter et al., 2007). La sensation de bien-être induite par les agonistes mu explique le risque d’addiction lié à ces molécules et le classement en stupéfiants des opioïdes forts.
Le risque de consommation de résidus des opioïdes ainsi que les contraintes liées à leur utilisation contrôlée expliquent qu’aucun opioïde ne soit actuellement autorisé pour les animaux de production. Cependant, leur usage très important chez l’être humain, chez les carnivores domestiques et le cheval, mais aussi en contexte expérimental, met en évidence l’intérêt qu’ils présenteraient chez les animaux de production.
Les trois opioïdes forts les plus utilisés en médecine vétérinaire sont la morphine, le fentanyl et la méthadone, qui sont adaptés à la prise en charge des douleurs sévères, qui comprennent en particulier toutes les interventions chirurgicales (Riviere & Papich, 2018).
Les opioïdes agonistes partiels les plus utilisés en médecine vétérinaire sont la buprénorphine et le butorphanol. Le butorphanol présente un faible effet analgésique, une courte durée d’action et un risque d’altération du comportement (p. ex. agressivité, hyperexcitation) et de mal-être psychique, qui devraient limiter son usage à des douleurs légères ponctuelles. Au contraire, la buprénorphine est adaptée aux douleurs modérées et son action relativement longue (de quatre à huit heures selon les espèces) en fait une molécule de référence pour la prise en charge des douleurs postopératoires chez toutes les espèces (Riviere & Papich, 2018). De nombreuses études ont pu démontrer son efficacité analgésique dans des contextes variés chez les animaux de production, dont la castration du porcelet (Riviere & Papich, 2018 ; Viscardi & Turner, 2018 ; Stillman & Whittaker, 2019 ; Costea et al., 2023). Un médicament contenant de la buprénorphine est actuellement autorisé chez le cheval.
b. Alpha2-agonistes
La famille des alpha2-agonistes regroupe des molécules agonistes des récepteurs alpha2-adrénergiques, sur lesquels agit physiologiquement la noradrénaline, à la fois dans le système nerveux central et en périphérie (Riviere & Papich, 2018) (figure 2). Leurs principaux effets sont une sédation et une analgésie (Riviere & Papich, 2018). Leur usage est associé à un risque d’hypotension, et chez le mouton et la chèvre, d’œdème aigu du poumon (Riviere & Papich, 2018 ; Stillman & Whittaker, 2019 ; Singh et al., 2024).
Plusieurs molécules sont autorisées chez les animaux de production : la xylazine et la détomidine (bovins et cheval) et la romifidine (cheval). Aucune AMM n’est actuellement disponible chez le porc alors que l’usage des alpha2-agonistes en recherche est bien décrit dans cette espèce (Costea et al., 2023).
L’effet sédatif des alpha2-agonistes restreint souvent leur usage au contexte chirurgical, où ils présentent un intérêt majeur pour la gestion de la douleur chirurgicale. L’action analgésique procurée par les alpha2-agonistes est de courte durée d’action (20 minutes à une heure selon les molécules et les doses) (Riviere & Papich, 2018 ; Stillman & Whittaker, 2019 ; Singh et al., 2024), ce qui nécessite un relais rapide en cas de persistance de la douleur au-delà de l’acte réalisé. Par ailleurs, l’action analgésique des alpha2-agonistes est considérée comme insuffisante à elle seule en cas de réalisation d’un acte douloureux (chirurgie, ébourgeonnage…) (Singh et al., 2024). Leur action analgésique est par contre potentialisée par les opioïdes et les anesthésiques locaux, ce qui justifie l’utilisation combinée de ces molécules (Stillman & Whittaker, 2019 ; Singh et al., 2024).
c. Anesthésiques locaux
Les anesthésiques locaux constituent des molécules-clés de la gestion de la douleur, en particulier chirurgicale. Contrairement aux deux familles étudiées précédemment (figure 2), les anesthésiques locaux n’agissent pas uniquement sur les voies de la douleur mais la nociception* est parmi les premières fonctions inhibées, avant la sensibilité tactile et la motricité (Brunton & Knollmann, 2023). Cette réponse graduée permet d’utiliser les anesthésiques locaux pour abolir la nociception sans inhiber la motricité, ce qui est particulièrement intéressant pour une intervention sur un animal debout.
L’anesthésique local peut être administré sur toute la surface de la lésion, par application topique ou infiltration, ou à proximité du nerf sensitif correspondant (on parle de bloc loco-régional ou bloc nerveux) ou à l’arrivée des fibres sensitives dans la moelle épinière (par injection épidurale notamment) (Riviere & Papich, 2018 ; Brunton & Knollmann, 2023). Contrairement à l’application topique ou l’infiltration locale, l’inhibition de la conduction nécessite de connaître les repères anatomiques précis correspondants et requiert plus de technicité (par exemple, elle peut être facilitée par échoguidage). Elle permet cependant d’assurer une analgésie plus efficace.
En médecine vétérinaire, deux anesthésiques locaux sont disponibles pour injection : la procaïne et la lidocaïne. La procaïne dispose d’une AMM chez les bovins, ovins, porcins et le cheval. La lidocaïne ne dispose d’une AMM que chez le cheval mais son utilisation est autorisée chez les autres animaux de production [avis du Committee for Veterinary Medicinal Products (CVMP) de l’Agence européenne du médicament émis en 2015]. Cette autorisation est particulièrement intéressante car la lidocaïne présente des propriétés pharmacocinétiques plus intéressantes que la procaïne : elle agit plus vite, à dose plus faible et plus longtemps (Riviere & Papich, 2018 ; Katzung & Vanderah, 2021). Une troisième molécule est particulièrement intéressante pour injection mais ne dispose pas actuellement d’AMM vétérinaire : la bupivacaïne. Cette molécule, très utilisée en médecine humaine, présente une plus longue latence mais une durée d’action de plusieurs heures (Riviere & Papich, 2018 ; Brunton & Knollmann, 2023). L’association de lidocaïne et de bupivacaïne présente ainsi une action rapide et de plusieurs heures.
L’utilisation des anesthésiques locaux présente un intérêt majeur pour la réalisation d’actes douloureux, tels que les actes chirurgicaux ou l’ébourgeonnage. De nombreuses études attestent de leur intérêt analgésique dans ces contextes chez toutes les espèces de production (Coetzee, 2013b ; Stillman & Whittaker, 2019 ; Steagall et al., 2021 ; Reedman et al., 2022 ; Windsor, 2022 ; Singh et al., 2024). Il faut cependant bien garder en tête qu’une anesthésie locale efficace requiert une certaine technicité pour son administration et repose sur un choix optimal des molécules utilisées. Par ailleurs, l’effet d’un anesthésique local n’est jamais immédiat et nécessite plusieurs minutes de délai entre son administration et la réalisation de l’acte douloureux (Coetzee, 2013a). Enfin, la durée d’action de l’anesthésie locale est souvent très inférieure à la durée de la douleur générée par le geste effectué. L’utilisation en parallèle d’un autre analgésique qui soit à dose efficace au moment de la levée de l’anesthésie locale s’impose dans ce cas.
Un gel contenant de la lidocaïne, de la bupivacaïne, de l’adrénaline (vasoconstrictrice), ainsi qu’un antiseptique (le cétrimide) est commercialisé sous le nom de Tri-Solfen. Disponible en Australie depuis 2005, il bénéficie actuellement d’une autorisation temporaire d’utilisation en France par l’Anses
d. Anti-inflammatoires non stéroïdiens
Les AINS regroupent plusieurs familles de molécules inhibitrices de la synthèse de médiateurs de l’inflammation (prostaglandines et thromboxanes en particulier). Ils inhibent pour cela les cyclo-oxygénases (COX) qui génèrent ces médiateurs à partir de l’acide arachidonique (Coetzee, 2013a ; Riviere & Papich, 2018 ; Brunton & Knollmann, 2023). Parmi l’ensemble des molécules utilisables dans le contrôle de la douleur chez les animaux de production, les AINS sont les seuls à permettre de lutter contre l’inflammation. À ce titre, ils jouent un rôle direct d’inhibition de la stimulation nociceptive dans toutes les situations mettant en jeu une composante inflammatoire, ce qui correspond à la grande majorité des douleurs rencontrées en élevage. Aussi, leur utilisation pour la gestion d’une douleur post-chirurgicale doit être aussi systématique que possible. Ils présentent par ailleurs pour beaucoup une action suffisamment longue pour permettre une administration par 24 heures. Le mécanisme d’action des AINS ne leur permet cependant pas de contrôler une douleur peropératoire, contrairement aux trois classes détaillées précédemment (Coetzee, 2013a ; Schoos et al., 2019 ; Stillman & Whittaker, 2019).
Les familles d’AINS peuvent présenter des propriétés pharmacocinétiques différentes ainsi qu’une action variable sur les deux principales COX. En effet, on différencie COX1, d’expression constitutive
Les principaux AINS utilisés chez les animaux de production appartiennent aux familles des salicylés, des pyrazolés, des fénamates, des propioniques, des oxicams et des coxibs (Coetzee, 2013a ; Riviere & Papich, 2018 ; Schoos et al., 2019).
Les salicylés comprennent l’acide salicylique (AMM bovins, porcins, chevaux) et l’acide acétylsalicylique (AMM bovins, caprins, ovins, porcins, chevaux), utilisés pour leur propriété antipyrétique (inhibition de la fièvre). Leur intérêt dans la gestion de la douleur est peu documenté (Coetzee, 2013a ; Schoos et al., 2019 ; Stillman & Whittaker, 2019).
Les pyrazolés comprennent la phénylbutazone (AMM chevaux) et le métamizole (ou dipyrone) (AMM bovins, porcins, chevaux). La phénylbutazone est utilisée dans la gestion des douleurs ostéoarticulaires chez le cheval mais cette molécule pouvant être mortelle chez l’être humain, son usage chez les animaux destinés à la consommation est prohibé (Coetzee, 2013a). Le métamizole ne possède qu’une faible activité anti-inflammatoire mais il présente la particularité d’une action antispasmodique forte, intéressante face aux douleurs viscérales (Schoos et al., 2019).
Les AINS propioniques comprennent le kétoprofène (AMM bovins, porcins, chevaux) et le carprofène (AMM bovins), disposant d’un effet anti-inflammatoire et analgésique puissant, indiqués en particulier pour les douleurs ostéoarticulaires. La plus forte sélectivité du carprofène vis-à-vis de COX2 que de COX1 réduit ses risques toxiques. Par ailleurs, sa demi-vie longue chez les bovins est susceptible de lui conférer une analgésie adéquate sur 24 heures (Coetzee, 2013a).
Les fénamates comprennent la flunixine (AMM bovins, porcins, chevaux) et l’acide tolfénamique (AMM bovins, porcins), ce dernier inhibant préférentiellement COX2. Les preuves d’un intérêt analgésique réel de la flunixine manquent cependant à ce jour concernant les animaux de production (Coetzee, 2013a ; Schoos et al., 2019).
Les oxicams, dont le méloxicam est le principal représentant en médecine vétérinaire (AMM bovins, porcins et chevaux), présentent une affinité préférentielle pour COX2 et ainsi une plus faible toxicité digestive et rénale (Coetzee, 2013a ; Riviere & Papich, 2018 ; Schoos et al., 2019). Parmi tous les AINS, le méloxicam est de loin celui pour lequel l’intérêt analgésique a été le plus démontré, dans de très nombreux contextes, dans toutes les espèces de production (Coetzee, 2013a ; Schoos et al., 2019 ; Stillman & Whittaker, 2019 ; Singh et al., 2024). Compte tenu de ces preuves accumulées d’efficacité, de sa facilité d’utilisation, par injection ou voie orale, de sa durée d’action relativement longue, de son coût raisonnable et de sa faible toxicité, cette molécule présente un intérêt majeur dans le contrôle de la douleur chez les animaux de production, en particulier en contexte postopératoire.
Enfin, les coxibs sont des inhibiteurs sélectifs de COX2 et à ce titre, les AINS avec la plus faible toxicité digestive (Riviere & Papich, 2018). Le seul actuellement disponible chez les animaux de production est le firocoxib (AMM chevaux), avec une indication pour les douleurs articulaires.
Le paracétamol, qui peut être classé parmi les AINS de par son mécanisme moléculaire mais qui ne présente pas d’activité anti-inflammatoire (Brunton & Knollmann, 2023), ne présente pas d’intérêt analgésique démontré à ce jour chez les animaux (Matsumiya et al., 2012 ; Schoos et al., 2019). Son usage (AMM chez le porc) est restreint à son effet antipyrétique (Schoos et al., 2019).
3.3. Mise en œuvre de l’analgésie : bilan et perspectives
Si nous prenons l’exemple de la réalisation d’une intervention d’élevage ou vétérinaire qui engendre de la douleur (par exemple l’écornage), celle-ci résulte de deux phases distinctes (de Boyer des Roches et al., 2025b ; dans ce numéro) : une phase aiguë, relativement courte et possiblement très intense lors du geste lui-même, et une phase secondaire, en grande partie inflammatoire, plus longue et d’intensité potentiellement encore intense avant décroissance (Coetzee, 2013a). L’existence de ces deux phases et l’intensité potentiellement très élevée de la douleur nécessitent le recours à une analgésie multimodale. Ainsi, la phase initiale doit justifier l’usage individuel ou combiné des trois premières classes abordées (opioïdes, alpha2-agonistes et anesthésiques locaux) tandis que la phase secondaire doit idéalement comprendre un AINS, auquel peut être ajouté (ou substitué si l’inflammation générée est faible) un opioïde (Coetzee, 2013a ; Stillman & Whittaker, 2019 ; Steagall et al., 2021 ; Reedman et al., 2022 ; Singh et al., 2024). La phase postopératoire peut aussi bénéficier de l’application d’anesthésiques locaux tels que le Tri-Solfen (Windsor, 2022). De nombreuses études ont relaté l’efficacité supérieure de l’association d’un anesthésique local et d’un AINS, voire d’un alpha2-agoniste, dans le contrôle de la douleur liée aux gestes réalisés chez les animaux d’élevage (castration, section de la queue, ébourgeonnage) en comparaison à l’usage d’une seule de ces molécules (Coetzee, 2013a ; Stillman & Whittaker, 2019 ; Steagall et al., 2021 ; Reedman et al., 2022 ; Singh et al., 2024).
Un écueil majeur dans la gestion de la douleur réside dans le temps d’action et la durée d’action des molécules utilisées. Un contrôle optimal de la douleur ne peut être obtenu que si le geste douloureux est réalisé lorsque l’analgésie est déjà pleinement opérationnelle et si le protocole utilisé confère une analgésie jusqu’à disparition de la stimulation nociceptive. Ces deux aspects peuvent aisément faire défaut en pratique, par exemple si l’on ne respecte pas le délai d’action de quelques minutes d’un anesthésique local ou si l’action analgésique postopératoire ne perdure que quelques heures alors que la douleur persiste plus longtemps. Il est en particulier probable que de nombreuses interventions douloureuses nécessiteraient la ré-administration d’un AINS (ou d’un opioïde) après 12 ou 24 heures. Pour cela, l’évaluation de la douleur dans les heures et les jours suivant une intervention douloureuse devrait être systématique, et d’autant plus que le ressenti douloureux varie entre individus.
Par exemple, pour l’ébourgeonnage
Parmi les options analgésiques, nous retiendrons les principaux éléments décrits ci-après :
a. Pour la réalisation d’un geste douloureux (castration, ébourgeonnage, coupe de queue, autres gestes chirurgicaux)
– L’usage d’un anesthésique local devrait être systématique.
La lidocaïne présente les meilleures propriétés pour cela (forte efficacité, action en quelques minutes et durée d’action d’environ une heure) et son usage est actuellement autorisé chez les chevaux et par extension, chez tous les animaux de production (« cascade ») mais avec des temps d’attente particuliers de 15 jours pour le lait et 28 jours pour la viande.
Le Tri-Solfen (gel pour application topique de lidocaïne, bupivacaïne, adrénaline et cétrimide) présente un intérêt démontré dans de nombreux contextes. L’analgésie qu’il procure étant superficielle, il devrait idéalement être couplé à une autre modalité d’analgésie (injection sous-cutanée de lidocaïne par exemple) pour la réalisation de la section cutanée initiale (lors d’une castration par exemple).
– L’usage d’un alpha2-agoniste peut renforcer l’action de l’anesthésique local et, par son effet sédatif, réduire le stress des animaux. L’accès à un alpha2-agoniste chez le porc serait à ce titre très intéressant.
– L’accès à des opioïdes chez les animaux de production serait une avancée majeure. Si les opioïdes forts nécessitent un encadrement réglementaire très strict, peu compatible avec un usage en élevage, l’utilisation de la buprénorphine semblerait possible sur le terrain, avec un bénéfice majeur attendu pour les animaux.
b. Pour les douleurs postopératoires
– L’usage d’un AINS devrait être systématique. À ce titre, le méloxicam, autorisé chez les bovins, les porcs et les chevaux et d’usage aisé, bénéficie de nombreuses preuves d’efficacité.
– Un opioïde tel que la buprénorphine présenterait un intérêt majeur dans le contrôle de la douleur postopératoire, seule ou en combinaison avec un AINS.
– Une évaluation de la douleur devrait être systématiquement pratiquée dans les heures et les jours suivant une intervention pour assurer une analgésie aussi longtemps que nécessaire, par le biais d’administrations renouvelées selon les besoins.
c. Pour les douleurs chroniques
Actuellement, seuls les AINS sont disponibles chez les animaux de production pour le contrôle des douleurs chroniques. Si leur intérêt est démontré dans les contextes inflammatoires tels que les douleurs ostéoarticulaires, la principale limitation tient dans leur durée d’action très courte (au mieux 24 heures) au regard de la situation chronique, ce qui n’autorise qu’une prise en charge parcellaire de ces douleurs. Si l’usage des AINS doit être encouragé dans les contextes de douleur chronique pour soulager la douleur et la détresse des animaux lors des phases les plus sévères, seule la prévention de ces douleurs chroniques représente une option satisfaisante à ce jour chez les animaux de production.
Conclusion et perspectives
La douleur existe en élevage et concerne toutes les espèces. Le cadre général de la gestion de la douleur est celui des 3S (Supprimer, Substituer, Soulager). Supprimer signifie éviter les douleurs évitables ; Substituer consiste à raffiner les pratiques, le matériel, et à améliorer les conditions du point de vue de l’animal ; Soulager concerne le raffinement, c’est-à-dire l’optimisation des approches (facteurs attentionnels et émotionnels) et l’usage des médicaments disponibles. Ainsi, une prise en charge multimodale combinant anesthésiques et analgésiques devrait permettre de respecter le principe de précaution visant à éviter toute souffrance aux animaux mis sous la responsabilité de l’être humain. Les perspectives de recherche sont nombreuses. Le recours à des grilles reposant sur des indicateurs validés permet de mieux monitorer les effets de la prise en charge de la douleur. L’élargissement de la pharmacopée et de son utilisation permettrait une amélioration du soulagement de la douleur. Enfin, les études évaluant l’impact des facteurs attentionnels et émotionnels sur le soulagement de la douleur et de l’inconfort* devront être développées chez les animaux de production. Chez les poissons et les oiseaux, les recherches, à ce jour trop peu nombreuses, doivent se poursuivre sur chacune des espèces puisque leur neuroanatomie diffère. La création d’un réseau à l’échelle nationale pourrait être envisagée, afin de coordonner des études de référence mono- ou multicentriques pour la validation de méthodes d’évaluation de la douleur et de protocoles de traitement de la douleur des animaux d’élevage.
Contribution des auteurs
Tous les auteurs de cet article ont élaboré les messages centraux, ont coconstruit le plan, ont rédigé une/plusieurs parties du texte en lien avec leur expertise, ont relu et approuvé la version finale du manuscrit. Alice de Boyer des Roches a coordonné le projet, la rédaction et la révision de l’article. Alice de Boyer des Roches et Fanny Pilot-Storck ont harmonisé les sections et finalisé les versions soumises.
Glossaire
Animal de production : Les animaux de production, également appelés animaux de rente, sont les animaux dont l’élevage est effectué en vue de la production de denrées alimentaires, de laine, de peaux ou d’autres fins agricoles.
Analgésie : Nous adoptons ici le terme d’analgésie au sens anglo-saxon pour désigner toutes les méthodes permettant de réduire ou supprimer une douleur et nous considérons donc comme analgésiques tous les principes actifs capables d’agir directement pour éviter ou soulager une douleur, qu’ils agissent dans le système nerveux central (opioïdes et alpha2-agonistes) ou en périphérie (AINS et anesthésiques locaux).
Anesthésie locale : Il s’agit de la perte dans un territoire des différentes sensibilités, incluant la nociception, provoquée par l’action d’un anesthésique local.
Antalgique : En français, les anti-inflammatoires non stéroïdiens sont parfois désignés sous le terme d’antalgiques (« qui luttent contre la douleur »). Nous les regroupons ici sous le terme plus large d’analgésiques.
Douleur : Il s’agit d’après la dernière définition de l’International Association for the Study of Pain (2020)
Inconfort : État affectif négatif induit par des stimuli internes ou externes n’induisant pas de lésion, caractérisé par une composante physique et émotionnelle et qui peut entraîner des modifications de comportements (Herskin et al., 2018).
Nociception : Processus neuronal d'encodage et de transmission des stimuli nocifs jusqu’au cortex cérébral.
Stress : Ensemble des réactions physiologiques et comportementales d’origine émotionnelle d’un individu face à une situation qu’il perçoit comme potentiellement menaçante (Veissier & Boissy, 2007).
Notes
- 1. Les mots suivis d’un astérisque à leur première occurrence dans le texte sont définis dans le glossaire.
- 2. https://www.anses.fr/fr/system/files/tableau%201%20-%2027%20mai%202024.pdf
- 3. https://www.anses.fr/fr/system/files/trisolfen003.pdf
- 4. COX1 est exprimée normalement et constamment dans différents organes par opposition à l’expression inductible de COX2.
- 5. https://www.veterinaire.fr/je-suis-veterinaire/mon-exercice-professionnel/les-fiches-professionnelles/mon-client-eleveur-souhaite-ecorner-ses-veaux
- 6. https://www.iasp-pain.org/publications/iasp-news/iasp-announces-revised-definition-of-pain/
Références
- Abramov, U., Kurrikoff, K., Matsui, T., & Vasar, E. (2009). Environmental enrichment reduces mechanical hypersensitivity in neuropathic mice, but fails to abolish the phenotype of CCK2 receptor deficient mice. Neuroscience Letters, 467(3), 230‑233. https://doi.org/10.1016/j.neulet.2009.10.043
- Alcasde. (2009). Final recommendations to DG SANCO regarding the alternatives to the dehorning. SANCO. http://www.alcasde.eu/
- Barbas, L. A. L., Torres, M. F., da Costa, B. M. P. A., Feitosa, M. J. M., Maltez, L. C., Amado, L. L., Toda, Y. P. S., dos Santos Batista, P., Cabral, D. A. C., & Hamoy, M. (2021). Eugenol induces body immobilization yet evoking an increased neuronal excitability in fish during short-term baths. Aquatic Toxicology, 231, 105734. https://doi.org/10.1016/j.aquatox.2020.105734
- Brunton, L. L., & Knollmann, B. C. (2023). Goodman and Gilman’s—The pharmacological basis of therapeutics (14th edition). McGraw Hill.
- Bushnell, M. C., Duncan, G. H., Hofbauer, R. K., Ha, B., Chen, J.-I., & Carrier, B. (1999). Pain perception: Is there a role for primary somatosensory cortex? Proceedings of the National Academy of Sciences, 96(14), 7705‑7709. https://doi.org/10.1073/pnas.96.14.7705
- Chatigny, F., Creighton, C. M., & Stevens, E. D. (2018). Updated Review of Fish Analgesia. Journal of the American Association for Laboratory Animal Science: JAALAS, 57(1), 5‑12. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5875091/
- Coetzee, J. F. (2013a). A Review of Analgesic Compounds Used in Food Animals in the United States. Veterinary Clinics of North America: Food Animal Practice, 29(1), 11-28. https://doi.org/10.1016/j.cvfa.2012.11.008
- Coetzee, J. F. (2013b). Assessment and Management of Pain Associated with Castration in Cattle. Veterinary Clinics of North America: Food Animal Practice, 29(1), 75‑101. https://doi.org/10.1016/j.cvfa.2012.11.002
- Costea, R., Ene, I., & Pavel, R. (2023). Pig Sedation and Anesthesia for Medical Research. Animals, 13(24), 3807. https://doi.org/10.3390/ani13243807
- de Boyer Des Roches, A., Colson, V., Guatteo, R., Terlouw, C., Barrière, D. A., Boitard, P.-M., Ledoux, D., Belloc, C., Mormède, P., Pottier, K., Kohlauer, M., & Pilot-Storck, F. (2025b). Vers une meilleure gestion de la douleur des mammifères et poissons destinés à la consommation humaine – Partie 1 : Concepts, mécanismes, causes, détection. In C. Ginane, E. Chaillou, & R. Baumont (Coord.), INRAE Productions Animales : Vol. 38(4) Numéro spécial : Bien-être animal : avancées scientifiques et innovations pour des systèmes d’élevage durables (9398). https://doi.org/10.20870/productions-animales.2025.38.4.9398
- de Boyer des Roches, A., Dumoulin, E., Roux, E., Guinotte, J., Brunet, V., & Otz, P. (2025a). Medical training in dairy heifers – A pilot study. Applied Animal Behaviour Science, 286, 106624. https://doi.org/10.1016/j.applanim.2025.106624
- de Boyer des Roches, A., Peyrecave-Capo, X., Rocafort-Ferrer, G., Thomas, A., Roche, H., Desjardins, I., Mounier, L., & Cadoré, J.-L. (2021). Welfare and management of decreased visual capacities and pain in a pony suffering from equine recurrent uveitis: A clinical case. Equine Veterinary Education, 33(11), e438‑e444. https://doi.org/10.1111/eve.13365
- Díaz-Rúa, A., Chivite, M., Comesaña, S., Conde-Sieira, M., & Soengas, J. L. (2022). The Opioid System in Rainbow Trout Telencephalon Is Probably Involved in the Hedonic Regulation of Food Intake. Frontiers in Physiology, 13. https://doi.org/10.3389/fphys.2022.800218
- Dumoulin, E. (2022). Effet à long terme d’une méthode d’apprentissage par renforcement positif sur le comportement des jeunes bovins laitiers [Thèse d’exercice vétérinaire, Université Lyon 1, VetAgro Sup]. DUMAS. https://dumas.ccsd.cnrs.fr/dumas-05168211v1/file/2023lyon017.pdf
- EURCAW. (2023). Environmental enrichment for ruminants & equines: The basics. EURCAW Ruminants & Equines. https://www.eurcaw-ruminants-equines.eu/knowledge_base/environmental-enrichment-for-ruminants-equines-the-basics/
- Farm Animal Welfare Council. (1992). FAWC updates the five freedoms. Veterinary Record, 131, 357.
- Gabriel, A. F., Marcus, M. A. E., Honig, W. M. M., Helgers, N., & Joosten, E. A. J. (2009). Environmental housing affects the duration of mechanical allodynia and the spinal astroglial activation in a rat model of chronic inflammatory pain. Brain Research, 1276, 83‑90. https://doi.org/10.1016/j.brainres.2009.04.039
- Gabriel, A. F., Marcus, M. A. E., Honig, W. M. M., & Joosten, E. A. J. (2010a). Preoperative housing in an enriched environment significantly reduces the duration of post-operative pain in a rat model of knee inflammation. Neuroscience Letters, 469(2), 219‑223. https://doi.org/10.1016/j.neulet.2009.11.078
- Gabriel, A. F., Paoletti, G., Seta, D. D., Panelli, R., Marcus, M. A. E., Farabollini, F., Carli, G., & Joosten, E. A. J. (2010b). Enriched environment and the recovery from inflammatory pain: Social versus physical aspects and their interaction. Behavioural Brain Research, 208(1), 90‑95. https://doi.org/10.1016/j.bbr.2009.11.015
- Garcia, P. (2023). Petit guide illustré pour préparer son bovin aux concours agricoles. Une approche éthologique. Éditions France Agricole. https://www.decitre.fr/livres/petit-guide-illustre-pour-preparer-son-bovin-aux-concours-agricoles-9782855578446.html
- Gaynor, J. S., & Muir, W. W. (Eds.). (2015). Handbook of Veterinary Pain Management. Elsevier. https://doi.org/10.1016/C2010-0-67083-0
- Glerup, P., Bratbo, D., Mølgaard, S., & Andersen, L. (2010). The use of positive reinforcement in Göttingen minipigs. Toxicology Letters, 196, S248‑S249. https://doi.org/10.1016/j.toxlet.2010.03.832
- Graham, M. L. (2017). Positive reinforcement training and research. In S. J. Schapiro, & S. J. Schapiro (Eds), Handbook of Primate Behavioral Management (pp. 187‑200). CRC Press. https://doi.org/10.1201/9781315120652
- Guatteo, R., Levionnois, O., Fournier, D., Guémené, D., Latouche, K., Leterrier, C., Mormède, P., Prunier, A., Servière, J., Terlouw, C., & Le Neindre, P. (2012). Minimising pain in farm animals: The 3S approach – ‘Suppress, Substitute, Soothe’. Animal, 6(8), 1261‑1274. https://doi.org/10.1017/S1751731112000262
- Heinsius, J. L., Lomb, J., Lee, J. H. W., von Keyserlingk, M. A. G., & Weary, D. M. (2023). Training dairy heifers with positive reinforcement: Effects on anticipatory behavior. Journal of Dairy Science, 107(2), 1143-1150. https://doi.org/10.3168/jds.2023-23709
- Herskin, M. S., & Nielsen, B. H. (2018). Welfare Effects of the Use of a Combination of Local Anesthesia and NSAID for Disbudding Analgesia in Dairy Calves—Reviewed Across Different Welfare Concerns. Frontiers in Veterinary Science, 5, 117. https://doi.org/10.3389/fvets.2018.00117
- Houpt, K. A. (2018). Domestic Animal Behaviour for Veterinarians and Animal Scientists (6th edition). Wiley Blackwell. https://blackwells.co.uk/bookshop/product/Domestic-Animal-Behaviour-for-Veterinarians-and-Animal-Scientists-by-Katherine-A-Houpt-author/9781119232766
- Jahangeer, A.-C., Mellier, D., & Caston, J. (1997). Influence of Olfactory Stimulation on Nociceptive Behavior in Mice. Physiology & Behavior, 62(2), 359‑366. https://doi.org/10.1016/S0031-9384(97)00024-3
- Katzung, B. G., & Vanderah, T. W. (2021). Basic and clinical pharmacology (15th edition). McGraw Hill.
- Kling-Eveillard, F., Dockes, A. C., Ribaud, D., & Mirabito, L. (2009). L’écornage des bovins en France : état des lieux des pratiques et des représentations [Communication]. 16es Rencontres autour des Recherches sur les Ruminants, Paris. https://journees3r.fr/textes3r/20090701-lecornage-des-bovins-en-france-etat-des-lieux-des-pratiques-et-des-representations/
- Larrondo, C., Orihuela, A., Strappini, A., Acosta-Jamett, G., Mota-Rojas, D., & Gallo, C. (2021). Provision of straw and the presence of undocked lambs reduce the behavioural and physiological expressions of pain and stress associated with tail docking in lambs: A preliminary study. Animal Production Science, 61(4), 423-431. https://doi.org/10.1071/AN20237
- Le Neindre, P., Guatteo, R., Guémené, D., Guichet, J. L., Latouche, K., Leterrier, C., Levionnois, O., Mormède, P., Prunier, A., Serrie, A., & Servière, J. (2009). Douleurs animales. Les identifier, les comprendre, les limiter chez les animaux d’élevage (Synthèse du rapport d’expertise réalisé par l’INRA à la demande du Ministère de l’Alimentation, de l’Agriculture et de la Pêche et du Ministère de l’Enseignement Supérieur et de la Recherche). INRA. https://www.inrae.fr/sites/default/files/pdf/ce6134a6e6437d208ea4f10b2b9b3744.pdf
- Lomb, J., Mauger, A., von Keyserlingk, M. A. G., & Weary, D. M. (2021). Effects of positive reinforcement training for heifers on responses to a subcutaneous injection. Journal of Dairy Science, 104(5), 6146‑6158. https://doi.org/10.3168/jds.2020-19463
- Martins, T., Valentim, A., Pereira, N., & Antunes, L. M. (2019). Anaesthetics and analgesics used in adult fish for research: A review. Laboratory Animals, 53(4), 325‑341. https://doi.org/10.1177/0023677218815199
- Matsumiya, L. C., Sorge, R. E., Sotocinal, S. G., Tabaka, J. M., Wieskopf, J. S., Zaloum, A., King, O. D., & Mogil, J. S. (2012). Using the Mouse Grimace Scale to Reevaluate the Efficacy of Postoperative Analgesics in Laboratory Mice. Journal of the American Association for Laboratory Animal Science, 51(1), 42-49. https://pubmed.ncbi.nlm.nih.gov/22330867/
- Miron, D., Duncan, G. H., & Bushnell, C. M. (1989). Effects of attention on the intensity and unpleasantness of thermal pain. Pain, 39(3), 345‑352. https://doi.org/10.1016/0304-3959(89)90048-1
- Pearson, G. (2015a). Practical application of equine learning theory, part 1. In Practice, 37(5), 251‑254. https://doi.org/10.1136/inp.h2046
- Pearson, G. (2015b). Practical application of equine learning theory, part 2. In Practice, 37(6), 286‑292. https://doi.org/10.1136/inp.h2483
- Perlman, J. E., Bloomsmith, M. A., Whittaker, M. A., McMillan, J. L., Minier, D. E., & McCowan, B. (2012). Implementing positive reinforcement animal training programs at primate laboratories. Applied Animal Behaviour Science, 137(3-4), 114‑126. https://doi.org/10.1016/j.applanim.2011.11.003
- Pluchot, C., Adriaensen, H., Parias, C., Dubreuil, D., Arnould, C., Chaillou, E., & Love, S. A. (2024). Sheep (Ovis aries) training protocol for voluntary awake and unrestrained structural brain MRI acquisitions. Behavior Research Methods, 56(7), 7761‑7773. https://doi.org/10.3758/s13428-024-02449-6
- Prunier, A., Mounier, L., Le Neindre, P., Leterrier, C., Mormède, P., Paulmier, V., Prunet, P., Terlouw, C., & Guatteo, R. (2013). Identifying and monitoring pain in farm animals: A review. Animal, 7(6), 998‑1010. https://doi.org/10.1017/s1751731112002406
- Pryor, K. (2002). Don’t Shoot the Dog! The New Art of Teaching and Training. Interpet.
- Ramirez, K. (2012). Marine Mammal Training: The History of Training Animals for Medical Behaviors and Keys to Their Success. Veterinary Clinics of North America: Exotic Animal Practice, 15(3), 413‑423. https://doi.org/10.1016/j.cvex.2012.06.005
- Reedman, C. N., Duffield, T. F., DeVries, T. J., Lissemore, K. D., & Winder, C. B. (2022). Graduate Student Literature Review: Role of pain mitigation on the welfare of dairy calves undergoing disbudding*. Journal of Dairy Science, 105(8), 6809‑6819. https://doi.org/10.3168/jds.2021-21349
- Ritter, J. M., Flower, R. J., & Rang, H. P. (2007). Rang and Dale’s pharmacology (6th edition). Elsevier Health Sciences.
- Riviere, J. E., & Papich, M. G. (2018). Veterinary pharmacology and therapeutics (10th edition). Wiley Blackwell.
- Roche, H. (2013). Motiver son cheval : Clicker et récompenses (1re édition). BELIN.
- Roche, H. (2023). Préparer son cheval aux soins vétérinaires : Medical training pour chevaux, poneys et ânes (1re édition). Éditions Vigot.
- Rode, S., Salkovskis, P. M., & Jack, T. (2001). An experimental study of attention, labelling and memory in people suffering from chronic pain. PAIN, 94(2), 193‑203. https://doi.org/10.1016/S0304-3959(01)00356-6
- Rostang, A., Belloc, C., Maridor, M. L., & Pouliquen, H. (2022). La pharmacie vétérinaire – un enjeu majeur pour un élevage durable. In E. Baéza, N. Bareille & C. Ducrot (Coord.), INRAE Productions Animales : Vol.35(4) Numéro spécial : Rationaliser l’usage des médicaments en élevage (pp. 245‑256). https://doi.org/10.20870/productions-animales.2022.35.4.7181
- Rushen, J., Boissy, A., Terlouw, E. M. C., & de Passillé, A. M. B. (1999). Opioid peptides and behavioral and physiological responses of dairy cows to social isolation in unfamiliar surroundings. Journal of Animal Science, 77(11), 2918‑2924. https://doi.org/10.2527/1999.77112918x
- Russell, W. M. S., & Burch, R. L. (1959). The principles of humane experimental technique. Methuen.
- Schoos, A., Devreese, M., & Maes, D. G. (2019). Use of non-steroidal anti-inflammatory drugs in porcine health management. Veterinary Record, 185(6), 172. https://doi.org/10.1136/vr.105170
- Schroeder, P. G., & Sneddon, L. U. (2017). Exploring the efficacy of immersion analgesics in zebrafish using an integrative approach. Applied Animal Behaviour Science, 187, 93‑102. https://doi.org/10.1016/j.applanim.2016.12.003
- Singh, P., Venkatachalam, D., Kongara, K., & Chambers, P. (2024). Pain Mitigation Strategies for Disbudding in Goat Kids. Animals, 14(4), 555. https://doi.org/10.3390/ani14040555
- Smith, M. A., Bryant, P. A., & McClean, J. M. (2003). Social and environmental enrichment enhances sensitivity to the effects of kappa opioids: Studies on antinociception, diuresis and conditioned place preference. Pharmacology Biochemistry and Behavior, 76(1), 93‑101. https://doi.org/10.1016/S0091-3057(03)00189-8
- Smith, M. A., Chisholm, K. A., Bryant, P. A., Greene, J. L., McClean, J. M., Stoops, W. W., & Yancey, D. L. (2005). Social and environmental influences on opioid sensitivity in rats: Importance of an opioid’s relative efficacy at the mu-receptor. Psychopharmacology, 181(1), 27‑37. https://doi.org/10.1007/s00213-005-2218-2
- Sneddon, L. U. (2012). Clinical Anesthesia and Analgesia in Fish. Journal of Exotic Pet Medicine, 21(1), 32‑43. https://doi.org/10.1053/j.jepm.2011.11.009
- Stafford, K. J., & Mellor, D. J. (2005). Dehorning and disbudding distress and its alleviation in calves. The Veterinary Journal, 169(3), 337‑349. https://doi.org/10.1016/j.tvjl.2004.02.005
- Steagall, P. V., Bustamante, H., Johnson, C. B., & Turner, P. V. (2021). Pain Management in Farm Animals: Focus on Cattle, Sheep and Pigs. Animals, 11(6), 1483. https://doi.org/10.3390/ani11061483
- Stillman, M. W., & Whittaker, A. L. (2019). Use and Efficacy of Analgesic Agents in Sheep (Ovis aries) Used in Biomedical Research. Journal of the American Association for Laboratory Animal Science, 58(6), 755‑766. https://doi.org/10.30802/AALAS-JAALAS-19-000036
- Stilwell, G., Carvalho, R. C., Carolino, N., Lima, M. S., & Broom, D. M. (2010). Effect of hot-iron disbudding on behaviour and plasma cortisol of calves sedated with xylazine. Research in Veterinary Science, 88(1), 188‑193. https://doi.org/10.1016/j.rvsc.2009.06.012
- Valentim, A. M., Félix, L. M., Carvalho, L., Diniz, E., & Antunes, L. M. (2016). A New Anaesthetic Protocol for Adult Zebrafish (Danio rerio): Propofol Combined with Lidocaine. PLoS ONE, 11(1), e0147747. https://doi.org/10.1371/journal.pone.0147747
- Veissier, I., & Boissy, A. (2007). Stress and welfare: Two complementary concepts that are intrinsically related to the animal’s point of view. Physiology & Behavior, 92(3), 429-433. https://doi.org/10.1016/j.physbeh.2006.11.008
- Villemure, C., & Bushnell, C. M. (2002). Cognitive modulation of pain: How do attention and emotion influence pain processing? Pain, 95(3), 195‑199. https://doi.org/10.1016/S0304-3959(02)00007-6
- Viscardi, A. V., & Turner, P. V. (2018). Efficacy of buprenorphine for management of surgical castration pain in piglets. BMC Veterinary Research, 14(1), 318. https://doi.org/10.1186/s12917-018-1643-5
- Windsor, P. A. (2022). Role of Topical Anaesthesia in Pain Management of Farm Animals, a Changing Paradigm. Animals, 12(18), 2459. https://doi.org/10.3390/ani12182459
- Yin, S. (2009). Low Stress Handling® Restraint and Behavior Modification of Dogs & Cats. Cattledog publishing. https://cattledogpublishing.com/
- Zahl, I. H., Samuelsen, O., & Kiessling, A. (2012). Anaesthesia of farmed fish: Implications for welfare. Fish Physiology and Biochemistry, 38(1), 201‑218. https://doi.org/10.1007/s10695-011-9565-1
Résumé
Après un premier article consacré à la douleur chez les animaux de production, cet article propose de dresser un état des lieux des connaissances scientifiques sur la gestion de la douleur chez les animaux de production destinés à la consommation humaine, à la fois chez les mammifères et les poissons. Le soulagement de la douleur repose notamment sur sa prise en charge pharmacologique. Quatre familles de molécules sont ou pourraient être mobilisables pour une analgésie multimodale : les anesthésiques locaux, les α2-agonistes, les anti-inflammatoires et les opioïdes. En complément, la douleur peut être gérée par une approche dite éthologique, qui repose sur les facteurs émotionnels et attentionnels, ou sur l’entraînement des animaux.
Pièces jointes
Pas de document complémentaire pour cet article##plugins.generic.statArticle.title##
 Vues: 721
Vues: 721
Téléchargements
 PDF: 28
PDF: 28
Articles les plus lus par le même auteur ou la même autrice
- Pierre MORMEDE, Lucille BOISSEAU-SOWINSKI, Julie CHIRON, Claire DIEDERICH, John EDDISON, Jean-Luc GUICHET, Pierre LE NEINDRE, Marie-Christine MEUNIER-SALAÜN, Bien-être animal : contexte, définition, évaluation , INRAE Productions Animales: Vol. 31 No 2 (2018)
- Philippe FAVERDIN, Clément ALLAIN, Raphaël GUATTEO, Nathalie HOSTIOU, Isabelle VEISSIER, Élevage de précision : De nouvelles informations utiles pour la décision ? , INRAE Productions Animales: Vol. 33 No 4 (2020)
- Antoine ROSTANG, Catherine BELLOC, Mily LEBLANC MARIDOR, Hervé POULIQUEN, La pharmacie vétérinaire – un enjeu majeur pour un élevage durable , INRAE Productions Animales: Vol. 35 No 4 (2022): Rationaliser l'usage des médicaments en élevage
- Isabelle VEISSIER, Florence KLING-EVEILLARD, Marie-Madeleine MIALON, Mathieu SILBERBERG, Alice DE BOYER DES ROCHES, Claudia TERLOUW, Dorothée LEDOUX, Bruno MEUNIER, Nathalie HOSTIOU, Élevage de précision et bien-être en élevage : la révolution numérique de l’agriculture permettra-t-elle de prendre en compte les besoins des animaux et des éleveurs ? , INRAE Productions Animales: Vol. 32 No 2 (2019): Volume 32 Numéro 2 : Numéro spécial. De grands défis et des solutions pour l'élevage
- Christian DUCROT, Cécile ADAM, Florence BEAUGRAND, Catherine BELLOC, Julie BLUHM, Claire CHAUVIN, Marina CHOLTON, Lucie COLLINEAU, Julien FAISNEL, Nicolas FORTANÉ, Florence HELLEC, Anne HÉMONIC, Nathalie JOLY, Guillaume LHERMIE, Marie-Angélina MAGNE, Mathilde PAUL, Axelle POIZAT, Didier RABOISSON, Nathalie ROUSSET, Apport de la sociologie à l’étude de la réduction d’usage des antibiotiques , INRAE Productions Animales: Vol. 31 No 4 (2018)
- Christian DUCROT, Maria Belén BARRIO, Alain BOISSY, François CHARRIER, Sergine EVEN, Pierre MORMÈDE, Sandrine PETIT, Marie-Hélène PINARD-VAN DER LAAN, François SCHELCHER, François CASABIANCA, Alain DUCOS, Gilles FOUCRAS, Raphaël GUATTEO, Jean-Louis PEYRAUD, Muriel VAYSSIER-TAUSSAT, Patrick VEYSSET, Nicolas C. FRIGGENS, Xavier FERNANDEZ, Améliorer conjointement la santé et le bien-être des animaux dans la transition des systèmes d’élevage vers la durabilité , INRAE Productions Animales: Vol. 37 No 3 (2024)
- Mathilde PAUL, Mily LEBLANC-MARIDOR, Nathalie ROUSSET, Anne HEMONIC, Jocelyn MARGUERIE, Philippe le COZ, Bernadette le NORMAND, Jonathan HERCULE, Christine ROGUET, Claire CHAUVIN, Catherine BELLOC, Christian DUCROT, Réduction de l’usage des antibiotiques en filières monogastriques : état d’avancement et perspectives , INRAE Productions Animales: Vol. 35 No 4 (2022): Rationaliser l'usage des médicaments en élevage
- Mohammed GAGAOUA, Claudia TERLOUW, Brigitte PICARD, Apport de la protéomique à la découverte de biomarqueurs pour l’étude de la couleur de la viande bovine , INRAE Productions Animales: Vol. 34 No 3 (2021)
- Catherine BELLOC, Marie-Jeanne GUENIN, Mily LEBLANC-MARIDOR, Anne HEMONIC, Nathalie ROUSSET, Yannick CARRÉ, Charles FACON, Philippe LE COZ, Jocelyn MARGUERIE, Jean-Marc PETIOT, Maxime JARNOUX, Mathilde PAUL, Sophie MOLIA, Christian DUCROT, Réflexion participative pour une optimisation de l’usage d’antibiotiques garantissant santé et bien-être des porcs et volailles , INRAE Productions Animales: Vol. 35 No 4 (2022): Rationaliser l'usage des médicaments en élevage
- Alain BOISSY, Pierre MORMÈDE, Le bien-être des animaux d’élevage : véritable objet scientifique et politique , INRAE Productions Animales: Vol. 38 No 4 (2025): Numéro spécial : Bien-être animal : avancées scientifiques et innovations pour des systèmes d’élevage durables

