La pharmacie vétérinaire – un enjeu majeur pour un élevage durable Full text available in English
Chapeau
La pharmacie vétérinaire est une composante importante de la gestion de la santé et du bien-être des animaux d’élevage. Bien utiliser le médicament reste indispensable pour un élevage plus durable. Une bonne compréhension de l’environnement règlementaire, du besoin des filières et des enjeux d’avenir est essentielle pour répondre à ces nouveaux besoins.
Introduction
La pharmacie vétérinaire est un enjeu majeur dans les élevages. Les pratiques thérapeutiques évoluent peu à peu. Ainsi, l’utilisation des anti-infectieux (antibiotiques, antiparasitaires) est moins systématique et plus raisonnée aujourd’hui, alors qu’à l’inverse, l’utilisation des antidouleurs se généralise. L’une des difficultés pour l’éleveur est la multiplicité des intervenants, à l’origine de conseils plus ou moins contradictoires. Le vétérinaire, par ses compétences spécifiques, doit rester l’interlocuteur privilégié, l’équivalent de notre « médecin traitant », comme chef d’orchestre de la santé du troupeau. Parfois, pour différentes raisons (coût, disponibilité, ou autre), ce rôle lui échappe. Pourtant, pour chaque traitement, de quelque nature qu’il soit, c’est le plus apte à évaluer la balance bénéfices/risques pour les animaux, mais aussi pour l’Homme et l’environnement.
Cette communication a pour objectif de présenter le médicament vétérinaire chez les animaux de production, son rôle et ses enjeux, dans un environnement règlementaire, scientifique, économique et sociétal complexe. Elle est, pour ce faire, structurée en trois parties. La première partie présente les particularités règlementaires du médicament vétérinaire. La deuxième partie détaille les principaux usages de la pharmacie vétérinaire en France aujourd’hui, pour comprendre les besoins des différentes filières. La dernière partie se concentre sur les principaux enjeux d’avenir autour du médicament vétérinaire, en illustrant les principales problématiques que l’élevage doit surmonter : image dégradée auprès du grand public, lutte contre les résistances aux anti-infectieux, prise en compte du bien-être animal, de l’écotoxicité et de l’impact des traitements sur la biodiversité, respect des contraintes liées aux chartes et labels. En France, comme en Europe, l’élevage est plus que jamais à un carrefour qui le force à se réinventer.
1. Le médicament vétérinaire, une règlementation très stricte pour un produit pas comme les autres
Lorsque l'on évoque la notion de pharmacie vétérinaire, on pense d'abord aux médicaments qui vont être utilisés en élevage (par exemple, des antibiotiques, des antiparasitaires, des vaccins ou des anti-inflammatoires). Pourtant, pris dans un sens plus large, on pourrait également inclure dans la pharmacie d'élevage certains biocides (par exemple, produits d'hygiène pour l'antisepsie des trayons en élevage laitier, insecticides destinés à lutter contre les mouches en bâtiment ou produits destinés à la lutte contre les rongeurs), certains additifs alimentaires (par exemple compléments minéraux et vitaminiques pour l'alimentation des animaux, conservateurs pour l'ensilage ou coccidiostatiques en alimentation des volailles) et certains produits dits alternatifs (extraits de plantes ou huiles essentielles). Nous nous limiterons ici à une présentation des médicaments vétérinaires, mais le lecteur pourra trouver, en encadrés, des informations sur les autres catégories de produits utilisés, les biocides (encadré 1), les additifs (encadré 2) et sur les pratiques complémentaires (encadré 3) et alternatives.
Encadré 1. Qu’est-ce qu’un biocide ?
Les produits biocides sont des produits destinés à détruire, repousser ou rendre inoffensifs les organismes nuisibles. Ce sont par définition des produits actifs et donc susceptibles d’induire des effets néfastes sur l’homme, l’animal ou l’environnement. Le règlement européen 528/2012 relatif à la mise à disposition sur le marché et à l’utilisation des produits biocides est entré en application le 1er septembre 2013. Il a pour objectif d’assurer la mise sur le marché de produits biocides efficaces dont les risques liés à l’utilisation sont maîtrisés. La mise en œuvre réglementaire s’articule en deux étapes : i) une évaluation des substances actives biocides aboutissant ou non à leur approbation, puis ii) une évaluation des produits qui les contiennent en vue de l’obtention d’une autorisation de mise sur le marché (AMM). Le ministère en charge de l'Ecologie, du Développement durable et de l'Energie est l'autorité compétente française pour les produits biocides et délivre les autorisations de mise sur le marché des produits biocides.
Il existe 22 types de produits biocides (TP) répartis en 4 groupes : les désinfectants, les produits de protection (conservateurs, protection du bois), les produits de lutte contre les nuisibles, et les autres. Parmi les produits biocides, on retrouve des désinfectants à activité antimicrobienne pour désinfection des surfaces (TP2), des antiseptiques pour utilisation sur la peau ou les muqueuses des animaux (TP3), des rodenticides (TP14), mais aussi des insecticides ou acaricides pour la gestion des infestations par différents arthropodes comme les mouches ou les poux rouges (TP18). La frontière est donc parfois ténue entre un biocide et un médicament. Ainsi, un produit, présenté pour lutter contre les infestations par les mouches, contenant de la perméthrine, et s’administrant directement sur le dos des bovins, avait été mis sur le marché en tant que produit biocide. Estimant qu’il s’agit d’un médicament vétérinaire antiparasitaire, l’Anses a prononcé la suspension de la mise sur le marché de ce produit en 2016. Le tribunal administratif de Nîmes a annulé cette suspension en 2019. La Cour administrative d’appel de Marseille a annulé ce dernier jugement en 2021. Elle a considéré que, si le produit répond bien à la définition d’un biocide, à ce titre commercialisable à grande échelle sans réel contrôle de son utilisation, il répond aussi à celle d’un médicament vétérinaire par fonction et par présentation, susceptible de surcroît de présenter un risque pour la santé animale et humaine. Ce produit doit donc être considéré comme médicament vétérinaire et se conformer à cette règlementation. Mais le parcours judiciaire a été long pour parvenir à ce jugement.
Les produits biocides sont disponibles à la vente en libre-service, mais certains d’entre eux sont interdits de vente à des utilisateurs non professionnels (par exemple ceux pour lesquels l’apparition de résistances est suspectée ou établie). Les contraintes quant à la production, la qualité, l’évaluation du risque et la délivrance des biocides sont moindres que celles exigées pour les médicaments, même si ces exigences se sont fortement renforcées ces dernières années, et les contrôles sont de plus en plus fréquents.
Un nouveau règlement européen (2019/6) relatif au médicament vétérinaire (125 pages) et un nouveau règlement européen (2019/4) relatif aux aliments médicamenteux et aux produits intermédiaires (22 pages) sont applicables sans transposition en droit national depuis le 28 janvier 2022. Cette présentation s’appuiera donc exclusivement sur cette nouvelle règlementation européenne.
1.1. Définitions
On entend par médicament toute substance ou toute association de ces substances qui remplit au moins l’une des conditions suivantes :
a) elle est présentée comme possédant des propriétés curatives ou préventives à l’égard des maladies animales ;
b) elle a pour but d’être utilisée chez l’animal ou de lui être administrée en vue de restaurer, de corriger ou de modifier des fonctions physiologiques en exerçant une action pharmacologique, immunologique ou métabolique ;
c) elle a pour but d’être utilisée sur des animaux en vue d’établir un diagnostic médical ;
d) elle a pour but d’être utilisée pour « l’euthanasie d’animaux ».
En analysant cette définition règlementaire, on distingue donc les médicaments par présentation ou par fonction :
- Les médicaments par présentation (a) : ce sont des « substances ou compositions présentées comme possédant des propriétés curatives ou préventives ». Par exemple, ce peut être une préparation présentée comme « traitement des mammites cliniques causées par les staphylocoques et les streptocoques », ce qui la classe donc comme médicament par présentation. À noter que cette présentation peut être explicite (comme dans l’exemple ci-dessus) ou implicite (par exemple une forme galénique particulière telle qu’une solution injectable).
- Les médicaments par fonction (b) : ce sont des « substances ou compositions qui vont permettre de restaurer, corriger ou modifier les fonctions biologiques ». Par exemple, ce peut être une substance exerçant une action pharmacologique de type anti-inflammatoire. Cette deuxième catégorie élargit considérablement le champ de qualification, que l’on pourrait même étendre à l’aliment ! La limite a été fixée par l'administration : seul est considéré comme médicament ce qui est administré avec une intention thérapeutique, même si elle n'est pas expressément indiquée.
Au sein des médicaments, on distingue :
- Les spécialités pharmaceutiques, c’est-à-dire tout médicament préparé à l'avance, présenté sous un conditionnement particulier et caractérisé par une dénomination spéciale (article L.5111-2 du CSP). C’est la forme classique à laquelle on pense lorsque l’on parle de médicaments, celle que l’on peut obtenir habituellement en pharmacie.
- Les auto-vaccins à usage vétérinaire sont, pour simplifier, des médicaments vétérinaires immunologiques inactivés qui sont fabriqués à partir d’agents pathogènes ou d’antigènes issus d’un ou de plusieurs animaux appartenant à l'élevage concerné. Ces médicaments sont employés principalement en élevage monogastrique ou en pisciculture à ce jour. Il n’existe actuellement que trois laboratoires agréés en France pour leur fabrication.
- Les préparations magistrales, préparations extemporanées, réalisées selon une prescription vétérinaire, par une personne habilitée, et destinées à un animal ou à des animaux d'une même exploitation. Il peut s’agir de préparations à partir de matières premières à usage pharmaceutique, mais également à partir d’extraits de plantes ou d’huiles essentielles.
Encadré 2. Qu’est-ce qu’un additif ?
Les additifs destinés à l'alimentation animale sont des produits utilisés dans la nutrition des animaux pour leurs effets sur les aliments eux-mêmes, sur les animaux, sur les produits alimentaires obtenus à partir d’animaux ayant consommé cet additif, ou sur l'environnement. Par exemple, des additifs sont utilisés pour améliorer la saveur des aliments, pour répondre à des besoins en nutriments ou pour renforcer la performance d’animaux en bonne santé.
Les additifs utilisés en alimentation animale peuvent notamment être :
- des additifs technologiques (conservateurs, antioxydants, émulsifiants, régulateurs d’acidité ou additifs pour l'ensilage…),
- des additifs sensoriels (arômes, colorants…),
- des additifs nutritionnels (vitamines, aminoacides et oligo-éléments…),
- des additifs zootechniques (agents améliorant la digestibilité…),
- des coccidiostatiques (antiparasitaires).
Les additifs destinés à l'alimentation animale ne peuvent être mis sur le marché que s'ils ont été autorisés à la suite d'une évaluation scientifique menée par l'EFSA (European Food Safety Authority) et démontrant que l'additif n'a aucun effet néfaste ni sur la santé humaine et animale, ni sur l'environnement.
1.2. Autorisation de mise sur le marché (AMM)
Toute spécialité pharmaceutique ne peut être commercialisée qu’après obtention d’une décision favorable par une autorité compétente : l’autorisation de mise sur le marché ou AMM. Cette décision est fondée sur une évaluation préalable de sa qualité, de son innocuité et de son efficacité. L’AMM peut être accordée suite à une procédure nationale (via l’ANMV - Agence Nationale du Médicament Vétérinaire) ou plus généralement suite à une procédure communautaire (via le CVMP - Committee for Medicinal Products for Veterinary Use). Toutefois, pour certains médicaments homéopathiques, en l’absence de toute indication thérapeutique particulière, un simple enregistrement peut être suffisant.
Le dossier exigible pour obtenir l’AMM est très encadré. Il est constitué de plusieurs éléments, administratifs, techniques et scientifiques, répartis en quatre parties selon le format communautaire :
- Partie I, appelée résumé du dossier. Elle comprend notamment le Résumé des Caractéristiques du Produit (RCP). Il présente les particularités pharmaceutiques, pharmacologiques, toxicologiques et thérapeutiques du médicament, validées et approuvées par l’autorité compétente. Il est utilisé comme guide du bon usage du médicament et comme référence juridique pour l’établissement des responsabilités du prescripteur, du dispensateur et de l’utilisateur au regard de ses conditions d’emploi. Il comporte également les informations devant figurer sur l’étiquetage, la notice technique et les publicités.
- Partie II, appelée qualité. Elle comprend notamment les compositions qualitative et quantitative des composants du médicament, les informations relatives à son développement pharmaceutique et galénique, la description du mode et des conditions de sa fabrication, la description des techniques de contrôle des matières premières et du produit fini, ainsi que les protocoles et les résultats des essais de stabilité justifiant la durée de validité annoncée du médicament.
- Partie III, appelée innocuité et études de résidus. D’une part, elle contient de très nombreuses informations toxicologiques permettant une évaluation du risque, à la fois pour les espèces animales cibles, pour l’homme utilisateur (par exemple l’éleveur ou le vétérinaire) ou pour l’environnement (écotoxicologie). D’autre part, elle contient des études relatives à la déplétion des résidus dans les aliments d’origine animale (lait, muscle, foie, rein…), éléments indispensables à la détermination d’un temps d’attente (voir partie suivante).
- Partie IV, appelée efficacité. Elle comporte les résultats des études précliniques, et des études cliniques réalisées en conditions de laboratoire et de terrain.
L'AMM est donc fondée sur une évaluation stricte de la qualité, du bénéfice (efficacité) et du risque (innocuité) du médicament, par une autorité publique indépendante. L'AMM n'est octroyée que si le rapport bénéfices/risques est jugé favorable, notamment en fonction de la maladie traitée et des thérapeutiques existantes. Elle garantit à l’utilisateur un très haut niveau de connaissance du médicament considéré. Elle s’accompagne d’un suivi post-AMM (pharmacovigilance) qui vise à compléter les données d’innocuité (voire d’efficacité) pour l’animal, l’Homme et l’environnement.
Encadré 3. Pratiques complémentaires et alternatives.
Les pratiques complémentaires correspondent à des pratiques non traditionnelles utilisées conjointement avec la médecine conventionnelle, alors que les pratiques alternatives se réfèrent à des pratiques non traditionnelles utilisées à la place de la médecine conventionnelle. Ces pratiques sont fondées sur les meilleures données probantes disponibles, même lorsque ces données ne satisfont pas aux critères les plus stricts en matière d'efficacité et de sécurité. On peut citer notamment l’utilisation de produits à base de plantes ou d’extraits de plantes, d’huiles essentielles, etc… Selon le choix fait par l’industriel au moment de la mise sur le marché, ces produits peuvent être commercialisés comme médicament, comme biocide ou comme additifs, en répondant aux exigences règlementaires spécifiques requises. Mais le plus souvent, ces produits ne répondent à aucune de ces règlementations, sans bloquer pour autant leur commercialisation !
Ainsi, à moins qu’ils ne disposent d’un statut de médicament, de biocide ou d’additif, ces produits soulèvent un certain nombre de questions en 2022 :
- sur la qualité : leur production ne répond à aucun cahier des charges contraignant, ni système de contrôle extérieur. La vérification notamment des teneurs en impuretés ou en polluants dépend uniquement du bon vouloir du producteur. Par définition, surtout en phytothérapie, la composition du produit varie en fonction de la matière première, ce qui complexifie la répétabilité des traitements.
- sur l’innocuité : en productions animales, l’une des questions est relative à la sécurité de ces produits pour le consommateur de denrées animales. Par exemple, une huile essentielle, substance lipophile appliquée sur une mamelle de vache en lactation, se retrouvera nécessairement dans le lait de l’animal. Pourtant, le temps d’attente appliqué sera généralement nul. Contrairement à ce qui est exigé pour le médicament, aucune étude sur l’impact de ces résidus sur la santé de l’Homme, ou sur la filière aval (transformation fromagère notamment) n’est requise. Ainsi, nombre de ces produits alternatifs ou complémentaires contiennent des substances ne disposant pas de LMR. Ils sont donc normalement interdits de prescription et d’administration à un animal de production, a fortiori avec un temps d’attente nul !
- sur l’efficacité : les résultats des études disponibles ne permettent pas de conclusion définitive sur l’efficacité de ces thérapeutiques à ce jour, d’autant que la composition exacte en principes actifs varie souvent entre les lots. Il semble toutefois que les effets sont au mieux, partiels, ce qui encourage des fraudes comme celles observée en 2017 avec le fipronil, pour optimiser leur action thérapeutique ; dans cette affaire, un produit à base de plantes utilisé dans le cadre de la lutte contre le pou rouge des volailles contenait frauduleusement du fipronil, un insecticide acaride ne disposant pas de LMR et donc interdit chez la poule productrice d’œufs destinés à la consommation humaine.
- sur la commercialisation : leur vente reste libre, sans prescription médicale, c’est-à-dire que toute personne peut s’auto-déclarer spécialiste, sans formation particulière, ni vérification des compétences.
Il y a actuellement un vide dans lequel nombre de laboratoires peu scrupuleux se sont lancés. Un avis et un rapport de l’Anses (saisine 2020-SA-0083) en date du 08/12/21 portent sur la proposition d’une méthodologie d’évaluation des risques pour la santé humaine des produits à base de plantes (huiles essentielles incluses) utilisés chez les animaux de production.
L'Anses propose que la méthode décrite dans son rapport permette une classification des produits à base de plantes dans l'une des trois catégories suivantes : i) préparation utilisable en médecine vétérinaire sans risque pour le consommateur ; ii) préparation considérée comme potentiellement préoccupante pour le consommateur sur la base des données disponibles, iii) préparation non utilisable en médecine vétérinaire car existence d'une préoccupation pour le consommateur. Il faut souligner que le fait de parler de produits utilisés en phytothérapie ou en aromathérapie range immédiatement ceux-ci sous la définition du médicament « par présentation », ce que beaucoup ignorent. Il est aujourd'hui temps que la réglementation sur les produits utilisés comme pratiques complémentaires et alternatives évoluent et qu'une formation continue de qualité soit dispensée aux éleveurs comme aux vétérinaires.
1.3. Résidus et temps d’attente
Tout médicament vétérinaire administré à des animaux de production est susceptible de persister à l’état de résidus dans les denrées alimentaires d’origine animale (muscle, foie, rein, graisse, peau, lait, œufs et miel), sous une forme modifiée ou non. Les résidus sont ainsi constitués de toutes les substances pharmacologiquement actives, incluant les excipients et les produits de dégradation des substances présentes dans le médicament. L’évaluation du risque lié à la présence de résidus dans les denrées alimentaires destinées à la consommation humaine conduit à la fixation de Limites Maximales de Résidus (LMR) qui sont dédiées à chaque substance active (principe actif ou, plus rarement, autre constituant de la formule). La LMR est la teneur maximale en résidus dans ou sur des denrées alimentaires que l’UE peut accepter comme légalement autorisée ou qui est reconnue comme ne présentant pas de risque pour le consommateur. Sa détermination est très encadrée, basée sur de nombreuses études toxicologiques. Pour être prescrit sur des animaux de production, un médicament ne doit donc contenir que des substances pharmacologiquement actives dont les LMR ont été évaluées et figurent dans le tableau 1 de l’annexe du règlement (UE) n°37/2010 de la Commission du 22 décembre 2009.
Les LMR étant fixées, il convient ensuite de garantir que les denrées alimentaires ne contiennent pas de résidus en concentrations supérieures aux LMR. Pour cela, on fixe un Temps d’Attente (TA). C’est la période suivant la dernière administration du médicament vétérinaire pendant laquelle aucune denrée alimentaire provenant de cet animal ne peut être commercialisée. A l’issue de cette période, les concentrations en substances pharmacologiquement actives au sein des différents tissus consommés par l’Homme sont toutes inférieures aux LMR, ce qui permet à nouveau la consommation de ces denrées par l’Homme.
Par exemple, si le temps d’attente lait d’un médicament X administré à une vache en lactation est de 48h, cela signifie que l’éleveur doit écarter le lait des quatre traites suivant la dernière administration du médicament (en système traditionnel à 2 traites par jour) : le lait produit par cette vache ne pourra être remis au tank et donc commercialisé qu’à partir de la 5ème traite après la dernière administration du médicament. Le TA concerne une spécialité pharmaceutique vétérinaire et il peut être différent pour deux spécialités pharmaceutiques contenant les mêmes substances pharmacologiquement actives, par exemple parce que leurs excipients diffèrent.
1.4. Prescription - délivrance
Une des caractéristiques du médicament est que son marché est très encadré par la règlementation, vente et utilisation ne sont donc pas libres. Pour l’éleveur, l’obtention d’un médicament, quel que soit son lieu d’achat, passe obligatoirement par la rédaction d’une ordonnance par un vétérinaire, à quelques très rares exceptions près (l’obligation ou non d’une ordonnance est disponible sur le site de l’anses pour chaque médicament autorisé, http://www.ircp.anmv.anses.fr/). L’ordonnance est le résultat de la prescription du vétérinaire, un acte de nature médicale à visée curative, prophylactique, métaphylactique, voire zootechnique, ordonnant la mise en œuvre de soins aux animaux. Cette obligation d’ordonnance s’applique également lorsque le vétérinaire administre lui-même le médicament à l’animal. Différentes mentions obligatoires doivent être portées sur l’ordonnance, et notamment les temps d’attente applicables pour les animaux de production.
La prescription par le vétérinaire est généralement réalisée après examen clinique ou autopsie. Elle peut aussi, sous certaines conditions, se réaliser hors examen clinique ou autopsie chez les animaux de production (ruminants, porcs, volailles, lapins et poissons) et les équidés. Pour prescrire « hors examen clinique », le vétérinaire doit exercer la surveillance sanitaire d’un nombre limité d’animaux (quotas fixés par vétérinaire et par espèce animale), en réalisant :
- un bilan sanitaire d’élevage annuel ;
- un protocole de soins pour chaque maladie pour laquelle l’éleveur pourra mettre en place un traitement sans visite vétérinaire pour l’année à venir ;
- au moins une visite de suivi entre deux visites de bilan annuel.
Une annexe de 23 pages à l’arrêté du 24 avril 2007 fixe, pour chacune des dix filières animales, les exigences minimales de ce suivi avec, entre autres, les données sanitaires à collecter lors du Bilan Sanitaire d’Élevage (BSE) annuel pour établir le protocole de soins qui en découle. Le bilan sanitaire et le protocole de soins sont signés et datés par le vétérinaire et le détenteur des animaux. Les originaux de ces deux documents sont insérés dans le registre d'élevage et conservés pendant cinq ans.
La délivrance de médicaments est un acte officinal par lequel l’exécutant de la prescription, un ayant-droit, remet (délivre) à celui qui présente une ordonnance, les médicaments prescrits. Les ayant-droit en France sont :
- le pharmacien titulaire d’une officine : il peut délivrer tout médicament, vétérinaire ou humain, on parle de plein exercice ;
- le vétérinaire autorisé à exercer : il ne peut délivrer que des médicaments vétérinaires (AMM vétérinaire). Son autorisation de délivrance se limite toutefois aux animaux auxquels il donne personnellement ses soins, ou dont la surveillance sanitaire et les soins lui sont régulièrement confiés, si les médicaments sont en lien avec cette surveillance ou ces soins ;
- le pharmacien ou le vétérinaire d’un groupement agréé : la délivrance est dans ce cas restreinte, d’une part aux médicaments à prescription obligatoire figurant sur une liste positive, d’autre part aux médicaments à prescription non obligatoire, dans le cadre d’un Programme Sanitaire d’Elevage (PSE) octroyé au groupement agréé ;
- le fabricant d’aliment médicamenteux, pour les seuls aliments médicamenteux qui n’ont plus le statut de médicament depuis le 28 janvier 2022.
En 2020, en France, les vétérinaires ont délivré environ 79 % des médicaments destinés aux animaux, les pharmaciens environ 6 % et les groupements environ 15 % (AIEMV, 2021). La délivrance de médicaments, outre un enregistrement sur un support papier ou informatique, impose de porter des mentions particulières sur l’ordonnance ainsi que sur les médicaments prescrits.
2. Une pharmacie vétérinaire : pour quoi faire ?
2.1. Pharmacie en élevage
La pharmacie en élevage, c’est la pharmacie de l’éleveur. Elle répond à plusieurs grands principes : avoir à disposition les médicaments jugés nécessaires à la bonne santé des animaux (cf. partie 2.2) dans le respect de la règlementation (cf. partie 1), leur assurer une bonne conservation, et disposer du matériel nécessaire et adapté pour leur administration (par exemple aiguilles ou pistolets drogueurs). Ainsi, la pharmacie de l’élevage, dédiée exclusivement aux animaux, doit être propre, bien rangée, fermée, à l’abri de la poussière, de la lumière, du gel et des écarts de température pour les médicaments stockés à température ambiante (cf. photos N°1 et N°2). Le respect de la chaîne du froid est essentiel pour les médicaments à conserver entre 2 et 8°C. L’éleveur doit vérifier et éliminer régulièrement les médicaments périmés. La gestion des déchets d’activité de soins (périmés, aiguilles, contenants vides…) est également une obligation règlementaire : ils doivent être stockés, collectés et éliminés de manière spécifique.
Pour l’éleveur, l’utilisation du médicament vétérinaire est soumise à d’importantes contraintes administratives, pour garantir un usage conforme à la règlementation. Ainsi, dans l’élevage, la tenue d’un registre d’élevage a été rendue obligatoire par l’arrêté ministériel du 5 juin 2000. Elle est sous la responsabilité de l’éleveur. Le registre d’élevage permet d’améliorer la traçabilité des mouvements d’animaux, la traçabilité sanitaire mais également la transparence par rapport à l’utilisation du médicament. Ainsi, au sein du registre d’élevage, on retrouve obligatoirement un carnet sanitaire qui permet d’assurer la traçabilité des traitements réalisés par l’éleveur ou le vétérinaire : tous les traitements administrés aux animaux sont rigoureusement enregistrés, avec la date de traitement, l’identification du ou des animaux traités, la date de début et de fin de traitement, le médicament utilisé (dosage, posologie, voie d’administration, intervenant), le temps d’attente et d’éventuelles observations. De plus, les originaux des ordonnances doivent être conservés dans le registre d’élevage pendant au moins cinq ans.
Photo 1. Une pharmacie d’élevage bien tenue : la date d’ouverture est indiquée sur les flacons entamés, le stockage assure une bonne conservation des médicaments.

Photo 2. Exemple d’une pharmacie en élevage n’assurant pas une bonne conservation des médicaments : la stérilité des médicaments injectables n’est notamment plus garantie.
2.2. Grandes familles de médicaments
On peut répartir les médicaments classiquement utilisés en médecine vétérinaire en plusieurs grandes familles (cf. figure 1) :
- Les antiparasitaires : ils représentent 31 % des ventes de médicaments en 2020 (AIEMV, 2021). Cette catégorie englobe la lutte contre les parasites internes (nématodes, cestodes, trématodes, protozoaires dont coccidies) et les parasites externes (insectes, acariens). C’est une catégorie de médicaments très employée car les parasitoses sont très fréquentes et très pénalisantes dans les élevages (mortalité, retards de croissance, maladies). Les résistances aux antiparasitaires sont en développement, bien que la situation demeure globalement contrôlée, à quelques exceptions près (cf. infra). L’absence d’alternative crédible pour la gestion de certaines parasitoses rend la réduction de l’utilisation d’antiparasitaires, principale mesure de lutte contre le développement des résistances, parfois délicate. De plus, le recours au pâturage, voire le retour au pâturage pour certaines productions, suite à une demande sociétale, engendre nécessairement un besoin accru d’antiparasitaires. De nouveaux outils de gestion du risque antiparasitaire sont en cours de développement dans les différentes espèces, et les recommandations changent progressivement, pour un usage moins systématique.
- Les vaccins : ils représentent 24,5 % de ventes de médicaments en 2020, et leurs ventes sont en croissance (AIEMV, 2021). Le développement de la prévention en élevage, notamment par l’utilisation de vaccins, fait partie du plan écoantibio2 lancé en 2017 pour réduire les risques d’antibiorésistance en médecine vétérinaire. De ce fait, l’augmentation de l’utilisation de ce type de médicament est très encourageante pour le développement d’un élevage plus durable. Les limites de l’utilisation des vaccins sont connues : i) le prix qui peut être perçu comme une grosse part du budget médicament : la balance économique est généralement très en faveur de la vaccination par rapport aux coûts de certaines maladies infectieuses, mais une partie de ces coûts est parfois difficile à quantifier par l’éleveur (pertes de croissance, problèmes de reproduction, temps de travail supplémentaire…). Du coup, il ne les prend pas toujours en compte dans son analyse ; ii) la charge de travail associée à l’acte vaccinal ; iii) le temps de mise en place de l’immunité qui pénalise leur emploi à l’introduction des animaux dans certaines filières spécifiques.
- Les antibiotiques : ils représentent 9,5 % des ventes de médicaments en 2020 (AIEMV, 2021). En poids vif traité, les familles les plus utilisées sont les tétracyclines (23,47 %), les pénicillines (22,59 %), les aminoglycosides (11,82 %), les macrolides (11,05 %), les sulfamides (8,88 %) et les polypeptides (8,77 %) (Anses, 2021). L’indicateur ALEA (Animal Level of Exposure to Antimicrobials), lié au pourcentage d’animaux traités par rapport à la population animale totale, est utilisé classiquement pour évaluer l’exposition aux antibiotiques. Par exemple, un ALEA de 0,2 pour une espèce donnée signifie que 20 % du total du poids vif de cette espèce ont été traités aux antibiotiques. Classées par ALEA décroissants, voici les expositions aux antibiotiques calculées en 2020 dans les différentes espèces : Lapin = 1,910 ; Chiens/chats = 0,659 ; Porcs = 0,491 ; Ovins/caprins = 0,363 ; Volailles = 0,358 ; Bovins = 0,255 ; Chevaux = 0,220 ; Poissons = 0,164 (Anses, 2021).
L’usage des antibiotiques en médecine vétérinaire a été fortement réduit ces dernières années, conformément aux plans ecoantibio1 et écoantibio2. Ainsi en 2020, en comparaison avec l’année 2011 qui est considérée comme année de référence, l’ALEA a diminué pour toutes les espèces : – 22,5 % pour les bovins, – 55,5 % pour les porcs, – 64,4 % pour les volailles, – 39,9 % pour les lapins (Anses, 2021). Par ailleurs, certaines catégories d’antibiotiques dits d’importance critique (céphalosporines de 3 et 4ème génération, fluoroquinolones de 2ème génération) ne sont plus utilisées qu’en dernier recours, et leur utilisation s’est effondrée sur le terrain (ils représentent aujourd’hui moins de 0,5 % des traitements en poids vifs traités) (Anses, 2021). À noter que depuis 2017, en Europe (29 pays), grâce aux efforts de réduction de l’usage des antibiotiques en médecine vétérinaire, la consommation moyenne d’antibiotiques par l’Homme (130 mg/kg) est supérieure à la consommation moyenne d’antibiotiques par les animaux de rentes (108,3 mg/kg) (ECDC EFSA EMA, 2021).
- Les anti-inflammatoires et antidouleurs : cette catégorie de médicaments voit son usage augmenter ces dernières années avec les nouvelles recommandations autour de la gestion du bien-être animal (écornage, castration, maladies douloureuses). Nous n’avons pas de détail quant au volume de vente qu’ils représentent (< 10 %).
-Les autres catégories de médicaments sont mineures en termes de volume de ventes :
- Médicaments pour la maîtrise du cycle de reproduction : essentiellement des hormones pour favoriser, synchroniser ou bloquer la reproduction des animaux d’élevage
- Réhydratants et médicaments des syndromes métaboliques
- Anesthésiques
- Euthanasiques
- Médicaments des grandes fonctions (digestives, rénales…)
- Autres
Figure 1. Répartition des ventes de médicaments en 2020 par grandes classes thérapeutiques en médecine vétérinaire, toutes espèces confondues (d’après AIEMV, 2021).
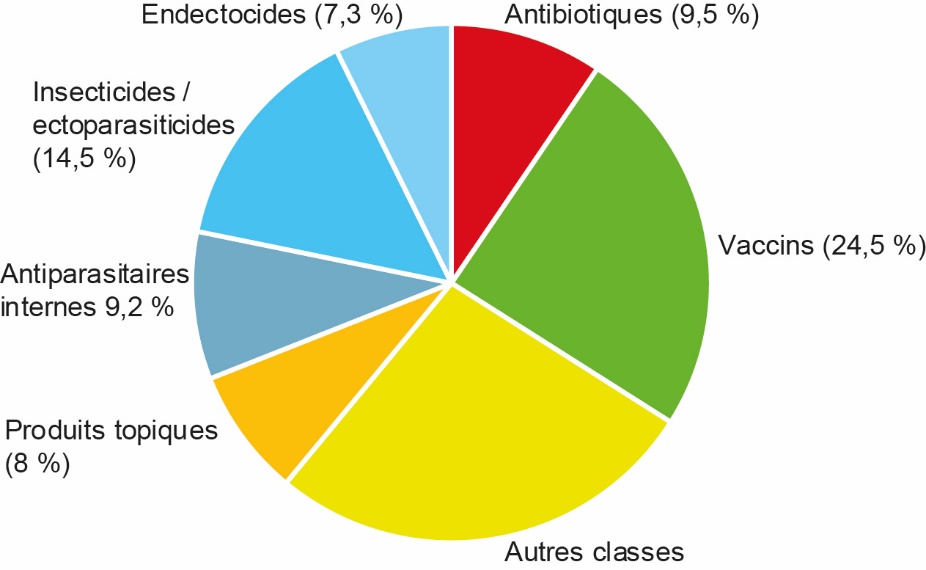
Globalement, si l’on compare 2020 à 2019, la vente de médicaments a reculé de 2,58 % pour les volailles, de 1,34 % pour les ruminants, mais elle a augmenté de 0,99 % chez les porcs (ce qui fait un global à – 1,08 % pour les animaux de production) (AIEMV, 2021). En l’état, ces chiffres sont peu informatifs car, en fonction des familles de médicaments concernés, les objectifs peuvent diverger. Ainsi, une réduction de l’usage des anti-infectieux (antibiotiques et antiparasitaires) est recommandée aujourd’hui, principalement dans une optique de lutte contre la sélection et la dissémination d’organismes résistants. A contrario, les éleveurs sont encouragés à vacciner plus largement, mais également à recourir aux antidouleurs en cas de souffrance animale (maladie, chirurgie), afin de garantir le respect des cinq libertés fondamentales de l’animal, énoncées par la FAWC (Farm Animal Welfare Council).
2.3. Différents usages du médicament
En élevage, les traitements sont le plus souvent collectifs. Différentes stratégies coexistent concernant l’utilisation du médicament :
- Les traitements curatifs : l’animal est vu malade et le traitement de cette maladie relève du nécessaire soin aux animaux, toujours dans le respect des cinq libertés fondamentales précitées. Ce traitement peut être individuel ou collectif si plusieurs animaux sont touchés, par exemple via un agent infectieux bactérien, fongique ou parasitaire.
- La prophylaxie vaccinale : cet usage concerne exclusivement l’utilisation de vaccins dans la lutte contre les infections bactériennes, virales, parasitaires ou fongiques. La prophylaxie, c’est l’ensemble des mesures à prendre pour prévenir l’apparition des maladies. Elle se décompose habituellement d’un volet sanitaire/zootechnique, notamment la biosécurité i.e. l’utilisation des « gestes barrières » pour faire un parallèle avec la crise de COVID-19, et d’un volet vaccinal lorsqu’il existe. L’approche vaccinale est principalement une approche collective, même si elle peut parfois être individuelle (tétanos du cheval par exemple). Elle permet de renforcer les capacités de défense des animaux, et par là de limiter les conséquences cliniques ou zootechniques des infections. Pour autant, la vaccination doit en général être couplée à des mesures sanitaires ou zootechniques pour exprimer pleinement son potentiel. Ainsi, de jeunes broutards correctement vaccinés mais logés dans un bâtiment inadapté à leurs besoins (mauvais renouvellement de l’air, courants d’air ou stress thermique) resteront très sensibles aux maladies respiratoires bovines. Enfin, idéalement, la prophylaxie vaccinale doit être réalisée avant la période à risque de la maladie dans l’élevage, notamment parce que la mise en place de l’immunité chez l’animal après vaccination est souvent assez longue (de l’ordre de quelques semaines). Dans certaines situations particulières, et pour certains vaccins, une utilisation sur des animaux pendant la période à risque, ou contemporains d’animaux malades, peut être faite avec des résultats probants (exemple de la vaccination contre la colibacillose chez les poules pondeuses).
- Les traitements préventifs : les traitements sont administrés à un moment donné du cycle de production, qu'il y ait des animaux malades ou pas au sein de l'élevage. Par exemple, des traitements préventifs contre les strongles gastro-intestinaux sont très souvent administrés aux jeunes bovins à la mise à l'herbe, pour limiter le recyclage parasitaire au cours du pâturage et ainsi de futures infestations pénalisantes pour la santé et la croissance des animaux. L'antibioprophylaxie, qui relève de ce même principe, est parfois utilisée pour limiter la morbidité et la mortalité associées aux maladies respiratoires ou digestives dans les jours ou semaines suivant la mise en lot ou le sevrage, chez le porc ou le bovin. Dans les feedlots bovins américains, une méta-analyse a permis d'estimer que l'antibioprévention permettait une amélioration du gain moyen quotidien (GMQ) de 0,11 kg/j (Wileman et al., 2009). Cependant, en fonction des lots de bovins, le nombre de malades évités par cette mesure ne compense pas toujours le surcoût lié au traitement de l'ensemble du lot (Nickell et al., 2008). Par ailleurs, cette administration préventive d'antibiotiques est très critiquée dans la mesure où elle participe à un usage massif d'antibiotiques, favorisant la sélection et la dissémination de souches antibiorésistantes (Schwarz et Chaslus-Dancla, 2001 ; McEwen et Fedorka-Cray, 2002 ; Phillips et al., 2004). L'antibioprévention ne représente pas une mesure envisageable dans un cadre de gestion durable (Scientific Committee on Animal Health and Animal Welfare, 2001). Elle est désormais proscrite en France, depuis le 28 janvier 2022 (sauf dans des cas très particuliers). C'est d'abord la mise en place de mesures sanitaires et vaccinales qui doit être privilégiée (Anses, 2014). À noter que certaines familles d'antibiotiques dites critiques sont interdites d'usage dans ce cadre.
- Les traitements métaphylactiques : ces traitements consistent à traiter à la fois les animaux cliniquement malades et les animaux d’un même groupe qui sont encore cliniquement sains mais ont une forte probabilité d’être infectés à cause du contact étroit avec les animaux malades (EMA, 2016). Cette approche est spécifique à l’union européenne, les autres pays ne faisant pas de distinction entre antibioprophylaxie et métaphylaxie. Ce type d’administration est une pratique qui se développe dans les élevages en lot, en alternative à l’antibioprophylaxie, justement dans la perspective de diminuer l’utilisation des antibiotiques en ne traitant que lorsque la maladie est effectivement présente. Les principaux objectifs sont la maîtrise du temps de travail (plus facile de traiter une seule fois tous les animaux), et la mise en place d’un traitement précoce qui maximise l’efficacité de l’antibiothérapie, réduit les risques de rechutes ou de passage à la chronicité, et palie la sous-détection. Le choix du recours à la métaphylaxie devrait revenir au vétérinaire, le plus à même de juger de sa pertinence, en se basant sur ses connaissances de la maladie, de son épidémiologie, de sa gravité mais également sur sa connaissance de l’élevage.
Les facteurs de croissance : ce sont des antibiotiques distribués par voie orale, généralement selon un schéma posologique employant des doses plus faibles que celles employées pour les autres types de traitements. Le but est de maximiser les performances zootechniques des animaux. Cet usage est interdit en Europe depuis 2006.
Dans le choix des médicaments à utiliser, plusieurs éléments sont à considérer. En filière porcine, avicole, cunicole ou de veaux de boucherie, la notion de marge est essentielle (coûts/bénéfices), et parfois le recours à une antibiothérapie est économiquement plus intéressant que d’autres mesures plus durables. Il ne faut pas non plus négliger l’importance du temps éleveur : par exemple, l’hyperthermie est le signe le plus précoce d’une maladie respiratoire chez les bovins, mais il est impossible qu’un éleveur armé d’un simple thermomètre puisse prendre la température de tous ses animaux chaque jour, d’où l’intérêt du recours à la métaphylaxie lorsque la situation sanitaire se dégrade. Le développement d’outils de suivi automatisés est en cours, mais ces systèmes restent encore trop onéreux ou insuffisamment fiables.
3. Enjeux d’avenir autour de la pharmacie d’élevage
3.1. Une image dégradée du médicament en élevage
Si l’on regarde la dernière campagne marketing du distributeur Carrefour, « Act for food », le message est marquant : Carrefour supprime les antibiotiques pour toutes ses filières « qualité carrefour ». Le message de fond est séduisant, avec une mise en valeur du travail collaboratif de prévention proposé par le distributeur avec ses éleveurs sous contrat (consultable sur un site internet dédié). Malheureusement, le format publicitaire contraint, qui touche la plus grande partie des consommateurs, peut se résumer ainsi : l’élevage (français) utilise trop d’antibiotiques, alors que l’on peut faire autrement, grâce à la grande distribution (!). Cette campagne illustre bien le fossé qui se creuse entre les efforts réalisés en France (en huit ans, réduction de 45 % de l’utilisation des antibiotiques chez les animaux, toutes filières confondues (source DGAL Novembre 2020), cf. partie 2.2) et l’image perçue par le grand public d’un élevage trop industriel, en marge des grands enjeux du moment. Ce déficit d’image est très pénalisant pour toutes les filières d’élevage, et démotivant pour ses acteurs qui ne voient pas leurs efforts payer.
De même, de nombreuses confusions persistent pour le grand public sur la réalité de l’utilisation des médicaments en élevage en France. Ainsi, le recours aux hormones de croissance ou l’utilisation d’antibiotiques comme facteurs de croissance sont des pratiques rigoureusement interdites en Europe, alors que ce n’est pas le cas partout, notamment aux États-Unis. La communication grand-public autour des médicaments par les professionnels est très encadrée règlementairement, et se limite généralement à un discours assez opaque pour les non-initiés. L’absence de communication claire à destination du grand-public favorise la dissémination de messages perturbants par des associations lobbyistes anti-élevages, notamment sur les réseaux sociaux, messages qui participent grandement à la dégradation de l’image de toute une filière. D’autant que parmi les médicaments, on compte nombre de vaccins indispensables à la maîtrise durable des maladies infectieuses en élevage.
À l’opposé, une promotion excessive est faite pour des produits dit alternatifs, présentés comme naturels (phytothérapie, aromathérapie), produits qui jouissent de ce fait d’une image très favorable pour le grand public et les éleveurs. Ces nouvelles thérapeutiques posent pourtant de nombreuses questions sur leur qualité, sur leur innocuité pour l’animal ou pour le consommateur, ou sur leur efficacité, notamment lorsqu’on les compare aux exigences appliquées au médicament (cf. encadré 3). De plus, l’absence de tout encadrement règlementaire approprié engendre une absence complète de transparence sur les usages en ferme, ce qui complique la gestion du risque et déroge aux exigences actuelles du marché et des consommateurs. Un nouveau scandale sanitaire n’améliorerait certainement pas l’image de l’élevage français.
3.2. Lutte contre les résistances aux anti-infectieux
Au sein des antiinfectieux, on distingue principalement les antibiotiques et les antiparasitaires. La lutte contre le développement des résistances aux anti-infectieux passe aujourd’hui essentiellement par une réduction de leur utilisation, avec des mesures soit contraignantes (pour les antibiotiques), soit basées sur la bonne volonté des différents acteurs (pour les antiparasitaires) ; deux poids, deux mesures en quelque sorte.
La lutte contre les résistances aux antibiotiques est mondiale, impliquant différentes organisations internationales (ONU, OMS, OIE), régionales (EMA, FDA) et locales (Ministère de la Santé et Ministère de l'Agriculture en France). L'approche « une seule santé » s'est démocratisée, considérant que les santés animale, humaine et environnementale sont liées. En effet, les échecs thérapeutiques en lien avec l'antibiorésistance chez les animaux sont rares. Les mesures prises en médecine vétérinaire répondent avant tout à un problème de santé publique. En découle l'application de deux principes : le principe de précaution quant à l'évaluation du risque, et le principe de prohibition pour la gestion de ce risque. Pour autant, l'analyse quantitative du risque, qui aurait permis de hiérarchiser les principaux facteurs de risque, a été rejetée par les experts de l'OMS, considérant qu'un risque plausible était suffisant à l'application du principe de précaution (Toutain et al., 2014). Ainsi, la contribution vétérinaire au développement de l'antibiorésistance chez l'Homme est inconnue. Deux risques principaux sont identifiés :
- transmission à l’Homme de germes zoonotiques devenus résistants, par contact direct ou via l’alimentation : c’est un risque individuel qui concerne d’abord les professionnels de la filière agro-alimentaire. Le consommateur final peut également localement être touché
- amplification de gènes de résistances chez l’animal et dans ses effluents, à l’origine d’une diffusion dans différents écosystèmes : c’est un risque écologique global, avec des échanges de gènes de résistance entre bactéries commensales humaines, animales et environnementales. Ce risque semble le plus important car il est difficile à circonscrire.
La stratégie déployée à l’échelon mondial s’appuie principalement sur une réduction de l’utilisation des antibiotiques en médecine vétérinaire, avec une emphase particulière sur certaines familles d’antibiotiques critiques (interdiction ou fortes restrictions d’utilisation).
La lutte contre les résistances aux antiparasitaires est par contre une problématique essentiellement vétérinaire, les pays dits « développés » ayant peu de parasitoses impactant la santé humaine (ce qui n’est pas forcément le cas des pays du Sud). De ce fait, les moyens disponibles sont nettement moindres, et la coordination internationale se limite essentiellement à l’échelon régional (Union Européenne pour ce qui nous concerne). Les principales résistances qui posent des difficultés en élevage aujourd’hui sont les résistances aux nématodicides chez les petits ruminants et chez les équidés, voire les résistances aux anticoccidiens chez les volailles ou les résistances de certains arthropodes (Colloque SNGTV/OIE, 2017). Un usage raisonné des antiparasitaires est indispensable à l’avenir de certaines productions. Certains usages vont donc devoir évoluer, obligatoirement.
3.3. Bien-être animal
Le bien-être animal est un enjeu plus récent mais essentiel en élevage, non seulement pour garantir la qualité des produits commercialisés (le stress est défavorable à la qualité des viandes par exemple), mais surtout pour répondre à de nouvelles exigences sociétales. Le code civil n’a ainsi reconnu l’animal comme « être vivant doué de sensibilité » que le 28 janvier 2015 (article 528), bien que cette mention existait déjà dans le code rural. La pharmacie d’élevage joue notamment un rôle essentiel pour répondre à la prise en charge de la douleur. Contrairement aux antiinfectieux, l’utilisation des analgésiques doit absolument être encouragée. L’utilisation plus fréquente aujourd’hui des antiinflammatoires pour la gestion de la douleur liée à l’écornage ou au vêlage chez les bovins tout comme à la mise bas des truies illustre cette évolution des mentalités. De même, la règlementation évolue rapidement et force les éleveurs à modifier certaines pratiques. Ainsi, depuis février 2022, la castration des porcelets à vif est interdite. Elle reste possible uniquement après usage d’un anesthésique local et d’un antiinflammatoire. Les autres alternatives sont (1) l’absence de castration (mais cela engendre une viande moins grasse, des animaux plus agressifs et un risque d’odeur d’urine à la cuisson pour certains mâles entiers) ou (2) le recours à un vaccin qui bloque temporairement la fonction testiculaire. La prise en compte de la douleur animale s’accompagne aujourd’hui d’une incitation, voire d’une obligation, de faire évoluer certaines pratiques et de soulager l’animal en souffrance.
3.4. Ecotoxicité et biodiversité
La prise en compte de l’influence des médicaments sur l’environnement, sur les organismes non cibles et sur la biodiversité, représente un enjeu récent mais fondamental pour la pérennité des élevages. La société civile est aujourd’hui particulièrement sensible à cette thématique, avec des associations particulièrement actives. On a tous en tête le débat autour de la levée de l’interdiction des néonicotinoïdes comme traitement phytosanitaire pour la filière betterave, en 2020, à cause de l’impact environnemental de cet insecticide, notamment sur les insectes pollinisateurs. La multiplication des zones natura2000 est une autre illustration de ce phénomène. Dans ces espaces particuliers, des restrictions d’usage de certains médicaments peuvent avoir un impact sur les prescriptions des vétérinaires. C’est le cas par exemple des lactones macrocycliques ou des pyréthrinoïdes, deux antiparasitaires très utilisés chez les ruminants pour traiter respectivement les infestations par les nématodes ou par les mouches/tiques pendant la saison estivale. Dans ces territoires particuliers, ces molécules doivent parfois être soit remplacées par d’autres moins écotoxiques (mais il existe peu d’alternatives crédibles), soit utilisées en parallèle d’un confinement des animaux en bâtiment pendant une période plus ou moins importante, ce qui ne correspond pas à la valorisation estivale des pâtures !
En 2007, le règlement européen REACH (règlement N°1907/2006) est entré en vigueur pour sécuriser la fabrication et l’utilisation des substances chimiques dans l’industrie européenne. Ce règlement a imposé un recensement de toutes les substances chimiques fabriquées ou importées sur le marché européen (achevé en 2018), suivi d’une évaluation de la dangerosité de ces substances, dans le but notamment de protéger la santé humaine et l’environnement, et de fournir une information identique et transparente à tous. Cette règlementation s’applique aujourd’hui également à certains principes actifs retrouvés dans les médicaments, et tout particulièrement aux substances qualifiées d’extrêmement préoccupantes : ce sont des substances persistantes, bioaccumulables et toxiques (PBT), ou des substances très persistantes et très bioaccumulables (vPvB). Depuis 2017, tous les médicaments qui souhaitent obtenir une autorisation de mise sur le marché doivent vérifier leur appartenance à l’une de ces deux catégories (EMA CVMP, 2015). Concrètement, si une substance appartenant à l’une de ces catégories n’apporte pas un bénéfice considérable par rapport à ce qui existe sur le marché, son autorisation sera refusée. Ainsi, en 2018, un premier médicament vétérinaire s’est vu refusé son AMM à cause du risque environnemental : Longrange®, une éprinomectine longue action (EMA CVMP, 2018). Concernant les médicaments déjà sur le marché, le classement comme substance extrêmement préoccupante est achevé, et près de 20 molécules ont été identifiées, toutes des antiparasitaires. À ce jour, il n’y a pas eu de retrait d’AMM pour ces substances, mais certaines sont sous investigation, notamment pour mieux préciser leur impact environnemental en conditions terrain, mais aussi pour évaluer les alternatives disponibles en cas de retrait d’AMM. Des précautions particulières d’emploi sont apparues sur les notices de ces médicaments, précisant l’écotoxicité spécifique de ces molécules, et les organismes non cibles qui sont touchés, ainsi que certaines restrictions d’usage (comme la restriction d’accès aux cours d’eau pendant une période donnée). L’objectif à terme de cette règlementation, c’est l’interdiction des molécules classées comme extrêmement préoccupantes, et leur substitution par des molécules moins dangereuses pour l’environnement. Malheureusement, pour certaines indications, notamment concernant les traitements insecticides ou acaricides, il n’existe pas d’alternative crédible qui ne soient pas très toxique pour l’environnement. De ce fait, un usage le plus raisonné possible doit être promu, tout particulièrement pour ces molécules. Le vétérinaire devrait être le chef d’orchestre et le garant de cet usage raisonné, appliquant les nouvelles recommandations issues des centres de recherche sur la gestion durable des parasites. Sur le terrain, la situation reste plus contrastée, les connaissances dans ce domaine étant insuffisamment partagées. De plus, ceci s’oppose parfois aux besoins sanitaires, comme en 2008 lors de la crise de la Fièvre Catarrhale Ovine (FCO), crise qui n’est toujours pas achevée et qui s’est traduite par une obligation de désinsectisation massive des animaux et des camions assurant leur transport, mesure dont les résultats restent discutés sur la gestion de la crise de la FCO alors que ces insecticides très écotoxiques ont été utilisés larga manu.
3.5. Chartes et labels
Différentes chartes et labels existent dans les élevages aujourd’hui, et vont avoir un impact sur les prescriptions de médicaments. Le label le plus connu est le label « production ou agriculture biologique », label officiel qui répond à des obligations règlementaires. Il en existe bien d’autres, qui peuvent être privés et répondre à des cahiers des charges qui leur sont propres. Pour être éligible à la certification biologique, concernant les traitements vétérinaires, les contraintes suivantes s’imposent aux élevages (Journal Officiel de l’Union européenne, 2018) :
- Tout traitement préventif, y compris anticoccidiens, ou tout traitement en vue de maîtriser la reproduction (induction ou synchronisation des chaleurs) est strictement interdit.
- Pas de restriction à l’emploi de vaccins
- Encadrement des traitements antiparasitaires (en fonction des espèces)
- À l’exclusion des vaccins, des traitements antiparasitaires et des plans d’éradication obligatoires, un maximum de 3 traitements curatifs allopathiques peut être administré sur une période de douze mois coulissants. Le nombre de traitements autorisés est ramené à un seul pour tout cycle de production de moins d’1 an.
- Le temps d’attente applicable est doublé par rapport au temps d’attente légal utilisé en agriculture conventionnelle, et au minimum de 48 h.
Quelques remarques des auteurs sur ces labels :
Tout d’abord, le doublement des temps d’attente en label biologique n’a aucune base scientifique solide, la détermination des temps d’attente dans les AMM vétérinaires étant déjà réalisée avec des postulats très sévères. Cette option a principalement pour objectif de décourager l’emploi de traitement allopathiques à moins qu’ils ne soient totalement indispensables, une philosophie vertueuse donc. Pourtant, le nombre limité de traitements possibles et le rallongement des temps d’attente peuvent avoir également des effets pervers, notamment concernant la prise en charge thérapeutique de la douleur. En élevage monogastrique, avec des durées de productions courtes, cette pression du traitement unique peut également retarder la mise en place d’un traitement antibiotique nécessaire, augmentant ainsi échecs thérapeutiques, rechutes ou souffrance animale (la précocité du traitement est souvent essentielle à l’efficacité des antibiotiques). Au sein des éleveurs bio, ou des filières sans antibiotiques, on observe même une minorité extrémiste qui refuse toute médication allopathique, avec des animaux en souffrance à qui l’on refuse le traitement indispensable à leur santé. Le risque de démédicalisation des animaux d’élevage existe aujourd’hui dans ces labels dont la philosophie originelle était pourtant un retour vers une production plus durable et une meilleure prise en compte du bien-être animal. La rigidité des chartes et labels s’oppose parfois au bon sens du soignant et peut mettre l’éleveur en difficulté dans sa capacité à apporter les soins nécessaires à ses animaux.
Conclusion
La pharmacie vétérinaire est une composante importante de la gestion de la santé et du bien-être des animaux d’élevage. Elle est aujourd’hui décriée parce que trop mal comprise, notamment par le grand-public. D’abord, elle est multiple, et s’il est souhaitable de réduire l’usage des anti-infectieux à leur strict nécessaire, il est important d’encourager le recours aux vaccins, aux anti-inflammatoires ou aux antidouleurs. Ensuite, elle est très encadrée règlementairement, s’appuyant sur un réseau de professionnels formés, ce qui permet un réel contrôle des pratiques par les services de l’état, et une traçabilité qui assure la protection du consommateur. Enfin, elle est un enjeu financier important, car la France est le premier pays de l’UE en volume de ventes de médicaments vétérinaires.
Bien utiliser le médicament reste indispensable pour un élevage plus durable. S’il reste encore nombre de batailles à mener, de connaissances à acquérir ou de pratiques à changer, beaucoup de choses ont déjà été mises en place avec des résultats très probants, ce qui est très encourageant pour l’avenir. Reste à mieux communiquer ces efforts auprès du grand public, pour que chaque citoyen puisse demeurer fier de la filière d’élevage française.
Références
- AIEMV, 2021. AIEMV (Association Interprofessionnelle d’Étude du Médicament Vétérinaire). Marché 2020 France - chiffres clés. Paris, France.
- Anses, 2014. Évaluation des risques d’émergence d’antibiorésistances liées aux modes d’utilisation des antibiotiques dans le domaine de la santé animale. Anses, France, janvier 2014, auto-saisine n°2011-SA0071, 240p.
- Anses, 2021. Suivi des ventes de médicaments vétérinaires contenant des antibiotiques en France en 2020. Anses - ANMV, France, octobre 2021, rapport annuel, 92p.
- Colloque SNGTV/OIE, 2017. Utilisation raisonnée des antiparasitaires à l’horizon 2020-2025. Paris, France.
- ECDC EFSA EMA, 2021. Third joint inter-agency report on integrated analysis of antimicrobial agent consumption and occurrence of antimicrobial resistance in bacteria from humans and food-producing animals in the EU/EEA.
- EMA, 2016. Question and aswer on the CVMP guideline on the SPC for antimicrobial products (EMEA/CVMP/SAGAM/383441/2005). European Medicines Agency. London - UK. EMA/CVMP/414812/2011-Rev.2.
- EMA CVMP, 2015. Guideline on the assessment of persistent, bioaccumulative and toxic (PBT) or very persistent and very bioaccumulative (vPvB) substances in veterinary medicinal products. European Medicines Agency. London - UK. EMA/CVMP/ERA/52740/2012
- EMA CVMP, 2018. Final CVMP assessment report for LONGRANGE. European Medicines Agency. London - UK. EMA/804461/2018.
- Journal Officiel de l’Union européenne, 2018. Règlement (UE) 2018/848 du Parlement européen et du Conseil du 30 mai 2018 relatif à la production biologique et à l’étiquetage des produits biologiques, et abrogeant le règlement (CE) no 834/2007 du Conseil.
- McEwen S.A., Fedorka-Cray P.J., 2002. Antimicrobial use and resistance in animals. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America. 1 juin 2002. 34, S93‑S106. doi:10.1086/340246
- Nickell J.S., White B.J., Larson R.L., Blasi D.A., Renter D.G., 2008. Comparison of short-term health and performance effects related to prophylactic administration of tulathromycin versus tilmicosin in long-hauled, highly stressed beef stocker calves. Vet. Ther., 9, 147‑156.
- Phillips I., Casewell M., Cox T., De Groot B., Friis., Jones R., Nightingale C., Preston R., Waddell J., 2004. Does the use of antibiotics in food animals pose a risk to human health? A critical review of published data. J. Antimicrob. Chemoth., 53, 28‑52. doi:10.1093/jac/dkg483
- Schwarz S., Chaslus-Dancla E., 2001. Use of antimicrobials in veterinary medicine and mechanisms of resistance. Vet. Res., 32, 201‑225. doi:10.1051/vetres:2001120
- Scientific Committee on Animal Health and Animal Welfare, 2001. The Welfare of Cattle kept for Beef Production. Eur. Commission - Health and Consumer protection directorate general., 150p. https://orgprints.org/id/eprint/742/
- Toutain P.L., Ferran A., Lalleman E., Bousquet-Melou A., 2014. Les anciens antibiotiques sont-ils meilleurs que les nouveaux pour lutter contre l’antibiorésistance ? Quand et comment utiliser les antibiotiques critiques ? In : SNGTV. Reims, France.
- Wileman B.W., Thomson D.U., Reinhardt C.D., Renter D.G., 2009. Analysis of modern technologies commonly used in beef cattle production: conventional beef production versus nonconventional production using meta-analysis. J. Anim. Sci., 87, 3418‑3426. doi:10.2527/jas.2009-1778
Résumé
Le médicament vétérinaire n’est pas un produit comme les autres. Ainsi, il ne peut être commercialisé qu’après obtention d’une Autorisation de Mise sur le Marché (AMM), fondée sur une évaluation scientifique stricte de sa qualité, de son efficacité, de son innocuité, et des résidus retrouvés dans les denrées alimentaires, par une autorité publique compétente. De même, sa commercialisation est très encadrée, avec un rôle central du vétérinaire de l’élevage, et une traçabilité rigoureuse qui assure une protection efficace du consommateur. La pharmacie vétérinaire est une composante clé de la gestion de la santé et du bien-être des animaux d’élevage. Bien utiliser le médicament reste indispensable pour un élevage plus durable. Ainsi, il faut réduire l’usage des anti-infectieux au strict nécessaire, dans un environnement de lutte contre la sélection et la diffusion de gènes de résistances. A contrario, le recours aux vaccins, aux anti-inflammatoires ou aux antidouleurs doit être absolument encouragé pour lutter contre les maladies infectieuses ou améliorer le bien-être animal. Parfois, à cause de l’écotoxicité de certains médicaments, ou de par l’existence de chartes et de labels spécifiques, de nouvelles stratégies doivent être mises en place pour la gestion de la santé des animaux. Dans tous ces domaines, même s’il reste encore beaucoup de connaissances nouvelles à produire, de pratiques à changer ou d’alternatives à mettre au point, l’élevage français a fait de grands progrès ces dernières années. Reste à communiquer auprès du grand public qui conserve une image très dégradée du médicament en élevage.
Pièces jointes
Pas de document complémentaire pour cet articleStatistiques de l'article
 Vues: 12036
Vues: 12036
Téléchargements
 PDF: 542
PDF: 542
 XML: 120
XML: 120
Articles les plus lus par le même auteur ou la même autrice
- Christian DUCROT, Cécile ADAM, Florence BEAUGRAND, Catherine BELLOC, Julie BLUHM, Claire CHAUVIN, Marina CHOLTON, Lucie COLLINEAU, Julien FAISNEL, Nicolas FORTANÉ, Florence HELLEC, Anne HÉMONIC, Nathalie JOLY, Guillaume LHERMIE, Marie-Angélina MAGNE, Mathilde PAUL, Axelle POIZAT, Didier RABOISSON, Nathalie ROUSSET, Apport de la sociologie à l’étude de la réduction d’usage des antibiotiques , INRAE Productions Animales: Vol. 31 No 4 (2018)
- Mathilde PAUL, Mily LEBLANC-MARIDOR, Nathalie ROUSSET, Anne HEMONIC, Jocelyn MARGUERIE, Philippe le COZ, Bernadette le NORMAND, Jonathan HERCULE, Christine ROGUET, Claire CHAUVIN, Catherine BELLOC, Christian DUCROT, Réduction de l’usage des antibiotiques en filières monogastriques : état d’avancement et perspectives , INRAE Productions Animales: Vol. 35 No 4 (2022): Rationaliser l'usage des médicaments en élevage
- Alice DE BOYER DES ROCHES, Violaine COLSON, Raphaël GUATTEO, Claudia TERLOUW, David André BARRIÈRE, Pierre-Marie BOITARD, Dorothée LEDOUX, Catherine BELLOC, Pierre MORMÈDE, Karine PORTIER, Matthias KOHLHAUER, Fanny PILOT-STORCK, Vers une meilleure gestion de la douleur des mammifères et poissons destinés à la consommation humaine – Partie 1 : Concepts, mécanismes, causes, détection , INRAE Productions Animales: Vol. 38 No 4 (2025): Numéro spécial : Bien-être animal : avancées scientifiques et innovations pour des systèmes d’élevage durables
- Catherine BELLOC, Marie-Jeanne GUENIN, Mily LEBLANC-MARIDOR, Anne HEMONIC, Nathalie ROUSSET, Yannick CARRÉ, Charles FACON, Philippe LE COZ, Jocelyn MARGUERIE, Jean-Marc PETIOT, Maxime JARNOUX, Mathilde PAUL, Sophie MOLIA, Christian DUCROT, Réflexion participative pour une optimisation de l’usage d’antibiotiques garantissant santé et bien-être des porcs et volailles , INRAE Productions Animales: Vol. 35 No 4 (2022): Rationaliser l'usage des médicaments en élevage
- Fanny PILOT-STORCK, Matthias KOHLHAUER, Violaine COLSON, Raphaël GUATTEO, Claudia TERLOUW, David André BARRIÈRE, Pierre-Marie BOITARD, Dorothée LEDOUX, Catherine BELLOC, Pierre MORMÈDE, Karine PORTIER, Alice DE BOYER DES ROCHES, Vers une meilleure gestion de la douleur des mammifères et poissons destinés à la consommation humaine – Partie 2 : Prise en charge , INRAE Productions Animales: Vol. 38 No 4 (2025): Numéro spécial : Bien-être animal : avancées scientifiques et innovations pour des systèmes d’élevage durables

