Vers une meilleure gestion de la douleur des mammifères et poissons destinés à la consommation humaine – Partie 1 : Concepts, mécanismes, causes, détection
Au cours de leur vie, les animaux de production (ruminants ou monogastriques, terrestres ou aquatiques) destinés à l’alimentation humaine sont confrontés un jour ou l’autre à la douleur. Celle-ci doit être prise en charge pour des raisons éthiques, médicales, réglementaires mais aussi économiques. Cet article multidisciplinaire dresse un état des lieux des connaissances scientifiques sur la douleur chez les animaux de production appartenant aux taxons des mammifères (ruminants, porcins) et des poissons : ses mécanismes, ses causes, ses conséquences, et les méthodes de détection et d’évaluation connues.
Introduction
Au cours de leur vie, les animaux de production*
1. Douleur : définition, mécanismes chez les animaux
1.1. Définition de la douleur
Chez l’être humain (encadré 1), la douleur était définie depuis 1979 et jusqu’en 2020, par l’International Association for the Study of Pain (IASP), comme « une expérience sensitive et émotionnelle désagréable associée à une atteinte tissulaire réelle ou potentielle, ou décrite en termes d’une telle lésion ». Chez les animaux (c’est-à-dire l’ensemble des espèces animales non humaines), la douleur était définie jusqu’en 2020 comme une « expérience sensitive et émotionnelle aversive qui traduit l’identification par l’animal d’une atteinte ou d’une menace à l’intégrité de ses tissus. […] Elle modifie la physiologie et le comportement de l’animal pour réduire les dommages, réduire la probabilité de sa récurrence et favoriser la guérison » (Molony & Kent, 1997). Ces définitions soulignaient toutes deux l’importance des expériences sensitives et émotionnelles, mais elles différaient quant à la manifestation de la douleur. Ainsi, la définition relative à l’être humain soulignait l’importance de la description de l’expérience, alors que la définition concernant les animaux renvoyait à leurs réponses physiologiques et comportementales.
En 1973, le premier symposium international sur la douleur acte la création de l’IASP (International Association for the Study of Pain) qui a pour vocation de rassembler scientifiques, cliniciens, personnels soignants et décideurs politiques afin de soutenir l'étude de la douleur et d’améliorer sa prise en charge dans le monde entier. En 1979, l’IASP propose une première définition de la douleur qui reconnaît son aspect multidimensionnel. La communauté scientifique met au point dans les années 1980-1990, des questionnaires (ex. McGill pain questionnaire), des échelles (ex. échelle visuelle analogique) et des procédures (ex. paliers antalgiques) qui ont été validés et diffusés dans le monde entier par l’Organisation mondiale de la santé (OMS) afin que les États organisent la prise en charge de la douleur dans leurs systèmes de santé. En France, trois programmes nationaux d’actions ont été mis en place afin de faire progresser la prise en charge de la douleur (1998-2010) : création des centres antidouleur, généralisation des comités de lutte contre la douleur (CLUD) dans les établissements de santé, création d’un Centre national de ressources contre la douleur (CNrD) avec pour mission de diffuser les recommandations de prises en charge diagnostiques et médicamenteuses. En parallèle, la recherche fondamentale s’est orientée vers la compréhension de la physiopathologie des douleurs chroniques dont les causes sont diverses (arthrose, neuropathie, cancer…) et les traitements souvent inefficaces. En 2020, l’IASP a proposé une nouvelle définition de la douleur. En cinq décennies, la recherche fondamentale a révélé l’extraordinaire complexité du système nociceptif composé d’une kyrielle de récepteurs spécifiques qui véhiculent les informations douloureuses vers le cerveau où un réseau complexe et encore mal compris intègre toutes les dimensions de la douleur. Si cette compréhension nouvelle a permis de faire des avancées importantes pour les patients, des années de recherche seront encore nécessaires pour proposer de nouvelles thérapies plus efficaces que les traitements actuels, mais également pour faire reconnaître l’importance de la prévention et de la prise en charge des douleurs chroniques.
En 2020, l’IASP a proposé une nouvelle définition de la douleur (Raja et al., 2020), commune pour l’être humain et les autres animaux : « une expérience sensitive et émotionnelle désagréable associée ou ressemblant à celle associée à une atteinte tissulaire réelle ou potentielle ». Cette définition s’accompagne de six points clés :
i) La douleur est toujours une expérience personnelle et est influencée à des degrés divers par des facteurs biologiques, psychologiques et sociaux ; la douleur et la nociception*, sont des phénomènes différents. La douleur, à la différence de la nociception, ne peut être déduite uniquement de l’activité des neurones sensitifs, elle inclut une composante émotionnelle supplémentaire.
ii) Les individus apprennent le concept de douleur via leurs expériences.
iii) Lorsqu’une personne rapporte qu’elle ressent de la douleur, il faut en tenir compte.
iv) Bien que la douleur ait généralement un rôle adaptatif, elle peut avoir des effets néfastes sur le fonctionnement de l’organisme et son bien-être.
v) La description verbale n’est qu’un comportement parmi d’autres pour exprimer la douleur.
vi) L’incapacité à communiquer ne signifie pas qu’un être humain ou un animal ne ressent pas de douleur.
Cette nouvelle définition reconnaît que tout animal est capable de ressentir la douleur et met sur le même plan les douleurs animales et humaines (Raja et al., 2020). À court terme, la douleur est bénéfique car elle empêche l’individu de se blesser et contribue entre autres à l’apprentissage spatial chez le jeune. Chez l’être humain, la douleur aiguë est définie comme une douleur durant moins de trois mois et directement liée à la présence d’une blessure ou d’une atteinte tissulaire comme une coupure, une brûlure ou une fracture. Si la douleur persiste alors que les tissus ont guéri, on parle de douleur chronique. La douleur chronique n’a pas de rôle protecteur de l’organisme et elle est à l’origine d’une atteinte fonctionnelle invalidante associée à des comorbidités psychosociales importantes (anxiété, dépression…). Elle est particulièrement difficile à traiter.
La douleur ne doit pas être confondue avec les notions de stress*, ou d’inconfort* qui sous-entendent une composante émotionnelle sans qu’il y ait nécessairement une atteinte tissulaire. Stress et inconfort peuvent ainsi exister indépendamment d’une douleur, bien qu’une douleur soit en elle-même une source de stress et souvent d’inconfort.
La douleur repose sur trois composantes (Raja et al., 2020) : i) la composante sensitive (nociception), c’est-à-dire la détection de la zone du corps concernée, de la nature et l’intensité de la stimulation ; ii) la composante affective et émotionnelle, c’est-à-dire l’expérience subjective consciente qu’a l’individu quand il est confronté au stimulus douloureux ; iii) la composante cognitive, c’est-à-dire les mécanismes de traitement, d’attention, de mémorisation et de stratégies comportementales mises en place par l’individu pour éviter une situation douloureuse.
Ces trois composantes interagissent. Par exemple, l’expérience émotionnelle négative de la douleur peut engendrer des troubles cognitifs chez l’individu (p. ex. biais de jugement, d’attention ou de mémoire) (Eccleston & Crombez, 1999 ; Moriarty et al., 2011 ; Low, 2013). Aussi, la prise en compte du triptyque sensitif-affectif-cognitif est nécessaire pour appréhender l’expérience douloureuse et pouvoir la traiter au mieux. Chez l’animal, la compréhension du ressenti de l’individu, en situation douloureuse ou non, est inférée de ses réponses comportementales et physiologiques (Paul et al., 2005 ; Boissy et al., 2007a). Cette approche est retrouvée pour de nombreux taxons de mammifères – incluant l’humain (encadré 1), mais aussi chez d’autres vertébrés comme les poissons (encadré 2).
Jusqu’au début des années 2000, aucune étude scientifique n’avait été entreprise pour déterminer si les poissons pouvaient ressentir de la douleur, cette capacité ayant longtemps été réservée aux vertébrés dotés d’un néocortex (Rose, 2002). En 2003, paraît l’article de Lynne Sneddon qui fera ensuite référence dans la littérature relative à la douleur chez les poissons. Ayant découvert la présence de nocicepteurs* chez la truite arc-en-ciel (Oncorhynchus mykiss) grâce à des techniques de neuroanatomie et d’électrophysiologie (Sneddon et al., 2003), ces auteurs démontrent également que le comportement de l’animal est durablement affecté suite à une stimulation nocive et qu’il ne s’agit pas de simples réponses réflexes. De plus, l’administration de morphine réduit les manifestations comportementales observées. Sneddon (2003) conclut alors que les poissons – a minima l’espèce étudiée – sont capables de percevoir la douleur. Des résultats similaires ont ensuite été obtenus chez d’autres espèces, même si les réponses comportementales et physiologiques, ainsi que les seuils de sensibilité à la douleur varient. Par exemple, la carpe (Cyprinus carpio) semble moins sensible (elle manifeste moins de comportements liés à la douleur après un stimulus nocif*) que la truite ou le poisson-zèbre (Danio rerio) (Ashley et al., 2007 ; Reilly et al., 2008). Les recherches permettant de déterminer les molécules analgésiques efficaces et les doses à administrer se poursuivent donc, espèce par espèce (poisson rouge (Carassius auratus) et saumon Atlantique (Salmo salar) (Nordgreen et al., 2009) ; carpe (Harms et al., 2005) ; truite (Mettam et al., 2011)).
Pour être considérée comme sensible à la douleur, une espèce doit répondre à ces deux conditions : elle doit présenter une réaction globale (comportement et physiologie) à la douleur et doit présenter des changements motivationnels après un évènement douloureux (Sneddon et al., 2014). À ce jour, les vertébrés et invertébrés répondent à ces conditions.
1.2. Mécanismes et types de douleur
Chez les mammifères, les nocicepteurs primaires sont des neurones spécialisés, capables de transformer le stimulus nocif en un message nociceptif (Paulmier et al., 2015). Le message nociceptif est formé dans les terminaisons libres de ces nocicepteurs qui se trouvent dans la peau, les articulations et les muscles pour les douleurs somatiques et dans les organes internes pour les douleurs dites viscérales (figure 1).
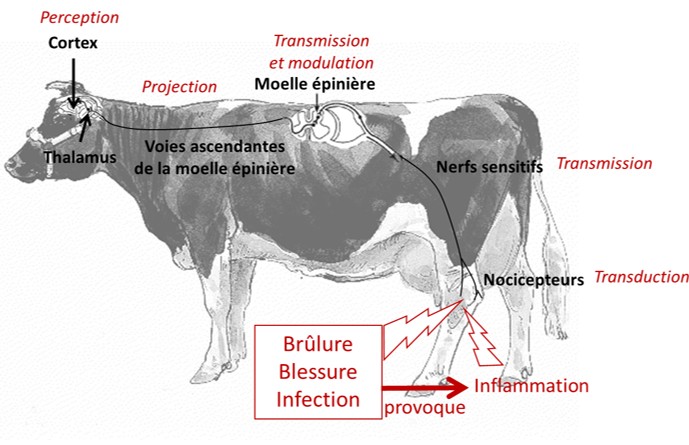
Figure 1. Mécanismes de la douleur chez les animaux de production, adapté de Gaynor & Muir (2015).
La plupart des nocicepteurs répondent via des récepteurs spécifiques à des stimuli nocifs mécaniques, thermiques et chimiques (Ghori et al., 2009). Une lésion provoque ainsi la transduction d’un message nociceptif. En parallèle, les nocicepteurs primaires peuvent libérer des substances qui activent des réactions vasculaires et immunitaires sur le site lésionnel (vasodilatation, extravasation du plasma, attraction des macrophages, dégranulation des mastocytes…).
Il existe deux types de nocicepteurs primaires : les fibres A et C. La stimulation des fibres A correspond à la nociception immédiate. Le signal, perçu en moins de 500 ms, provoque une douleur aiguë avec une sensation de piqûre précisément localisée, qui dure tant que le stimulus est présent. Si le stimulus est d’ampleur suffisante, il stimule également les nocicepteurs C. Le signal est perçu environ une seconde après la stimulation, avec une sensation de brûlure ou une douleur sourde plus diffuse et persistante, s'étendant au-delà de la fin du stimulus nocif (Ploner et al., 2002). Ainsi, une piqûre ou coupure par exemple provoquent dans un premier temps une sensation douloureuse aiguë très précise, puis une douleur plus diffuse qui perdure.
Le message nociceptif est conduit par les nerfs sensitifs depuis son origine périphérique jusqu’à la moelle épinière où le nocicepteur primaire se connecte via une synapse sur un autre nocicepteur, appelé « neurone de second ordre » et dont la fonction est de transmettre le message via les voies ascendantes de la moelle épinière au cerveau (Paulmier et al., 2015) (figure 1). Le signal y est alors traité par un réseau, appelé la matrice de la douleur, et impliquant de nombreuses structures. Certaines zones spécialisées du cortex permettent d’identifier la partie du corps concernée, le type, la durée et l’intensité du stimulus et amènent au déclenchement d’une réaction de l’animal (le plus souvent, une fuite, un affrontement ou une immobilisation). D’autres zones du cortex interprètent la douleur en termes d’émotion négative. Ainsi, l’expérience de la douleur représente une sensation nociceptive associée à une émotion négative, en accord avec la définition de la douleur de l’IASP. D’autres parties du cerveau, sous-corticales, sont impliquées dans l’activation des voies du stress (système orthosympathique et axe corticotrope) qui accompagne la douleur, ou encore dans la modulation de la douleur. Cette modulation se fait grâce à des voies descendantes venant du cerveau et influençant la transmission entre les nocicepteurs primaires et les neurones de second ordre : le signal peut ainsi être renforcé ou au contraire inhibé sous ces influences.
Suite à une lésion, selon une séquence précise d’événements (annexe 1), les cellules immunitaires migrent vers le site de la lésion pour initier la réparation des tissus. Il s’agit de la phase inflammatoire qui aboutit à une nociception accrue car certains médiateurs de l’inflammation accroissent la sensibilité des nocicepteurs ; on parle d’hyperalgésie (Zhang & An, 2007). Dans certains cas, des douleurs chroniques (ex. arthrose…) peuvent se développer. En élevage, les douleurs chroniques peuvent avoir des origines nociceptives (traumatiques, post-chirurgicales, musculosquelettiques en particulier), ou possiblement neuropathiques (Cheng, 2006). Les douleurs chroniques nociceptives sont les plus fréquentes. Ainsi, des affections chroniques, comme l’arthrose, sont une source permanente d’inflammation et de stimulation nociceptive, provoquant une douleur chronique (Grace et al., 2021).
La douleur neuropathique (sensation de brûlure, picotements) est définie comme une « douleur causée par une lésion ou maladie du système nerveux somatosensoriel » (IASP). Une douleur neuropathique peut être générée par une lésion ou une compression nerveuse, ou s’ajouter à une douleur nociceptive en phase chronique. Elle peut également être causée par une affection du système nerveux somatosensoriel : le système nerveux lui-même est affecté et signale la présence d’un stimulus nocif alors qu’il n’existe pas (Schaible et al., 2011). La douleur neuropathique peut être associée à l’allodynie : une stimulation normalement non douloureuse, comme un léger toucher, provoque alors de la douleur (Finnerup et al., 2021).
Les poissons répondent aux deux conditions (voir précédemment) nécessaires pour être considérés comme sensibles à la douleur : la réaction globale à la douleur et l’existence de changements motivationnels après un évènement douloureux (Sneddon et al., 2014).
Premièrement, aux niveaux anatomique et physiologique, les poissons osseux sont équipés de nocicepteurs tels que les fibres C et A avec un ratio qui diffère par rapport aux mammifères puisque les fibres C ne représenteraient que 4 à 5 % du total (Sneddon et al., 2003 ; Roques et al., 2010 ; Sneddon, 2020), alors que chez l’être humain, dans les racines dorsales de la moelle épinière, jusqu'à 80 % des fibres sont de type C (DaSilva & DosSantos, 2012). Une différence notable pour la classe des chondrichtyens (poissons cartilagineux) est que seules des fibres de type A sont présentes (Snow et al., 1996). Chez les poissons osseux comme la truite, trois classes de nocicepteurs aux propriétés électrophysiologiques comparables à celles des mammifères ont été identifiées : nocicepteurs polymodaux (sensibles aux stimuli mécaniques, thermiques, chimiques), mécanothermiques et mécanochimiques. Une adaptation spécifique existe tout de même puisque, par exemple, les thermorécepteurs de la truite ne réagissent pas aux températures basses (Sneddon, 2020). Les parcours neuroanatomiques des informations transmises par les nocicepteurs sont fortement conservés entre les téléostéens (poissons osseux) et les mammifères (Sneddon, 2004). Différentes zones du cerveau, également impliquées chez les mammifères, sont mises en jeu dans la réception de ce signal, en particulier le thalamus et plusieurs aires corticales. Lors de stimuli nocifs, les aires réflexes de la moelle épinière et du cerveau postérieur ne sont donc pas les seules mises en jeu. Par ailleurs, des récepteurs opioïdes et les opioïdes endogènes sont présents dans diverses zones du cerveau et dans la moelle épinière des poissons (Sneddon, 2004) (Pilot-Storck et al., 2025 ; dans ce numéro). Chez les poissons, des réponses comportementales persistantes ont été mises en évidence suite à un stimulus nocif (section de nageoire ou injection d’acide au niveau de la bouche), allant de quelques heures à plusieurs jours (Sneddon et al., 2003 ; Reilly et al., 2008 ; Schroeder & Sneddon, 2017). La réaction des animaux ne se limite donc pas à des réflexes nociceptifs instantanés. Ces réactions sont en revanche variables selon les espèces (Flecknell et al., 2007).
Concernant la deuxième condition, les études portent sur le fait que les poissons soient prêts à « payer un prix » pour accéder au soulagement de la douleur (effort supplémentaire ou suppression d’une ressource). Cette seconde condition est également validée chez les poissons puisque, par exemple, le poisson-zèbre (Sneddon, 2020) et la truite (Ashley et al., 2009) sont prêts à s’imposer des conditions environnementales défavorables pour accéder à un soulagement de leur douleur (Pilot-Storck et al., 2025 ; dans ce numéro).
2. Sources et conséquences de la douleur chez les animaux de production
2.1. Sources de douleur
a. Facteurs environnementaux : élevage, transport et abattage
Les animaux d’élevage sont confrontés à différentes situations pouvant générer de la douleur. Il peut s’agir d’interventions (Prunier et al., 2013) comme la castration, l’ébourgeonnage, le bouclage, etc. Ces douleurs ont la particularité d’être prévisibles et donc leur prise en charge peut être anticipée. À l’inverse, les conflits entre animaux qui génèrent des lésions, ou les maladies telles que les mammites par exemple (Fogsgaard et al., 2012) ont une survenue et une douleur associée qui ne sont pas ou que peu prévisibles. En outre, les boiteries et mammites peuvent être sources de douleurs chroniques.
À ce jour, les scientifiques ne sont pas capables de classer les interventions en fonction de la douleur qu’elles créent. En effet, pour de nombreuses atteintes, nous ne disposons que d’évaluation de douleur « à dire d’expert » de la part de vétérinaires (Remnant et al., 2017) et pas ou peu d’études expérimentales. Par exemple, sur une échelle de 1 (pas de douleur) à 10 (douleur maximale), les praticiens jugent que, chez les bovins, les interventions les plus douloureuses (score médian > 8) sont l’amputation d’onglons, la fracture d’un membre, la césarienne, l’intervention chirurgicale de l’ombilic chez le veau, le déplacement de caillette et la fracture du bassin (Remnant et al., 2017).
Le transport (encadré 3) et l’abattage des animaux d’élevage sont des phases critiques au regard de la protection animale. Un grand nombre d'animaux sont concernés. La consommation annuelle de viande dans l’Union européenne représente environ 360 millions de mammifères (porcins, ovins, caprins, bovins), et plus de 4 milliards de volailles et 13 millions de tonnes de poissons. De plus, quasiment dans tous les cas, l’abattage est associé à un transport des animaux. Les sources de stress d'origine psychologique sont multiples et essentiellement liées à la peur et au stress social. Les sources de stress d’origine physique font référence à la fatigue, la faim et la soif et l’inconfort mais aussi à la douleur, qui peut être provoquée par des impacts et des chocs avec des équipements et avec d’autres animaux, comme des chevauchements ou des interactions agressives. Les interventions par des humains peuvent être douloureuses lorsqu’elles impliquent l’utilisation de bâtons ou d’ASACE*. Si elle est mal gérée, la contention à l’abattoir avant étourdissement peut aussi induire des douleurs. C’est le cas en particulier de l’accrochage par les pattes chez les volailles avant étourdissement, lorsqu’elles sont encore conscientes. L’objectif de l’étourdissement est d’induire l’inconscience de l’animal avant la saignée, pour éviter stress et douleur. Après l’application de l’étourdissement, l’état d’inconscience de l’animal doit être vérifié. Lorsque qu’elle n’est pas confirmée, l’étourdissement doit être renouvelé. Un étourdissement mal maîtrisé est une source de douleur. L’étourdissement par gaz peut également être source de douleur, à cause des effets irritants sur les muqueuses respiratoires (Terlouw et al., 2021).
Le règlement (CE) No 1099/2009 stipule que « Les exploitants ou toute personne associée à la mise à mort des animaux devraient prendre les mesures nécessaires pour éviter la douleur et atténuer autant que possible la détresse et la souffrance des animaux pendant l’abattage ou la mise à mort, en tenant compte des meilleures pratiques en la matière et des méthodes autorisées par le présent règlement. » Il est important de rappeler que les manipulations douloureuses intentionnelles comme les coups, l’usage des aiguillons, l’atteinte des zones sensibles sont strictement interdites.
Les transports, par voie terrestre ou maritime, sont des situations à risque important vis-à-vis de la protection animale. Ils sont notamment confrontés à des incertitudes liées aux conditions climatiques, aux imprévus du transport et aux contraintes administratives ou sanitaires. Les conditions physiologiques et sanitaires des animaux influencent leurs réponses aux différentes contraintes. L’aptitude des animaux au transport est définie par les textes réglementaires et exclut les animaux en mauvais état général, présentant des difficultés de déplacement ou un certain nombre de lésions ou de problèmes pathologiques. Les femelles en gestation avancée (dernier tiers) ou ayant mis bas récemment sont aussi exclues. L’âge des animaux est un facteur important. Le règlement européen interdit le transport des nouveau-nés et des porcelets de moins de trois semaines, agneaux de moins d’une semaine, veaux de moins de dix jours (sauf sur une distance inférieure à 100 km). La Commission européenne a publié des guides de bonnes pratiques sur le transport des bovins
b. Facteurs génétiques
La sélection génétique des animaux reproducteurs est un levier majeur pour augmenter la productivité. Un principe de cette sélection a été la spécialisation des races ou lignées pour une production donnée, lait (Prim’Holstein) ou viande (Charolais) chez les bovins, prolificité (Large White) ou conformation (Piétrain) chez le porc, œufs (Isa Brown) ou croissance (Ross) chez les volailles, complété par des caractères à visée économique (efficacité alimentaire, adiposité). Les progrès ont été considérables et mènent dans plusieurs productions à l’obtention d’« hypertypes », anatomiques ou physiologiques, résultant de l'accentuation à l'extrême de traits distinctifs propres à une race ou à une lignée, tels que les animaux « culards » à la musculature hypertrophiée, des vaches laitières hautes productrices, à la mamelle de grande taille, des lignées « hyperprolifiques » aux nouveau-nés trop nombreux et à viabilité réduite. Cette intense sélection essentiellement orientée vers les caractères de production a conduit à des réponses corrélées défavorables sur les aptitudes fonctionnelles des animaux. Divers troubles cardiovasculaires et métaboliques sont observés (myopathies, ascite, problèmes cardiaques et hépatiques, déséquilibre phospho-calcique) ainsi que des problèmes liés à la reproduction (difficultés de mise bas ou nouveau-nés de petit poids, portées hétérogènes, mortalité dans le jeune âge, stérilité) (Huber, 2024). Ces troubles limitent la productivité des animaux à plusieurs niveaux (fertilité, résistance aux maladies, locomotion, longévité, comportement…) et, globalement, mènent à une perte de robustesse des animaux et une diminution de la résilience des systèmes de production (Le Roy et al., 2019). La plupart de ces troubles sont à l’origine de douleurs telles que par exemple le recours systématique à la césarienne lors de la mise bas en race blanc-bleu-belge, ou encore les fractures des membres chez les poulets de chair issus de souches à croissance rapide. La solution passe par une évolution des objectifs de sélection génétique : limitation des phénotypes extrêmes (conformation, croissance, production de lait ou d’œufs) et prise en compte des caractères dits « fonctionnels » dans les objectifs de sélection (aptitude maternelle, longévité fonctionnelle, résistance aux maladies, qualité des aplombs, fertilité, comportement, sensibilité au stress…).
2.2. Conséquences de la douleur
a. Conséquences de la douleur sur le bien-être
La douleur est l’un des facteurs les plus préjudiciables au bien-être, et c’est pourquoi l’« absence de douleur » fait partie des libertés et des dimensions du bien-être animal (Farm Animal Welfare Council, 1992 ; Botreau et al., 2009 ; Mellor, 2016).
La douleur est une expérience multidimensionnelle, qui repose sur trois composantes (sensori-discriminative, émotionnelle et cognitive) (voir § 1.1). Lorsque l’on s’intéresse à la douleur du point de vue de l’animal et de son bien-être, c’est-à-dire à la manière dont l’animal vit et ressent cette douleur, il est indispensable d’aller au-delà de l’étude de sa composante sensitive, et ainsi d’essayer de comprendre si et comment ce stimulus nocif atteint l’animal sur les plans émotionnels et cognitifs (de Boyer des Roches, 2021). Ces trois composantes de la douleur ont été mises en évidence chez l’espèce humaine et chez les rongeurs (Mogil, 2009 ; Moriarty et al., 2011 ; Sneddon et al., 2014). Chez les animaux de production, les travaux se sont surtout concentrés sur la caractérisation de la composante sensitive et ont abordé la composante émotionnelle mais très peu la composante cognitive.
Plusieurs dispositifs expérimentaux et indicateurs permettent d’étudier les états affectifs négatifs durables. Ces dispositifs ont été développés, au départ, chez les rongeurs (Jirkof et al., 2019 ; Planchez et al., 2019). Certains ont été adaptés pour une utilisation chez les animaux de production (ex. revue pour les bovins (Ede et al., 2019b)), mais ces travaux sont, pour l’instant, rares. Certaines approches ont permis d’appréhender la composante émotionnelle négative de la douleur, via l’étude de l’anhédonie, l’anxiété, ou l’utilisation de mesures telles que l’évaluation qualitative du comportement (QBA) ou de dispositifs de tests.
L’anhédonie est l’incapacité, pour un individu, à ressentir des émotions positives comme la joie ou le plaisir. L’anhédonie est un signe de dépression, car elle affecte la motivation et le plaisir (Treadway & Zald, 2011). Chez les bovins, l’écornage induirait de l’anhédonie : des génisses consommaient moins de solution sucrée après avoir été écornées qu’avant (Lecorps et al., 2020) ; de même des vaches adultes venaient moins au cornadis lors d’un test de motivation alimentaire (distribution de concentrés) lors de la phase aiguë d’une inflammation systémique associée à de la douleur (Ledoux et al., 2023).
L’anxiété correspond à l’anticipation plus ou moins consciente d’un danger ou d’un problème à venir. La plupart des tests visant à évaluer l’anxiété reposent sur des conflits entre l’approche et l’évitement. Chez les bovins et ovins, les tests en open field ont été les plus utilisés, pour étudier les réactions de peur (Forkman et al., 2007). En revanche, à notre connaissance, ils n’ont jamais été utilisés dans un contexte de douleur.
L’Évaluation qualitative du comportement (QBA) (Wemelsfelder, 2007) est une méthode d’observation du comportement qui permet de décrire la qualité du comportement plutôt que sa quantité, et permet ainsi d’étudier l'expressivité animale (c'est-à-dire le langage corporel) : le QBA précise peu ce que fait l'animal, mais comment il le fait (Wemelsfelder et al., 2001). Le QBA est utilisé afin de déterminer l’état émotionnel des individus (ex. protocoles Welfare Quality® et Awin®), dans différents contextes (ferme ou abattoir par exemple) et chez plusieurs espèces de production (Rousing & Wemelsfelder, 2006 ; Phythian et al., 2016). Récemment, le QBA a été utilisé pour évaluer la composante émotionnelle de la douleur. Il a été mis en évidence que les vaches laitières avaient un état émotionnel négatif lors de mammites et d’autant plus marqué lors de la phase aiguë de l’affection (de Boyer des Roches et al., 2018). Cette méthode a permis également de discriminer la présence ou l’absence de douleur suite à une castration chez de jeunes agneaux (Masłowska et al., 2020). Elle a permis également de discriminer le niveau de douleur ressenti suivant différentes techniques de castration : les agneaux castrés avec des élastiques avaient un état émotionnel plus dégradé que ceux castrés chirurgicalement ou avec la pince burdizzo (Masłowska et al., 2020).
Le test de conditionnement d’évitement du lieu (« conditioned place avoidance », CPA ; reposant sur l’association entre un lieu et de la douleur) a été utilisé récemment pour tester l’effet de l’ébourgeonnage des veaux sur leur état affectif (Ede et al., 2019a). Des veaux ont été ébourgeonnés (sous sédation et anesthésie) et d’autres veaux ont eu un ébourgeonnage fictif sous sédation dans l’un des compartiments du dispositif. La préférence de lieu a été évaluée 48, 72 et 96 heures après intervention. Les veaux qui avaient été ébourgeonnés passaient moins de temps dans le compartiment où l’intervention avait été réalisée que dans l’autre compartiment, mettant en évidence un conditionnement d’évitement du lieu.
La composante cognitive de la douleur correspond aux mécanismes de traitement de l’information et donc d’attention, de mémorisation et de stratégies comportementales mises en place par l’individu pour éviter une situation douloureuse (Grégoire et al., 2010). De nombreux travaux en médecine humaine ont montré les conséquences de la douleur chronique sur les capacités cognitives des patients (Hart et al., 2000). Ces processus cognitifs ne peuvent être observés ou mesurés directement. Ils doivent être inférés à partir de l’observation des changements survenus au niveau d’une performance comportementale. Il existe quelques travaux chez les animaux de production.
Le biais de jugement est un biais cognitif qui correspond à la propension qu’a un individu à attribuer une valence positive ou négative à une situation ambiguë. Une seule étude a été conduite sur un modèle de douleur chez les animaux de production : l’ébourgeonnage, qui a induit un biais de jugement négatif (Neave et al., 2013).
L’attention est l’allocation sélective des ressources cognitives à des informations en particulier. Les biais d’attention décrivent l’allocation de l’attention envers un stimulus plutôt que d’autres (Crump et al., 2018). À notre connaissance, une seule étude, réalisée chez le cheval, a exploré les liens entre la douleur et l’attention (Rochais et al., 2016). Dans cette étude, les auteurs ont observé les animaux dans leur milieu de vie et ont noté à intervalle régulier si l’animal était attentif à son environnement de vie (écurie). Cette étude a montré une réduction de l’attention chez des chevaux présentant des atteintes dorsales douloureuses.
Plusieurs dispositifs ont été développés afin de tester la mémoire, sociale et non sociale, et spatiale (pour revue chez les humains et rongeurs : Moriarty et al., 2011 ; Planchez et al., 2019). Cependant, à notre connaissance de tels dispositifs n’ont jamais été déployés pour évaluer l’effet de la douleur sur les capacités amnésiques des animaux de production.
b. Conséquences de la douleur sur la santé
La douleur contribue également à une dégradation de la santé des animaux. L’incidence de troubles respiratoires était significativement moindre durant l’engraissement pour les bouvillons ayant reçu des Anti-inflammatoires non stéroïdiens (AINS) en plus de l’anesthésie (21 %) lors de leur castration en comparaison de ceux n’ayant reçu qu’une anesthésie locale* (36 %) (Coetzee et al., 2012). En outre, l’ajout d’un AINS lors d’une césarienne avait un impact positif sur la qualité du transfert d’immunité colostrale probablement en lien avec un temps de tétée plus long pour le veau du fait de l’analgésie* dont bénéficiait la mère (Guatteo et al., 2022).
c. Impact économique des affections douloureuses
Les affections douloureuses, de par leur impact sur le comportement, la santé et le bien-être des animaux, ont des conséquences néfastes sur leurs performances. À titre d’exemple, chez les bovins, compte tenu de la douleur générée par les boiteries, les animaux modifient leur comportement alimentaire. Les impacts à court terme varient selon la gravité de la boiterie. Une boiterie modérée est associée à une réduction de l’ingestion (–3 %) et de la production laitière (–5 %). Une boiterie sévère a un impact plus marqué : elle est associée à une réduction de l’ingestion (–16 %) et de la production laitière (–36 %). On observe une augmentation de 25 jours de l’intervalle vêlage - première insémination et un risque de réforme multiplié par cinq en cas de boiterie sévère (Robinson, 2011) justifiant, en plus des considérations éthiques, une prise en charge. On dispose de données similaires pour nombre d’autres affections ou situations douloureuses chez les ruminants : ébourgeonnage (Herskin & Nielsen, 2018), castration (Earley & Crowe, 2002 ; Coetzee, 2013), mammites (Mcdougall et al., 2009, 2016), etc. Chez les bovins allaitants, une étude a décrit un ralentissement de la croissance, mesurée par le gain moyen quotidien (GMQ), associé à la castration, en comparant les résultats obtenus sur des bovins castrés avec ou sans anesthésie et/ou analgésie et relevé une baisse du GMQ en cas de castration sans analgésie adaptée (figure 2) (Earley & Crowe, 2002). Chez le taureau, l’électroéjaculation est reconnue comme douloureuse et stressante : on constate une augmentation de la cortisolémie et de la progestéronémie ainsi qu'une diminution marquée des teneurs sanguines en LH (luteinizing hormone) et en testostérone après stimulation (Welsh & Johnson, 1981). Ces anomalies sont associées à une altération de la qualité et une moindre quantité de sperme produite en comparaison à une récolte « manuelle » (Welsh & Johnson, 1981).
Une analgésie permet de limiter les pertes de croissance (+/– écart-type) après une castration chez des bovins, d’après Earley & Crowe (2002). AINS = anti-inflammatoire non stéroïdien.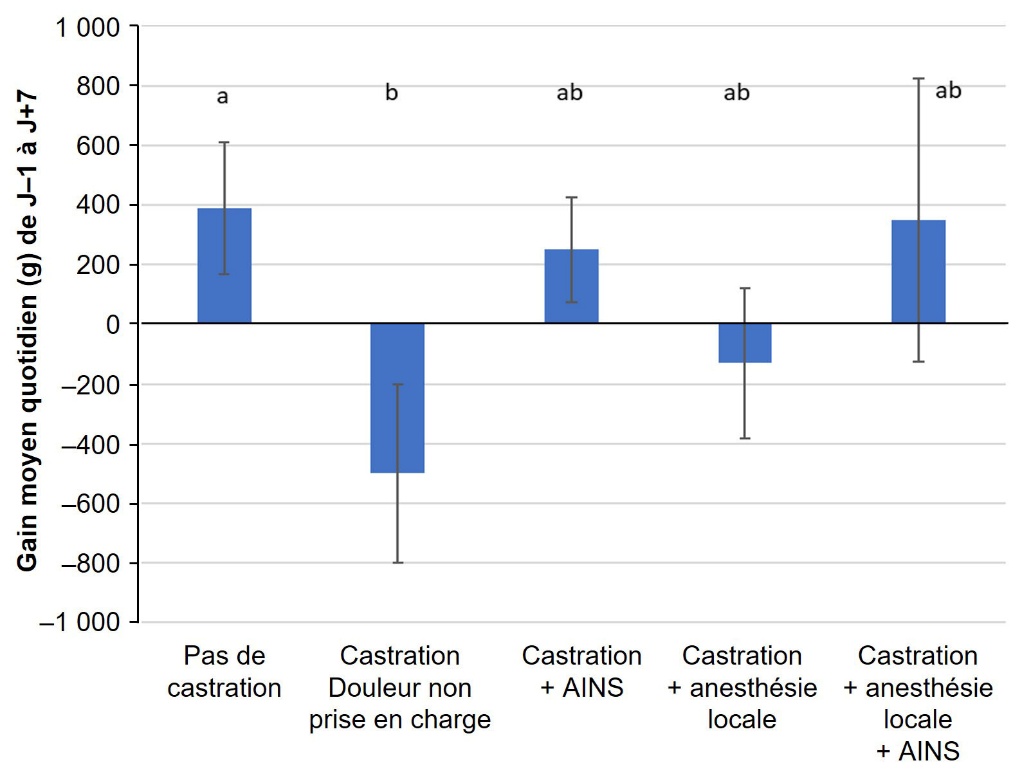
Figure 2. Effet de la castration avec ou sans anesthésie locale et avec ou sans AINS sur la croissance des bovins pendant les sept jours suivant l’intervention.
3. Détecter et évaluer la douleur chez les animaux de production
3.1. Méthodologie de l’évaluation de la douleur
Chez l’être humain pouvant parler il est possible d’évaluer la douleur en questionnant le patient. Chez l’animal, la douleur ne peut pas être mesurée ainsi ; le ressenti douloureux est inféré des réponses comportementales et physiologiques (Boissy et al., 2007a, 2007b), et ce, pour toutes les espèces. Les schémas expérimentaux des études portant sur l’évaluation de la douleur incluent ainsi le suivi d’animaux avant, pendant et après des événements douloureux, la comparaison de réponses entre des individus témoins et des individus soumis à des situations douloureuses, avec et sans analgésie ou anesthésie, ou avec différents degrés de gravité.
Plusieurs indicateurs peuvent être utilisés (voir ci-après). Chaque catégorie d’indicateurs présente des avantages et des inconvénients (tableau 1). Les méthodes de validation de ces indicateurs ont été décrites afin d’éviter des biais d’évaluation ; nous ne les détaillerons pas ici (Tomacheuski et al., 2023).
Indicateurs cliniques et de l’atteinte tissulaire | Indicateurs de la réponse neuroendocrine | Indicateurs comportementaux | Indicateurs zootechniques | |
Avantages | Non invasifs pour les critères lésionnels | Sensibles | Non invasifs Très sensibles Très précoces | Non invasifs |
Inconvénients | Invasifs (critères inflammatoires) Souvent spécifiques Nécessité de les combiner à d’autres critères | Peu spécifiques Peu adaptés à des mesures en conditions d’élevage Invasifs (si dosés dans le sang) ou moins (si dosage dans la salive) | Pas toujours spécifiques Varient selon l’espèce, l’âge, le stade physiologique et la source de douleur Formation indispensable pour favoriser une bonne reproductibilité | Peu sensibles Très peu spécifiques |
3.2. Atteinte tissulaire et inflammation
L’examen clinique, l’autopsie ou l’analyse histopathologique peuvent révéler des lésions à l’origine d’une douleur telles que les fractures, les atteintes cutanées, les abcès et les névromes (Prunier et al., 2013). En élevage, une approche classique consiste à relever au niveau de différentes zones du corps (épaules, dos, genoux, tarses, carpes, mamelle…) le nombre et la gravité des blessures, les abcès et, dans les cas extrêmes, les fractures. À partir du dénombrement de ces lésions et/ou de leur gravité (Lardy et al., 2020), il est possible d’établir des scores (Botreau et al., 2009).
La réponse inflammatoire, suite à une atteinte tissulaire, comporte trois phases : la phase d’initiation, la phase d’amplification et une phase de résolution. Lors de la phase d’initiation, les cellules phagocytaires produisent et libèrent des espèces réactives oxygénées (ERO) avec une action bactéricide locale. La production des ERO est contrôlée par des antioxydants endogènes : le rapport GSH/GSSG permet de caractériser, de manière indirecte, l’inflammation. Lors de la phase d’amplification, des cytokines anti-inflammatoires (interleukines 10, IL10) ou pro-inflammatoires (IL-1, IL-6, IL-8, TNFα) sont sécrétées. Elles modulent la production de protéines de la phase aiguë de l’inflammation (haptoglobine et amyloïde A sérique, SAA). Les cytokines, l’haptoglobine et la SAA peuvent être utilisées comme indicateurs de l’inflammation (castration (Coetzee, 2011) ; ébourgeonnage (Herskin & Nielsen, 2018), mammite (Herry et al., 2017)).
3.3. Réponse neuroendocrinienne
La douleur entraîne des modifications neurophysiologiques via deux voies principales (Prunier et al., 2013 ; Faure et al., 2015 ; Paulmier et al., 2015). Le système nerveux autonome (SNA), sympathique et parasympathique, régule les fonctions des organes et de l’appareil circulatoire. Les organes (cœur, poumon, viscères abdominaux) sont innervés par les fibres de ces deux systèmes, jouant un rôle activateur ou inhibiteur. La douleur engendre une activation du système nerveux sympathique, ce qui se traduit par une élévation de la fréquence cardiaque, par des modifications de la variabilité de la fréquence cardiaque (Faure et al., 2017), et par la libération d’adrénaline et de noradrénaline. L’axe corticotrope (ou axe hypothalamo-hypophyso-surrénalien, HHS) est également activé lors d’une situation douloureuse, ce qui peut être mis en évidence par le dosage de glucocorticoïdes, tels que le cortisol salivaire ou plasmatique. Ainsi, on constate une élévation du taux de cortisol plasmatique ou salivaire suite à une castration (Coetzee, 2011), un ébourgeonnage (Herskin & Nielsen, 2018), ou lors de maladies douloureuses telles que les mammites (Hirvonen et al., 1999 ; de Boyer des Roches et al., 2017 ; Ginger et al., 2023b). Ces modifications physiologiques induisent des modifications métaboliques : la stimulation du système sympathique et de l’axe HHS augmente la néoglucogenèse et le catabolisme protéique et lipidique, modifiant ainsi les concentrations plasmatiques de nombreux métabolites.
3.4. Réponse Comportementale
La réponse comportementale est la plus sensible et certains comportements sont très spécifiques. Les réponses comportementales en situation de douleur (« Pain-Like Behavior ») peuvent être étudiées selon deux modalités. La première consiste à observer les réponses spontanées de l’animal dans un environnement donné (son lieu de vie, lors d’une intervention…). Cette démarche est prépondérante dans les études portant sur les animaux de production (Prunier et al., 2013), et chez les animaux de compagnie (encadré 4). La seconde, prépondérante dans les études portant sur les rongeurs (Mogil, 2020), consiste à placer l’animal dans un dispositif de test comportemental où la réponse de l’animal est provoquée. Le choix de l’observation de comportements spontanés ou provoqués dépend de la question de recherche posée (Nielsen, 2020). Par exemple, la modification de l’organisation des activités en cas de douleur est plus facilement mise en évidence par des observations de l’animal dans son environnement de vie ; en revanche, un biais cognitif provoqué par la douleur est plus facilement mis en évidence lors de tests comportementaux (Neave et al., 2013).
L'attention portée à la reconnaissance et au traitement de la douleur est particulièrement marquée chez les animaux de compagnie, qui sont en contact étroit avec les humains.
La douleur aiguë est essentiellement observée lors de réalisation d’actes chirurgicaux et a pour conséquence immédiate un déséquilibre du système nerveux autonome (Hernandez-Avalos et al., 2019). La douleur chronique a des répercussions très diverses qui affectent la qualité de vie de l'individu.
Chez l’animal de compagnie, la mesure de la douleur aiguë est le plus souvent fondée sur l’observation du comportement par le soignant, tandis que la douleur chronique est généralement évaluée par le propriétaire qui vit avec son animal (Reid et al., 2018). Des moniteurs de la nociception, initialement développés pour la médecine humaine, ont été adaptés. Parmi ces dispositifs, on trouve le pupillomètre (Mascaró Triedo et al., 2024) et l'Indice Analgésie-Nociception (ANI ou PTA en médecine vétérinaire) (Ruíz-López et al., 2023). Mais l'évaluation qualitative (Zanusso et al., 2024) de la douleur aiguë chez ces animaux repose aussi sur l’observation de certains signes comportementaux spécifiques ou de grimaces faciales (Maulave et al., 2022).
L'approche contemporaine de l’évaluation de la douleur chronique chez l’être humain et l’animal cherche à mesurer la composante affective (émotionnelle) de l’expérience de la douleur à l’aide de questionnaires structurés et d'une méthodologie de notation formelle. On trouve plus de 18 grilles de score de douleur chez le cheval et chez le chien, 12 chez le chat et 3 chez l’âne
Les indicateurs comportementaux utilisables dans les études portant sur la douleur peuvent être classés de trois façons différentes : centrés sur l’individu, en interaction avec son environnement physique ou avec son environnement social. Ces indicateurs peuvent être spécifiques ou non de certaines composantes de la douleur. Certains peuvent être enregistrés à l’aide de capteurs (encadré 5).
Dans certains cas, l’utilisation d’indicateurs comportementaux comme signes de douleur se révèle très chronophage, soit parce que les comportements sont rarement exprimés (ex. toilettage, jeu), soit parce que leur évolution doit être suivie sur plusieurs heures voire journées (ex. temps passé à ruminer, à ingérer, à rester immobile, à s’isoler…). Les outils permettant d’automatiser la collecte des informations comportementales sont alors complémentaires à l’observation visuelle pour la mise en évidence d’un animal présentant une douleur (Ledoux et al., 2023). En utilisant des technologies de pointe telles que la microélectronique, l’informatique, les télécommunications ou encore les nanotechnologies, capables de fournir des indicateurs physiologiques, comportementaux ou de production, les capteurs (outils de monitoring) déjà présents au sein des élevages des animaux de production sont détournés au profit de la détection de la douleur. Ce sont ces variations de comportement ou de physiologie qui sont généralement utilisées dans les outils d’élevage de précision pour avertir l’éleveur d’un problème. En complément de l’observation visuelle, les systèmes utilisant des capteurs, comme les accéléromètres (Stygar et al., 2021), bolus intraruminaux (moins fréquents en élevage) (Villot et al., 2020), systèmes de géolocalisation (Veissier et al., 2017) et les systèmes d’analyse d’image permettent de détecter les changements d'activité. Ces changements d'activité ne sont pas spécifiques à la douleur mais ils permettent de détecter un problème précocement et sur la durée. L’analyse d’image associée à de l’intelligence artificielle (IA) permettrait de repérer des lésions. Tous ces signes peuvent être pertinents selon le type de douleur dont souffre l’animal (aiguë, chronique, somatique, viscérale…) et les caractéristiques de l’animal (âge, personnalité, stade physiologique, race…). En plus des questionnements sur la performance des outils, pas toujours disponibles (Stygar et al., 2021), des questions pratiques telles que l’acheminement et le stockage des données, l’autonomie en énergie des dispositifs embarqués et le coût des capteurs sont encore particulièrement critiques, ainsi que le coût environnemental associé.
a. Indicateurs comportementaux individu-centrés
Les comportements de douleur observés à l’échelle de l’individu (ou « individu-centrés ») ont été beaucoup étudiés chez les animaux de production (Prunier et al., 2013). Ces comportements (figure 3) peuvent être observés pendant ou après l’acte douloureux, et peuvent être regroupés en sept catégories.
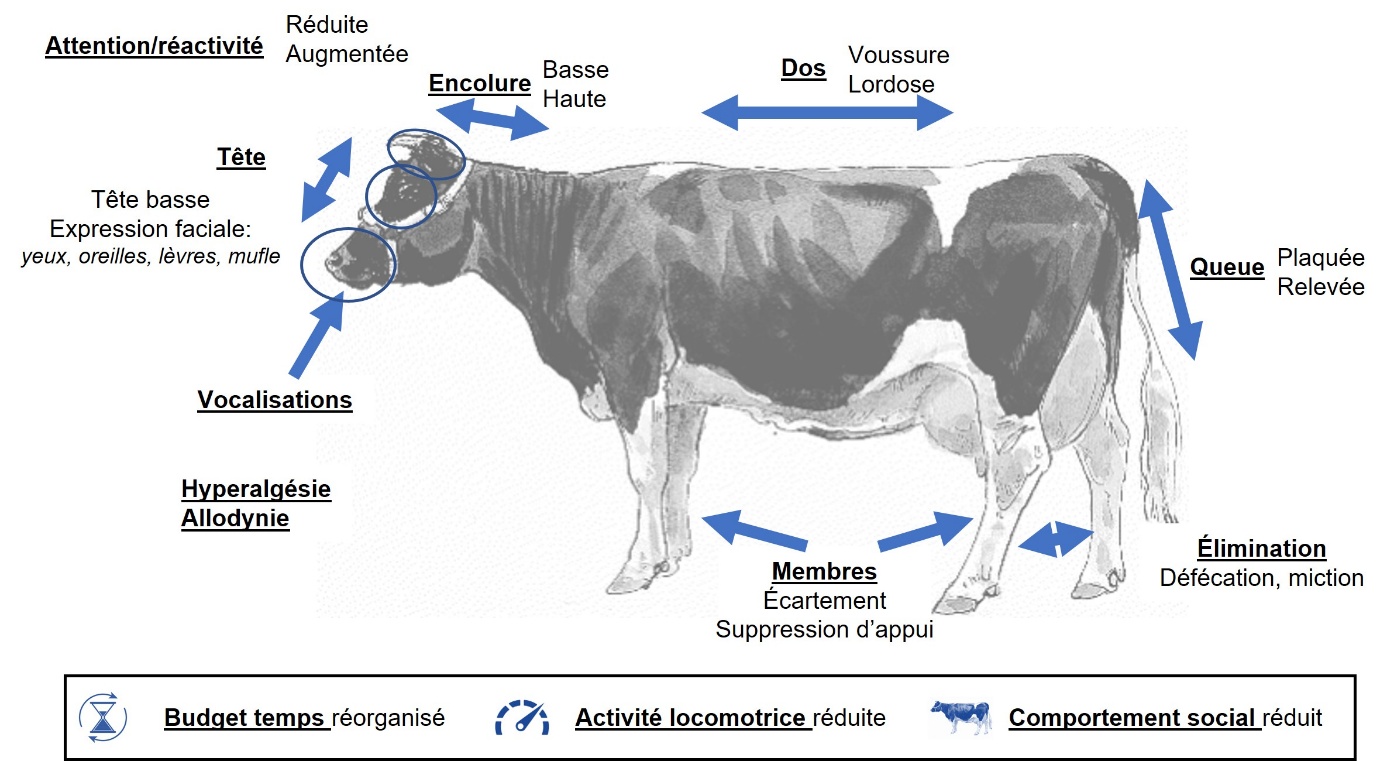
Figure 3. Principales modifications comportementales des bovins en lien avec la douleur.
Réponse de défense lors de l’acte douloureux ou après
La plupart des études portant sur l’effet d’interventions douloureuses enregistrent les comportements de retrait/de défense au moment de l’intervention, ou lors de la palpation de la zone suite à l’intervention. Ces réactions de défense ont été décrites lors de l’ébourgeonnage (Herskin & Nielsen, 2018), de la castration (bovins : (Coetzee, 2011, 2013), ovins (Molony et al., 1995, 1997) ; porcs (Hay et al., 2003)). Elles sont également observables lors de maladies associées à de la douleur, par exemple les vaches souffrant de mammites sont plus réactives lorsqu’on leur manipule la mamelle lors de la traite (Ginger et al., 2023b). Dans l’ensemble, la douleur provoque chez ces espèces des réponses de défense pendant l’intervention, mais également après l’intervention lors d’une palpation. Chez les poissons, les interventions/manipulations/palpations sont réalisées sous anesthésie ; il n’y a donc pas d’observation directe des poissons pendant l’acte potentiellement douloureux.
Activité locomotrice
En cas de douleur, les animaux modifient leur activité locomotrice. Par exemple les veaux se déplacent davantage suite à l’ébourgeonnage (Heinrich et al., 2010 ; Theurer et al., 2012), ou à la castration (Stafford & Mellor, 2005 ; Coetzee, 2011). En cas de mammite, les vaches restent plus longuement debout (Siivonen et al., 2011 ; Cyples et al., 2012). Chez les poissons, une modification de l’activité natatoire est également observée : chez le tilapia (Oreochromis niloticus), l’activité augmente suite à la section d’une nageoire (Roques et al., 2010), tandis qu’elle diminue chez le poisson-zèbre (Reilly et al., 2008).
Postures
Les animaux (toutes espèces) adoptent des postures (membres, queue, dos, tête) limitant la stimulation des zones douloureuses. Par exemple, en cas d’atteinte podale, on observe une modification des appuis lors de la station debout (Siivonen et al., 2011) ou de la marche (Sprecher et al., 1997). On observe également des changements de position, couchée ou debout : l’animal étend ou replie un membre, se couche sur un côté plutôt que l’autre. En cas de douleur, les bovins abaissent plus leur queue (Mølgaard et al., 2012 ; Ledoux et al., 2023), portent leur encolure basse (Faure et al., 2014 ; Durand et al., 2019), et voussent le dos (Sprecher et al., 1997). Ces changements de posture sont également observés chez le porc (Ison et al., 2016). Suite à une stimulation nocive, la truite se pose sur ses nageoires pectorales au fond du bassin et se balance d’un côté à l’autre (Sneddon, 2003).
Vocalisations
Certains bovins peuvent émettre des vocalisations lors de l’application d’un stimulus nocif (p. ex. lors de marquage (Watts & Stookey, 1999), ou pendant et après l'ébourgeonnage (Caray et al., 2015)) mais ce n’est pas le cas systématiquement (Mølgaard et al., 2012). Chez le porc, en revanche, les vocalisations constituent un indicateur pertinent pour évaluer une douleur aiguë et les émotions ressenties dans des contextes variés (Ison et al., 2016 ; Briefer et al., 2022). Par exemple, plusieurs études ont trouvé des différences dans les appels des porcelets subissant une procédure douloureuse (castration) sans anesthésie par rapport à ceux ayant été castrés mais ayant reçu un anesthésique local, notamment en termes de fréquence, de durée et de type de cris (Marx et al., 2003).
Comportements dirigés vers la zone douloureuse
Les animaux ont fréquemment tendance à se lécher ou se gratter au niveau de la zone douloureuse : la stimulation non douloureuse peut réduire la transmission d'un message douloureux (théorie du « Gate control »). Par exemple, suite à une castration, les veaux lèchent leur scrotum (Molony et al., 1995), ils bougent plus la queue (Robertson et al., 1994) et les porcelets se frottent l’arrière-train (Ison et al., 2016). Suite à un ébourgeonnage, les veaux se frottent la tête et secouent les oreilles ou la tête (Stafford & Mellor, 2005). Après une stimulation nocive autour de la bouche, la truite (Sneddon, 2003) et le poisson rouge (Newby et al., 2009) frottent cette zone contre les parois du bassin.
Expressions faciales
Les variations d’expression faciale lors d’expériences douloureuses ont été d’abord étudiées chez les rongeurs (Langford et al., 2010), puis chez le cheval (Dalla Costa et al., 2014) et le mouton (McLennan et al., 2016). Chez le bovin, deux études ont été publiées, l’une incluant des modèles de douleurs variées (Gleerup et al., 2015), l’autre portant sur des vaches souffrant de mammite modérée contrôlée (Ginger et al., 2023a). Récemment, une grille a été proposée chez le veau (Farghal et al., 2024). Dans toutes ces études, une observation fine des yeux, du mufle/museau, des joues, des lèvres et des vibrisses (le cas échéant) permettrait de caractériser le niveau de douleur ressentie. Dans la plupart des cas, les animaux ferment les yeux, plissent les lèvres, serrent les dents, retroussent ou serrent les naseaux. Cependant, le rythme biologique des animaux doit être pris en compte au moment de l’observation, pour éviter les faux positifs en cas d’endormissement par exemple (Ginger et al., 2023a). Chez le porc, les études n’ont pas permis de valider ces indicateurs (Ison et al., 2016).
Hyperalgésie, allodynie
L’hyperalgésie est une sensibilité excessive à un stimulus nocif, alors que l’allodynie caractérise une douleur déclenchée par une stimulation habituellement indolore. Des dispositifs de test ont été développés pour étudier ces deux phénomènes, en utilisant soit un stimulus mécanique, soit un stimulus thermique (chaud ou froid). La stimulation minimale induisant une réaction de la part de l’animal (mouvement de retrait ou vocalisation) définit le seuil nocif.
Chez les bovins, les filaments de Von Frey* n’ont été utilisés que dans le contexte de l’ébourgeonnage (Mintline et al., 2013). L’algomètre de pression* a été utilisé suite à l’ébourgeonnage (Heinrich et al., 2010) ou lors de mammites (Fitzpatrick et al., 2013). Dans les deux cas, le seuil de stimulation induisant une réaction diminuait, ce qui prouve une sensibilité douloureuse augmentée. En élevage, les vaches laitières réagissent plus lors de la manipulation/palpation de la mamelle à la traite et en particulier lors des tests des premiers jets quand elles souffrent de mammite modérée que lorsqu’elles sont saines (Ginger et al., 2023b).
Le test de sonde thermique a été utilisé au niveau des membres et a montré qu’une mammite (Rasmussen et al., 2011) ou une castration (Ting et al., 2010) diminuait le seuil nocif des bovins.
Enfin, à notre connaissance, aucun test de réaction à un stimulus froid n’a été utilisé. Les nocicepteurs sensibles au froid qui existent chez les vertébrés terrestres n’ont pas été découverts chez les poissons (Ashley et al., 2007).
b. Animal en interaction avec son environnement physique
L’impact de la douleur sur les interactions de l’animal envers son environnement physique est de plus en plus étudié chez les animaux de production. Les indicateurs qui ont été utilisés concernent l’activité alimentaire, l’utilisation d’un support de toilettage ou encore, chez les juvéniles, le jeu locomoteur.
Activités alimentaires
En cas de mammite (Fogsgaard et al., 2012 ; Ginger et al., 2023b) ou d’inflammation systémique provoquée par une épreuve inflammatoire (Ledoux et al., 2023), les vaches s’alimentent et ruminent moins. En revanche, aucune modification de l’activité alimentaire n’a été mise en évidence suite à un ébourgeonnage (Herskin & Nielsen, 2018). Chez les porcs, la douleur est souvent associée à une réduction de l’activité alimentaire, et ce dans différents contextes (castration, mammite, thoracotomie, chirurgie abdominale, boiterie (Ison et al., 2016)). Les poissons cessent également de s’alimenter suite à une stimulation nocive. Cette anorexie peut durer trois heures chez la truite après une injection d’acide au niveau de la bouche (Sneddon et al., 2003), et plus de deux jours chez le saumon suite à une chirurgie abdominale (Bjørge et al., 2011).
Toilettage contre un élément de l’environnement physique
La douleur est souvent associée à une réduction des activités de toilettage/confort. Des vaches atteintes de métrite (Mandel et al., 2017) ou de boiterie (Mandel et al., 2018) réduisent leur activité d’utilisation d’une brosse lorsque celle-ci est placée loin de l’aire d’alimentation, en comparaison avec des vaches saines. De même, des vaches atteintes de mammites se toilettent (grattages) moins contre des éléments de l’environnement que des vaches saines (Fogsgaard et al., 2012). À notre connaissance, ce type de comportement n’a pas été étudié chez les autres espèces.
Jeu locomoteur
Les jeunes animaux réduisent leur activité de jeu locomoteur en cas de perception douloureuse. Des veaux ébourgeonnés avec une pâte caustique jouent moins le jour suivant l’intervention que des veaux qui n’ont pas été ébourgeonnés (Rushen & de Passillé, 2012). De même, des veaux ébourgeonnés au fer sans anesthésie, ni analgésie jouent moins au cours des trois heures suivant l’intervention que des veaux qui ont été ébourgeonnés avec anesthésie et analgésie (Mintline et al., 2013). Après castration, les agneaux âgés d’une semaine réduisent leur temps passé à jouer (Thornton & Waterman-Pearson, 2002) ; cet effet n’a pas été observé chez des veaux âgés d’une semaine (Molony et al., 1995).
c. Animal dans son environnement social
L’impact de la perception douloureuse sur les interactions de l’animal envers son environnement social a été peu étudié. Les indicateurs généralement utilisés sont la distance inter-individuelle, la synchronisation des activités et les interactions sociales.
Distance inter-individuelle, isolement, synchronisation
Suite à une castration ou à une caudectomie, les porcelets s’isolent de leurs congénères et synchronisent moins leurs activités (Ison et al., 2016). Des vaches souffrant de maladies connues pour être douloureuses (mammite, métrite, pneumonie) semblent éviter le contact visuel avec leurs congénères (Proudfoot et al., 2014) et augmentent leur distance inter-individuelle (Rebout et al., en révision
Interactions sociales affiliatives et agonistiques
La douleur entraîne, chez plusieurs espèces, une modification des interactions sociales (Ison et al., 2016 ; Rebout et al., en révision). Ainsi, les vaches boiteuses réalisent moins d’interactions agonistiques mais sont plus souvent toilettées par une congénère que des vaches non boiteuses (Galindo & Broom, 2000). Des vaches présentant une mammite infectieuse (Sepúlveda-Varas et al., 2016) ou des vaches diagnostiquées la semaine suivante pour une cétose (Goldhawk et al., 2009) ou une métrite (Huzzey et al., 2007) réalisent moins d’interactions agonistiques autour du distributeur automatique de concentrés que des vaches saines. Lors de la phase aiguë de la mammite, les vaches interagissent moins (Rebout et al., en révision). Chez le porc, les procédures douloureuses semblent réduire notamment les comportements interactifs (mâcher, lécher, jouer, et agressivité) (Ison et al., 2016). Une truite identifiée comme dominante dans un groupe manifeste moins de comportements agonistiques envers ses congénères familiers après avoir été exposée à une expérience douloureuse (Ashley et al., 2009). En revanche, si la truite est mise en présence d’individus non familiers, cette diminution des comportements agressifs n’est pas observée, suggérant que le maintien de la dominance prévaut sur l’expression de signes de douleur dans un groupe où son statut doit être confirmé.
Jeu social
Suite à une castration sans analgésie, les porcelets jouent moins avec un partenaire social (Llamas Moya et al., 2008). Ces résultats ont été confirmés chez des porcelets après castration et caudectomie (Backus & McGlone, 2018). Chez les veaux, trois heures après ébourgeonnage thermique, ceux ayant reçu un anesthésique et un analgésique et ceux n’ayant pas été ébourgeonnés jouent plus avec un partenaire social que des veaux qui l’ont été sans anesthésie, ni analgésie (Mintline et al., 2013).
3.6 Indicateurs zootechniques
En cas de douleur, les altérations comportementales et physiologiques peuvent être à l’origine de baisses des performances zootechniques. Ainsi, les critères zootechniques, malgré une faible spécificité et une faible sensibilité, peuvent constituer un système d’alerte, à l’échelle individuelle et du troupeau. Les indicateurs utilisés sont ceux du suivi de performance des individus, comme la croissance, la production de lait, etc. Ces éléments ayant déjà été évoqués dans le paragraphe 2.2.c, nous ne les détaillerons pas ici.
3.7. Intérêt de l’approche multiparamétrique
Malgré l’utilisation d’une grande variété d’indicateurs (comportementaux, physiologiques, cliniques) (tableau 1), l’évaluation de la douleur reste difficile car la plupart de ceux-ci ne sont pas spécifiques de la douleur (Tomacheuski et al., 2023). Par exemple, la manipulation d’animaux entraîne une élévation du taux de cortisol plasmatique et de la fréquence cardiaque ; le sommeil induit également un relâchement du tonus musculaire. De plus, bon nombre de ces indicateurs (p. ex. cortisol) sont utilisés pour évaluer les expériences de stress ou de douleur (Prunier et al., 2013). Aussi, la plupart des études que nous avons citées précédemment s’intéressant à la manière dont les animaux de production ressentent la douleur se fondent généralement sur un ou deux types d'indicateurs. Or, la combinaison d’informations provenant de divers indicateurs permet d’augmenter les chances de détecter et d’évaluer l’intensité de la douleur ressentie par les animaux (Prunier et al., 2013). Des premiers travaux dans ce sens ont été conduits chez le mouton (Molony et al., 2002). Plus récemment, l’intérêt de combiner des indicateurs de différentes natures (p. ex. physiologiques, cliniques, comportementaux) (de Boyer des Roches et al., 2017 ; Faure et al., 2017 ; Durand et al., 2019) ou des indicateurs comportementaux mesurés par observation directe ou par des capteurs (Ledoux et al., 2023) a été mis en évidence pour caractériser le ressenti douloureux de bovins ou d’ovins dans des contextes variés. Quelques études ont proposé des scores pour quantifier le niveau de douleur (de Oliveira et al., 2014). Cependant, les choix pour attribuer à chaque indicateur un score (souvent exprimé sur une échelle discontinue (0-1-2)) et les modalités d’agrégation de l’information issue de plusieurs items restent à valider. À ce jour, les grilles sont surtout utilisées pour détecter la présence ou l’absence de douleur, mais peu pour une quantification absolue du niveau de douleur.
Conclusion et perspectives
La douleur existe en élevage et concerne toutes les espèces. Elle peut être aiguë, en lien avec les interventions et certaines maladies. La douleur chronique, en lien avec des affections persistantes, est également présente et souvent sous-estimée. Les nombreux travaux scientifiques de ces 15 dernières années ont permis de mieux caractériser et évaluer la douleur des animaux de production. L’évaluation multiparamétrique, qui combine des indicateurs de différentes natures (comportementaux, cliniques, physiologiques) et des méthodes variées (observation directe, utilisation de capteurs…), renforce la qualité de cette évaluation. Il reste cependant indispensable que tous les acteurs de l’élevage se forment pour mieux détecter les différentes formes de douleur.
Les perspectives de recherche sont nombreuses. La validation des indicateurs permettant d’évaluer la douleur doit se poursuivre, quelle que soit leur nature (physiologique, comportementale…) et les méthodes pour les mesurer. La mise au point de grilles combinant plusieurs indicateurs et validées selon l’espèce et le type de douleur doit se poursuivre. Le développement de l’intelligence artificielle pourrait être mis à contribution afin de raffiner et d’automatiser la détection de la douleur en conditions d’élevage. Ces méthodes permettront également de mieux monitorer les effets d’une prise en charge de la douleur. La création d’un réseau à l’échelle nationale pourrait être envisagée, afin de coordonner des études de référence mono- ou multicentriques pour la validation de méthodes d’évaluation de la douleur des animaux d’élevage à l’aide notamment d’échelles ou d’approches multidimensionnelles.
Glossaire
Algomètre de pression : Appareil utilisé pour mesurer le seuil de pression nécessaire pour induire une douleur ou un inconfort.
Animal de production : Les animaux de production, également appelés animaux de rente, sont les animaux dont l’élevage est effectué en vue de la production de denrées alimentaires, de laine, de peaux ou d’autres fins agricoles.
Analgésie : Nous adoptons ici le terme d’analgésie au sens anglo-saxon pour désigner toutes les méthodes permettant de réduire ou supprimer une douleur et nous considérons donc comme analgésiques tous les principes actifs capables d’agir directement pour éviter ou soulager une douleur, qu’ils agissent dans le système nerveux central (opioïdes et alpha2-agonistes) ou en périphérie (AINS et anesthésiques locaux).
Anesthésie locale : Il s’agit de la perte dans un territoire des différentes sensibilités, incluant la nociception, provoquée par l’action d’un anesthésique local.
Antalgique : En français, les anti-inflammatoires non stéroïdiens sont parfois désignés sous le terme d’antalgiques (« qui luttent contre la douleur »). Nous les regroupons ici sous le terme plus large d’analgésiques.
ASACE : Appareil soumettant l'animal à un choc électrique.
Douleur : Il s’agit d’après la dernière définition de l’International Association for the Study of Pain (2020)
Filament de von Frey : Ensemble de monofilaments calibrés, de diamètres variables, se courbant selon l’intensité de la force appliquée. Ces filaments sont utilisés pour déterminer, de manière standardisée, le seuil de force nécessaire pour produire la sensation de toucher ou de douleur.
IASP : International Association for the Study of Pain. https://www.iasp-pain.org/
Inconfort : État affectif négatif induit par des stimuli internes ou externes n’induisant pas de lésion, caractérisé par une composante physique et émotionnelle et qui peut entraîner des modifications de comportements (Herskin et al., 2018).
Nocicepteur : Neurone impliqué dans la genèse ou la transmission d’une information nociceptive. Le nocicepteur primaire est un neurone sensitif capable de détecter un stimulus nocif et de générer un message nerveux qu’il transmet à un nocicepteur de second ordre dans la moelle épinière.
Nociception : Processus neuronal d'encodage et de transmission des stimuli nocifs jusqu’au cortex cérébral.
Stimulus nocif : Un stimulus nocif (noxious stimulus en anglais, parfois traduit en stimulus nociceptif en français) est un stimulus capable de déclencher une réponse nociceptive. Il peut s’agir d’un stimulus mécanique (température trop froide ou trop chaude ou pression trop forte par exemple) ou chimique (acidité par exemple).
Stress : Ensemble des réactions physiologiques et comportementales d’origine émotionnelle d’un individu face à une situation qu’il perçoit comme potentiellement menaçante (Veissier & Boissy, 2007).
Contribution des auteurs
Les auteurs de cet article ont élaboré les messages centraux, ont coconstruit le plan, ont rédigé une/plusieurs parties du texte en lien avec leur expertise, ont relu et approuvé la version finale du manuscrit. Alice de Boyer des Roches a coordonné le projet, la rédaction et la révision de l’article. Alice de Boyer des Roches et Fanny Pilot-Storck ont harmonisé les sections et finalisé les versions soumises.
Annexes
Annexe 1
Événements après une lésion, avec les différents délais, les cellules du système immunitaire qui produisent des médiateurs, les fonctions de ces médiateurs et le site de leur effet (Ghori et al., 2009 ; Dawes et al., 2013 ; Ringkamp et al., 2013 ; Stein, 2013 ; MacLeod & Mansbridge, 2016).
Délai après la lésion | Origine des médiateurs | Site d’action des médiateurs | Effet |
Secondes à minutes | Cellules endommagées | Nocicepteurs primaires | Création du message nociceptif |
Vaisseaux endommagés | |||
Plaquettes | Site de la blessure | Hémostase, création du message nociceptif, initiation de l’inflammation | |
Minutes à heures | Mastocytes, plaquettes, cellules immunitaires et endothéliales, cellules de Schwann, kératinocytes, fibroblastes et terminaisons libres des nocicepteurs | Immunoprotection, début du processus inflammatoire, modification de la sensibilité des nocicepteurs primaires | |
2 heures à 2 jours | Cellules T | Inflammation | |
Neutrophiles, macrophages M1, kératinocytes | Hémostase, inflammation immunoprotection, cicatrisation | ||
Cellules endothéliales, fibroblastes | Cicatrisation | ||
Cellules immunitaires productrices d'opioïdes recrutées sur le site de la blessure | Nocicepteurs primaires | Réduction de la douleur liée à l’inflammation | |
Jours, semaines, mois | Macrophages M2 | Site de la blessure | Résolution de l’inflammation, prolifération de fibroblastes et de kératinocytes pour permettre la cicatrisation |
Notes
- 1. Les mots suivis d’un astérisque à leur première occurrence dans le texte sont définis dans le glossaire.
- 2. https://food.ec.europa.eu/document/download/36c133d8-f249-4f50-a94b-0735d68d4580_fr?filename=aw_awp_transport-guides_good-practices-cattle_en.pdf
- 3. https://food.ec.europa.eu/document/download/74387586-9cf4-44f2-a6bf-1d897f12a8c8_fr?filename=aw_awp_transport-guides_good-practices-pigs_en.pdf
- 4. https://food.ec.europa.eu/document/download/5b6c685e-fd01-4b08-bd74-76a9e8092c8b_fr?filename=aw_awp_transport-guides_equine_transport-good-practices_en.pdf
- 5. https://food.ec.europa.eu/document/download/1145d52d-3673-457c-821a-f2bc91869549_fr?filename=aw_awp_transport-guides_sheep_transport-good-practices_en.pdf
- 6. https://food.ec.europa.eu/document/download/7e082580-304b-4be3-8d66-07d912121771_fr?filename=aw_awp_transport-guides_poultry_transport-good-practices_en.pdf
- 7. https://www.thinkanesthesia.education/sites/default/files/202112/Veterinary%20Pain%20Assessment%20Tool%20-%20v2.1.pdf
- 8. Rebout, N., Bagnard, C., Ginger, L., Bouchon, M., Ledoux, D., Sueur, C., & de Boyer des Roches, A. Impact of pain on social behaviour and barn use in dairy cows with lipopolysaccharide-induced clinical mastitis. En révision pour la revue Animal.
- 9. https://www.iasp-pain.org/publications/iasp-news/iasp-announces-revised-definition-of-pain/
Références
- Ashley, P. J., Ringrose, S., Edwards, K. L., Wallington, E., McCrohan, C. R., & Sneddon, L. U. (2009). Effect of noxious stimulation upon antipredator responses and dominance status in rainbow trout. Animal Behaviour, 77(2), 403‑410. https://doi.org/10.1016/j.anbehav.2008.10.015
- Ashley, P. J., Sneddon, L. U., & McCrohan, C. R. (2007). Nociception in fish: Stimulus-response properties of receptors on the head of trout Oncorhynchus mykiss. Brain Research, 1166, 47‑54. https://doi.org/10.1016/j.brainres.2007.07.011
- Backus, B. L., & McGlone, J. J. (2018). Evaluating environmental enrichment as a method to alleviate pain after castration and tail docking in pigs. Applied Animal Behaviour Science, 204, 37‑42. https://doi.org/10.1016/j.applanim.2018.04.009
- Bjørge, M. H., Nordgreen, J., Janczak, A. M., Poppe, T., Ranheim, B., & Horsberg, T. E. (2011). Behavioural changes following intraperitoneal vaccination in Atlantic salmon (Salmo salar). Applied Animal Behaviour Science, 133(1-2), 127-135. https://doi.org/10.1016/j.applanim.2011.04.018
- Boissy, A., Arnould, C., Chaillou, E., Désiré, L., Duvaux-Ponter, C., Greiveldinger, L., Leterrier, C., Richard, S., Roussel, S., Saint-Dizier, H., Meunier-Salaün, M. C., Valance, D., & Veissier, I. (2007a). Emotions and cognition: A new approach to animal welfare. Animal Welfare, 16(S1), 37‑43. https://doi.org/10.1017/s0962728600031717
- Boissy, A., Manteuffel, G., Jensen, M. B., Moe, R. O., Spruijt, B., Keeling, L. J., Winckler, C., Forkman, B., Dimitrov, I., Langbein, J., Bakken, M., Veissier, I., & Aubert, A. (2007b). Assessment of positive emotions in animals to improve their welfare. Physiology & Behavior, 92(3), 375‑397. https://doi.org/10.1016/j.physbeh.2007.02.003
- Botreau, R., Veissier, I., & Perny, P. (2009). Overall assessment of animal welfare: Strategy adopted in Welfare Quality®. Animal Welfare, 18(4), 363‑370. https://doi.org/10.1017/s0962728600000762
- Briefer, E. F., Sypherd, C. C.-R., Linhart, P., Leliveld, L. M. C., Padilla de la Torre, M., Read, E. R., Guérin, C., Deiss, V., Monestier, C., Rasmussen, J. H., Špinka, M., Düpjan, S., Boissy, A., Janczak, A. M., Hillmann, E., & Tallet, C. (2022). Classification of pig calls produced from birth to slaughter according to their emotional valence and context of production. Scientific Reports, 12(1), 3409. https://doi.org/10.1038/s41598-022-07174-8
- Caray, D., de Boyer des Roches, A., Frouja, S., Andanson, S., & Veissier, I. (2015). Hot-iron disbudding: Stress responses and behavior of 1- and 4-week-old calves receiving anti-inflammatory analgesia without or with sedation using xylazine. Livestock Science, 179, 22-28. https://doi.org/10.1016/j.livsci.2015.05.013
- Cheng, H. (2006). Morphopathological changes and pain in beak trimmed laying hens. World’s Poultry Science Journal, 62(1), 41‑52. https://doi.org/10.1079/WPS200583
- Coetzee, J. F. (2011). A review of pain assessment techniques and pharmacological approaches to pain relief after bovine castration: Practical implications for cattle production within the United States. Applied Animal Behaviour Science, 135(3), 192‑213. https://doi.org/10.1016/j.applanim.2011.10.016
- Coetzee, J. F. (2013). Assessment and Management of Pain Associated with Castration in Cattle. Veterinary Clinics of North America: Food Animal Practice, 29(1), 75‑101. https://doi.org/10.1016/j.cvfa.2012.11.002
- Coetzee, J. F., Edwards, L. N., Mosher, R. A., Bello, N. M., O’Connor, A. M., Wang, B., Kukanich, B., & Blasi, D. A. (2012). Effect of oral meloxicam on health and performance of beef steers relative to bulls castrated on arrival at the feedlot. Journal of Animal Science, 90(3), 1026‑1039. https://doi.org/10.2527/jas.2011-4068
- Crump, A., Arnott, G., & Bethell, E. J. (2018). Affect-Driven Attention Biases as Animal Welfare Indicators: Review and Methods. Animals, 8(8), 136. https://doi.org/10.3390/ani8080136
- Cyples, J. A., Fitzpatrick, C. E., Leslie, K. E., DeVries, T. J., Haley, D. B., & Chapinal, N. (2012). Short communication: The effects of experimentally induced Escherichia coli clinical mastitis on lying behavior of dairy cows. Journal of Dairy Science, 95(5), 2571‑2575. https://doi.org/10.3168/jds.2011-5135
- Dalla Costa, E., Minero, M., Lebelt, D., Stucke, D., Canali, E., & Leach, M. C. (2014). Development of the Horse Grimace Scale (HGS) as a pain assessment tool in horses undergoing routine castration. PloS One, 9(3), e92281. https://doi.org/10.1371/journal.pone.0092281
- DaSilva, A. F., & DosSantos, M. F. (2012). The role of sensory fiber demography in trigeminal and postherpetic neuralgias. Journal of dental research, 91(1), 17-24. https://doi.org/10.1177/0022034511411300
- Dawes, J. M., Andersson, D. A., Bennett, D. L. H., Bevan, S., & McMahon, S. B. (2013). Inflammatory Mediators and Modulators of Pain. In S. B. McMahon, M. Koltzenburg, I.Tracey, & D. C. Turk (Eds.), Wall & Melzack’s Textbook of Pain(Chap. 3, pp. 48‑67). https://www.clinicalkey.com/#!/content/book/3-s2.0-B9780702040597000036
- de Boyer des Roches, A. (2021). Douleur et bien-être des animaux d’élevage : De la compréhension des troubles à leur amélioration. [Habilitation à diriger les recherches]. Université Clermont Auvergne.
- de Boyer des Roches, A., Faure, M., Lussert, A., Herry, V., Rainard, P., Durand, D., & Foucras, G. (2017). Behavioral and patho-physiological response as possible signs of pain in dairy cows during Escherichia coli mastitis: A pilot study. Journal of Dairy Science, 100(10), 8385‑8397. https://doi.org/10.3168/jds.2017-12796
- de Boyer des Roches, A., Lussert, A., Faure, M., Herry, V., Rainard, P., Durand, D., Wemelsfelder, F., & Foucras, G. (2018). Dairy cows under experimentally-induced Escherichia coli mastitis show negative emotional states assessed through Qualitative Behaviour Assessment. Applied Animal Behaviour Science, 206, 1‑11. https://doi.org/10.1016/j.applanim.2018.06.004
- de Oliveira, F. A., Luna, S. P. L., do Amaral, J. B., Rodrigues, K. A., Sant’Anna, A. C., Daolio, M., & Brondani, J. T. (2014). Validation of the UNESP-Botucatu unidimensional composite pain scale for assessing postoperative pain in cattle. BMC Veterinary Research, 10(1), 200. https://doi.org/10.1186/s12917-014-0200-0
- Durand, D., Faure, M., de la Foye, A., & de Boyer des Roches, A. (2019). Benefits of a multimodal analgesia compared to local anesthesia alone to alleviate pain following castration in sheep: A multiparametric approach. Animal, 13(9), 2034-2043. https://doi.org/10.1017/S1751731119000314
- Earley, B., & Crowe, M. A. (2002). Effects of ketoprofen alone or in combination with local anesthesia during the castration of bull calves on plasma cortisol, immunological, and inflammatory responses. Journal of Animal Science, 80(4), 1044‑1052. https://doi.org/10.2527/2002.8041044x
- Eccleston, C., & Crombez, G. (1999). Pain demands attention: A cognitive-affective model of the interruptive function of pain. Psychological Bulletin, 125(3), 356‑366. https://doi.org/10.1037/0033-2909.125.3.356
- Ede, T., Lecorps, B., von Keyserlingk, M. A. G., & Weary, D. M. (2019a). Calf aversion to hot-iron disbudding. Scientific Reports, 9(1), 5344. https://doi.org/10.1038/s41598-019-41798-7
- Ede, T., Lecorps, B., von Keyserlingk, M. A. G., & Weary, D. M. (2019b). Symposium review: Scientific assessment of affective states in dairy cattle. Journal of Dairy Science, 102(11), 10677‑10694. https://doi.org/10.3168/jds.2019-16325
- Farghal, M., Pajor, E., Luna, S. P. L., Pang, D., Windeyer, M. C., & Ceballos, M. C. (2024). Development of the calf grimace scale for pain and stress assessment in castrated Angus beef calves. Scientific Reports, 14(1), 25620. https://doi.org/10.1038/s41598-024-77147-6
- Farm Animal Welfare Council. (1992). FAWC updates the five freedoms. Veterinary Record, 131, 357.
- Faure, M., Paulmier, V., Boissy, A., Bage, A.-S., Ravel, C., Guittard, A., De Boyer Des Roches, A., & Durand, D. (2014). Multiparametric approach to assess pain in sheep following an experimental surgery. In L. Mounier & I. Veissier, Proceedings of the 6th International Conference on the Assessment of Animal Welfare at the Farm and Group Level (pp. 117). https://doi.org/10.3920/9789086867981_085
- Faure, M., Paulmier, V., Boissy, A., de la Foye, A., de Boyer des Roches, A., & Durand, D. (2017). A multiparametric approach to discriminate the impacts of different levels of invasiveness of surgical procedures in sheep. Animal, 11(12), 2275-2284. https://doi.org/10.1017/s1751731117000805
- Faure, M., Paulmier, V., De Boyer Des Roches, A., Boissy, A., Terlouw, E. M. C., Guatteo, R., Cognié, J., Courteix, C., & Durand, D. (2015). Douleurs animales. 2. Évaluation et traitement de la douleur chez les ruminants. INRA Productions Animales, 28(3), 231-242. https://doi.org/10.20870/productions-animales.2015.28.3.3028
- Finnerup, N. B., Kuner, R., & Jensen, T. S. (2021). Neuropathic Pain: From Mechanisms to Treatment. Physiological Reviews, 101(1), 259‑301. https://doi.org/10.1152/physrev.00045.2019
- Fitzpatrick, C. E., Chapinal, N., Petersson-Wolfe, C. S., DeVries, T. J., Kelton, D. F., Duffield, T. F., & Leslie, K. E. (2013). The effect of meloxicam on pain sensitivity, rumination time, and clinical signs in dairy cows with endotoxin-induced clinical mastitis. Journal of Dairy Science, 96(5), 2847‑2856. https://doi.org/10.3168/jds.2012-5855
- Flecknell, P., Gledhill, J., & Richardson, C. (2007). Assessing animal health and welfare and recognising pain and distress. ALTEX, 24(Spec No), 82‑83.
- Fogsgaard, K. K., Røntved, C. M., Sørensen, P., & Herskin, M. S. (2012). Sickness behavior in dairy cows during Escherichia coli mastitis. Journal of Dairy Science, 95(2), 630‑638. https://doi.org/10.3168/jds.2011-4350
- Forkman, B., Boissy, A., Meunier-Salaün, M.-C., Canali, E., & Jones, R. B. (2007). A critical review of fear tests used on cattle, pigs, sheep, poultry and horses. Physiology & Behavior, 92(3), 340‑374. https://doi.org/10.1016/j.physbeh.2007.03.016
- Galindo, F., & Broom, D. M. (2000). The relationships between social behaviour of dairy cows and the occurrence of lameness in three herds. Research in Veterinary Science, 69(1), 75‑79. https://doi.org/10.1053/rvsc.2000.0391
- Gaynor, J. S., & Muir, W. W. (2015). Handbook of Veterinary Pain Management. Elsevier. https://doi.org/10.1016/C2010-0-67083-0
- Ghori, M. K., Zhang, Y.-F. R., & Sinatra, R. S. (2009). Pathophysiology of Acute Pain. In B. Ginsberg, E. R. Viscusi, O. A. de Leon-Cassasola, & R. S. Sinatra (Eds.), Acute Pain Management (pp. 21‑32). Cambridge University Press. https://doi.org/10.1017/CBO9780511576706.004
- Ginger, L., Aubé, L., Ledoux, D., Borot, M., David, C., Bouchon, M., Leach, M., Durand, D., & de Boyer des Roches, A. (2023a). A six-step process to explore facial expressions performances to detect pain in dairy cows with lipopolysaccharide-induced clinical mastitis. Applied Animal Behaviour Science, 264, 105951. https://doi.org/10.1016/j.applanim.2023.105951
- Ginger, L., Ledoux, D., Bouchon, M., Rautenbach, I., Bagnard, C., Lurier, T., Foucras, G., Germon, P., Durand, D., & de Boyer des Roches, A. (2023b). Using behavioral observations in freestalls and at milking to improve pain detection in dairy cows after lipopolysaccharide-induced clinical mastitis. Journal of Dairy Science, 106(8), 5606‑5625. https://doi.org/10.3168/jds.2022-22533
- Gleerup, K. B., Andersen, P. H., Munksgaard, L., & Forkman, B. (2015). Pain evaluation in dairy cattle. Applied Animal Behaviour Science, 171, 25‑32. https://doi.org/10.1016/j.applanim.2015.08.023
- Goldhawk, C., Chapinal, N., Veira, D. M., Weary, D. M., & von Keyserlingk, M. A. G. (2009). Prepartum feeding behavior is an early indicator of subclinical ketosis. Journal of Dairy Science, 92(10), 4971‑4977. https://doi.org/10.3168/jds.2009-2242
- Grace, P. M., Tawfik, V. L., Svensson, C. I., Burton, M. D., Loggia, M. L., & Hutchinson, M. R. (2021). The Neuroimmunology of Chronic Pain: From Rodents to Humans. The Journal of Neuroscience, 41(5), 855‑865. https://doi.org/10.1523/JNEUROSCI.1650-20.2020
- Grégoire, S., Muller, É., & Marchand, F. (2010). Structures et mécanismes cérébraux impliqués dans les aspects émotionnels et cognitifs de la douleur. Douleurs : Evaluation - Diagnostic - Traitement, 11(4), 182‑193. https://doi.org/10.1016/j.douler.2010.07.001
- Guatteo, R., Lesort, C., & Touzot-Jourde, G. (2022). Impact of Meloxicam Administration in Cows Prior to Caesarean Section on the Efficacy of Passive Immunity Transfer in Calves. Animals, 13(1), 37. https://doi.org/10.3390/ani13010037
- Harms, C. A., Lewbart, G. A., Swanson, C. R., Kishimori, J. M., & Boylan, S. M. (2005). Behavioral and clinical pathology changes in koi carp (Cyprinus carpio) subjected to anesthesia and surgery with and without intra-operative analgesics. Comparative Medicine, 55(3), 221‑226.
- Hart, R. P., Martelli, M. F., & Zasler, N. D. (2000). Chronic pain and neuropsychological functioning. Neuropsychology Review, 10(3), 131‑149. https://doi.org/10.1023/A:1009020914358
- Hay, M., Vulin, A., Génin, S., Sales, P., & Prunier, A. (2003). Assessment of pain induced by castration in piglets: Behavioral and physiological responses over the subsequent 5 days. Applied Animal Behaviour Science, 82(3), 201‑218. https://doi.org/10.1016/S0168-1591(03)00059-5
- Heinrich, A., Duffield, T. F., Lissemore, K. D., & Millman, S. T. (2010). The effect of meloxicam on behavior and pain sensitivity of dairy calves following cautery dehorning with a local anesthetic. Journal of Dairy Science, 93(6), 2450‑2457. https://doi.org/10.3168/jds.2009-2813
- Hernandez-Avalos, I., Mota-Rojas, D., Mora-Medina, P., Martínez-Burnes, J., Casas Alvarado, A., Verduzco-Mendoza, A., Lezama-García, K., & Olmos-Hernandez, A. (2019). Review of different methods used for clinical recognition and assessment of pain in dogs and cats. International Journal of Veterinary Science and Medicine, 7(1), 43‑54. https://doi.org/10.1080/23144599.2019.1680044
- Herry, V., Gitton, C., Tabouret, G., Répérant, M., Forge, L., Tasca, C., Gilbert, F. B., Guitton, E., Barc, C., Staub, C., Smith, D. G. E., Germon, P., Foucras, G., & Rainard, P. (2017). Local immunization impacts the response of dairy cows to Escherichia coli mastitis. Scientific Reports, 7(1), 3441. https://doi.org/10.1038/s41598-017-03724-7
- Herskin, M. S., & Nielsen, B. H. (2018). Welfare Effects of the Use of a Combination of Local Anesthesia and NSAID for Disbudding Analgesia in Dairy Calves—Reviewed Across Different Welfare Concerns. Frontiers in Veterinary Science, 5, 117. https://doi.org/10.3389/fvets.2018.00117
- Hirvonen, J., Eklund, K., Teppo, A. M., Huszenicza, G., Kulcsar, M., Saloniemi, H., & Pyörälä, S. (1999). Acute phase response in dairy cows with experimentally induced Escherichia coli mastitis. Acta Veterinaria Scandinavica, 40(1), 35‑46. https://doi.org/10.1186/bf03547039
- Huber, K. (2024). Review: Welfare in farm animals from an animal-centred point of view. Animal, 18(10), 101311. https://doi.org/10.1016/j.animal.2024.101311
- Huzzey, J. M., Veira, D. M., Weary, D. M., & von Keyserlingk, M. A. G. (2007). Prepartum Behavior and Dry Matter Intake Identify Dairy Cows at Risk for Metritis. Journal of Dairy Science, 90(7), 3220‑3233. https://doi.org/10.3168/jds.2006-807
- Ison, S. H., Clutton, R. E., Di Giminiani, P., & Rutherford, K. M. D. (2016). A Review of Pain Assessment in Pigs. Frontiers in Veterinary Science, 3, 108. https://doi.org/10.3389/fvets.2016.00108
- Jirkof, P., Rudeck, J., & Lewejohann, L. (2019). Assessing Affective State in Laboratory Rodents to Promote Animal Welfare—What Is the Progress in Applied Refinement Research? Animals, 9(12), 1026. https://doi.org/10.3390/ani9121026
- Langford, D. J., Bailey, A. L., Chanda, M. L., Clarke, S. E., Drummond, T. E., Echols, S., Glick, S., Ingrao, J., Klassen-Ross, T., LaCroix-Fralish, M. L., Matsumiya, L., Sorge, R. E., Sotocinal, S. G., Tabaka, J. M., Wong, D., van den Maagdenberg, A. M. J. M., Ferrari, M. D., Craig, K. D., & Mogil, J. S. (2010). Coding of facial expressions of pain in the laboratory mouse. Nature Methods, 7(6), 447-449. https://doi.org/10.1038/nmeth.1455
- Lardy, R., de Boyer des Roches, A., Capdeville, J., Bastien, R., Mounier, L., & Veissier, I. (2020). New recommendations for self-locking barriers to reduce skin injuries in dairy cows. Animal, 14(8), 1745-1756. https://doi.org/10.1017/S175173112000052X
- Lecorps, B., Nogues, E., von Keyserlingk, M. A. G., & Weary, D. M. (2020). Pessimistic dairy calves are more vulnerable to pain-induced anhedonia. PLoS ONE, 15(11), e0242100. https://doi.org/10.1371/journal.pone.0242100
- Ledoux, D., Veissier, I., Meunier, B., Gelin, V., Richard, C., Kiefer, H., Jammes, H., Foucras, G., & de Boyer des Roches, A. (2023). Combining accelerometers and direct visual observations to detect sickness and pain in cows of different ages submitted to systemic inflammation. Scientific Reports, 13(1), 1977. https://doi.org/10.1038/s41598-023-27884-x
- Le Roy, P., Ducos, A., & Phocas, F. (2019). Quelles performances pour les animaux de demain ? Objectifs et méthodes de sélection. In R. Baumont (Coord.), INRA Productions Animales : Vol.32(2) Numéro spécial : De grands défis et des solutions pour l’élevage (pp. 233-246). https://doi.org/10.20870/productions-animales.2019.32.2.2466
- Llamas Moya, S., Boyle, L. A., Lynch, P. B., & Arkins, S. (2008). Effect of surgical castration on the behavioural and acute phase responses of 5-day-old piglets. Applied Animal Behaviour Science, 111(1-2), 133‑145. https://doi.org/10.1016/j.applanim.2007.05.019
- Low, L. A. (2013). The impact of pain upon cognition: What have rodent studies told us? Pain, 154(12), 2603-2605. https://doi.org/10.1016/j.pain.2013.06.012
- MacLeod, A. S., & Mansbridge, J. N. (2016). The Innate Immune System in Acute and Chronic Wounds. Advances in Wound Care, 5(2), 65‑78. https://doi.org/10.1089/wound.2014.0608
- Mandel, R., Harazy, H., Gygax, L., Nicol, C. J., Ben-David, A., Whay, H. R., & Klement, E. (2018). Short communication: Detection of lameness in dairy cows using a grooming device. Journal of Dairy Science, 101(2), 1511‑1517. https://doi.org/10.3168/jds.2017-13207
- Mandel, R., Nicol, C. J., Whay, H. R., & Klement, E. (2017). Short communication: Detection and monitoring of metritis in dairy cows using an automated grooming device. Journal of Dairy Science, 100(7), 5724‑5728. https://doi.org/10.3168/jds.2016-12201
- Marx, G., Horn, T., Thielebein, J., Knubel, B., & von Borell, E. (2003). Analysis of pain-related vocalization in young pigs. Journal of Sound and Vibration, 266(3), 687‑698. https://doi.org/10.1016/S0022-460X(03)00594-7
- Mascaró Triedo, C. E., Karar, S., Abunemeh, M., & Portier, K. (2024). Effect of nose twitching on the pupillary dilation in awake and anesthetized horses. Frontiers in Veterinary Science, 11. https://doi.org/10.3389/fvets.2024.1412755
- Masłowska, K., Mizzoni, F., Dwyer, C. M., & Wemelsfelder, F. (2020). Qualitative behavioural assessment of pain in castrated lambs. Applied Animal Behaviour Science, 233, 105143. https://doi.org/10.1016/j.applanim.2020.105143
- Maulave, J., Mascaró Triedo, C., & Portier, K. (2022). Evaluation of the practical clinical use of the Horse Grimace Scale translated into French. Veterinary Anaesthesia and Analgesia, 49(6), 615‑623. https://doi.org/10.1016/j.vaa.2022.07.003
- McDougall, S., Abbeloos, E., Piepers, S., Rao, A. S., Astiz, S., van Werven, T., Statham, J., & Pérez-Villalobos, N. (2016). Addition of meloxicam to the treatment of clinical mastitis improves subsequent reproductive performance. Journal of Dairy Science, 99(3), 2026‑2042. https://doi.org/10.3168/jds.2015-9615
- McDougall, S., Bryan, M. A., & Tiddy, R. M. (2009). Effect of treatment with the nonsteroidal antiinflammatory meloxicam on milk production, somatic cell count, probability of re-treatment, and culling of dairy cows with mild clinical mastitis. Journal of Dairy Science, 92(9), 4421‑4431. https://doi.org/10.3168/jds.2009-2284
- McLennan, K. M., Rebelo, C. J. B., Corke, M. J., Holmes, M. A., Leach, M. C., & Constantino-Casas, F. (2016). Development of a facial expression scale using footrot and mastitis as models of pain in sheep. Applied Animal Behaviour Science, 176, 19‑26. https://doi.org/10.1016/j.applanim.2016.01.007
- Mellor, D. J. (2016). Updating Animal Welfare Thinking: Moving beyond the “Five Freedoms” towards “A Life Worth Living”. Animals, 6(3), 21. https://doi.org/10.3390/ani6030021
- Mettam, J. J., Oulton, L. J., McCrohan, C. R., & Sneddon, L. U. (2011). The efficacy of three types of analgesic drugs in reducing pain in the rainbow trout, Oncorhynchus mykiss. Applied Animal Behaviour Science, 133(3-4), 265‑274. https://doi.org/10.1016/j.applanim.2011.06.009
- Mintline, E. M., Stewart, M., Rogers, A. R., Cox, N. R., Verkerk, G. A., Stookey, J. M., Webster, J. R., & Tucker, C. B. (2013). Play behavior as an indicator of animal welfare: Disbudding in dairy calves. Applied Animal Behaviour Science, 144(1-2), 22‑30. https://doi.org/10.1016/j.applanim.2012.12.008
- Mogil, J. S. (2009). Animal models of pain: Progress and challenges. Nature Reviews Neuroscience, 10(4), 283‑294. https://doi.org/10.1038/nrn2606
- Mogil, J. S. (2020). The Measurement of Pain in the Laboratory Rodent.In J. N. Wood (Ed.), The Oxford Handbook of the Neurobiology of Pain (pp. 28-60). Oxford University Press. https://doi.org/10.1093/oxfordhb/9780190860509.013.21
- Mølgaard, L., Damgaard, B. M., Bjerre-Harpøth, V., & Herskin, M. S. (2012). Effects of percutaneous needle liver biopsy on dairy cow behaviour. Research in Veterinary Science, 93(3), 1248‑1254. https://doi.org/10.1016/j.rvsc.2012.04.001
- Molony, V., & Kent, J. E. (1997). Assessment of acute pain in farm animals using behavioral and physiological measurements. Journal of Animal Science, 75(1), 266‑272. https://doi.org/10.2527/1997.751266x
- Molony, V., Kent, J. E., Hosie, B. D., & Graham, M. J. (1997). Reduction in pain suffered by lambs at castration. The Veterinary Journal, 153(2), 205‑213. https://doi.org/10.1016/S1090-0233(97)80041-X
- Molony, V., Kent, J. E., & McKendrick, I. J. (2002). Validation of a method for assessment of an acute pain in lambs. Applied Animal Behaviour Science, 76(3), 215‑238. https://doi.org/10.1016/S0168-1591(02)00014-X
- Molony, V., Kent, J. E., & Robertson, I. S. (1995). Assessment of acute and chronic pain after different methods of castration of calves. Applied Animal Behaviour Science, 46(1-2), 33‑48. https://doi.org/10.1016/0168-1591(95)00635-4
- Moriarty, O., McGuire, B. E., & Finn, D. P. (2011). The effect of pain on cognitive function: A review of clinical and preclinical research. Progress in Neurobiology, 93(3), 385‑404. https://doi.org/10.1016/j.pneurobio.2011.01.002
- Neave, H. W., Daros, R. R., Costa, J. H. C., von Keyserlingk, M. A. G., & Weary, D. M. (2013). Pain and Pessimism: Dairy Calves Exhibit Negative Judgement Bias following Hot-Iron Disbudding. PLoS ONE, 8(12), e80556. https://doi.org/10.1371/journal.pone.0080556
- Newby, N. C., Wilkie, M. P., & Stevens, E. D. (2009). Morphine uptake, disposition, and analgesic efficacy in the common goldfish (Carassius auratus). Canadian Journal of Zoology, 87(5), 388-399. https://doi.org/10.1139/Z09-023
- Nielsen, B. L. (2020). Asking animals: An introduction to animal behaviour testing. CABI International. https://doi.org/10.1079/9781789240603.0000
- Nordgreen, J., Kolsrud, H. H., Ranheim, B., & Horsberg, T. E. (2009). Pharmacokinetics of morphine after intramuscular injection in common goldfish Carassius auratus and Atlantic salmon Salmo salar. Diseases of Aquatic Organisms, 88, 55‑63. https://doi.org/10.3354/dao02147
- Paul, E. S., Harding, E. J., & Mendl, M. (2005). Measuring emotional processes in animals: The utility of a cognitive approach. Neuroscience & Biobehavioral Reviews, 29(3), 469‑491. https://doi.org/10.1016/j.neubiorev.2005.01.002
- Paulmier, V., Faure, M., Durand, D., Boissy, A., Cognie, J., Eschalier, A., & Terlouw, C. (2015). Douleurs animales.1. Les mécanismes. INRA Productions Animales, 28(3), 217‑229. https://doi.org/10.20870/productions-animales.2015.28.3.3027
- Phythian, C. J., Michalopoulou, E., Cripps, P. J., Duncan, J. S., & Wemelsfelder, F. (2016). On-farm qualitative behaviour assessment in sheep: Repeated measurements across time, and association with physical indicators of flock health and welfare. Applied Animal Behaviour Science, 175, 23‑31. https://doi.org/10.1016/j.applanim.2015.11.013
- Pilot-Storck, F., Kohlhauer, M., Colson, V., Guatteo, R., Terlouw, C., Barrière, D. A., Boitard, P.-M., Ledoux, D., Belloc, C., Mormède, P., Portier, K., & De Boyer des Roches, A. (2025). Vers une meilleure gestion de la douleur des mammifères et poissons destinés à la consommation humaine Partie 2 : Prise en charge. In C. Ginane, E. Chaillou, & R. Baumont (Coord.), INRAE Productions Animales : Vol. 38(4) Numéro spécial : Bien-être animal : avancées scientifiques et innovations pour des systèmes d’élevage durables (9399). https://doi.org/10.20870/productions-animales.2025.38.4.9399
- Planchez, B., Surget, A., & Belzung, C. (2019). Animal models of major depression: Drawbacks and challenges. Journal of Neural Transmission, 126(11), 1383‑1408. https://doi.org/10.1007/s00702-019-02084-y
- Ploner, M., Gross, J., Timmermann, L., & Schnitzler, A. (2002). Cortical representation of first and second pain sensation in humans. Proceedings of the National Academy of Sciences, 99(19), 12444‑12448. https://doi.org/10.1073/pnas.182272899
- Proudfoot, K. L., Jensen, M. B., Weary, D. M., & von Keyserlingk, M. A. G. (2014). Dairy cows seek isolation at calving and when ill. Journal of Dairy Science, 97(5), 2731‑2739. https://doi.org/10.3168/jds.2013-7274
- Prunier, A., Mounier, L., Le Neindre, P., Leterrier, C., Mormède, P., Paulmier, V., Prunet, P., Terlouw, C., & Guatteo, R. (2013). Identifying and monitoring pain in farm animals: A review. Animal, 7(6), 998‑1010. https://doi.org/10.1017/s1751731112002406
- Raja, S. N., Carr, D. B., Cohen, M., Finnerup, N. B., Flor, H., Gibson, S., Keefe, F. J., Mogil, J. S., Ringkamp, M., Sluka, K. A., Song, X.-J., Stevens, B., Sullivan, M. D., Tutelman, P. R., Ushida, T., & Vader, K. (2020). The revised International Association for the Study of Pain definition of pain: Concepts, challenges, and compromises. PAIN, 161(9), 1976‑1982. https://doi.org/10.1097/j.pain.0000000000001939
- Rasmussen, D. B., Fogsgaard, K., Røntved, C. M., Klaas, I. C., & Herskin, M. S. (2011). Changes in thermal nociceptive responses in dairy cows following experimentally induced Escherichia coli mastitis. Acta Veterinaria Scandinavica, 53(1), 32. https://doi.org/10.1186/1751-0147-53-32
- Reid, J., Nolan, A. M., & Scott, E. M. (2018). Measuring pain in dogs and cats using structured behavioural observation. The Veterinary Journal, 236, 72‑79. https://doi.org/10.1016/j.tvjl.2018.04.013
- Reilly, S. C., Quinn, J. P., Cossins, A. R., & Sneddon, L. U. (2008). Behavioural analysis of a nociceptive event in fish: Comparisons between three species demonstrate specific responses. Applied Animal Behaviour Science, 114(1‑2), 248‑259. https://doi.org/10.1016/j.applanim.2008.01.016
- Remnant, J. G., Tremlett, A., Huxley, J. N., & Hudson, C. D. (2017). Clinician attitudes to pain and use of analgesia in cattle: Where are we 10 years on? Veterinary Record, 181(15), 400. https://doi.org/10.1136/vr.104428
- Ringkamp, M., Raja, S. N., Campbell, J. N., & Meyer, R. A. (2013). Peripheral Mechanisms of Cutaneous Nociception. In S. B. McMahon, M. Koltzenburg, I.Tracey, & D. C. Turk (Eds.), Wall & Melzack’s Textbook of Pain(Chap. 1, pp. 1‑30). https://www.clinicalkey.com/#!/content/book/3-s2.0-B9780702040597000012
- Robertson, I. S., Kent, J. E., & Molony, V. (1994). Effect of different methods of castration on behaviour and plasma cortisol in calves of three ages. Research in Veterinary Science, 56(1), 8‑17. https://doi.org/10.1016/0034-5288(94)90189-9
- Robinson, P. H. (2011). Locomotion Scoring Your Cows. Cooperative Extension, University of California, Davis. https://animalscience.ucdavis.edu/sites/g/files/dgvnsk446/files/inline-files/web201312_locomotion_scoring_your_cows.pdf
- Rochais, C., Fureix, C., Lesimple, C., & Hausberger, M. (2016). Lower attention to daily environment: A novel cue for detecting chronic horses’ back pain? Scientific Reports, 6(1), 20117. https://doi.org/10.1038/srep20117
- Roques, J. A. C., Abbink, W., Geurds, F., van de Vis, H., & Flik, G. (2010). Tailfin clipping, a painful procedure: Studies on Nile tilapia and common carp. Physiology & Behavior, 101(4), 533‑540. https://doi.org/10.1016/j.physbeh.2010.08.001
- Rose, J. D. (2002). The Neurobehavioral Nature of Fishes and the Question of Awareness and Pain. Reviews in Fisheries Science, 10(1), 1-38. https://doi.org/10.1080/20026491051668
- Rousing, T., & Wemelsfelder, F. (2006). Qualitative assessment of social behaviour of dairy cows housed in loose housing systems. Applied Animal Behaviour Science, 101(1-2), 40‑53. https://doi.org/10.1016/j.applanim.2005.12.009
- Ruíz-López, P., Domínguez, J. M., Morgaz, J., Quirós-Carmona, S., Navarrete-Calvo, R., Gómez-Villamandos, R. J., Fernández-Sarmiento, J. A., & Granados, M. M. (2023). Evaluation of the averaged parasympathetic tone activity and its dynamic variation to assess intraoperative nociception in relation to hemodynamic changes in dogs. Veterinary Quarterly, 43(1), 1‑9. https://doi.org/10.1080/01652176.2023.2239311
- Rushen, J., & de Passillé, A. M. (2012). Automated measurement of acceleration can detect effects of age, dehorning and weaning on locomotor play of calves. Applied Animal Behaviour Science, 139(3-4), 169‑174. https://doi.org/10.1016/j.applanim.2012.04.011
- Schaible, H.-G., Ebersberger, A., & Natura, G. (2011). Update on peripheral mechanisms of pain: Beyond prostaglandins and cytokines. Arthritis Research & Therapy, 13(2), 210. https://doi.org/10.1186/ar3305
- Schroeder, P. G., & Sneddon, L. U. (2017). Exploring the efficacy of immersion analgesics in zebrafish using an integrative approach. Applied Animal Behaviour Science, 187, 93‑102. https://doi.org/10.1016/j.applanim.2016.12.003
- Sepúlveda-Varas, P., Proudfoot, K. L., Weary, D. M., & von Keyserlingk, M. A. G. (2016). Changes in behaviour of dairy cows with clinical mastitis. Applied Animal Behaviour Science, 175, 8‑13. https://doi.org/10.1016/j.applanim.2014.09.022
- Siivonen, J., Taponen, S., Hovinen, M., Pastell, M., Lensink, B. J., Pyörälä, S., & Hänninen, L. (2011). Impact of acute clinical mastitis on cow behaviour. Applied Animal Behaviour Science, 132(3-4), 101‑106. https://doi.org/10.1016/j.applanim.2011.04.005
- Sneddon, L. U. (2003). The evidence for pain in fish: The use of morphine as an analgesic. Applied Animal Behaviour Science, 83(2), 153‑162. https://doi.org/10.1016/S0168-1591(03)00113-8
- Sneddon, L. U. (2004). Evolution of nociception in vertebrates: Comparative analysis of lower vertebrates. Brain Research Reviews, 46(2), 123‑130. https://doi.org/10.1016/j.brainresrev.2004.07.007
- Sneddon, L. U. (2020). Can Fish Experience Pain? In T. S. Kristiansen, A. Fernö, M. A. Pavlidis, & H. van de Vis (Eds.), The welfare of fish (Animal Welfare Vol. 10, pp. 229‑249). Springer. https://doi.org/10.1007/978-3-030-41675-1_10
- Sneddon, L. U., Braithwaite, V. A., & Gentle, M. J. (2003). Do fishes have nociceptors? Evidence for the evolution of a vertebrate sensory system. Proceedings of the Royal Society of London. Series B: Biological Sciences, 270(1520), 1115‑1121. https://doi.org/10.1098/rspb.2003.2349
- Sneddon, L. U., Elwood, R. W., Adamo, S. A., & Leach, M. C. (2014). Defining and assessing animal pain. Animal Behaviour, 97, 201‑212. https://doi.org/10.1016/j.anbehav.2014.09.007
- Snow, P. J., Renshaw, G. M. C., & Hamlin, K. E. (1996). Localization of enkephalin immunoreactivity in the spinal cord of the long-tailed ray Himantura fai. The Journal of Comparative Neurology, 367(2), 264‑273. https://doi.org/10.1002/(SICI)1096-9861(19960401)367:2<264::AID-CNE8>3.0.CO;2-3
- Sprecher, D. J., Hostetler, D. E., & Kaneene, J. B. (1997). A lameness scoring system that uses posture and gait to predict dairy cattle reproductive performance. Theriogenology, 47(6), 1179‑1187. https://doi.org/10.1016/s0093-691x(97)00098-8
- Stafford, K. J., & Mellor, D. J. (2005). Dehorning and disbudding distress and its alleviation in calves. The Veterinary Journal, 169(3), 337‑349. https://doi.org/10.1016/j.tvjl.2004.02.005
- Stein, C. (2013). Targeting pain and inflammation by peripherally acting opioids. Frontiers in Pharmacology, 4. https://doi.org/10.3389/fphar.2013.00123
- Stygar, A. H., Gómez, Y., Berteselli, G. V., Dalla Costa, E., Canali, E., Niemi, J. K., Llonch, P., & Pastell, M. (2021). A Systematic Review on Commercially Available and Validated Sensor Technologies for Welfare Assessment of Dairy Cattle. Frontiers in Veterinary Science, 8. https://doi.org/10.3389/fvets.2021.634338
- Terlouw, E. M. C. (2018). Période de pré-abattage et d’abattage : Procédures, stress, bien-être animal et qualités des viandes. In M.-N. Bellon-Fontaine, J.-F. Hocquette & M.-P. Ellies-Oury (Coord.), La chaîne de la viande bovine (pp. 35-50). Lavoisier Tec & Doc. https://hal.science/hal-02264358
- Terlouw, E. M. C., Deiss, V., & Astruc, T. (2021). Stunning of pigs with different gas mixtures: Behavioural and physiological reactions. Meat Science, 175, 108452. https://doi.org/10.1016/j.meatsci.2021.108452
- Theurer, M. E., White, B. J., Coetzee, J. F., Edwards, L. N., Mosher, R. A., & Cull, C. A. (2012). Assessment of behavioral changes associated with oral meloxicam administration at time of dehorning in calves using a remote triangulation device and accelerometers. BMC Veterinary Research, 8(1), 48. https://doi.org/10.1186/1746-6148-8-48
- Thornton, P. D., & Waterman-Pearson, A. E. (2002). Behavioural Responses to Castration in Lambs. Animal Welfare, 11(2), 203‑212. https://doi.org/10.1017/s0962728600028153
- Ting, S. T. L., Earley, B., Veissier, I., Gupta, S., & Crowe, M. A. (2010). Effects of Burdizzo castration on CO2 laser induced thermal nociception of Holstein–Friesian calves of different ages. Applied Animal Behaviour Science, 126(1-2), 12‑18. https://doi.org/10.1016/j.applanim.2010.05.005
- Tomacheuski, R. M., Monteiro, B. P., Evangelista, M. C., Luna, S. P. L., & Steagall, P. V. (2023). Measurement properties of pain scoring instruments in farm animals: A systematic review using the COSMIN checklist. PLoS ONE, 18(1), e0280830. https://doi.org/10.1371/journal.pone.0280830
- Treadway, M. T., & Zald, D. H. (2011). Reconsidering anhedonia in depression: Lessons from translational neuroscience. Neuroscience & Biobehavioral Reviews, 35(3), 537‑555. https://doi.org/10.1016/j.neubiorev.2010.06.006
- Veissier, I., Mialon, M.-M., & Sloth, K. H. (2017). Early modification of the circadian organization of cows’ activity in relation to disease or estrus. Journal of Dairy Science, 100(5), 3969‑3974. https://doi.org/10.3168/jds.2016-11853
- Villot, C., Martin, C., Bodin, J., Durand, D., Graulet, B., Ferlay, A., Mialon, M. M., Trevisi, E., & Silberberg, M. (2020). Combinations of non-invasive indicators to detect dairy cows submitted to high-starch-diet challenge. Animal, 14(2), 388‑398. https://doi.org/10.1017/S1751731119001629
- Watts, J. M., & Stookey, J. M. (1999). Effects of restraint and branding on rates and acoustic parameters of vocalization in beef cattle. Applied Animal Behaviour Science, 62(2-3), 125‑135. https://doi.org/10.1016/S0168-1591(98)00222-6
- Welsh, T. H., & Johnson, B. H. (1981). Stress-induced alterations in secretion of corticosteroids, progesterone, luteinizing hormone, and testosterone in bulls. Endocrinology, 109(1), 185‑190. https://doi.org/10.1210/endo-109-1-185
- Wemelsfelder, F. (2007). How animals communicate quality of life: The qualitative assessment of behaviour. Animal Welfare, 16(S1), 25‑31. https://doi.org/10.1017/s0962728600031699
- Wemelsfelder, F., Hunter, T. E. A., Mendl, M. T., & Lawrence, A. B. (2001). Assessing the ‘whole animal’: A free choice profiling approach. Animal Behaviour, 62(2), 209‑220. https://doi.org/10.1006/anbe.2001.1741
- Zanusso, F., Contiero, B., Normando, S., Gottardo, F., & De Benedictis, G. M. (2024). Qualitative behavioral assessment of dogs with acute pain. PloS One, 19(6), e0305925. https://doi.org/10.1371/journal.pone.0305925
- Zhang, J.-M., & An, J. (2007). Cytokines, inflammation, and pain. International Anesthesiology Clinics, 45(2), 27‑37. https://doi.org/10.1097/AIA.0b013e318034194e
Résumé
Cet article propose de dresser un état des lieux des connaissances scientifiques sur la douleur chez les animaux de production destinés à la consommation humaine. La douleur est « une expérience sensitive et émotionnelle désagréable associée ou ressemblant à celle associée à une atteinte tissulaire réelle ou potentielle ». Elle comporte trois composantes : sensitive, émotionnelle et cognitive. Les mécanismes de la douleur sont similaires chez la plupart des espèces : transduction, transmission, intégration. Tout au long de leur vie, les animaux de production sont confrontés à divers contextes pouvant générer de la douleur, avec un impact important sur leurs performances zootechniques, économiques, sur leur santé et sur leur bien-être. La douleur provoquée par certaines interventions en élevage est prévisible et sa prise en charge peut être anticipée, à l’inverse des accidents ou des maladies dont la survenue n’est pas ou peu prévisible. Les animaux manifestent la douleur en modifiant leurs comportements et leurs réponses physiologiques. Pour la détecter, on peut mobiliser l’observation centrée sur les animaux (posture, expression faciale, réaction à la palpation…) mais aussi sur la manière dont ils interagissent avec leur environnement physique (activités, locomotion, utilisation de l’espace…) et social (proximité, interactions, synchronisation).
Pièces jointes
Pas de document complémentaire pour cet articleStatistiques de l'article
 Vues: 2167
Vues: 2167
Téléchargements
 PDF: 141
PDF: 141
 XML: 22
XML: 22
Articles les plus lus par le même auteur ou la même autrice
- Pierre MORMEDE, Lucille BOISSEAU-SOWINSKI, Julie CHIRON, Claire DIEDERICH, John EDDISON, Jean-Luc GUICHET, Pierre LE NEINDRE, Marie-Christine MEUNIER-SALAÜN, Bien-être animal : contexte, définition, évaluation , INRAE Productions Animales: Vol. 31 No 2 (2018)
- Philippe FAVERDIN, Clément ALLAIN, Raphaël GUATTEO, Nathalie HOSTIOU, Isabelle VEISSIER, Élevage de précision : De nouvelles informations utiles pour la décision ? , INRAE Productions Animales: Vol. 33 No 4 (2020)
- Antoine ROSTANG, Catherine BELLOC, Mily LEBLANC MARIDOR, Hervé POULIQUEN, La pharmacie vétérinaire – un enjeu majeur pour un élevage durable , INRAE Productions Animales: Vol. 35 No 4 (2022): Rationaliser l'usage des médicaments en élevage
- Isabelle VEISSIER, Florence KLING-EVEILLARD, Marie-Madeleine MIALON, Mathieu SILBERBERG, Alice DE BOYER DES ROCHES, Claudia TERLOUW, Dorothée LEDOUX, Bruno MEUNIER, Nathalie HOSTIOU, Élevage de précision et bien-être en élevage : la révolution numérique de l’agriculture permettra-t-elle de prendre en compte les besoins des animaux et des éleveurs ? , INRAE Productions Animales: Vol. 32 No 2 (2019): Volume 32 Numéro 2 : Numéro spécial. De grands défis et des solutions pour l'élevage
- Christian DUCROT, Cécile ADAM, Florence BEAUGRAND, Catherine BELLOC, Julie BLUHM, Claire CHAUVIN, Marina CHOLTON, Lucie COLLINEAU, Julien FAISNEL, Nicolas FORTANÉ, Florence HELLEC, Anne HÉMONIC, Nathalie JOLY, Guillaume LHERMIE, Marie-Angélina MAGNE, Mathilde PAUL, Axelle POIZAT, Didier RABOISSON, Nathalie ROUSSET, Apport de la sociologie à l’étude de la réduction d’usage des antibiotiques , INRAE Productions Animales: Vol. 31 No 4 (2018)
- Christian DUCROT, Maria Belén BARRIO, Alain BOISSY, François CHARRIER, Sergine EVEN, Pierre MORMÈDE, Sandrine PETIT, Marie-Hélène PINARD-VAN DER LAAN, François SCHELCHER, François CASABIANCA, Alain DUCOS, Gilles FOUCRAS, Raphaël GUATTEO, Jean-Louis PEYRAUD, Muriel VAYSSIER-TAUSSAT, Patrick VEYSSET, Nicolas C. FRIGGENS, Xavier FERNANDEZ, Améliorer conjointement la santé et le bien-être des animaux dans la transition des systèmes d’élevage vers la durabilité , INRAE Productions Animales: Vol. 37 No 3 (2024)
- Mathilde PAUL, Mily LEBLANC-MARIDOR, Nathalie ROUSSET, Anne HEMONIC, Jocelyn MARGUERIE, Philippe le COZ, Bernadette le NORMAND, Jonathan HERCULE, Christine ROGUET, Claire CHAUVIN, Catherine BELLOC, Christian DUCROT, Réduction de l’usage des antibiotiques en filières monogastriques : état d’avancement et perspectives , INRAE Productions Animales: Vol. 35 No 4 (2022): Rationaliser l'usage des médicaments en élevage
- Mohammed GAGAOUA, Claudia TERLOUW, Brigitte PICARD, Apport de la protéomique à la découverte de biomarqueurs pour l’étude de la couleur de la viande bovine , INRAE Productions Animales: Vol. 34 No 3 (2021)
- Alain BOISSY, Pierre MORMÈDE, Le bien-être des animaux d’élevage : véritable objet scientifique et politique , INRAE Productions Animales: Vol. 38 No 4 (2025): Numéro spécial : Bien-être animal : avancées scientifiques et innovations pour des systèmes d’élevage durables
- Catherine BELLOC, Marie-Jeanne GUENIN, Mily LEBLANC-MARIDOR, Anne HEMONIC, Nathalie ROUSSET, Yannick CARRÉ, Charles FACON, Philippe LE COZ, Jocelyn MARGUERIE, Jean-Marc PETIOT, Maxime JARNOUX, Mathilde PAUL, Sophie MOLIA, Christian DUCROT, Réflexion participative pour une optimisation de l’usage d’antibiotiques garantissant santé et bien-être des porcs et volailles , INRAE Productions Animales: Vol. 35 No 4 (2022): Rationaliser l'usage des médicaments en élevage

