Faibles concentrations cellulaires du lait et sensibilité aux mammites des ruminants laitiers
Chapeau
La sélection, basée sur la concentration en cellules du lait, de ruminants laitiers moins sensibles aux mammites est un objectif important pour l’avenir de la production laitière mais suscite une controverse : faut-il s’inquiéter d’une trop forte réduction de cette concentration, sachant que ces cellules sont à la fois des témoins d’une infection et des acteurs de la défense immunitaire de la mamelle ? Des données récentes issues de la sélection divergente de ruminants laitiers permettent de répondre à cette question
Introduction
La concentration en cellules somatiques du lait (CCS), biomarqueur très sensible de l’inflammation mammaire, est très utilisée pour détecter au niveau du quartier les infections mammaires en médecine individuelle, et à l’échelle de l’animal pour la gestion de la santé du troupeau et de la qualité du lait (encadré 1). La CCS à l’échelle d’une lactation est également une information utilisée en amélioration génétique comme un des critères de sélection pour accroitre la résistance aux mammites. Dans ce dernier cas, la CCS, ou plus précisément sa transformation logarithmique en score de concentration des cellules somatiques (SCS), est considérée comme un critère pour évaluer la résistance ou la sensibilité aux infections mammaires. La sélection accorde une valeur supérieure aux géniteurs dont la descendance présente les plus faibles SCS.
S’il y a un consensus sur l’intérêt à pénaliser les CCS les plus élevées, leur évolution vers des valeurs de plus en plus faibles fait l’objet de controverses. Les CCS mesurant essentiellement les concentrations dans le lait des leucocytes qui défendent la mamelle vis-à-vis des infections, la question se pose du risque encouru à sélectionner des animaux dont le lait serait pratiquement dépourvu de cellules.
Une question revient souvent de la part des acteurs de la filière bovine laitière, qu’ils s’intéressent à la gestion de la santé à l’échelle individuelle ou collective : existe-t-il un risque à sélectionner des ruminants laitiers ayant une très faible concentration cellulaire du lait ? De tels animaux ne seront-ils pas au final plus sensibles à certaines infections mammaires, si le lait est dépourvu des cellules sensées les protéger ? Les CCS peuvent-elles être réduites au minimum, ou convient-il de ne pas dépasser un seuil inférieur critique correspondant à un optimum biologique et économique ? Des réponses contradictoires ont été données à ces questions (Timms, 1990 ; Schukken et al., 2001).
Les études épidémiologiques ne permettent pas à elles seules de répondre à cette problématique, et plusieurs d’entre elles ont fourni des conclusions contradictoires quant à la sensibilité aux mammites des vaches ayant de très faibles concentrations de cellules dans le lait. En intégrant les dernières connaissances acquises sur l’immunité mammaire qui permettent de clarifier la signification biologique des CCS, il est possible de préciser ce questionnement. Il apparaît alors que les résultats des enquêtes épidémiologiques et des évaluations expérimentales de la résistance de la mamelle aux infections, qui apparaissaient contradictoires, ne sont en fait pas inconciliables. Par ailleurs, les résultats des expérimentations réalisées avec des animaux issus de programmes de sélection basés sur les SCS permettent de répondre aux questions dès lors qu’elles sont bien posées. Elles indiquent clairement que les descendants de géniteurs ayant des index Cellules favorables (concentrations plus faibles dans les descendances) ne sont pas moins réactifs aux intrusions bactériennes de la mamelle, et ont globalement de meilleures défenses mammaires vis-à-vis des infections. Une réflexion sur ce thème a été récemment publiée en langue anglaise (Rainard et al., 2018a), la présente étude s’adresse à un lectorat francophone.
Encadré 1. Rappels sur les niveaux de mesure de la CCS du lait
La CCS, concentration en cellules somatiques, ou comptage de cellules somatiques, est une appellation consacrée par l’usage (bien que grammaticalement impropre, le comptage étant l’action de compter et non son résultat, contrairement à l’anglais « count » - « somatic cell count » - qui a les deux sens, de comptage et de décompte). Les CCS varient de quelques dizaines de milliers de cellules par mL de lait dans une mamelle saine, à plusieurs centaines de milliers et même plusieurs millions par mL dans une mamelle infectée.
La CCS peut se mesurer à différents niveaux :
- CCS du lait d’un seul quartier ou d’une glande considérée individuellement. Alors que chaque glande n’est pas complètement indépendante des glandes adjacentes ou de la glande contra-latérale, c’est un indicateur très sensible de l’inflammation de la glande échantillonnée. Dans la grande majorité des cas, une élévation de la CCS résulte d’une infection bactérienne de la mamelle. L’amplitude de l’élévation dépend du pouvoir pathogène de la bactérie responsable et de l’intensité de la réponse de l’animal modulée par différents facteurs. Elle varie aussi en fonction de la fraction analysée, le lait de fin de vidange étant plus riche en cellules.
- CCS de lait de traite, représentatif du statut de la mamelle globalement, donc indicateur à l’échelle de l’animal individuel. En principe, c’est la moyenne des CCS des quartiers, pondérée par la production de lait de chacun d’entre eux.
- CCS de lait de tank, en relation directe avec la prévalence des infections chroniques majoritairement subcliniques, car le lait des vaches avec une mammite aiguë (et traitée avec des antibiotiques) est écarté de la collecte. Ces infections chroniques sont qualifiées de persistantes par les épidémiologistes.
- CCS de lait de troupeau, moyenne des CCS de toutes les vaches du troupeau (y compris celles atteintes de mammite clinique) mesurées par le Contrôle Laitier et pondérées par les quantités de lait produites.
1. Des enquêtes épidémiologiques aux conclusions apparemment contradictoires
De nombreuses enquêtes épidémiologiques ont traité de la relation entre valeurs des CCS et sensibilité aux mammites. Le tableau qu’elles tracent n’est pas facile à saisir, car elles considèrent aussi bien des mammites cliniques, des mammites chroniques (persistantes) subcliniques, des CCS au niveau du quartier, de la vache, ou du tank, et réalisent des comparaisons entre ces différents niveaux. En outre, ces études reposent sur des observations réalisées en mode simultané (CCS et mammites enregistrées sur la même période), qui ne permet pas d’isoler l’effet des mammites cliniques sur les CCS, ou en mode consécutif (CCS antérieur pour l’évaluation du risque de mammites sur une période postérieure). L’impression générale est celle d’une certaine confusion et surtout d’une apparente contradiction entre les résultats ou les conclusions qui en sont tirées. Il est cependant possible d’en extraire des informations utiles.
À l’échelle individuelle (de la vache), plusieurs études ont montré que le risque de mammites cliniques augmente lorsque les CCS sont plus élevées (Coffey et al., 1986 ; Beaudeau et al., 1998 ; Rupp et al., 2000 ; Rupp et Boichard 2000 ; van den Borne et al., 2011). Ceci peut s’expliquer par le fait que des vaches avec des CCS élevées en raison d’infections chroniques sont sujettes à des épisodes cliniques assez fréquents. Si on considère des troupeaux dans lesquels les infections chroniques sont bien maitrisées (faibles CCS de tank), la faible prévalence d’infections chroniques est en principe favorable à la mise en évidence de l’effet CCS individuel sur la sensibilité aux infections par des bactéries pathogènes d’environnement comme E. coli. Dans une enquête réalisée sur des troupeaux à faibles CCS de tank, la plupart (80 %) des mammites cliniques étaient effectivement dues à des agents pathogènes d’environnement (Hogan et al., 1989). À l’opposé, plusieurs études indiquent que les très faibles CCS sont associées à un risque accru de mammite clinique. C’est le cas d’une étude en mode consécutif de l’incidence des mammites cliniques survenues dans un troupeau sur une période de 12 ans (Suriyasathaporn et al., 2000), ou d’une étude en mode simultané qui suggère que la sensibilité des mamelles à faible CCS pourrait être spécifique de certains agents pathogènes (Green et al., 2004).
Plusieurs analyses du lien entre la CCS et l’incidence des mammites cliniques ont été faites à l’échelle du troupeau. Une étude (Erskine et al., 1988) a mis en évidence une incidence des mammites cliniques plus grande dans les troupeaux avec des CCS de tank faibles (< 150 000 cel./mL) que dans les troupeaux avec des CCS élevées (> 750 000 cel./mL). L’étude a montré que la plupart des mammites cliniques étaient dues à des streptocoques et à des staphylocoques dans les troupeaux à CCS élevées, alors qu’elles étaient dues à des bactéries coliformes dans les autres. Une autre étude conforte l’idée que les troupeaux ayant des CCS de tank < 150 000 cel./mL ont plus de mammites cliniques que les troupeaux dont les CCS de tank > 250 000 cel./mL (Miltenburg et al., 1996). Dans une autre étude, réalisée sur le mode consécutif et portant sur 121 troupeaux, l’incidence des mammites cliniques a été analysée en tenant compte des CCS individuelles, et distinguant les proportions de vaches ayant de faibles ou fortes CCS dans les troupeaux. Il est apparu que dans les troupeaux ayant peu de vaches avec des CCS > 250 000 cel./mL (donc en principe une plus faible fréquence d’épisodes cliniques dus à des infections chroniques évoluant selon un mode contagieux), l’incidence des mammites cliniques augmentait avec la proportion de vaches ayant des CCS < 50 000 cel./mL (Beaudeau et al., 2002).
Par ailleurs, plusieurs études ont suggéré que les mammites étaient plus sévères dans les troupeaux à faible CCS de tank ou sur des animaux avec de faibles CCS individuelles (Green et al., 1996 ; Barkema et al., 1998 ; Tadich et al., 1998). Cela pourrait indiquer que des vaches à faibles CCS se défendent moins bien contre les infections mammaires que des animaux dont les CCS sont plus élevées. Une sensibilité d’origine génétique est en principe possible, mais d’autres éléments peuvent entrer en ligne de compte, qui méritent d’être examinés en détail.
On peut cependant remarquer que la relation entre l’incidence de mammites cliniques et la CCS moyenne du troupeau n’est pas très étroite : dans une étude portant sur 1771 troupeaux ayant <100 000 cel./mL de lait de tank, l’incidence des mammites cliniques variait de 0,6 à 147,1 cas/100 vaches/an. Un intervalle de valeurs aussi large montre bien qu’on peut avoir soit très peu, soit beaucoup de mammites cliniques dans des troupeaux à faible CCS (Peeler et al., 2002). Certaines études ont même montré que l’incidence des mammites cliniques pouvait être inférieure dans les troupeaux avec de faibles CCS en comparaison de troupeaux avec des CCS modérées ou élevées (Berry, 1994). L’analyse de l’incidence des mammites cliniques basée sur 20 422 vaches primipares ayant des CCS < 400 000 cel./mL a indiqué que les vaches avec le niveau cellulaire initial le plus bas présentaient le risque le plus faible de mammite clinique, sans qu’il y ait d’optimum intermédiaire (Rupp et Boichard, 2000). Une étude portant sur 350 troupeaux en Norvège a été réalisée pour explorer l’association entre la CCS en tout début de lactation ou au tarissement, et la survenue d’une mammite clinique au cours de la lactation en cours ou de la suivante : les résultats indiquent que ce sont les vaches ayant des CCS très faibles (10 000 - 20 000 cel./mL) qui présentent le risque le plus faible de développer une mammite clinique (Whist et Osteras, 2007).
2. Des résultats qui suscitent une controverse au sujet de la sélection sur la base des CCS
Les enquêtes épidémiologiques fournissent donc des résultats qui semblent contradictoires et ne permettent pas de conclure quant à la prédisposition des mamelles dont le lait contient très peu de cellules (< 20 000 cel./mL). La question est d’importance, car la CCS est largement utilisée pour l’évaluation génétique des reproducteurs dans les diverses espèces et races laitières. S’il y a un accord général sur la pertinence de la sélection contre les CCS élevées, considérées comme témoignant d’infections mammaires, il y a désaccord sur la sélection pour les CCS très faibles, considérées par certains comme indicateurs d’une plus faible capacité de défense contre les infections mammaires.
Certains auteurs ont clairement mis en cause les faibles CCS, et s’interrogent sur des CCS éventuellement trop basses (Kehrli et Shuster, 1994 ; Schukken et al., 2001), d’où leur proposition d’une courbe en U, la sensibilité aux mammites étant plus marquée aux deux extrêmes de la distribution des valeurs CCS. À l’encontre de cette hypothèse, on peut noter que la relation génétique entre le SCS et l’incidence des mammites cliniques est linéaire, sans qu’un optimum intermédiaire ne soit détecté (Philipsson et al., 1995 ; Cranford et Pearson, 2001). Cette relation est cependant loin d’être complète puisque la corrélation génétique entre SCS et mammites cliniques est de l’ordre de 0,5 à 0,7 (Rupp et Boichard, 1999 ; Govignon-Gion et al., 2016). Les programmes de sélection en cours n’intègrent pas de limite inférieure des CCS. Il est donc important de savoir s’il existe un risque à sélectionner des vaches dont les leucocytes du lait sont très peu nombreux, voire quasiment absents. Pour pouvoir répondre à cette question, il est nécessaire de préciser ce que recouvre, du point de vue biologique, la notion de CCS.
3. La nature des cellules du lait
3.1. Quelles sont les cellules présentes dans le lait et leur relation avec la CCS ?
Plusieurs types cellulaires entrent dans la composition de ce qu’il est convenu d’appeler les cellules somatiques du lait. Cette appellation recouvre les cellules leucocytaires et les cellules du tissu mammaire qui peuvent être éliminées dans le lait, comme les cellules épithéliales mammaires (Schalm et Lasmanis, 1968). Les catégories cellulaires les plus représentées sont les macrophages, les lymphocytes et les granulocytes neutrophiles (autrement appelés polynucléaires à cause de leur noyau plurilobé) (Riollet et al., 2000). Les neutrophiles deviennent largement majoritaires lors d’infection, et jouent un rôle de premier plan dans le contrôle de la prolifération bactérienne dans la lumière de la glande mammaire (Paape et al., 2002). Dans les glandes saines, ce sont les macrophages et les lymphocytes qui prédominent (Concha, 1986 ; Paape et al., 2002 ; Dosogne et al., 2003 ; Sarikaya et al., 2006). Par conséquent lors d’infection il y a un glissement de la composition cellulaire, des leucocytes mononucléés vers les granulocytes neutrophiles (figure 1). La sélection génétique contre des CCS élevées est donc une sélection contre la présence de neutrophiles dans le lait, qui témoignent d’une infection. Par contre, la sélection vers des valeurs de CCS très faibles est en principe une sélection contre les lymphocytes et les macrophages du lait. Cela nourrit la crainte que cette sélection s’accompagne d’une baisse des défenses mammaires, en raison du rôle important attribué aux cellules dites résidentes du lait de glandes saines. Afin d’évaluer le bien-fondé de cette crainte, une analyse critique du rôle des leucocytes du lait est nécessaire, en évaluant successivement le rôle des neutrophiles d’une part, et celui des macrophages et des lymphocytes d’autre part.
Figure 1. Composition cellulaire du lait avec des CCS faibles ou élevées.
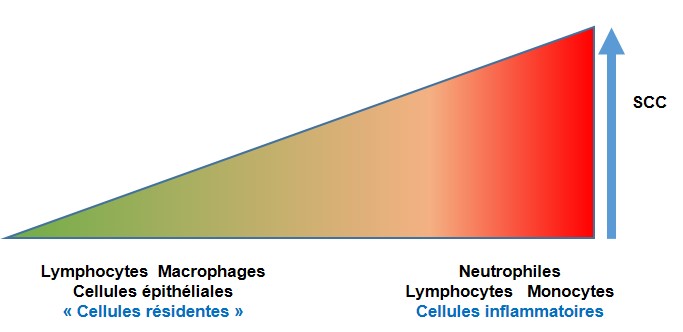
Les variations de CCS ne sont pas seulement des variations du nombre de cellules par unité volumique, mais elles correspondent aussi à des changements de la nature des cellules présentes, et donc également à des fonctions cellulaires différentes. Il en découle que la sélection contre les CCS fortes est une sélection contre les neutrophiles, et donc contre l’inflammation, alors que la sélection pour de très faibles CCS serait une sélection contre les macrophages et lymphocytes du lait, et pourrait être une contre-sélection de la réactivité de la glande mammaire aux infections.
3.2. Les granulocytes neutrophiles et la notion de barrière leucocytaire
Le concept de « barrière leucocytaire » a été forgé suite à des expérimentations qui ont montré qu’il était difficile d’établir une infection en présence d’une quantité de cellules anormalement élevée dans le lait d’un quartier en lactation (Schalm et Lasmanis, 1968). Les cellules et les facteurs humoraux présents dans le quartier enflammé préviennent la multiplication et éliminent les bactéries inoculées. Ce sont les neutrophiles qui jouent ce rôle protecteur dans ce cas de figure (Paape et al., 2003 ; Rainard et Riollet, 2003). Une étude systématique des conditions favorables à l’établissement d’une infection expérimentale avec des souches de S. aureus a établi que les quartiers éligibles devaient avoir des CCS < 600 000 cel./mL et être exempts d’infections, y compris par des agents pathogènes mineurs comme Corynebacterium bovis ou les staphylocoques coagulase-négatifs (CNS) (Postle et al., 1978). Le concept de barrière cellulaire a été mis à profit pour tenter de réduire l’incidence de nouvelles infections en induisant un état inflammatoire permanent, comme par exemple en introduisant dans la citerne de la glande une boucle de polyéthylène (« stérilait »). Malheureusement, l’effet protecteur était inconstant et pour obtenir une certaine efficacité, les CCS devaient être nettement supérieures à 500 000 cel./mL (Paape et al., 1981 ; Poutrel et al., 1983).
Les infections mammaires chroniques et l’état inflammatoire qu’elles entrainent semblent protéger, dans une certaine mesure, la glande mammaire contre la survenue d’une infection supplémentaire (ou surinfection). Ceci est en particulier vrai des infections par les agents pathogènes dits mineurs, ainsi qu’observé dans des conditions expérimentales (Schalm et Lasmanis, 1968 ; Poutrel et Lerondelle, 1980). Cependant, dans ce dernier cas, l’effet protecteur est observé avec des valeurs de CCS inférieures à celles qui permettent une protection lorsqu’une inflammation stérile (stérilait) a été provoquée, ce qui fait penser que d’autres phénomènes, comme l’interférence entre bactéries, pourraient intervenir, en particulier dans le canal du trayon (Rainard, 1987). Les observations réalisées dans les conditions du terrain ont fourni des indications mitigées et parfois contradictoires, montrant que la réceptivité à une nouvelle infection d’une glande déjà infectée par un agent pathogène donné pouvait être soit augmentée, soit diminuée selon les cas (Brooks et al., 1983 ; Rainard et Poutrel, 1988 ; Bradley, 2002).
Une conséquence logique de l’effet de barrière leucocytaire est qu’une glande mammaire saine est en principe plus réceptive aux infections qu’une glande mammaire enflammée, dans laquelle les mécanismes de réponse inflammatoire et immunitaire sont déjà activés. On pourrait penser que dans un troupeau ayant une forte proportion de quartiers infectés le taux de nouvelles infections (rapporté à l’ensemble des quartiers) tende à être plus faible que dans un troupeau à faible niveau d’infections mammaires, mais ce n’est pas toujours le cas (Rainard et Poutrel, 1982). Il est vraisemblable que le risque d’infection croisée (d’un quartier infecté à un quartier sain d’une mamelle) et la pression d’infection dans le troupeau soient des facteurs de risque déterminants. Ce sont des différences de pression d’infection, principalement à cause des germes d’environnement, qui pourraient expliquer la grande variété d’incidence des mammites cliniques dans les troupeaux ayant de faibles CCS de tank rapportée dans l’étude de Peeler et al. (2002).
3.3. Les lymphocytes et les macrophages du lait et la notion de cellules résidentes
En l’absence d’inflammation, les cellules les plus représentées dans le lait, et qui composent le niveau de base des CCS, sont les macrophages et les lymphocytes. Ces cellules sont souvent considérées comme des cellules résidentes, ou plus exactement représentatives d’une population de cellules résidentes (en effet, éliminées dans le lait de traite, celles que l’on compte ne résident plus dans la mamelle). La notion de population résidente est répandue, mais mal définie et son rôle est rarement explicité. Cette notion théorise qu’il existe dans la lumière de la glande mammaire saine une population de cellules résidentes, composée essentiellement de lymphocytes et de macrophages, qui jouent le rôle de première ligne de défense du tissu mammaire et de sentinelles de la glande. Ces cellules, en particulier les macrophages, sont supposées détecter les bactéries pathogènes, les phagocyter, et émettre des signaux (par exemple des médiateurs solubles pro-inflammatoires comme les chimiokines et les cytokines) qui déclenchent la réponse immunitaire.
Cette théorie est née avant que la capacité des cellules épithéliales à détecter les motifs bactériens et à réagir au contact des bactéries n’ait été établie. Elle ne repose cependant pas sur de solides bases expérimentales et peut au contraire être remise en cause avec l’évolution des connaissances. Tout d’abord il faut tenir compte de la faible concentration cellulaire dans le lait des glandes saines ; elle est généralement inférieure à 50 000 cel./mL, ce qui rend difficile leur capacité à exercer un pouvoir phagocytaire et bactéricide notable, car une concentration au moins 10 fois supérieure est nécessaire pour que le contact cellule-bactérie s’établisse avec une fréquence suffisante (Leijh et al., 1981). Ensuite, les examens histologiques et immunohistochimiques du tissu mammaire, que ce soit à hauteur des citernes, des canaux, ou des alvéoles, n’ont pas mis en évidence de cellules de type macrophagique adhérant à la face apicale de l’épithélium des glandes saines, et distinctes des leucocytes intraépithéliaux (Nickerson et Heald, 1981 ; Rainard et al., 2008 ; Maxymiv et al., 2012 ; Rainard et al., 2013). Si elle existe, la population de cellules réellement résidentes dans la lumière de la glande mammaire est extrêmement clairsemée. On peut donc faire l’hypothèse que les cellules qui constituent les faibles et très faibles CCS sont des cellules qui viennent de migrer du parenchyme dans la lumière de la glande, et qu’elles sont rapidement éliminées par la traite.
Le rôle de sentinelle des macrophages du lait n’est pas lui non plus clairement établi. Les macrophages du lait ont une efficacité phagocytaire nettement moindre que celle des neutrophiles (Sandgren et al., 1991 ; Dosogne et al., 2001). Une étude a par ailleurs montré que les macrophages du lait ne sont pas bactéricides envers S. uberis, contrairement aux neutrophiles, qu’ils sont de moins bons producteurs de TNF-α et de NO que les monocytes sanguins, et qu’ils ne répondent pas à l’INF-γ, un activateur des macrophages (Denis et al., 2006).
Les activités des lymphocytes du lait ne sont pas très bien connues (encadré 2). On sait que ces lymphocytes présentent un phénotype qui les fait qualifier de cellules mémoires (Taylor et al., 1994). Quelques travaux indiquent que les lymphocytes T CD8+ peuvent avoir une activité antibactérienne (Denis et al., 2011), mais aussi qu’ils peuvent avoir une activité immunosuppressive sur les fonctions des lymphocytes T CD4+ (Shafer-Weaver et Sordillo, 1997). Les fonctionnalités des lymphocytes T auxiliaires CD4+ que l’on trouve dans le lait n’ont pas été caractérisées. Dans tous les cas, les lymphocytes dans le lait sont isolés, incapables de se diriger en milieu liquide et donc d’interagir efficacement avec les cellules effectrices comme les macrophages ou les cellules présentatrices d’antigènes. Elles sont en trop faible concentration pour produire des concentrations actives de médiateurs solubles en raison de leur dilution dans un grand volume de lait.
Encadré 2. Les lymphocytes du lait
Les lymphocytes présents dans le lait sont en majorité des lymphocytes T, et parmi ces cellules, les lymphocytes T CD4+ (exprimant le marqueur de surface CD4) et CD8+ (exprimant le marqueur de surface CD8) sont les plus nombreux. Ces lymphocytes T possèdent des récepteurs spécifiques d’un antigène et sont des cellules majeures de l’immunité adaptative.
Les lymphocytes T CD4+ sont des lymphocytes auxiliaires qui aident les lymphocytes B à produire des anticorps, mais ils ont aussi bien d’autres fonctions dans l’orchestration des réponses immunitaires. En particulier, ils peuvent sécréter des cytokines ou interleukines (IL) comme l’IL-17 ou l’interféron gamma (IFN-γ) qui agissent à leur tour sur d’autres cellules de l’immunité comme les macrophages ou les cellules épithéliales.
Des sous-populations de lymphocytes CD4+ ou CD8+ peuvent avoir des fonctions régulatrices. Certains lymphocytes CD8+ ont des capacités cytotoxiques ; ils peuvent tuer des cellules infectées par des agents pathogènes viraux ou bactériens. La plupart des lymphocytes T du lait sont des cellules dites à mémoire : elles ont été précédemment au contact de leur antigène spécifique et sont prêtes à réagir lors d’un nouveau contact avec cet antigène.
4. L’épithélium mammaire, un rôle de sentinelle et une ligne de défense pour la mamelle
Il est bien établi que le tissu mammaire détecte efficacement la présence de bactéries en multiplication active dans le lait et qu’il réagit par une réponse inflammatoire de type neutrophilique (Jain, 1976). Si les leucocytes présents dans le lait ne jouent pas ce rôle dans les glandes saines, quelles sont les cellules sentinelles de la mamelle capables de détecter une infection et de mobiliser les défenses immunitaires ? Il est maintenant admis que l’épithélium mammaire peut jouer le rôle de sentinelle et de deuxième ligne de défense, après le canal du trayon.
De nombreuses études ont montré que les cellules épithéliales mammaires sont équipées pour détecter la présence de bactéries ou de leurs composants, et de déclencher le recrutement des leucocytes sanguins (Strandberg et al., 2005 ; Lahouassa et al., 2007 ; Günther et al., 2009 ; Gilbert et al., 2013). Au-delà des seules cellules épithéliales, l’épithélium qui borde la lumière de la glande mammaire et en particulier des citernes et des gros canaux réagit aux bactéries et à leurs composants, orchestrant le déclenchement d’une réponse inflammatoire (Lind et al., 2015). Cet épithélium comprend des leucocytes associés aux cellules épithéliales, comme des cellules de type dendritique ou macrophagique (Maxymiv et al., 2012) et des lymphocytes T CD8+ en position intra- ou sous-épithéliale (Leitner et al., 2003). De ces travaux, il ressort que le parenchyme mammaire, et en particulier l’épithélium qui le borde, est équipé pour détecter et répondre aux infections indépendamment des cellules qui sont éliminées dans le lait.
Du rôle éminent de l’épithélium mammaire dans l’alerte et la défense de la mamelle, on pourrait déduire que les glandes à faible CCS ne sont pas plus sensibles aux infections mammaires que les glandes non-infectées ayant une concentration moyenne de cellules. Ce n’est pas ce qui est communément constaté. En fait il est possible que la quantité de cellules du lait soit le reflet indirect de la réactivité de la glande mammaire aux stimuli irritants. Certaines observations vont dans ce sens (Wellnitz et al., 2010), et le concept de CCS comme indicateur de la réactivité mammaire mériterait d’être exploré. Cependant, cette réactivité n’est pas nécessairement efficace et bénéfique, comme semblent l’indiquer la sensibilité des vaches multipares aux mammites cliniques et les essais infructueux du stérilait, ainsi que la réduction de production laitière qui apparaît dès que les CCS dépassent 55 000 ou 100 000 cel./mL (Hortet et al., 1999 ; Archer et al., 2013).
La question qui est au cœur de notre réflexion concerne l’influence de la sélection génétique sur les CCS et son impact sur la sensibilité/résistance aux infections mammaires (cliniques et subcliniques chroniques) sur la réactivité de la glande mammaire aux bactéries et sa capacité à lutter contre l’infection. En d’autres termes, est-ce que la sélection sur la base des CCS, sans limite inférieure, modifie la réactivité de la mamelle et ses capacités de défense contre les infections ?
Nous avons maintenant des réponses à cette question, suite à des travaux récents réalisés avec des animaux issus de programmes de sélection sur la base des index Cellules des géniteurs.
Encadré 3. Composantes génétique et environnementale de la CCS
Le phénotype CCS résulte d’une composante génétique et d’une composante environnementale qui modifient le statut inflammatoire de la glande mammaire.
L’héritabilité moyenne du critère CCS est d’environ 0,15 dans les espèces laitières ce qui laisse une large place à l’effet de la composante environnementale sur la CCS.
La composante environnementale est liée à la pression d’infection (exposition au risque infectieux propreté des bâtiments, de la litière, conduite d’élevage), la qualité de la traite (intégrité des tissus du trayon et du sphincter du canal du trayon, contamination entre vaches lors de la traite, entretien de l’équipement), l’alimentation, les facteurs de stress et de confort, les conditions climatiques, etc. (qui sont habituellement confondus dans l’effet troupeau global).
La CCS du quartier à un instant donné est déterminée principalement par son statut infectieux et inflammatoire, la présence d’une infection résultant de la pression infectieuse et de différents facteurs de risque environnementaux, physiologiques (comme l’âge, le stade ou le rang de lactation) et individuels (génétique, histoire infectieuse).
Le critère CCS utilisé en sélection intègre des mesures répétées mensuelles au cours de la lactation ; il reflète donc plus l’état moyen ou chronique sur la carrière qu’une réponse instantanée à l’intrusion d’un agent pathogène. Chez les bovins, depuis 2010, l’index Santé de la mamelle combine CCS et cas de mammites cliniques.
5. CCS et sélection génétique : études expérimentales sur animaux obtenus par sélection sur le critère SCS
Les valeurs de CCS sont en partie sous le contrôle de la génétique (cf. encadré 3). Pour tester l’effet de la sélection sur la base des SCS, la première expérience a été réalisée en créant deux groupes de brebis par sélection divergente à partir de géniteurs extrêmes pour le caractère SCS moyen de la lactation. Une forte divergence de 3 écarts-types génétiques a été obtenue, ce qui correspond à un rapport de CCS attendu de 2,8 entre les deux lignées. Dans les conditions d’élevage d’un troupeau commercial, les brebis du groupe sélectionné pour des index Cellules favorables ont, comme attendu, eu des CCS moyennes plus faibles au long de la lactation que les brebis du groupe aux index défavorables (Rupp et al., 2009). Il est à noter cependant que lors de la première mesure après agnelage, les CCS des glandes des deux groupes ne différaient pas, probablement en raison d’une faible prévalence des infections mammaires. La différence s’est établie au cours de la lactation en association avec le développement progressif d’infections chroniques, pour la plupart dues à des CNS. Le groupe génétiquement prédisposé aux mammites (index défavorable) a eu également une incidence annuelle de mammites cliniques plus grande (5 vs 0 pour 40 vs 38 brebis) et des abcès mammaires en plus grand nombre, et une plus longue persistance des infections subcliniques. Les glandes infectées des brebis du groupe aux index favorables avaient également tendance à produire un lait avec moins de cellules que les glandes infectées des brebis du groupe aux index défavorables pour une même bactérie infectante. Ceci pourrait indiquer soit une défense plus efficace se traduisant par un contrôle plus rapide de l’agent pathogène, soit une meilleure régulation de la réaction inflammatoire, soit une moindre réactivité à l’infection de la mamelle des brebis ayant des index favorables.
La capacité de la mamelle des brebis des deux groupes à contrôler les infections staphylococciques a été évaluée à l’aide d’infections expérimentales avec un isolat de S. epidermidis dans une glande, puis un isolat de S. aureus dans l’autre glande au cours de deux lactations consécutives. Les réponses aux infections n’ont pas montré de différence quant à la promptitude, l’intensité et la nature du recrutement de leucocytes dans le lait au début de l’infection, mais ont montré une tendance vers un meilleur contrôle de l’infection en termes de réduction de l’excrétion bactérienne dans le groupe à index favorable, ce qui suggère une meilleure efficacité de l’activité antibactérienne des cellules recrutées (Bonnefont et al., 2011).
Une sélection divergente basée sur le même principe a été réalisée sur des chèvres de race Alpine. Les résultats des expérimentations menées sur ces animaux indiquent les mêmes tendances que chez la brebis : différence de CCS sur la lactation en défaveur du groupe à index défavorable, liée à une plus grande fréquence d’infections chroniques par des CNS, pas de différence de CCS dans les glandes saines (Huau et al., 2015 ; Rupp et al., 2019), pas de différence dans la capacité à recruter les leucocytes dans le lait et à contrôler la charge bactérienne (excrétion de S. aureus dans le lait) (Cremonesi et al., 2012 ; Rainard et al., 2018b). Chez la chèvre la résistance à une épreuve parasitaire par Hemonchus contortus n’a pas été modifiée par la sélection (Rupp et al., 2019). Lors d’une expérimentation plus récente conduite chez les bovins Holstein et Normand avec, dans chaque race, une lignée dite résistante et une lignée contrôle représentative de la moyenne de la population commerciale, les mêmes effets sur les CCS et la prévalence des mammites cliniques ont été observés (Lefebvre et al., 2016).
La réponse de différents types cellulaires susceptibles d’intervenir de façon importante au cours de l’infection mammaire par des staphylocoques a été étudiée par l’analyse de profils d’expression génique chez la brebis laitière. Les cellules épithéliales mammaires (CEM) forment la dernière barrière franchie par les leucocytes avant leur arrivée dans la lumière de la glande mammaire. Par conséquent, ces cellules sont en bonne position pour jouer un rôle important dans la migration des cellules retrouvées dans le lait. Les réponses des CEM isolées des deux lignées divergentes de brebis suite à la stimulation par S. aureus n’ont pas montré de différences qui pourraient expliquer la différence de prédisposition des deux lignées aux infections mammaires (Bonnefont et al., 2012). Une étude réalisée sur des CEM isolées de vaches elles-aussi sélectionnées sur la base des SCS et stimulées par des staphylocoques ou des colibacilles tués n’a pas montré non plus de différence nette dans l’expression de 10 gènes associés à l’immunité innée (Griesbeck-Zilch et al., 2009). Ces deux études suggèrent que les mécanismes sous-jacents à la différence de prédisposition aux infections mammaires des lignées divergentes n’impliquent pas les CEM, ou du moins ne s’expriment pas lorsque ces cellules sont isolées de leur environnement tissulaire naturel.
Un autre type cellulaire, les macrophages/cellules dendritiques, important en raison de son rôle de premier plan dans l’immunité innée et l’orientation des réponses adaptatives, a également été étudié. Après stimulation par des staphylocoques tués par la chaleur, les cellules dendritiques issues de la lignée sensible ont révélé une surexpression de gènes (myd88, ilrap) impliqués dans la signalisation par la voie du récepteur pour l’IL-1β (IL-1R), ainsi que des gènes associés à la migration trans-endothéliale des leucocytes (Toufeer et al., 2011). Cela pourrait être relié à la propension des brebis du groupe sensible aux mammites à avoir des CCS plus élevées que les brebis du groupe résistant dans les quartiers infectés (Rupp et al., 2009). La surexpression de certains gènes (C1qc, et ido1) par les cellules dendritiques du groupe résistant suggère que l’inflammation pourrait être mieux contrôlée par ces animaux. D’autre part, la surexpression des gènes tlr2 et cd36 par les leucocytes constituant les CCS suggère que la voie de signalisation de TLR2 pourrait être plus efficace dans le groupe résistant, ce qui pourrait favoriser l’efficacité phagocytaire et contribuer au meilleur contrôle de la charge bactérienne observé chez les brebis du groupe résistant dans la phase initiale de l’infection en conditions expérimentales (Bonnefont et al., 2011). Les études réalisées sur les lignées divergentes ont plusieurs implications (encadré 4).
Encadré 4. Implications des études réalisées sur les lignées divergentes
La sélection à l’aide du critère SCS réduit la prévalence des mammites cliniques et subcliniques dans des conditions où la pression infectieuse est identique, par rapport aux animaux non-sélectionnés ou avec des index Cellules défavorables.
La sélection basée sur le critère SCS n’affecte pas la concentration basale de cellules dans le lait des glandes saines (hors infection et hors inflammation).
Des infections expérimentales ont permis d’établir que la réactivité de la mamelle aux infections n’est pas réduite par la sélection, et que la réponse inflammatoire semble mieux régulée alors que son efficacité n’est pas altérée.
La sélection ne semble pas avoir d’incidence sur la résistance aux parasites gastro-intestinaux.
La sélection ne semble pas être associée à une modification de la réponse des cellules épithéliales mammaires aux agonistes bactériens de l’immunité innée, mais modifie la réponse des cellules somatiques du lait (leucocytes recrutés par l’inflammation) et des cellules dendritiques à S. aureus.
Conclusion
Les résultats des enquêtes épidémiologiques qui ont étudié la relation entre CCS et sensibilité aux mammites semblent contradictoires. En réalité, elles ne le sont pas car les données qu’elles analysent résultent de différents mécanismes agissant à des échelles différentes :
i) L’immunité de barrière créée par la leucocytose du lait à la suite d’infections déjà établies ;
ii) la pression infectieuse générée par l’exposition à différents agents pathogènes, en distinguant les germes contagieux à réservoir mammaire de ceux présents dans l’environnement ;
iii) la résistance génétique aux infections mammaires ;
iv) la réactivité de la glande conditionnée par des évènements récents ou actuels.
Le phénotype résultant de ces diverses influences, et en particulier le statut infectieux de la mamelle, détermine le caractère plus ou moins réceptif ou réfractaire aux nouvelles infections de la glande mammaire. La biologie qui sous-tend ce caractère intègre les infections concomitantes (immunité d’infection, interférence bactérienne) et antérieures (entrainement ou éducation de l’immunité innée), qui peuvent s’exprimer au travers de la barrière cellulaire ou d’une réactivité accrue à l’infection. C’est un caractère essentiellement propre au quartier (ou à l’hémi-mamelle) et non à la vache ou à la mamelle dans son ensemble, même s’il existe une composante généralisée à l’organe ou à l’individu. En conséquence, dans un troupeau dans lequel le nombre de glandes infectées et/ou la pression infectieuse sont élevés, il y a une plus forte proportion de quartiers (glandes) réfractaires à une nouvelle infection, et à l’inverse lorsque la pression d’infection est faible, la proportion de quartiers réceptifs est élevée.
Une conséquence d’une sélection génétique efficace contre les mammites sera d’obtenir des troupeaux à faible CCS et bonne productivité, donc à forte proportion de glandes phénotypiquement réceptives, mais dont les mamelles sont globalement génétiquement plus résistantes, soit parce qu’elles contractent peu d’infections (en raison par exemple d’une bonne efficacité du canal du trayon) soit parce qu’elles se débarrassent efficacement d’une infection naissante (bonne immunité de contrôle).
En conclusion, il y a deux éléments de réponse à la question « Est-ce que les CCS peuvent être trop basses ? » :
i) Est-ce que de très faibles valeurs de CCS sont un indicateur d’une plus forte sensibilité aux infections ? Ici la réponse doit être nuancée, car il est possible que les CCS soient un indicateur de la réactivité de la mamelle, notion intégrant la promptitude et l’adéquation de la réponse inflammatoire (figure 2). Mais ce n’est qu’une hypothèse, qui doit être évaluée expérimentalement. Dans l’état actuel des connaissances, il semble qu’il existe une légère différence entre le potentiel de réactivité entre glandes saines à faibles et très faibles CCS.
ii) Est-ce que l’augmentation de sensibilité aux infections des glandes à faible CCS par rapport à des glandes à forte CCS est la conséquence de la sélection sur la base des CCS de la descendance ? A cette question, la réponse est clairement non, comme l’ont montré les expérimentations sur les animaux issus d’une telle sélection.
Figure 2. La sélection basée sur les CCS n’altère pas la réactivité de la glande mammaire à l’infection.

La réactivité de la mamelle aux infections dépend essentiellement de l’état de l’immunité innée et adaptative locale et systémique. On peut considérer que le niveau de CCS, dans sa composante environnementale, est relié à la réactivité mammaire. Les expérimentations sur animaux sélectionnés sur la base des CCS indiquent clairement que la composante génétique des CCS n’a pas d’effet mesurable sur la réactivité de la mamelle aux infections.
Notes
- Cette question a fait l’objet d’un article paru récemment dans le Journal of Dairy Science : Rainard, P., Foucras, G., Boichard, D., Rupp, R. (2018a). Invited review: Low milk somatic cell count and susceptibility to mastitis. J Dairy Sci., 101,6703-6714.
Références
- Archer S.C., Mc Coy F., Wapenaar W., Green M.J., 2013. Association between somatic cell count after first parturition and cumulative milk yield in dairy cows. Vet. Rec., 173, 316.
- Barkema H.W., Schukken Y.H., Lam T.J., Beiboer M.L., Wilmink H., Benedictus G., Brand A., 1998. Incidence of clinical mastitis in dairy herds grouped in three categories by bulk milk somatic cell counts. J. Dairy Sci., 81, 411-419.
- Beaudeau F., Seegers H., Fourichon C., Hortet P., 1998. Association between milk somatic cell counts up to 400,000 cells/ml and clinical mastitis in French Holstein cows. Vet. Rec., 143, 685-687.
- Beaudeau F., Fourichon C., Seegers H., Bareille N., 2002. Risk of clinical mastitis in dairy herds with a high proportion of low individual milk somatic-cell counts. Prev. Vet. Med., 53, 43-54.
- Berry E.A., 1994. Mastitis incidence in low cell count herds. Vet. Rec., 135, 479-480.
- Bonnefont C.M., Toufeer M., Caubet C., Foulon E., Tasca C., Aurel M.R., Bergonier D., Boullier S., Robert-Granie C., Foucras G., Rupp R., 2011. Transcriptomic analysis of milk somatic cells in mastitis resistant and susceptible sheep upon challenge with Staphylococcus epidermidis and Staphylococcus aureus. BMC Genomics, 12, 208.
- Bonnefont C.M., Rainard P., Cunha P., Gilbert B.F., Toufeer M., Aurel M.R., Rupp R., Foucras G., 2012. Genetic susceptibility to S. aureus mastitis in sheep: differential expression of mammary epithelial cells in response to live bacteria or supernatant. Physiol. Genomics, 44, 403-416.
- Bradley A.J., 2002. Bovine mastitis: An evolving disease. Vet. J., 164, 116-128.
- Brooks B.W., Barnum D.A., Meek A.H., 1983. An observational study of Corynebacterium bovis in selected Ontario dairy herds. Can. J. Comp. Med., 47, 73-78.
- Coffey E.M., Vinson W.E., Pearson R.E., 1986. Somatic cell counts and infection rates for cows of varying somatic cell count in initial test of first lactation. J. Dairy Sci., 69, 552-555.
- Concha C., 1986. Cell types and their immunological functions in bovine mammary tissues and secretions--a review of the literature. Nord. Vet. Med., 38, 257-272.
- Cranford J.L., Pearson R.E., 2001. Relationships of sire predicted transmitting ability for somatic cell score with measures of daughter performance. J. Dairy Sci., 84, 1501-1507.
- Cremonesi P., Capoferri R., Pisoni G., Del Corvo M., Strozzi F., Rupp R., Caillat H., Modesto P., Moroni P., Williams J.L., Castiglioni B., Stella A., 2012. Response of the goat mammary gland to infection with Staphylococcus aureus revealed by gene expression profiling in milk somatic and white blood cells. BMC Genomics, 13, 540.
- Denis M., Parlane N.A., Lacy-Hulbert S.J., Summers E.L., Buddle B.M., Wedlock D.N., 2006. Bactericidal activity of macrophages against Streptococcus uberis is different in mammary gland secretions of lactating and drying off cows. Vet. Immunol. Immunopathol., 114, 111-120.
- Denis M., Lacy-Hulbert S.J., Buddle B.M., Williamson J.H., Wedlock D.N., 2011. Streptococcus uberis-specific T cells are present in mammary gland secretions of cows and can be activated to kill S. uberis. Vet. Res. Commun., 35, 145-156.
- Dosogne H., Vangroenweghe F., Barrio B., Rainard P., Burvenich C., 2001. Decreased number and bactericidal activity against Staphylococcus aureus of the resident cells in milk of dairy cows during early lactation. J. Dairy Res., 68, 539-549.
- Dosogne H., Vangroenweghe F., Mehrzad J., Massart-Leen A.M., Burvenich C., 2003. Differential leukocyte count method for bovine low somatic cell count milk. J. Dairy Sci., 86, 828-834.
- Erskine R.J., Eberhart R.J., Hutchinson L.J., Spencer S.B., Campbell M.A., 1988. Incidence and types of clinical mastitis in dairy herds with high and low somatic cell counts. J. Am. Vet. Med. Assoc., 192, 761-765.
- Gilbert F.B., Cunha P., Jensen K., Glass E.J., Foucras G., Robert-Granie C., Rupp R., Rainard P., 2013. Differential response of bovine mammary epithelial cells to Staphylococcus aureus or Escherichia coli agonists of the innate immune system. Vet. Res., 44, 40.
- Govignon-Gion A., Dassonneville R., Baloche G., Ducrocq V., 2016. Multiple trait genetic evaluation of clinical mastitis in three dairy cattle breeds. Animal, 10, 558-565.
- Green M.J., Green L.E., Cripps P.J., 1996. Low bulk milk somatic cell counts and endotoxin-associated (toxic) mastitis. Vet. Rec., 138, 305-306.
- Green M.J., Green L.E., Schukken Y.H., Bradley A.J., Peeler E.J., Barkema H.W., de Haas Y., Collis V.J., Medley G.F., 2004. Somatic cell count distributions during lactation predict clinical mastitis. J. Dairy Sci., 87, 1256-1264.
- Griesbeck-Zilch B., Osman M., Kuhn C., Schwerin M., Bruckmaier R.H., Pfaffl M.W., Hammerle-Fickinger A., Meyer H.H., Wellnitz O., 2009. Analysis of key molecules of the innate immune system in mammary epithelial cells isolated from marker-assisted and conventionally selected cattle. J. Dairy Sci., 92, 4621-4633.
- Günther J., Koczan D., Yang W., Nurnberg G., Repsilber D., Schuberth H.J., Park Z., Maqbool N., Molenaar A., Seyfert H.M., 2009. Assessment of the immune capacity of mammary epithelial cells: comparison with mammary tissue after challenge with Escherichia coli. Vet. Res., 40, 31.
- Hogan J.S., Smith K.L., Hoblet K.H., Schoenberger P.S., Todhunter D.A., Hueston W.D., Pritchard D.E., Bowman G.L., Heider L.E., Brockett B.L., et al., 1989. Field survey of clinical mastitis in low somatic cell count herds. J. Dairy Sci., 72, 1547-1556.
- Hortet P., Beaudeau F., Seegers H., Fourichon C., 1999. Reduction in milk yield associated with somatic cell counts up to 600 000 cells/ml in French Holstein cows without clinical mastitis. Livestock Prod. Sci., 61, 33-42.
- Huau C., Foucras G., Tabouret G., Caubet C., Bouvier F., Fassier T., Rainard P., Martin P., Tosser-Klopp G., Rupp R., 2015. L'amélioration génétique sur le comptage de cellules somatiques du lait s'accompagne d'une meilleure qualité hygiénique chez la chèvre. Renc. Rech. Rum., 22, 53.
- Jain N.C., 1976. Neutrophil leukocytes and inflammation of the bovine mammary gland. Theriogenology, 6, 153-173.
- Kehrli M.E.Jr., Shuster D.E., 1994. Factors affecting milk somatic cells and their role in health of the bovine mammary gland. J.Dairy Sci., 77, 619-627.
- Lahouassa H., Moussay E., Rainard P., Riollet C., 2007. Differential cytokine and chemokine responses of bovine mammary epithelial cells to Staphylococcus aureus and Escherichia coli. Cytokine, 38, 12-21.
- Lefebvre R., Barbey S., Launay F., Boichard D., Germon P., 2016. A divergent genetic selection experiment on mastitis resistance in Holstein and Normand breeds. In: 6th IDF Mastitis Conference. Nantes, France.
- Leijh P.C., van den Barselaar M.T., van Furth R., 1981. Kinetics of phagocytosis and intracellular killing of Staphylococcus aureus and Escherichia coli by human monocytes. Scand. J. Immunol., 13, 159-174.
- Leitner G., Eligulashvily R., Krifucks O., Perl S., Saran A., 2003. Immune cell differentiation in mammary gland tissues and milk of cows chronically infected with Staphylococcus aureus. J. Vet. Med. B Infect. Dis. Vet. Public Health, 50, 45-52.
- Lind M., Sipka A.S., Schuberth H.J., Blutke A., Wanke R., Sauter-Louis C., Duda K.A., Holst O., Rainard P., Germon P., Zerbe H., Petzl W., 2015. Location-specific expression of chemokines, TNF-alpha and S100 proteins in a teat explant model. Innate Immunity, 21, 322-331.
- Maxymiv N.G., Bharathan M., Mullarky I.K., 2012. Bovine mammary dendritic cells: A heterogeneous population, distinct from macrophages and similar in phenotype to afferent lymph veiled cells. Comp. Immunol. Microbiol. Infect. Dis., 35, 31-38.
- Miltenburg J.D., deLange D., Crauwels A.P.P., Bongers J.H., Tielen M.J.M., Schukken Y.H., Elbers A.R.W., 1996. Incidence of clinical mastitis in a random sample of dairy herds in the southern Netherlands. Vet. Rec., 139, 204-207.
- Nickerson S.C., Heald C.W., 1981. Histopathologic response of the bovine mammary gland to experimentally induced Staphylococcus aureus infection. Am. J. Vet. Res., 42, 1351-1355.
- Paape M., Mehrzad J., Zhao X., Detilleux J., Burvenich C., 2002. Defense of the bovine mammary gland by polymorphonuclear neutrophil leukocytes. J. Mammary Gland Biol. Neoplasia, 7, 109-121.
- Paape M.J., Bannerman D.D., Zhao X., Lee J.W., 2003. The bovine neutrophil: Structure and function in blood and milk. Vet. Res., 34, 597-627.
- Paape M.J., Schultze W.D., Guidry A.J., Kortum W.M., Weinland B.T., 1981. Effect of an intramammary polyethylene device on the concentration of leukocytes and immunoglobulins in milk and on the leukocyte response to Escherichia coli endotoxin and challenge exposure with Staphylococcus aureus. Am. J. Vet. Res., 42, 774-783.
- Peeler E.J., Green M.J., Fitzpatrick J.L., Green L.E., 2002. Study of clinical mastitis in British dairy herds with bulk milk somatic cell counts less than 150,000 cells/ml. Vet. Rec., 151, 170-176.
- Philipsson J., Ral G., Berglund B., 1995. Somatic cell count as a selection criterion for mastitis resistance in dairy cattle. Livest. Prod.Sci., 41, 195-200.
- Postle D.S., Roguinsky M., Poutrel B., 1978. Induced staphylococcal infections in the bovine mammary gland. Am. J. Vet. Res., 39, 29-35.
- Poutrel B., Lerondelle C., 1980. Protective effect in the lactating bovine mammary gland induced by coagulase negative staphylococci against experimental Staphylococcus aureus infections. Ann. Rech. Vet., 11, 327-332.
- Poutrel B., Paape M.J., Lerondelle C., Grappin R., 1983. Essais de prévention de la mammite expérimentale à Staphylococcus aureus par immunisation et insertion intamammaire d'une boucle de polyéthylène (stérilait). [Attempts at preventing experimental Staphylococcus aureus mastitis by immunization and intramammary insertion of a polyethylene device (Sterilait)]. Ann. Rech. Vét., 14, 13-20.
- Rainard P., 1987. Faut-il éliminer les infections mammaires par Corynebacterium bovis et les staphylocoques coagulase-négative ? [Should mammary infections caused by Corynebacterium bovis and coagulase-negative staphylococci be eliminated?]. Ann. Rech. Vét., 18, 355-364.
- Rainard P., Poutrel B., 1982. Dynamics of nonclinical bovine intramammary infections with major and minor pathogens. Am. J. Vet. Res. 43, 2143-2146.
- Rainard P., Poutrel B., 1988. Effect of naturally occurring intramammary infections by minor pathogens on new infections by major pathogens in cattle. Am. J. Vet. Res., 49, 327-329.
- Rainard P., Riollet C., 2003. Mobilization of neutrophils and defense of the bovine mammary gland. Reprod. Nutr. Dev., 43, 439-457.
- Rainard P., Riollet C., Berthon P., Cunha P., Fromageau A., Rossignol C., Gilbert F.B., 2008. The chemokine CXCL3 is responsible for the constitutive chemotactic activity of bovine milk for neutrophils. Mol. Immunol., 45, 4020-4027.
- Rainard P., Cunha P., Bougarn S., Fromageau A., Rossignol C., Gilbert B.F., Berthon P., 2013. T helper 17-associated cytokines are produced during antigen-specific inflammation in the mammary gland. PLoS ONE, 8(5): e63471, https://doi.org/10.1371/journal.pone.0063471.
- Rainard P., Foucras G., Boichard D., Rupp R., 2018a. Invited review: Low milk somatic cell count and susceptibility to mastitis. J. Dairy Sci., 101, 6703-6714.
- Rainard P., Gitton C., Chaumeil T., Fassier T., Huau C., Riou M., Tosser-Klopp G., Krupova Z., Chaize A., Gilbert F.B., Rupp R., Martin P., 2018b. Host factors determine the evolution of infection with Staphylococcus aureus to gangrenous mastitis in goats. Vet. Res., 49, 72.
- Riollet C., Rainard P., Poutrel B., 2000. Cells and cytokines in inflammatory secretions of bovine mammary gland. Adv. Exp. Med. Biol., 480, 247-258.
- Rupp R., Boichard D., 1999. Genetic parameters for clinical mastitis, somatic cell score, production, udder type traits, and milking ease in first lactation Holsteins. J. Dairy Sci., 82, 2198-2204.
- Rupp R., Boichard D., 2000. Relationship of early first lactation somatic cell count with risk of subsequent first clinical mastitis. Livestock Prod. Sci., 62, 169-180.
- Rupp R., Beaudeau F., Boichard D., 2000. Relationship between milk somatic-cell counts in the first lactation and clinical mastitis occurrence in the second lactation of French Holstein cows. Prev. Vet. Med., 46, 99-111.
- Rupp R., Bergonier D., Dion S., Hygonenq M.C., Aurel M.R., Robert-Granie C., Foucras G., 2009. Response to somatic cell count-based selection for mastitis resistance in a divergent selection experiment in sheep. J. Dairy Sci., 92, 1203-1219.
- Rupp R., Huau C., Caillat H., Fassier T., Bouvier F., Pampouille E., Clément V., Palhière I., Larroque H., Tosser-Klopp G., Jacquiet P., Rainard P., 2019. "Divergent selection on milk SCC in goats improves udder health and milk quality with no impact on parasite resistance." J. Dairy Sci., accepté pour publication, https://doi.org/10.3168/jds.2018-15664.
- Sandgren C.H., Nordling K., Bjork I., 1991. Isolation and phagocytic properties of neutrophils and other phagocytes from nonmastitic bovine milk. J. Dairy Sci., 74, 2965-2975.
- Sarikaya H., Schlamberger G., Meyer H.H., Bruckmaier R.M., 2006. Leukocyte populations and mRNA expression of inflammatory factors in quarter milk fractions at different somatic cell score levels in dairy cows. J. Dairy Sci., 89, 2479-2486.
- Schalm O.W., Lasmanis J., 1968. The leukocytes: origin and function in mastitis. J. Am. Vet. Med. Assoc., 153, 1688-1694.
- Schukken Y.H., Bennett G., Green L., Van Werven T., 2001. Can somatic cell count get too low? In: 40th annual meeting. National Mastitis Council, 19-28.
- Shafer-Weaver K.A., Sordillo L.M., 1997. Bovine CD8+ suppressor lymphocytes alter immune responsiveness during the postpartum period. Vet. Immunol. Immunopathol., 56, 53-64.
- Strandberg Y., Gray C., Vuocolo T., Donaldson L., Broadway M., Tellam R., 2005. Lipopolysaccharide and lipoteichoic acid induce different innate immune responses in bovine mammary epithelial cells. Cytokine, 31, 72-86.
- Suriyasathaporn W., Schukken Y.H., Nielen M., Brand A., 2000. Low somatic cell count: a risk factor for subsequent clinical mastitis in a dairy herd. J. Dairy Sci., 83, 1248-1255.
- Tadich N.A., Carey A., Porter R., Ridley J., Green M.J., Green L.E., 1998. Case control study of risk factors for toxic mastitis in 26 dairy herds. Vet. Rec., 143, 362-365.
- Taylor B.C., Dellinger J.D., Cullor J.S., Stott J.L., 1994. Bovine milk lymphocytes display the phenotype of memory T cells and are predominantly CD8+. Cell. Immunol., 156, 245-253.
- Timms L.L., 1990. Can somatic cell counts get too low? In: 29th Ann. Meet., NMC. Natinal Mastitis Council, Louisville, Kentucky, USA, 94-101.
- Toufeer M., Bonnefont C.M., Foulon E., Caubet C., Tasca C., Aurel M.R., Robert-Granie C., Rupp R., Foucras G., 2011. Gene expression profiling of dendritic cells reveals important mechanisms associated with predisposition to Staphylococcus infections. PLoS ONE, 6, e22147.
- van den Borne B.H., Vernooij J.C., Lupindu A.M., van Schaik G., Frankena K., Lam T.J., Nielen M., 2011. Relationship between somatic cell count status and subsequent clinical mastitis in Dutch dairy cows. Prev. Vet. Med., 102, 265-273.
- Wellnitz O., Baumert A., Saudenowa M., Bruckmaier R.M., 2010. Immune response of bovine milk somatic cells to endotoxin in healthy quarters with normal and very low cell counts. J. Dairy Res., 77, 452-459.
- Whist A.C., Osteras O., 2007. Associations between somatic cell counts at calving or prior to drying-off and clinical mastitis in the remaining or subsequent lactation. J. Dairy Res., 74, 66-73.
- RAINARD P., FOUCRAS G., BOICHARD D., RUPP R., 2018. Faibles concentrations cellulaires du lait et sensibilité aux mammites des ruminants laitiers. INRA Prod. Anim., 30,
Résumé
La concentration en cellules du lait (CCS) est un indicateur indirect d’une infection mammaire très utilisé en épidémiologie, mais aussi un prédicteur de la sensibilité aux infections mammaires utile pour la sélection génétique d’animaux plus résistants aux mammites. En raison du rôle de protection immunitaire attribué aux cellules du lait, des réserves sont émises à l’encontre de la sélection d’animaux dont le lait serait pauvre en cellules, ce qui entrainerait une sensibilité accrue aux mammites. Des enquêtes épidémiologiques apparemment contradictoires n’ont pas permis de lever ces réticences. Cependant, une analyse critique des connaissances sur l’immunité mammaire et des études récentes réalisées sur des animaux issus d’une sélection divergente sur les valeurs génétiques du caractère « Cellules » permettent de répondre à la question « Faut-il éviter de sélectionner des animaux laitiers dont les CCS sont très faibles ? ». Il apparait clairement qu’en l’absence d’infection, les valeurs de CCS sont physiologiquement très faibles et ne sont pas modifiées par la sélection, qui ne réduit pas non plus la capacité de la mamelle à se défendre contre les infections.
Pièces jointes
Pas de document complémentaire pour cet article##plugins.generic.statArticle.title##
 Vues: 5108
Vues: 5108
Téléchargements
 PDF: 679
PDF: 679
 XML: 198
XML: 198
Articles les plus lus par le même auteur ou la même autrice
- Alain DUCOS, Frédéric DOUHARD, Davi SAVIETTO, Marion SAUTIER, Valérie FILLON, Mélanie GUNIA, Rachel RUPP, Carole MORENO-ROMIEUX, Sandrine MIGNON-GRASTEAU, Hélène GILBERT, Laurence FORTUN-LAMOTHE, Contributions de la génétique animale à la transition agroécologique des systèmes d’élevage , INRAE Productions Animales: Vol. 34 No 2 (2021)
- Charlotte DEZETTER, Didier BOICHARD, Nathalie BAREILLE, Bénédicte GRIMARD, Pascale LE MEZEC, Vincent DUCROCQ, Le croisement entre races bovines laitières : intérêts et limites pour des ateliers en race pure Prim’Holstein ? , INRAE Productions Animales: Vol. 32 No 3 (2019)
- Didier BOICHARD, Sandra DOMINIQUE, Marie BÉRODIER, Sébastien FRITZ, Luc DELABY, Corentin FOUÉRÉ, Mekki BOUSSAHA, Anne BARBAT, Utilisation de la semence sexée en production bovine , INRAE Productions Animales: Vol. 37 No 4 (2024)
- Christian DUCROT, Maria Belén BARRIO, Alain BOISSY, François CHARRIER, Sergine EVEN, Pierre MORMÈDE, Sandrine PETIT, Marie-Hélène PINARD-VAN DER LAAN, François SCHELCHER, François CASABIANCA, Alain DUCOS, Gilles FOUCRAS, Raphaël GUATTEO, Jean-Louis PEYRAUD, Muriel VAYSSIER-TAUSSAT, Patrick VEYSSET, Nicolas C. FRIGGENS, Xavier FERNANDEZ, Améliorer conjointement la santé et le bien-être des animaux dans la transition des systèmes d’élevage vers la durabilité , INRAE Productions Animales: Vol. 37 No 3 (2024)
- Marie-Pierre SANCHEZ, Valérie WOLF, Cécile LAITHIER, Mohammed EL JABRI, Éric BEUVIER, Odile ROLET-RÉPÉCAUD, Nicolas GAUDILLIÈRE, Stéphanie MINÉRY, Yuliaxis RAMAYO-CALDAS, Thierry TRIBOUT, Alexis MICHENET, Mekki BOUSSAHA, Sébastien TAUSSAT, Sébastien FRITZ, Agnès DELACROIX-BUCHET, Philippe GROSPERRIN, Mickaël BROCHARD, Didier BOICHARD, Analyse génétique de la « fromageabilité » du lait de vache prédite par spectrométrie dans le moyen infrarouge en race Montbéliarde , INRAE Productions Animales: Vol. 32 No 3 (2019)
- Laurianne CANARIO, Nicolas BÉDÈRE, Marc VANDEPUTTE, Didier BOICHARD, Jérôme RAOUL, Catherine LARZUL, Quelles génétiques pour les systèmes d’élevages certifiés en agriculture biologique ? , INRAE Productions Animales: Vol. 37 No 2 (2024): Numéro spécial : L’élevage biologique : conditions et potentiel de développement
- Didier BOICHARD , C. GROHS, C. DANCHIN-BURGE, A. CAPITAN, Les anomalies génétiques : définition, origine, transmission et évolution, mode d'action , INRAE Productions Animales: Vol. 29 No 5 (2016)
- Florence GONDRET, Donato ANDUEZA, Mohamed Habibou ASSOUMA, Valérie BERTHELOT, Didier BOICHARD, Maguy EUGÈNE, Solène FRESCO, Amandine LURETTE, Cécile MARTIN, Pauline MARTIN, Diego P. MORGAVI, Rafael MUÑOZ-TAMAYO, Milka POPOVA, Simon ROQUES, Flavie TORTEREAU, Xavier FERNANDEZ, Réduction des émissions de méthane entérique chez les ruminants : enjeux, solutions et perspectives à l’échelle de l’animal et des systèmes d’élevage , INRAE Productions Animales: En avant-première

