La morsure de queue chez le porc : de la mesure aux solutions génétiques pour limiter le phénomène
Améliorer le bien-être des porcs en élevage nécessite de réduire les comportements sociaux délétères dont font partie les morsures de queue. Une caractérisation fine des comportements et des conditions environnementales, et une meilleure compréhension des facteurs biologiques sous-jacents, ainsi que des effets directs et indirects permettra d’utiliser l’amélioration génétique comme levier d’action efficace pour réduire l’incidence de la caudophagie et contribuer à l’abandon de la caudectomie
Introduction
Les porcs sont des animaux intelligents et très sociaux, ils interagissent fréquemment avec leurs congénères. Le comportement d’un porc au sein d’un groupe est façonné par la nature de ces interactions sociales au fil du temps. Certaines sont des interactions positives, aussi dites affiliatives, qui parfois relèvent d’associations préférentielles entre des membres du groupe. D’autres interactions sont négatives et peuvent avoir lieu dans des situations de compétition. Certaines interactions contribuent à stabiliser le groupe. Des porcs vont jusqu’à synchroniser leurs activités. La dynamique du groupe dépend de sa structure (ex. taille de groupe) et des individualités qui le composent (ex. personnalité de chaque porc). Chaque jour, pendant sa période d’activité, un porc passe plus d’un quart de son temps à explorer son environnement, y compris ses congénères. Le comportement normal qui consiste à mordiller doucement la queue des autres porcs, peut se transformer en morsure de queue plus ou moins sévère (figure 1) (Schrøder-Petersen et al., 2003). Tous les individus prédisposés à mordre la queue ou à être mordus ne réalisent pas forcément ce comportement au cours de leur vie. Cela dépend des situations auxquelles ils sont confrontés.

Figure 1. Illustration d’une séquence de préhension de la queue d’un congénère observée en élevage biologique INRAE (photos : © L. Canario).
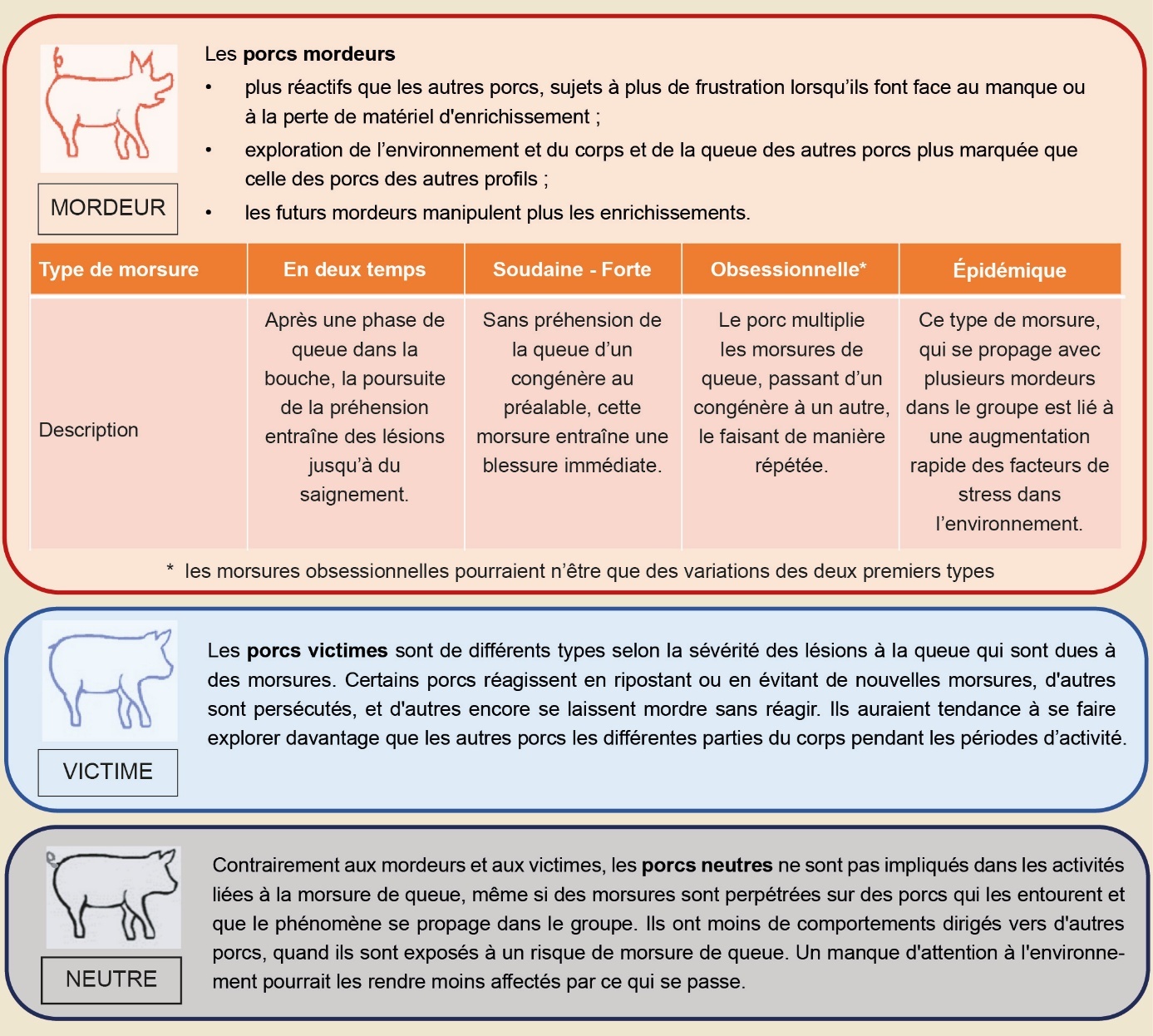
La caudophagie correspond en général à la redirection du comportement d’exploration vers les congénères si les ressources alimentaires tendent à être limitées et si les matériaux d’exploration ne sont pas fournis ou en quantité insuffisante (Prunier et al., 2020a). La sévérité des morsures peut être qualifiée selon une grille de notation telle que celle proposée par l’IFIP (2016). Certaines morsures de queue peuvent être accidentelles contrairement à d’autres qui sont parfois sévères et répétées surtout si la victime ne réagit pas. En fonction de leurs comportements, les porcs peuvent donc être qualifiés de victimes, mordeurs occasionnels ou obsessionnels, à la fois victimes et mordeurs, ou encore neutres lorsqu’ils ne sont pas impliqués dans les actes de caudophagie (encadré 1) (Taylor et al., 2010).
L’ampleur du phénomène de morsure de queue est mal connue en France car le phénomène est insuffisamment quantifié (Courboulay & Drouet, 2018). Entre 30 et 70 % des élevages européens seraient concernés (EFSA, 2007). La prévalence de porcs sévèrement affectés par des blessures est très variable entre les élevages (1 à 5 % en moyenne selon les études), sachant que cette prévalence est probablement sous-estimée faute de contrôle systématique.
La solution généralisée pour éviter la caudophagie est la coupe de queue des porcelets peu après la naissance. C’est une mesure préventive qui permet de réduire le risque de morsure de queue mais c’est un acte douloureux et qui est loin d’être totalement efficace (Prunier et al., 2020b). Depuis 1991, les textes réglementaires européens et nationaux précisent qu’avant de pratiquer une caudectomie, tous les moyens doivent avoir été mis en œuvre pour prévenir la caudophagie. Les améliorations environnementales préconisées concernent l’apport de matériaux d’enrichissement optimaux, une luminosité suffisante, ainsi que l’amélioration du confort thermique, de la propreté des cases, de la qualité de l’air, de l’état de santé des porcs et de leur alimentation, et d’une façon générale la réduction des sources potentielles de stress (Commission européenne, 2017). En France, malgré la législation, l’information dont on dispose est qu’en 2018, 95 % des porcs avaient encore une queue coupée (De Briyne et al., 2018).
Le problème de caudophagie est difficilement résolu par des modifications de l’environnement, à moins qu’elles ne soient drastiques (CNR BEA, 2024). Cependant, même en systèmes certifiés en agriculture biologique, donc sans coupe de queue, des études à l’étranger ont fait état de 14 à 20 % de prévalence de morsures de queue (Walker & Bilkei, 2006). Force est de constater que la sélection phénotypique menée par les éleveurs, qui consiste à isoler ou réformer précocement les agresseurs et les victimes ne fonctionne pas. De plus, en réponse au retrait d’animaux, chaque porc évolue dans ses relations aux autres et agit par rapport au comportement de ceux encore présents dans le groupe. Il est donc primordial de prendre en compte le comportement de chaque porc au sein du groupe qui dépend à la fois de ses gènes, (on parle de prédisposition) et de facteurs non génétiques (ex. l’imitation qui favorise la propagation au sein du groupe). D’Eath et al. (2014) soulignent que les épisodes commencent souvent par des changements dans l’environnement mais ce n’est pas systématique. Dans ce cas, le déclenchement du phénomène pourrait dépendre d’un changement du seuil de réponse d’un animal ou de fluctuations dans sa réponse au stress, d’où l'importance d'aborder le problème des morsures de queue du point de vue de chaque individu. La réponse du porc à une situation dépend de sa prédisposition ainsi que de son état interne et de sa perception de l’environnement à un moment donné. Il existe des différences de comportement entre les porcs des trois profils (Brunberg et al., 2011, 2013a ; Zupan et al., 2012). Cela suggère que des caractéristiques intrinsèques influencent la capacité des porcs à relever les défis environnementaux. Nous savons que de nombreux comportements des porcs sont reproductibles et héritables (Rydhmer & Canario, 2022) et qu’ils sont modifiés par l'expérience (Gieling et al., 2011). Cette modulation des comportements affecte le porc dans sa manière d’interagir avec ses congénères.
S’appuyer sur la sélection génétique peut être un levier d’action pour réduire la prévalence de ce phénomène. Dans cette synthèse, nous introduisons la notion d’effets génétiques indirects qui définissent pour partie la prédisposition d'un animal à mordre ou à se faire mordre la queue. Les effets indirects font référence à l’influence d’un porc sur les comportements des autres porcs avec lesquels il est logé. L’hypothèse est donc que la capacité à influencer les autres socialement est elle-même héritée, et donc le génotype d’un porc affecte les caractères des autres porcs (Moore et al., 1997). Nous décrivons l’état des connaissances sur l’importance des facteurs génétiques qui prédisposent certains porcs à devenir victime, mordeur, victime et mordeur ou à rester neutre. Nous expliquons quels travaux supplémentaires sont nécessaires pour améliorer nos connaissances sur les différents comportements de morsures de queue.
1. Facteurs associés aux différents profils
1.1. La croissance
Il est de plus en plus reconnu que la croissance des animaux joue un rôle clé dans le comportement de morsure de queue, mais les résultats des études ne font pas consensus. Selon certaines études, les victimes de morsure ont une croissance plus rapide (Van de Weerd et al., 2005 ; Hakansson & Houe, 2020 ; Valros et al., 2021) mais l’inverse a également été observé (Camerlink et al., 2012 ; Sinisalo et al., 2012). Ces divergences peuvent venir du fait que les porcs à croissance rapide qui sont sévèrement mordus peuvent, par la suite, avoir une croissance ralentie (Boyle et al., 2022). À un âge plus tardif, Canario et Flatres-Grall (2019) n’ont observé aucune différence de croissance entre les truies mordues et les truies non mordues. Toutefois, les truies mordues étaient plus maigres que les autres, comme précédemment rapporté par Breuer et al. (2005).
Les mordeurs sont les plus légers du groupe en post-sevrage (Sambraus, 1985 ; Zonderland et al., 2011 ; Czycholl et al., 2023) et à l’entrée en engraissement (Van de Weerd et al., 2005). Le poids inférieur des mordeurs peut s’expliquer par une plus grande dépense d’énergie ou par un moins bon état de santé (Valros & Heinonen, 2015 ; Czycholl et al., 2023). Deux autres études montrent que les mordeurs ont une meilleure croissance (Ursinus et al., 2014b ; Valros et al., 2021) et suggèrent que les porcs à croissance rapide ont un comportement alimentaire non assouvi. Ces différences entre mordeurs et non-mordeurs relèvent peut-être d’un défaut de croissance qui surviendrait près du moment où s’exprime le comportement (Van de Weerd et al., 2005). Les disparités de relation qui ont été établies entre études peuvent sans doute s’expliquer par des facteurs déterminants mais non identifiés qui seraient différents entre les populations. De plus, d’une étude à l’autre, les types de morsures de queue analysés pouvaient être différents.
1.2. Les comportements associés
En lien avec la frustration de ne pas satisfaire leurs besoins comportementaux, on observe parfois que des porcs réorientent l’exploration de l’environnement physique vers celle de leurs congénères (Fraser, 1987 ; Taylor et al., 2010). Toutefois, Ursinus et al. (2014a) n’ont pas constaté de changement dans la fréquence du comportement exploratoire avant des événements de morsure de queue, que ce soit chez les victimes ou les mordeurs. En comparant des porcs dans des groupes sans mordeurs à des porcs neutres dans des groupes avec des épisodes de morsures, Brunberg et al., 2013a, 2013b) ont souligné que les porcs neutres expriment moins de comportements dirigés vers d’autres porcs.
Le lien entre comportement alimentaire et morsure de queue est aussi mal connu mais la plupart des études tendent à montrer que des changements de comportement alimentaire peuvent servir à prédire des épisodes de morsure de queue. Les porcs victimes de morsure ont un nombre de visites à l’automate d’alimentation d’abord élevé mais qui diminue fortement en cas d’épisode alors que le comportement alimentaire des porcs neutres ou mordeurs ne change pas (Wallenbeck & Keeling, 2013).
1.3. La sensibilité au stress
Les mordeurs comme les victimes peuvent ne pas s'adapter à leur environnement s’ils le perçoivent comme trop pauvre ou peu sécurisant. L’image souvent utilisée pour illustrer la réponse d’un individu aux stress environnementaux est celle d’un verre en équilibre qui se remplit et finit par se renverser (Bracke et al., 2018). La réponse individuelle se caractériserait par un verre plus ou moins petit ou qui se remplit plus ou moins rapidement. Jensen et al. (2004) ont souligné que les animaux plus vulnérables au stress sont plus susceptibles de développer des comportements sociaux délétères. Ursinus et al. (2014c) ont constaté que les mordeurs semblent plus craintifs face à la nouveauté. Au contraire, dans une autre étude, les mordeurs ont été décrits comme plus explorateurs, plus audacieux et en quête de nouveauté (Zupan et al., 2012). Chou et al. (2023) ont montré que la liaison entre le style d’adaptation, au sens de type de réaction en situation de défi, et la classification mordeur, neutre et victime est sans doute complexe car elle diffère si les tests de réactivité sont effectués au moment ou en dehors des épisodes de morsure. Dans leur étude, les mordeurs étaient plus explorateurs que les autres, mais la différence disparaissait lorsque l’épisode de morsure était passé.
1.4. Le microbiote
Ces dernières années, la recherche sur le microbiote, en particulier dans l'intestin, a suscité un intérêt croissant car le microbiote intestinal peut interagir avec la physiologie de l'animal et avoir un impact sur sa santé et son bien-être (Kraimi et al., 2019). Le microbiote intestinal pourrait jouer un rôle important dans le développement de comportements délétères chez les porcs (Brunberg et al., 2016). En particulier, il existe des différences dans la composition du microbiote intestinal entre les mordeurs et les victimes d’une part, et les porcs neutres d’autre part, avec une abondance relative de Lactobacillus (Rabhi et al., 2020) ou de Prevotella_7 (Verbeek et al., 2021) plus importante chez les porcs neutres. Les porcs neutres ont également tendance à montrer des abondances relatives plus faibles de Butyrivibrio et Familiy_XIII_AD3011 par rapport aux mordeurs et aux victimes. Au-delà de ces constats, l’impact direct ou indirect du microbiote intestinal sur l’apparition des morsures de queue, ou le profil mordeur/victime/neutre des porcs, reste à préciser. Par exemple, les acides gras à chaîne courte produits par les processus de fermentation, surtout le butyrate, influencent la santé et la sensibilité au stress des animaux (Kobek-Kjeldager et al., 2022), mais jusqu’à présent le rôle de ces acides gras dans la caudophagie n’a pas été spécifiquement démontré (Verbeek et al., 2021).
1.5. La génétique et les effets de l’expérience
a. Effets génétiques directs et lien avec les caractères de production
Le rôle de la génétique a été évalué dans quelques études. Des différences entre races dans la tendance à mordre la queue ont parfois été signalées sans qu’il soit possible de conclure quels sont les types génétiques les plus à risque. La race ou le croisement qui présente de la caudophagie varie d’une étude à l’autre (Breuer et al., 2003 ; Sinisalo et al., 2012). Parfois aucun effet du type génétique n’est détecté (Lund & Simonsen, 2000 ; Guy et al., 2002). Peu d’études expérimentales ayant été menées à ce jour, on ne peut pas rejeter totalement l’hypothèse d’un effet de la race sur la morsure de queue. Breuer et al. (2005) ont constaté que le comportement de mordre la queue était faiblement héritable dans la race Landrace (h² = 0,27) et pas héritable dans une population Large White (h² = 0). La présence de lésions à la queue par morsures est quant à lui modérément héritable (h² = 0,16) selon Gorssen et al. (2024) qui ont étudié des porcs croisés et selon Aikins-Wilson et al. (2021) qui utilisaient des mesures répétées et divers croisements (h² = 0,23). Bien que ce ne soit pas explicité dans la plupart de ces articles, il est raisonnable de supposer que ces estimations ont été obtenues pour des animaux ayant subi une caudectomie.
Les différences dans l’élaboration des schémas de sélection peuvent expliquer pourquoi la morsure de queue varie en fonction de la teneur en gras et/ou de la vitesse de croissance entre lignées sélectionnées. Plusieurs études soulignent que mordre la queue et d’autres comportements délétères sont défavorablement corrélés à la teneur en gras au niveau génétique (Breuer et al., 2005 ; Sinisalo et al., 2012 ; Brunberg et al., 2013a ; Canario & Flatres-Grall, 2019). Cependant, rien ne prouve clairement que mordre la queue des congénères est plus fréquent dans les populations sélectionnées pour les performances de croissance que dans leurs homologues non sélectionnées (Lange et al., 2023).
b. Effets génétiques indirects
Chaque individu réagit aussi en réponse aux porcs qui l’entourent et il est lui-même capable d’influencer le comportement des autres porcs du groupe. Dans les études sur la présence de lésions à la queue par morsure, l’influence (y compris génétique) d’un porc sur le comportement de morsure de queue des autres porcs est appelée effet (génétique) indirect (figure 2). Canario et Flatres-Grall (2019) ont quantifié d’importants effets génétiques indirects chez des cochettes de la race Tai Zumu, victimes de morsure de queue. Les effets génétiques indirects contribuaient de 81 à 93 % de la variance héritable, représentant entre 40 et 80 % de la variation observable en élevage alors que les effets génétiques directs n’expliquaient que 6 % de cette variation.
Les effets génétiques indirects pour la croissance sont à l’heure actuelle bien mieux mesurés que ceux pour la morsure de queue. Ils font référence à l’influence de la génétique d’un porc sur la croissance des autres membres du groupe. Dans une expérience de sélection sur une seule génération, Camerlink et al. (2015) ont analysé les comportements de morsure dans des groupes composés de porcs ayant tous des effets génétiques indirects faibles ou tous des effets génétiques indirects élevés pour la croissance, et ceci dans deux environnements contrastés. Les porcs étaient soit logés en enclos conventionnels soit en enclos enrichis de paille et de copeaux de bois. Dans les enclos enrichis, les porcs avec des effets génétiques indirects plus élevés (c’est-à-dire prédisposés à favoriser la croissance de leurs congénères) présentaient des niveaux plus bas de comportements liés à de la morsure de queue. Les porcs avec des effets génétiques indirects plus faibles ont logiquement montré un niveau plus élevé de morsures de queue. Cependant, ces effets n’étaient pas retrouvés dans les enclos enrichis.
c. Effets de l’expérience précoce
Les porcelets qui partagent le même environnement au début de leur vie développent des compétences sociales communes qui génèrent des effets sociaux précoces. L’environnement intra-portée peut être le siège de difficultés dans les interactions avec d’autres porcs, ce qui peut induire du stress social qui conduit à de la morsure de queue à des stades ultérieurs (Prunier et al., 2020b ; figure 2). La dynamique d’interactions entre porcs, y compris le comportement de morsure de queue peut ainsi dépendre des expériences à des stades de vie précoce. Un cran encore plus tôt dans la vie, l’environnement prénatal peut lui aussi affecter le comportement social plus tard dans la vie (Prunier et al., 2020b), hypothétiquement par des effets neurologiques qui rendraient des porcs plus sensibles et plus susceptibles de développer de la morsure de queue (Reimert & Ursinus, 2024).
Sa compétence sociale à un stade donné découle de son expérience passée, notamment de début de vie et de son génotype. La typologie mordeur-victime-neutre est influencée par les effets précoces et génétiques, le conduisant à mordre (rouge et violet), à être mordu (bleu et violet) ou à ne faire ni l’un ni l’autre (gris et orange). La légende et la description des différents profils sont précisées dans l’encadré 1. 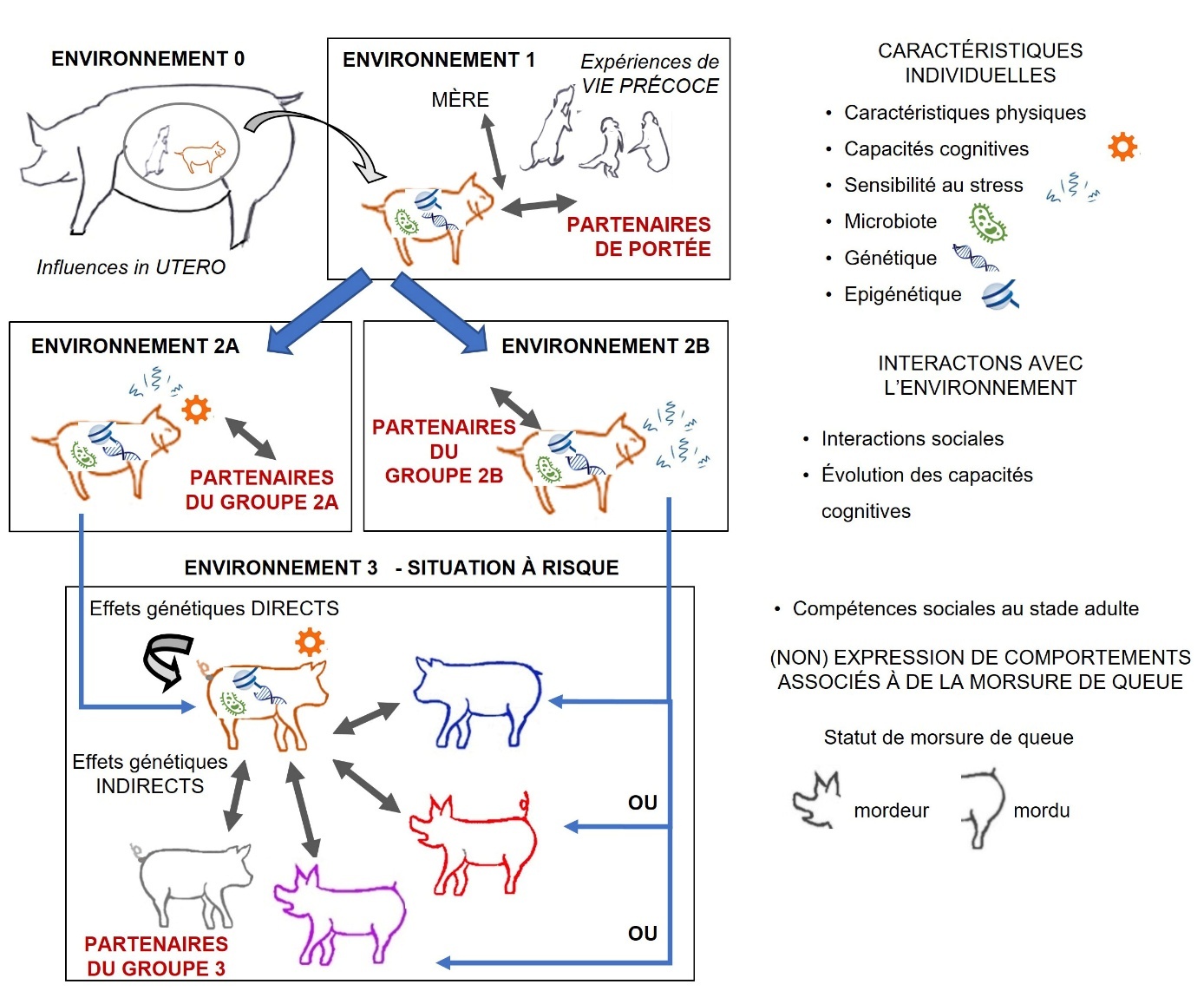
Figure 2. Représentation des effets intrinsèques, environnementaux et des effets génétiques indirects d’un porc sur le comportement des autres porcs qu’il côtoie au stade adulte, en lien avec la morsure de queue.
2. Mieux connaître les profils des porcs
2.1. Enregistrement des mesures clé
Le suivi individuel des comportements de morsure de queue, ou de comportements associés, est le facteur clé pour progresser dans la compréhension des mécanismes impliqués. Idéalement, il faudrait travailler dans des élevages où les porcelets ne subissent pas la coupe de queue. Actuellement, les données individuelles sont récoltées soit sur un intervalle de temps court en élevage, soit à l’abattoir et essentiellement sur des porcs ayant subi la caudectomie (Svoboda et al., 2023), en comptabilisant les lésions à la queue. Cette démarche ne donne qu’une vision parcellaire et ne permet pas d’identifier les victimes dont les lésions sont cicatrisées, ni les mordeurs quel que soit leur type. Les comportements associés aux morsures de queue peuvent être liés à l'expérience passée de l’individu au sein des différents groupes auxquels il a appartenu. Il est donc essentiel de générer des enregistrements individuels de façon longitudinale, à différents stades de la vie de l’animal. En outre, les paramètres de l’environnement doivent être enregistrés régulièrement.
L'enregistrement du comportement de chaque individu dans un groupe est compliqué si le comportement est peu fréquent et de courte durée, en particulier lorsque de nombreux porcs peuvent interagir les uns avec les autres. Les capacités d’observation visuelle par l’humain sont évidemment limitées, et l'enregistrement ponctuel du comportement et des mesures indirectes pertinentes telles que les dommages à la queue prennent du temps, d’autant plus que les lésions doivent être finement caractérisées pour établir si elles relèvent de morsure ou pas, notamment lorsqu’elles sont légères. En effet, la prévalence des morsures graves de la queue peut être faible, de l'ordre de 2 à 3 %, alors que celle des morsures légères peut atteindre jusqu’à 72 % (Svoboda et al., 2023).
Les développements technologiques en analyse d’image par des méthodes d’intelligence artificielle pour permettre un suivi automatique de l’activité des porcs de façon individuelle progressent rapidement. L'enregistrement automatisé pour un suivi simultané des individus et l’identification des interactions sociales qui irait jusqu’à détecter la préhension et les morsures par paire d’individus serait un progrès crucial pour enregistrer les morsures de queue (Liu et al., 2020). Les projets qui étudient le potentiel de la détection automatisée de l’activité des porcs et des morsures de queue utilisent l’analyse vidéo 2D pour établir la proximité spatiale entre les individus (Liu et al., 2020) et l’analyse 3D pour observer la posture et les mouvements de queue (D’Eath et al., 2021). Pour l'instant, l’analyse vidéo ne parvient pas à détecter les comportements subtils de préhension et de morsure de queue. Une autre voie pour détecter les animaux mordeurs est l’analyse des cris (Heseker et al., 2024). Pour la sélection génétique, l’identification du mordeur présente un intérêt considérable. L’étude du comportement social anormal à un stade spécifique de la vie, avec de multiples enregistrements obtenus avant et après l’événement, permettra d’améliorer la classification des porcs en différentes catégories, par exemple, mordeur ponctuel ou mordeur « persistant » (Taylor et al., 2010). Enfin, des observations multiples d’un individu nous permettraient d’étudier les changements d’état de manière dynamique – par exemple caractériser la transition entre le moment où un porc n’a pas de morsure et le moment où il en a (Ursinus et al., 2014a).
Pour permettre une sélection sur des caractères de comportement, il est impératif d’associer précisément les enregistrements comportementaux à l’identité de chaque individu, ce qui reste un véritable défi pour les mesures de comportement enregistrées et analysées de manière automatique. S’il est résolu, nous serons en mesure d’obtenir de grandes quantités de données comportementales, de définir des phénotypes intégratifs donc plus informatifs (par exemple, la position centrale d’un porc dans un réseau plutôt que la simple somme de ses interactions par paires) et de tenir compte des effets directs et indirects. La combinaison de méthodes, telles que l’identification par radiofréquence à la mangeoire et le suivi de l’identité par vidéo, peut améliorer la faisabilité et la précision de l’identification individuelle dans le suivi des trajectoires de l’animal dans son environnement physique et social. À titre d’exemple simple, pour identifier les mordeurs, le comportement sera la seule information, pour les victimes, on pourra se référer au comportement de fuite ou utiliser les lésions par morsure à la queue comme proxy.
2.2. Utilisation des mesures pour analyser le phénomène et définir des caractères à utiliser en sélection génétique
a. Mieux quantifier l’effet de la génétique de l’individu
Pour une estimation précise de l’influence des gènes sur le comportement de chaque individu, il est important de tenir compte des principales sources de variation pour ces comportements, des interactions possibles avec l’environnement, et d’utiliser des modèles d’analyse optimisés. Il a été démontré que les modèles qui intègrent à la fois des effets génétiques directs et des effets génétiques indirects capturent mieux et avec plus de précision la variation observée sur ces caractères qui relève de la génétique de l’animal (Ellen et al., 2014 ; Canario et al., 2017).
Il est donc essentiel d'avoir l’information de la composition du groupe. Si un animal (par exemple, un porc blessé) est retiré de la case, il faut l’enregistrer avec la date. L’utilisation de boucles électroniques pour suivre les animaux lorsqu’ils sont déplacés d’un enclos et/ou d’un bâtiment à l’autre peut faciliter l’enregistrement des changements de groupe. Chaque enclos possède un microenvironnement spécifique (p. ex. ventilation, température) qui peut contribuer à un comportement social délétère. L’identification de l’enclos aidera à distinguer les effets causés par les congénères de ceux causés par l’environnement physique. L’environnement social peut aussi jouer un rôle majeur dans l’expression de ce type de caractère. Nielsen et al. (2018) en estimant la corrélation génétique entre les effets directs et les effets indirects pour la croissance, ont mis en évidence de la compétition entre les femelles mais pas entre les mâles. Les caractéristiques de chaque individu telles que la croissance doivent être enregistrées si l’on veut contextualiser et analyser correctement ces comportements. Les porcelets élevés dans la même portée ont une expérience sociale commune pendant la phase d’allaitement qui peut influencer les comportements de leurs congénères jusqu’à la fin de l’engraissement (Canario et al., 2017). Il faut donc commencer le suivi des animaux dès la phase d’allaitement.
b. Repenser les dynamiques de groupe par l’analyse des réseaux sociaux
Une manière d’analyser les relations sociales des porcs au sein d’un groupe est l’analyse des réseaux sociaux (Canario et al., 2020). Cette méthode permet de préciser la position des individus dans un contexte social et quantifie les liens au sein du groupe en termes de centralité. Ce type d’analyse, comme illustré sur la figure 3, suppose que les individus sont interdépendants et que les interactions entre deux porcs dépendent des autres interactions au sein du groupe. Parmi les indices de centralité qui ont été proposés pour mesurer l’influence des individus au sein du groupe, ceux retenus sont la centralité de degré (nombre de contacts, qui peuvent être distingués entre « entrant » et « sortant » dans un réseau orienté), la centralité d’intermédiarité (nombre de plus courts chemins entre deux individus qui passent par l’individu focal) et la centralité de proximité (longueur moyenne des chemins entre deux individus). Le réseau peut également être décrit par des paramètres globaux comme la densité (le nombre de liens observés sur le nombre de liens possibles) et le diamètre (longueur du chemin le plus long observé entre l’ensemble des paires d’individus).
Le porc A est mordeur des porcs B, D, E ; C et D sont victimes de B, et B est aussi victime de C. Les valeurs des paramètres de centralité sont calculées pour chaque individu en fonction de sa position dans le réseau et des interactions qui existent avec ses congénères. Plus la proximité est élevée, plus l’individu est considéré comme influent et plus l’intermédiarité est élevée, plus l’individu est considéré comme propagateur (ici, de comportements).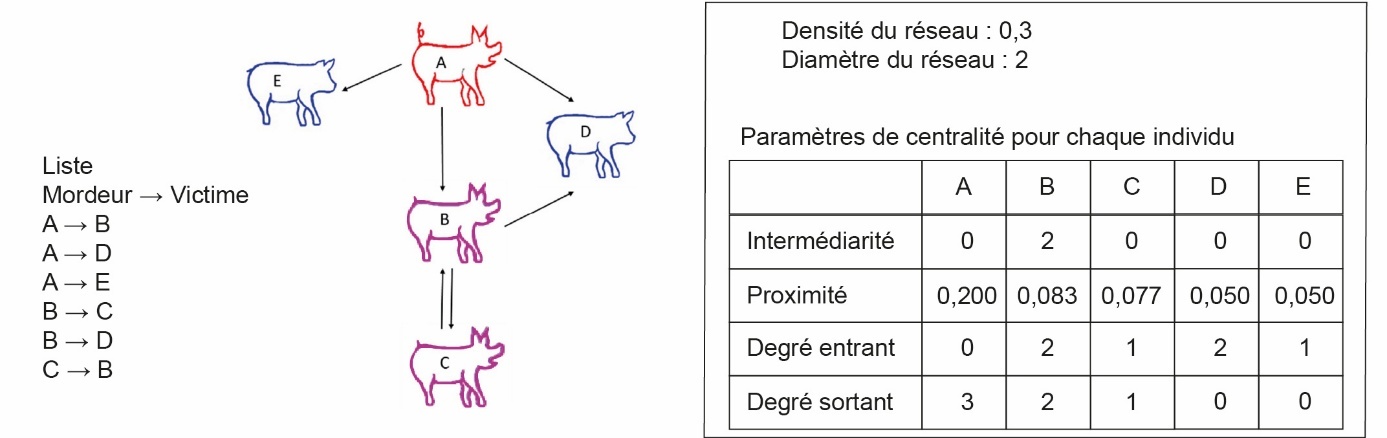
Figure 3. Représentation schématique de réseau social, sous forme de nœuds (les individus) et d’arêtes (les interactions) appliqué à l’analyse des morsures de queue, repris de Canario et al. (2020).
Cela semble être une méthode adéquate pour analyser la caudophagie chez les porcs (Kleinhappel et al., 2016). L’objectif principal serait de déterminer si les rôles de mordeurs ou victimes sont associés à la position (centrale, périphérique…) des individus dans le réseau et d’identifier les acteurs-clés au sein du groupe. Les réseaux sociaux permettent d’associer à chaque individu des coefficients de centralité qui peuvent ensuite être utilisés comme des caractères plus pertinents qu’une simple classification en mordeur/victime/neutre (Fisher & McAdam, 2017). Li et al. (2017) et St. Charles et al. (2024), en appliquant ce type d’analyse, ont mis en évidence que des animaux familialement plus proches avaient des comportements de morsure de queue plus fréquents entre eux, comparés à des individus familialement plus distants. La structure du groupe selon les origines familiales des porcs qui le constituent est donc un facteur important à prendre en compte. St. Charles et al. (2024) ont également observé que les individus avec un degré sortant plus élevé avaient des scores de sévérité de morsure de queue plus élevés. Au-delà de leur utilisation comme nouveaux caractères, les paramètres sociaux peuvent aussi être utilisés pour pondérer les effets génétiques indirects (Fisher & McAdam, 2017). Les informations requises pour positionner les porcs dans un réseau peuvent être obtenues via des observations du comportement des porcs par l’humain (Løvendahl et al., 2005). Cependant, dans le cas d’un comportement à basse fréquence comme les morsures de queue, cette méthode peut devenir fastidieuse et imprécise.
c. Modéliser le phénomène de propagation
D’autres méthodes statistiques pour modéliser les comportements peu fréquents et sporadiques, et prédire qui sont les victimes et les mordeurs ont été mises au point par Canario et al. (2020). Elles s’appuient sur le fait que la morsure de queue présente des similitudes avec la propagation d’une maladie infectieuse (Bracke et al., 2018 ; Valros, 2018), car le nombre de mordeurs augmente rapidement après qu’un animal ait commencé à mordre (figure 4). La vitesse de propagation varie selon le type de morsure (Reimert & Ursinus, 2024). Le fait qu’un individu se fasse mordre la queue est analogue au fait d’être contaminé, et la propension à mordre un autre porc est analogue à l’infectiosité. Comme les comportements évoluent au cours du temps, un modèle de contagion longitudinal inspiré des modèles épidémiologiques et d’analyses de survie pour suivre les changements d’états entre victime et mordeur dans le temps a été proposé (Canario et al., 2020). La combinaison de ce modèle longitudinal de contagiosité avec le modèle à effets génétiques indirects devrait permettre de mieux estimer les valeurs génétiques directes et indirectes associées à de la morsure de queue (Canario et al., 2020). Supposer qu’un animal a les mêmes effets génétiques indirects sur tous les autres porcs du groupe peut être erroné puisque le nombre de paires d’individus pouvant interagir augmente avec la taille du groupe. Selon la disponibilité des ressources, il peut être pertinent de traiter l’effet d’une taille de groupe variable en incluant un facteur de dilution dans le modèle génétique (Canario et al., 2017).
Avec : en rouge les mordeurs, en bleu les victimes, en violet les individus à la fois mordeurs et victimes et en gris, les porcs qui ne sont ni mordeurs ni victimes. De t1 à t2, l’individu 4, unique mordeur au départ, a mordu les individus 2, 7, 9, et possiblement, de nouveau, l’individu 5, déjà victime en t1, qui devient aussi mordeur à t3. En t3, l’individu 1 est devenu mordeur et l’individu 4, le mordeur initial, est lui aussi devenu victime. L’imitation peut jouer un rôle dans la propagation du phénomène.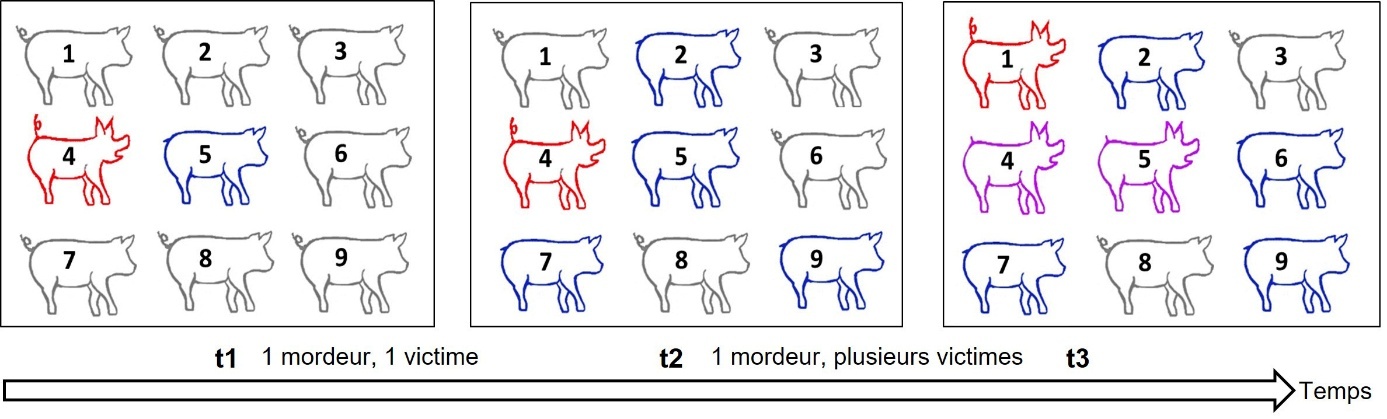
Figure 4. Illustration de la dynamique de propagation des comportements de morsure de queue au sein du groupe.
3. Perspectives de sélection pour limiter la caudophagie
3.1. Stratégies de sélection possibles
Résoudre le phénomène de caudophagie par la génétique consiste à conserver dans les populations les porcs qui ne mordent pas la queue des autres porcs et qui ne se laissent pas non plus faire. Il est nécessaire de travailler sur l’amélioration génétique des populations et de choisir des reproducteurs prédisposés à ne pas réaliser ou subir ces comportements délétères, pour réduire la fréquence des individus de type mordeur ou victime au sein des populations. Sur la base des connaissances actuelles, les héritabilités des comportements de mordeur ou de victime sont faibles. Par conséquent, une sélection qui tiendrait compte uniquement des effets génétiques directs sur les lésions à la queue, qu’elles soient observées en élevage ou à l’abattoir, n’offrirait qu’une amélioration limitée du comportement des animaux. Une alternative pourrait être la sélection directe sur d’autres caractères corrélés à de la morsure de queue, si possible déjà inclus dans les schémas d’amélioration. La difficulté ajoutée tient dans l’inclusion des effets indirects. Nielsen et al. (2023) ont montré qu’une sélection sur les effets génétiques indirects sur la croissance, qui tient compte de la prédisposition individuelle à influencer la croissance des autres porcs, diminue la fréquence et la sévérité des morsures. L’impact sur la réduction de comportements sociaux délétères serait donc réel. Une autre stratégie de sélection, éventuellement plus efficace, consisterait à cibler le caractère d’intérêt, avec la mesure des effets indirects sur les morsures. Faute d’enregistrement, aucune étude avec les effets génétiques indirects n’a été entreprise pour le moment pour analyser le comportement des mordeurs.
Engager une sélection sur les effets directs et indirects, qu’elle s’applique à de la performance ou du comportement, requiert un travail de compréhension des interactions entre effets directs et indirects. La covariance génétique entre les effets directs et les effets indirects est importante pour comprendre le fonctionnement des populations (Martin et al., 2019 ; Rydhmer & Canario, 2022). La corrélation est négative (défavorable) si les porcs sont en compétition pour des ressources limitées. Si la corrélation génétique est positive, il y a coopération. Des valeurs nulles de corrélation génétique entre effets directs et indirects ont été trouvées pour le statut de victime de morsure de queue (Canario & Flatres-Grall, 2019), ce qui se traduit par le fait que des cochettes prédisposées à se faire mordre la queue n’ont pas un effet génétique indirect plus élevé. La probabilité que d’autres cochettes du groupe se fassent mordre la queue ne devrait donc pas augmenter si une sélection directe contre les victimes est appliquée dans ce cas précis.
Des mesures sur des dizaines de milliers d’animaux sont nécessaires pour obtenir des estimations suffisamment précises. Wang et al. (2023) ont proposé des modèles pour évaluer des valeurs génétiques (directes) à partir d’informations temporelles en continu sur le comportement social et ont montré par simulation l’intérêt de ces modèles pour contre-sélectionner les comportements délétères. Pour explorer la réponse à la sélection, la corrélation génétique entre les statuts de mordeur et de victime devra aussi être estimée.
Se pose également la question des interactions entre génétique et environnement. Les premières études sur les porcs en engraissement n’ont montré aucune interaction entre le génotype et l’environnement pour les morsures de queue, qu’elles soient de nature obsessionnelle ou non (Hill et al., 1998 ; Guy et al., 2002). Cependant, dans l’analyse des morsures de queue (Canario & Flatres-Grall, 2019), la corrélation entre deux troupeaux (élevages) des classements des verrats fréquemment utilisés en fonction de leurs effets génétiques a indiqué un fort effet d’interaction génétique × environnement sur la présence de morsures à la queue. Il conviendrait de sélectionner la descendance des verrats qui présentent des effets génétiques stables et avantageux dans tous les environnements pour réduire la proportion de cochettes qui se laissent mordre la queue. Dans un environnement où la compétition entre porcs est élevée et où la corrélation génétique entre les effets directs et les effets indirects est négative, la raison d’utiliser un modèle avec effets génétiques indirects pour l’évaluation génétique est forte (Martin et al., 2019). Les limites de la sélection devront aussi être définies avec la caractérisation des porcs neutres, qui ont moins d’interactions dirigées vers les autres porcs en situation de caudophagie (Brunberg et al., 2013a). Il se pourrait que leur prédisposition les tienne à l’écart des interactions sociales associées à la morsure de queue (Brunberg et al., 2013b). L’estimation de valeurs génétiques pour la capacité à rester neutre devra être traitée en lien avec une réflexion sur l’acceptabilité d’une sélection pour des animaux qui réagissent moins à leur environnement.
3.2. Stratégies de phénotypage pour les programmes d’amélioration
Pour enrayer une possible propagation de la caudophagie au sein des groupes, les éleveurs doivent intervenir dès qu’un comportement délétère ou qu’un changement significatif (fréquence, intensité…) est constaté dans la réalisation d’un comportement qui permettrait de l’anticiper. Aller jusqu’à l’élaboration de systèmes d’alertes faciliterait les interventions, même si retirer du groupe des animaux problématiques n’est pas toujours une solution suffisante. Cela renforce l’utilité de développer et mettre en place des outils de suivi en continu du comportement. Combiner des mesures à l’échelle de l’individu et du groupe permettra d’améliorer la prédiction des effets génétiques directs et indirects. En effet, des déséquilibres dans la synchronisation des activités à l’échelle du groupe pourraient donner lieu à de la morsure de queue (Reimert & Ursinus, 2024). La manière dont les groupes sont constitués, avec des individus plus ou moins apparentés, est à prendre en compte. L’estimation des effets indirects est notamment facilitée lorsque les porcs qui constituent un groupe proviennent de deux portées différentes. L’analyse des perturbations intra-individu dans l’activité avec des mesures en continu, à long terme et à grande échelle apparaît désormais essentielle pour aborder la problématique de la caudophagie. Cela passera par la définition de mesures en continu qui évaluent la capacité à faire face à des perturbations environnementales. Gorssen et al. (2024) ont montré que la résilience de la courbe de croissance d’un porc, calculée à partir de déviations par rapport à une trajectoire de référence, est génétiquement corrélée à la présence de morsure de queue (rg = 0,22 à 0,30). Les développements des nouvelles technologies pour l’analyse d’image vidéo sont attendus pour élaborer de nouveaux caractères qui pourront constituer des critères intéressants pour la sélection (projet LIB – Livestock Images and Behaviour) (Bonneau, 2024). La plus grande difficulté à franchir sera d’enregistrer ces mesures dans des dispositifs sans caudectomie pour que les comportements soient exacerbés.
Les possibilités offertes par l’ensemble des technologies « omiques », qui vont de la génomique à la métabolomique en passant par la transcriptomique et la protéomique pourraient permettre d’identifier des marqueurs biologiques caractérisant les différents profils de porcs et, in fine, de mettre en place une sélection sur ces marqueurs (Kasper et al., 2020). Sur des caractères faiblement héritables, la sélection génomique peut apporter un gain de progrès génétique intéressant. Il pourrait s’avérer utile d’identifier plus précisément soit des locus à effets quantitatifs, soit les polymorphismes des gènes d’intérêt pour améliorer la précision des valeurs génomiques utilisées pour la sélection des animaux. Peu de régions génomiques ayant un effet sur le comportement de mordeur et celui de victime ont été mises en évidence (Wilson et al., 2012). Avec le développement des mesures de comportement, les connaissances devraient s’accroître dans ce domaine afin d’identifier des gènes d’intérêt.
Une autre voie possible pour mieux comprendre le déterminisme de la caudophagie est de prendre en compte des informations sur le microbiote. Elles peuvent traduire les phénomènes d’interfaces entre le porc et son environnement, notamment les réponses aux expériences stressantes. Quelques connaissances sont disponibles sur le lien entre la composition du microbiote en lien avec les morsures de queue, mais il est encore difficile d’élaborer des stratégies de sélection incluant cette information. Au-delà de la composition du microbiote, il est aussi important de considérer les effets bénéfiques des produits issus de la fermentation microbienne. Le lien entre la composition du microbiote intestinal et les réponses au stress peut constituer une autre piste intéressante. À titre d’exemple, une abondance élevée dans le microbiote intestinal de Ruminococcus, liée à un faible niveau de cortisol, pourrait aussi avoir un lien avec la gestion du stress et le développement de comportements délétères (Mudd et al., 2017).
Conclusion
Les attentes des éleveurs de porcs sont fortes pour éradiquer la caudophagie de leurs troupeaux. La réforme d’animaux et la gestion raisonnée des troupeaux couplées à l’optimisation de l’environnement de production ne suffisent pas et la caudectomie reste une pratique très fréquente. Des progrès doivent être réalisés pour mesurer le comportement des porcs sur le long terme, de manière à saisir les événements souvent sporadiques de morsure de queue. Cela passera par la compréhension des dynamiques de groupe. L’enregistrement continu des données relatives au comportement des animaux et à l’environnement, ainsi que le développement de modèles d’analyses appliqués à de grandes populations sont essentiels pour parvenir à réduire le phénomène de morsures de queue. La prise en compte des effets génétiques indirects dans le choix des futurs reproducteurs est une stratégie qui peut s’avérer efficace pour améliorer le bien-être des porcs. Le progrès (génétique) sur ces caractères dépendra de l’accès à l’information complète sur l’identité des mordeurs et des mordus.
Notes
- 1. Cet article est la compilation d’informations issues d’une synthèse réalisée pour les Journées de la Recherche Porcine (Canario & Larzul, 2023) et d’un chapitre de livre sur la morsure de queue (Canario & Larzul, 2024).
Références
- Aikins-Wilson, S., Bohlouli, M., & König, S. (2021). Maternal and direct genetic parameters for tail length, tail lesions, and growth traits in pigs. Journal of Animal Science, 99(1), skaa398. https://doi.org/10.1093/jas/skaa398
- Bonneau, M. (2024). Livestock Images and Behaviour. INRAE Unité ASSET. https://asset.antilles.hub.inrae.fr/vie-scientifique/projets-de-recherche/lib-2024-2025
- Boyle, L. A., Edwards, S. A., Bolhuis, J. E., Pol, F., Šemrov, M. Z., Schütze, S., Nordgreen, J., Bozakova, N., Sossidou, E. N., & Valros, A. (2022). The evidence for a causal link between disease and damaging behavior in pigs. Frontiers in Veterinary Science, 8, 771682. https://doi.org/10.3389/fvets.2021.771682
- Bracke, M. B. M., Rodenburg, T. B., Vermeer, H. M., & van Nieker, T. G. C. M. (2018). Towards a Common Conceptual Framework and Illustrative Model for Feather Pecking in Poultry and Tail Biting in Pigs–Connecting Science to Solutions. Wageningen University & Research. http://www.henhub.eu/wp-content/uploads/2018/02/Henhub-pap-models-mb-090218-for-pdf.pdf
- Breuer, K., Sutcliffe, M. E. M., Mercer, J. T., Rance, K. A., Beattie, V. E., Sneddon, I. A., & Edwards, S. A. (2003). The effect of breed on the development of adverse social behaviours in pigs. Applied Animal Behaviour Science, 84(1), 59-74. https://doi.org/10.1016/S0168-1591(03)00147-3
- Breuer, K., Sutcliffe, M. E. M., Mercer, J. T., Rance, K. A., O’Connell, N. E., Sneddon, I. A., & Edwards, S. A. (2005). Heritability of clinical tail-biting and its relation to performance traits. Livestock Production Science, 93(1), 87-94. https://doi.org/10.1016/j.livprodsci.2004.11.009
- Brunberg, E., Jensen, P., Isaksson, A., & Keeling, L. J. (2013a). Behavioural and Brain Gene Expression Profiling in Pigs during Tail Biting Outbreaks - Evidence of a Tail Biting Resistant Phenotype. PLoS One, 8(6), e66513. https://doi.org/10.1371/journal.pone.0066513
- Brunberg, E., Jensen, P., Isaksson, A., & Keeling, L. J. (2013b). Brain gene expression differences are associated with abnormal tail biting behavior in pigs. Genes, Brain and Behavior, 12(2), 275-281. https://doi.org/10.1111/gbb.12002
- Brunberg, E., Wallenbeck, A., & Keeling, L. J. (2011). Tail biting in fattening pigs: associations between frequency of tail biting and other abnormal behaviours. Applied Animal Behaviour Science, 133(1-2), 18–25. https://doi.org/10.1016/j.applanim.2011.04.019
- Brunberg, E. I., Rodenburg, T. B., Rydhmer, L., Kjaer, J. B., Jensen, P., & Keeling, L. J. (2016). Omnivores going astray: A review and new synthesis of abnormal behavior in pigs and laying hens. Frontiers in Veterinary Science, 3, 57. https://doi.org/10.3389/fvets.2016.00057
- Camerlink, I., Bijma, P., Kemp, B., & Bolhuis, J. E. (2012). Relationship between growth rate and oral manipulation, social nosing, and aggression in finishing pigs. Applied Animal Behaviour Science, 142(1-2), 11-17. https://doi.org/10.1016/j.applanim.2012.09.004
- Camerlink, I., Ursinus, W. W., Bijma, P., Kemp, B., & Bolhuis, J. E. (2015). Indirect genetic effects for growth rate in domestic pigs alter aggressive and manipulative biting behaviour. Behavior Genetics, 45(1), 117-126. https://doi.org/10.1007/s10519-014-9671-9
- Canario, L., Bijma, P., David, I., Camerlink, I., Martin, A., Rauw, W. M., Flatres-Grall, L., van der Zande, L., Turner, S. P., Larzul, C., & Rydhmer, L. (2020). Prospects for the analysis and reduction of damaging behaviour in group-housed livestock, with application to pig breeding. Frontiers in Genetics, 11, 611073. https://doi.org/10.3389/fgene.2020.611073
- Canario, L., & Flatres-Grall, L. (2019). Analyse du déterminisme génétique de la caudophagie chez des femelles de la lignée Tai Zumu en fin d’engraissement [Communication]. 51e Journées de la Recherche Porcine, Paris. https://www.journees-recherche-porcine.com/texte/2019/genetique/g01.pdf
- Canario, L., & Larzul, C. (2023). Prédisposition génétique et expression des comportements liés à la morsure de la queue en lien avec les caractéristiques de chaque porc [Communication]. 55e Journées de la Recherche Porcine, Saint-Malo. https://www.journees-recherche-porcine.com/texte/2023/santeanimale/s03.pdf
- Canario, L., & Larzul, C. (2024). Individual pig-related factors. In K. O’Driscoll, & A. Valros (Eds.), Tail-Biting in Pigs (First Edition, pp. 83-111). Wageningen Academic Press. https://doi.org/10.1163/9789004694989_006
- Canario, L., Lundeheim, N., & Bijma, P. (2017). The early-life environment of a pig shapes the phenotypes of its social partners in adulthood. Heredity, 118(6), 534-541. https://doi.org/10.1038/hdy.2017.3
- Chou, J.-Y., D’Eath, R. B., Sandercock, D. A., & O’Driscoll, K. (2023). A trait or a state - how consistent are tail biting phenotypes in pigs. bioRxiv https://doi.org/10.1101/2023.02.16.528837
- CNR BEA. (2024). Avis du CNR BEA sur les impacts des sols pleins partiels ou totaux sur le comportement des porcs. https://www.cnr-bea.fr/expertise-travaux/impacts-des-sols-pleins-partiels-ou-totaux-sur-le-bien-etre-et-le-comportement-des-porcs/
- Commission européenne. (2017). Ne plus avoir besoin de couper la queue – Pourquoi mes porcs se mordent–ils la queue entre eux (caudophagie) ?. EU publications. https://doi.org/10.2875/430499
- Courboulay, V., & Drouet, A. (2018). Évaluation de la prévalence de caudophagie par la notation des carcasses en abattoir [Communication]. 50e Journées de la Recherche Porcine, Paris. https://www.journees-recherche-porcine.com/texte/2018/bienetre/b13.pdf
- Czycholl, I., Büttner, K., Becker, D., Schwennen, C., Baumgärtner, W., Otten, W., Wendt, M., Puff, C., & Krieter, J. (2023). Are biters sick? Health status of tail biters in comparison to control pigs. Porcine Health Management, 9(1), 19. https://doi.org/10.1186/s40813-023-00314-0
- De Briyne, N., Berg, C., Blaha, T., Palzer, A., & Temple, D. (2018). Phasing out pig tail docking in the EU–present state, challenges and possibilities. Porcine Health Management, 4, 27. https://doi.org/10.1186/s40813-018-0103-8
- D’Eath, R. B., Arnott, G., Turner, S. P., Jensen, T., Lahrmann, H. P., Busch, M. E., Niemi, J. K., Lawrence, A. B., & Sandøe, P. (2014). Injurious tail biting in pigs: how can it be controlled in existing systems without tail docking? Animal, 8(9), 1479-1497. https://doi.org/10.1017/S1751731114001359
- D’Eath, R. B., Foister, S., Jack, M., Bowers, N., Zhu, Q., Barclay, D., & Baxter, E. M. (2021). Changes in tail posture detected by a 3D machine vision system are associated with injury from damaging behaviours and ill health on commercial pig farms. PLoS ONE, 16(10), e0258895. https://doi.org/10.1371/journal.pone.0258895
- EFSA. (2007). Scientific Opinion of the Panel on Animal Health and Welfare on a request from Commission on the risks associated with tail biting in pigs and possible means to reduce the need for tail docking considering the different housing and husbandry systems. EFSA Journal, 611, 1–13. https://doi.org/10.2903/j.efsa.2007.611
- Ellen, E. D., Rodenburg, T. B., Albers, G. A. A., Bolhuis, J. E., Camerlink, I., Duijvesteijn, N., Knol, E. F., Muir, W. M., Peeters, K., Reimert, I., Sell-Kubiak, E., van Arendonk, J. A. M., Visscher, J., & Bijma, P. (2014). The prospects of selection for social genetic effects to improve welfare and productivity in livestock. Frontiers in Genetics, 5, 377. https://doi.org/10.3389/fgene.2014.00377
- Fisher, D. N., & McAdam, A. G. (2017). Social traits, social networks and evolutionary biology. Journal of Evolutionary Biology, 30(12), 2088-2103. https://doi.org/10.1111/jeb.13195
- Fraser, D. (1987). Attraction to blood as a factor in tail-biting by pigs. Applied Animal Behaviour Science, 17(1-2), 61-68. https://doi.org/10.1016/0168-1591(87)90008-6
- Gieling, E. T., Nordquist, R. E., & van der Staay, F. J. (2011). Assessing learning and memory in pigs. Animal Cognition, 14(2), 151-173. https://doi.org/10.1007/s10071-010-0364-3
- Gorssen, W., Winters, C., Meyermans, R., Chapard, L., Hooyberghs, K., Depuydt, J., Janssens, S., Mulder, H., & Buys, N. (2024). Breeding for resilience in finishing pigs can decrease tail biting, lameness and mortality. Genetics Selection Evolution, 56(1), 48. https://doi.org/10.1186/s12711-024-00919-1
- Guy, J. H., Rowlinson, P., Chadwick, J. P., & Ellis, M. (2002). Behaviour of two genotypes of growing–finishing pig in three different housing systems. Applied Animal Behaviour Science, 75(3), 193-206. https://doi.org/10.1016/S0168-1591(01)00197-6
- Hakansson, F., & Houe, H. (2020). Risk factors associated with tail damage in conventional non-docked pigs throughout the lactation and rearing period. Preventive Veterinary Medicine, 184, 105160. https://doi.org/10.1016/j.prevetmed.2020.105160
- Heseker, P., Bergmann, T., Scheumann, M., Traulsen, I., Kemper, N., & Probst, J. (2024). Detecting tail biters by monitoring pig screams in weaning pigs. Scientific Reports, 14(1), 4523. https://doi.org/10.1038/s41598-024-55336-7
- Hill, J. D., McGlone, J. J., Fullwood, S. D., & Miller, M. F. (1998). Environmental enrichment influences on pig behavior, performance and meat quality. Applied Animal Behaviour Science, 57(1-2), 51-68. https://doi.org/10.1016/S0168-1591(97)00116-0
- Ifip. (2016). Prévenir la douleur chez le porc, Fiche 7 Prendre en charge un problème de caudophagie. Ifip, INRA, Chambres d’agricultures, RMT bien-être animal. https://ifip.asso.fr/app/uploads/2016/03/dossier-prevention-douleur-porc-caudectomie-caudophagie.pdf
- Jensen, T., Busch, M., Riis, A., Maribo, H., & Vernersen, A. (2004). Halebid: Manual om forebyggelse og håndtering. Landsudvalget for Svin, Danske Slagterier. https://svineproduktion.dk/-/media/PDF---Publikationer/Rapporter/Halebid-manual/Forebyggelse-og-hndtering-af-halebid.ashx
- Kasper, C., Ribeiro, D., de Almeida, A. M., Larzul, C., Liaubet, L., & Murani, E. (2020). Omics Application in Animal Science—A Special Emphasis on Stress Response and Damaging Behaviour in Pigs. Genes, 11(8), 920. https://doi.org/10.3390/genes11080920
- Kleinhappel, T. K., John, E. A., Pike, T. W., Wilkinson, A., & Burman, O. H. P. (2016). Animal welfare: a social networks perspective. Science Progress, 99(1), 68-82. https://doi.org/10.3184/003685016X14495640902331
- Kobek-Kjeldager, C., Schönherz, A. A., Canibe, N., & Pedersen, L. J. (2022). Diet and microbiota-gut-brain axis in relation to tail biting in pigs: A review. Applied Animal Behaviour Science, 246, 105514. https://doi.org/10.1016/j.applanim.2021.105514
- Kraimi, N., Dawkins, M., Gebhardt-Henrich, S. G., Velge, P., Rychlik, I., Volf, J., Creach, P., Smith, A., Colles, F., & Leterrier, C. (2019). Influence of the microbiota-gut-brain axis on behavior and welfare in farm animals: A review. Physiology & Behavior, 210, 112658. https://doi.org/10.1016/j.physbeh.2019.112658
- Lange, A., Wutke, M., Ammer, S., Appel, A. K., Henne, H., Deermann, A., & Traulsen, I. (2023). Old breeds, new solutions? Effects of two different traditional sire breeds on skin lesions, tail lesions, tail losses, performance and behaviour of rearing pigs. Animal, 17(3), 100721. https://doi.org/10.1016/j.animal.2023.100721
- Li, Y. Z., Zhang, H. F., Johnston, L. J., Martin, W., Peterson, J. D., & Coetzee, J. F. (2017). Effects of tail docking and tail biting on performance and welfare of growing-finishing pigs in a confinement housing system. Journal of Animal Science, 95(11), 4835-4845. https://doi.org/10.2527/jas2017.1571
- Liu, D., Oczak, M., Maschat, K., Baumgartner, J., Pletzer, B., He, D., & Nortin, T. (2020). A computer vision-based method for spatial-temporal action recognition of tail-biting behaviour in group-housed pigs. Biosystems Engineering, 195, 27-41. https://doi.org/10.1016/j.biosystemseng.2020.04.007
- Løvendahl, P., Damgard, L. H., Nielsen, B.L., Thodberg, K., Su, G., & Rydhmer, L. (2005). Aggressive behaviour of sows at mixing and maternal behaviour are heritable and genetically correlated traits. Livestock Production Science, 93(1), 73-85. https://doi.org/10.1016/j.livprodsci.2004.11.008
- Lund, A., & Simonsen, H. B. (2000). Aggression and stimulus-directed activities in two breeds of finishing pig. Pig Journal, 45, 123-130
- Martin, A., David, I., Reale, D., Garant, D., & Canario, L. (2019). La corrélation génétique entre effets directs et effets sociaux peut-elle varier du fait de la sélection ? Une étude par simulation [Communication]. 51e Journées de la Recherche Porcine, Paris. https://www.journees-recherche-porcine.com/texte/2019/genetique/g09.pdf
- Moore, A. J., Brodie III, E. D., & Wolf, J.A. (1997). Interacting phenotypes and the evolutionary process: I. Direct and Indirect genetic effects of social interactions. Evolution, 51(5), 1352-1362. https://doi.org/10.1111/j.1558-5646.1997.tb01458.x
- Mudd, A. T., Berding, K., Wang, M., Donovan, S. M., & Dilger, R. N. (2017). Serum cortisol mediates the relationship between fecal Ruminococcus and brain N-acetylaspartate in the young pig. Gut Microbes, 8(6), 589-600. https://doi.org/10.1080/19490976.2017.1353849
- Nielsen, B., Horndrup, L. V., Turner, S. P., Christensen, O. F., Nielsen, H. M., & Ask, B. (2023). Selection for social genetic effects in purebred pigs improves behaviour and handling of their crossbred progeny. Genetic Selection Evolution, 55, 54. https://doi.org/10.1186/s12711-023-00828-9
- Nielsen, H. M., Ask, B., & Madsen P. (2018). Social genetic efects for growth in pigs difer between boars and gilts. Genetic Selection Evolution, 50, 4. https://doi.org/10.1186/s12711-018-0375-0
- Prunier, A., Averos, X., Dimitrov, I., Edwards, S. A., Hillmann, E., Holinger, M., Ilieski, V., Leming, R., Tallet, C., Turner, S. P., Zupan, M., & Camerlink, I. (2020a). Review: Early life predisposing factors for biting in pigs. Animal, 14(3), 570-587. https://doi.org/10.1017/S1751731119001940
- Prunier, A., Devillers, N., Herskin, M. S., Sandercock, D. A., Sinclair, A. R. L., Tallet, C., & Von Borell, E. (2020b). Husbandry interventions in suckling piglets, painful consequences and mitigation. In C. Farmer (Eds.), The suckling and weaned piglet (pp. 107-138). Wageningen Academic Publishers.
- Rabhi, N., Thibodeau, A., Côté, J.-C., Devillers, N., Laplante, B., Fravalo, P., Larivière-Gauthier, G., Thériault, W. P., Faucitano, L., Beauchamp, G., & Quessy, S. (2020). Association Between Tail-Biting and Intestinal Microbiota Composition in Pigs. Frontiers in Veterinary Science, 7, 563762. https://doi.org/10.3389/fvets.2020.563762
- Reimert, I., & Ursinus, W. W. (2024). The social environment. In K. O’Driscoll, & A. Valros (Eds.), Tail Biting in Pigs (First Edition, pp. 138-163). Wageningen Academic Press. https://doi.org/10.1163/9789004694989_008
- Rydhmer, L., & Canario, L. (2022). Behavioral Genetics in Pigs and Relations to Welfare. In T. Grandin & M. J. Deesing. (Eds.), Genetics and the Behavior of Domestic Animals (Third Edition, pp. 397-434). Academic Press. https://doi.org/10.1016/B978-0-12-394586-0.00011-1
- Sambraus, H. H. (1985). Mouth-based anomalous syndromes. In A.F. Fraser (Ed.), A comprehensive study of the behavioural features of common farm animals (pp. 391-422). Elsevier.
- Schrøder-Petersen, D. L., Simonsen, H. B., & Lawson, L. G. (2003). Tail-in-mouth behaviour among weaner pigs in relation to age, gender and group composition regarding gender. Acta Agriculturae Scandinavica, Section A — Animal Science, 53(1), 29-34. https://doi.org/10.1080/09064700310002017
- Sinisalo, A., Niemi, J. K., Heinonen, M., & Valros, A. (2012). Tail biting and production performance in fattening pigs. Livestock Science, 143(2-3), 220-225. https://doi.org/10.1016/j.livsci.2011.09.019
- St. Charles, K. M., Van der Waal, K. L., Anderson, J. E., Johnston, L. J., & Li, Y. Z. (2024). Evaluating social network metrics as indicators of tail injury caused by tail biting in growing-finishing pigs (Sus scrofa domesticus). Frontiers in Veterinary Science, 11, 1441813. https://doi.org/10.3389/fvets.2024.1441813
- Svoboda, M., Hodkovicová, N., Siwicki, A., & Szweda, W. (2023). The importance of slaughterhouses in monitoring the occurrence of tail biting in pigs - Review. Veterinární medicína, 68(9), 349-358. https://doi.org/10.17221/85/2023-VETMED
- Taylor, N. R., Main, D. C. J., Mendl, M., & Edwards, S. A. (2010). Tail-biting: A new perspective. The Veterinary Journal, 186(2), 137-147. https://doi.org/10.1016/j.tvjl.2009.08.028
- Ursinus, W. W., Van Reenen, C. G., Kemp, B., & Bolhuis, J. E. (2014a). Tail biting behaviour and tail damage in pigs and the relationship with general behaviour: predicting the inevitable? Applied Animal Behaviour Science, 156, 22-36. https://doi.org/10.1016/j.applanim.2014.04.001
- Ursinus, W. W., van Reenen, C. G., Reimert, I., & Bolhuis, J. E. (2014c). Tail biting in pigs: blood serotonin and fearfulness as pieces of the puzzle? PLoS ONE, 9(9), e107040. https://doi.org/10.1371/journal.pone.0107040
- Ursinus, W. W., Wijnen, H. J., Bartels, A. C., Dijvesteijn, N., van Reenen, C. G., & Bolhuis, J. E. (2014b). Damaging biting behaviors in intensively kept rearing gilts: the effect of jute sacks and relations with production characteristics. Journal of Animal Science, 92(11), 5193-5202. https://doi.org/10.2527/jas.2014-7918
- Valros, A. (2018). Tail biting. In M. Špinka (Ed.), Advances in Pig Welfare (pp. 137-166). Woodhead Publishing. https://doi.org/10.1016/B978-0-08-101012-9.00004-6
- Valros, A., & Heinonen, M. (2015). Save the pig tail. Porcine Health Management, 1(1), 2. https://doi.org/10.1186/2055-5660-1-2
- Valros, A., Salib, V., Hällib, O., Saarib, S., & Heinonen, M. (2021). Does weight matter? Exploring links between birth weight, growth and pig-directed manipulative behaviour in growing-finishing pigs. Applied Animal Behaviour Science, 245, 105506. https://doi.org/10.1016/j.applanim.2021.105506
- Van de Weerd, H. A., Docking, C. M., Day, J. E. L., & Edwards, S. A. (2005). The development of harmful social behaviour in pigs with intact tails and different enrichment backgrounds in two housing systems. Animal Science, 80(3), 289298. https://doi.org/10.1079/ASC40450289
- Verbeek, E., Keeling, L., Landberg, L., Lindberg, J. E., & Dicksved, J. (2021). The gut microbiota and microbial metabolites are associated with tail biting in pigs. Scientific Reports, 11(1), 20547. https://doi.org/10.1038/s41598-021-99741-8
- Walker, P. K., & Bilkei, G. (2006). Tail-biting in outdoor pig production. The Veterinary Journal,171(2):367-369. https://doi.org/10.1016/j.tvjl.2004.10.011
- Wallenbeck, A., & Keeling, L. J. (2013). Using data from electronic feeders on visit frequency and feed consumption to indicate tail biting outbreaks in commercial pig production. Journal of Animal Science, 91(6), 2879-2884. https://doi.org/10.2527/jas.2012-5848
- Wang, Z., Doekes, H., & Bijma, P. (2023). Towards genetic improvement of social behaviours in livestock using large-scale sensor data: data simulation and genetic analysis. Genetic Selection Evolution, 55(1), 67. https://doi.org/10.1186/s12711-023-00840-z
- Wilson, K., Zanella, R., Ventura, C., Johansen, H. L., Framstad, T., Janczak, A., Zanella, A. J., & Neibergs, H. L. (2012). Identification of chromosomal locations associated with tail biting and being a victim of tail-biting behaviour in the domestic pig (Sus scrofa domesticus). Journal of Applied Genetics, 53(4), 449-56. https://doi.org/10.1007/s13353-012-0112-2
- Zonderland, J. J., Schepers, F., Bracke, M. B. M., Den Hartog, L. A., Kemp, B., & Spoolder, H. A. M. (2011). Characteristics of biter and victim piglets apparent before a tail-biting outbreak. Animal, 5(5), 767-775. https://doi.org/10.1017/S1751731110002326
- Zupan, M., Janczak, A. M., Framstad, T., & Zanella, A. J. (2012). The effect of biting tails and having tails bitten in pigs. Physiology & Behavior, 106(5), 638-644. https://doi.org/10.1016/j.physbeh.2012.04.025
Résumé
Le déterminisme de la morsure de queue est multifactoriel et complexe. La mesure préventive généralisée est la coupe de queue des porcelets peu après la naissance. Depuis quelques années, de nombreuses recommandations invitant à agir sur l’environnement de l’animal ont été émises pour limiter la morsure de queue et donc la caudectomie. Cependant, les porcs qui partagent le même environnement peuvent montrer des réponses largement variables vis-à-vis de ce phénomène de morsure. Pour progresser, il est nécessaire d'approfondir notre compréhension des facteurs propres à chaque individu. Cette synthèse s’intéresse aux facteurs génétiques et biologiques – l’état corporel, la sensibilité au stress, la santé et le microbiote – qui interviennent en interaction avec l’environnement sur l’expression de la caudophagie. Tous ces facteurs interagissent avec la prédisposition génétique de chaque animal à mordre ou se faire mordre la queue. Des progrès sont attendus sur la mesure du comportement des animaux, pour travailler sur la typologie mordeur-victime-neutre et la caractérisation de leur environnement physique et social. L’acquisition de données individuelles en continu au niveau du groupe et dans de grandes populations sur plusieurs générations est impérative pour pouvoir évaluer les effets génétiques liés aux interactions sociales entre les porcs. Des modèles analytiques qui tiennent compte de plusieurs facteurs internes à la fois, de leur évolution dans le temps, et de la composition du groupe d’individus sont maintenant disponibles. Leur utilisation devrait permettre d’utiliser le levier de la sélection génétique pour améliorer le bien-être des porcs élevés en groupe.
Pièces jointes
Pas de document complémentaire pour cet articleStatistiques de l'article
 Vues: 1067
Vues: 1067
Téléchargements
 PDF: 132
PDF: 132
 XML: 22
XML: 22
Articles les plus lus par le même auteur ou la même autrice
- Séverine PAROIS, Michel BONNEAU, Patrick CHEVILLON, Catherine LARZUL, Nathalie QUINIOU, Annie ROBIC, Armelle PRUNIER, Odeurs indésirables de la viande de porcs mâles non castrés : problèmes et solutions potentielles , INRAE Productions Animales: Vol. 31 No 1 (2018)
- Jean-Pierre BIDANEL, Parsaoran SILALAHI, Thierry TRIBOUT, Laurianne CANARIO, Alain DUCOS, Hervé GARREAU, Hélène GILBERT, Catherine LARZUL, Denis MILAN, Juliette RIQUET, Sandrine SCHWOB, Marie-José MERCAT, Claire HASSENFRATZ, Alain BOUQUET, Christophe BAZIN, Joel BIDANEL, Cinquante années d’amélioration génétique du porc en France : bilan et perspectives , INRAE Productions Animales: Vol. 33 No 1 (2020)
- Lucile MONTAGNE, Laurent ALIBERT, Cécile BONNEFONT, Jean-Philippe CHOISIS, Amandine DURPOIX, Hélène GILBERT, Souhil HARCHAOUI, Catherine LARZUL, Bénédicte LEBRET, Sarah LOMBARD, Gilles MARTEL, Marc MORAINE, Laurent PICGIRARD, Thomas PUECH, Justine FAURE, Quels défis au développement de la production porcine en agriculture biologique en France ? , INRAE Productions Animales: Vol. 37 No 2 (2024): Numéro spécial : L’élevage biologique : conditions et potentiel de développement
- Laurianne CANARIO, Nicolas BÉDÈRE, Marc VANDEPUTTE, Didier BOICHARD, Jérôme RAOUL, Catherine LARZUL, Quelles génétiques pour les systèmes d’élevages certifiés en agriculture biologique ? , INRAE Productions Animales: Vol. 37 No 2 (2024): Numéro spécial : L’élevage biologique : conditions et potentiel de développement
- Masoomeh TAGHIPOOR, Aurélien MADOUASSE, Mathieu BONNEAU, Romain LARDY, Dominique HAZARD, Jean-Baptiste MENASSOL, Céline TALLET, Mathilde VALENCHON, Laurianne CANARIO, Lucile RIABOFF, Les technologies numériques en élevage : de la mesure à l’évaluation comportementale du bien-être de chaque animal , INRAE Productions Animales: Vol. 38 No 4 (2025): Numéro spécial : Bien-être animal : avancées scientifiques et innovations pour des systèmes d’élevage durables

