Peut-on aller vers du bien-être positif par l’enrichissement ? Un focus sur les poissons
Pourtant élevés en bien plus grand nombre que les mammifères ou les oiseaux, le bien-être des poissons n’est devenu un enjeu sociétal majeur que très récemment. Quelle que soit la finalité de l’élevage, la recherche scientifique identifie quelques pistes pouvant améliorer leur bien-être, comme la complexification de l’environnement physique, les stimulations sensorielles ou sociales et, plus récemment, l’enrichissement cognitif.
Introduction
Comme évoqué dans ce numéro spécial, le concept de bien-être animal évolue au fil des progrès scientifiques réalisés dans la compréhension des capacités émotionnelles et cognitives des animaux maintenus sous la dépendance humaine. La définition actuelle du bien-être animal positif (ou positive welfare) pose des notions clés comme l’épanouissement de l’animal et l’opportunité pour l’individu de pouvoir être lui-même acteur de son propre bien-être. Interagir activement avec son environnement ou avoir l’opportunité de faire des choix pourraient être sources d’expériences émotionnelles positives immédiates et favoriser le bien-être positif à long terme. De plus, enrichir les expériences de vie de l’animal lui permettrait de développer des compétences et ainsi favoriser ses capacités d’adaptation à son environnement (Rault et al., 2025). La science du bien-être animal s’attelle aujourd’hui à définir un cadre conceptuel et des moyens pour accéder au bien-être positif chez un ensemble d’espèces sous la dépendance humaine à des fins commerciales, de récréation, de conservation ou d’expérimentation. Actuellement, ce travail de réflexion s’effectue notamment au sein de vastes consortiums européens réunissant plusieurs centaines de scientifiques issus de plus d’une trentaine de pays comme les actions COST*
Des études récentes montrent que les poissons possèdent les structures neuroanatomiques et physiologiques nécessaires pour éprouver des émotions variées. Leurs émotions impliqueraient des circuits cérébraux qui ont été développés et conservés au cours de l’évolution des vertébrés. Le télencéphale des poissons possède des structures limbiques et dopaminergiques homologues impliquées dans le traitement des émotions, comparables à l’amygdale et à l’hippocampe des mammifères. De plus, les poissons présentent des réponses au stress semblables à celles des mammifères, libérant de l’adrénaline et de la noradrénaline lors de réactions de peur, ce qui entraîne une augmentation du rythme cardiaque et respiratoire. Les poissons produisent également du cortisol en réponse à des stimuli émotionnels et produisent des substances neurochimiques, notamment la dopamine, la sérotonine et l’ocytocine/isotocine, associées à la récompense et aux états émotionnels positifs chez les vertébrés terrestres. De nombreuses études ont démontré que les poissons possèdent les critères neurophysiologiques nécessaires à la perception de la douleur, y compris des nocicepteurs, des analgésiques naturels (opioïdes), des voies neuronales et d’autres régions cérébrales impliquées dans la perception de la douleur (p. ex., Winberg & Nilsson, 1993 ; Sneddon, 2003 ; Thompson & Walton, 2004). Leur capacité à ressentir des émotions positives est un front de science émergent qui apportera certainement de nouvelles pistes pour améliorer leur bien-être.
Comparativement aux vertébrés terrestres, les poissons représentent un bien plus grand nombre d’espèces (plus de 35 000) (Fricke et al., 2025) et de diversité des milieux de vie. L’étude de leurs capacités cognitives reste parcellaire mais se développe de manière exponentielle depuis ces dix dernières années. Ainsi, pour les quelques espèces étudiées à ce jour, il a été mis en évidence que les poissons pouvaient posséder des capacités cognitives complexes parfois comparables aux vertébrés terrestres. En plus de capacités de mémorisation à long terme, on va retrouver, pour certaines espèces, des capacités complexes comme la capacité à utiliser des outils, à coopérer, à résoudre des règles numériques, à reconnaître des visages humains, à apprendre des concepts abstraits, à avoir une représentation spatiale de son environnement, à reconnaître ses congénères ou à se reconnaître dans un miroir comme chez le Labre nettoyeur (Labroides dimidiatus) (p. ex., Sneddon & Brown, 2020 ; Salena et al., 2021 ; pour des synthèses). La richesse de leur univers sensoriel, émotionnel et cognitif justifie grandement la nécessité de s’intéresser à leur bien-être et de proposer des solutions pour tendre vers du « positive welfare » pour toutes les espèces maintenues sous la dépendance humaine.
1. Qu’est qu’un enrichissement ?
Un enrichissement peut globalement se définir comme toute « modification de l’environnement des animaux captifs ou d’élevage qui offre des stimulations et facilite l’expression des comportements pour lesquels l’animal est fortement motivé, favorisant ainsi les émotions positives et améliorant son bien-être » (Botreau et al., 2023). D’un point de vue opérationnel, les pratiques d’enrichissement de l’environnement peuvent être classées en trois niveaux (Taylor et al., 2023). Le premier niveau correspond aux pratiques visant à satisfaire les besoins fondamentaux de chaque espèce. Ainsi, ils peuvent se traduire par l’amélioration des fonctions biologiques (ex. : santé, croissance), et favoriser l’expression des comportements naturels (ex : pouvoir se percher chez les volailles). Le deuxième niveau correspond aux enrichissements qui visent à procurer des émotions positives immédiates aux animaux (comme le plaisir) en leur permettant d’accéder à ce qu’ils désirent. Ces enrichissements sont des éléments ou des programmes d’enrichissement qui apportent à l’animal quelque chose qu’il désire, mais qui n’améliore pas forcément la santé ni le fonctionnement biologique. Dans cette catégorie, les expériences positives procurées par ces enrichissements ne suffisent pas à compenser les expériences négatives (c’est-à-dire qu’il existe des preuves d’expériences hédoniques positives, mais pas de preuves d’un bien-être durable, comme une résilience accrue au stress). Certains enrichissements environnementaux visant à procurer du plaisir peuvent être associés à des risques. Par exemple, l’accès à un extérieur, bien que stimulant pour les animaux, peut également avoir des conséquences négatives, telles que des attaques de prédateurs et l’exposition à des pathogènes. Pour déterminer ce que les animaux désirent, des tests de préférences entre plusieurs stimuli peuvent être couplés à des tests de motivation. Par exemple, plus l’animal sera prêt à fournir des efforts (comme pousser une porte lestée) pour accéder à une ressource, plus sa valeur hédonique sera considérée comme importante. Enfin, le troisième niveau correspond aux programmes d’enrichissements qui permettent une balance positive du bien-être sur le long terme. Cette balance va s’obtenir par l’accumulation d’expériences positives et de stimulations cognitives, comme la possibilité d’évoluer dans un environnement variable et complexe, de pouvoir interagir activement avec son environnement ou de résoudre des challenges adaptés à l’espèce. Dans cette catégorie, les expériences positives contrebalancent les expériences négatives et favorisent ainsi les capacités d’adaptation des animaux sur le long terme. La diversité des expériences vécues, incluant les expériences négatives, peut se traduire par une flexibilité comportementale plus importante, une amélioration des capacités cognitives ou une meilleure résilience suite à des évènements stressants.
Pour certains auteurs, ce troisième niveau serait celui qui définirait le mieux ce que devrait être un véritable enrichissement. Au regard des connaissances actuelles sur les vertébrés terrestres, le fait d’améliorer l’environnement afin de répondre aux besoins fondamentaux des espèces ne semble plus suffisant, car cela ne constitue pas nécessairement une source de stimulations et d’apprentissage pour les animaux (Veissier et al., 2024). Pour les espèces aquatiques, et notamment celles élevées en aquaculture, la grande diversité des espèces ainsi que le manque de connaissances sur les besoins fondamentaux propres à chacune d’elles ne permettent pas encore de déterminer clairement si les améliorations apportées à l’environnement constituent un véritable enrichissement ou si elles répondent simplement à un besoin fondamental. Comme le soulignent Maia et al. (2024), de nombreuses connaissances restent à acquérir pour chaque espèce, notamment en ce qui concerne le domaine vital, la profondeur de vie, les schémas migratoires, la reproduction, les comportements sociaux, ou encore les besoins en substrat ou en abris. Dans ce contexte, nous présenterons les avancées scientifiques actuelles, tous niveaux confondus.
2. L’enrichissement physique
L’enrichissement physique (ou structurel), consiste à ajouter de la complexité structurelle à l’environnement d’élevage en intégrant des structures, des objets ou toute modification architecturale visant à accroître l’hétérogénéité de cet environnement. L’enrichissement physique est la stratégie d’enrichissement environnemental la plus étudiée à ce jour (Jones et al., 2021 ; Arechavala-Lopez et al., 2022 ; Zhang et al., 2023 pour des synthèses).
2.1. L’apport d’abris et de substrats
Fournir aux poissons un environnement diversifié qui se rapproche de leur habitat naturel peut être un moyen efficace d’offrir du choix, d’encourager l’exploration, et de favoriser l’expression des comportements naturels. En fonction des espèces et des stades de vie, complexifier l’environnement peut se faire par l’ajout d’objets et/ou de substrats appropriés. L’ajout d’objets ou de structures va avoir comme fonction, entre autres, de fournir aux poissons la possibilité de s’abriter d’un potentiel danger ou d’individus dominants. Les objets, tels que des plantes artificielles ou, des tuyaux en PVC peuvent être disposés sur le fond du bassin (figure 1). Des algues peuvent être suspendues ou encore des couvercles peuvent être ajoutés pour protéger les poissons de la lumière du soleil ou des prédateurs aériens en conditions extérieures. Bien que les résultats soient variables en fonction des espèces, l’abri est considéré comme un enrichissement recherché chez les poissons. Par exemple, le bar de sable (Puntius oligolepis) et les poissons zèbres (Danio rerio) préfèrent passer du temps dans un compartiment contenant des plantes et des pots en argile plutôt que dans un compartiment vide (Kistler et al., 2011). Le poisson-lime préfère passer plus de temps dans un compartiment agrémenté de plantes sans nourriture que dans un compartiment vide pourvu de nourriture (Horinouchi et al., 2013). Les poissons rouges (Carassius auratus) peuvent faire des efforts, en nageant à contre-courant, pour pouvoir accéder à une zone enrichie de plantes (Sullivan et al., 2016).
Pour ce qui est de l’ajout de substrat, celui-ci doit être composé d’un matériau sûr, non toxique et exempt d’agents pathogènes, comme du sable stérilisé, du gravier ou du corail concassé ou encore d’images de substrat placées sous le fond des aquariums. Les Corydoras (Corydoras spp.) préfèrent le sable aux graviers plus gros, ce qui facilite leur comportement naturel de recherche de nourriture (Maia & Volpato, 2018). Pour le tilapia du Mozambique, la présence d’un substrat va permettre aux mâles dominants d’exprimer leur comportement naturel de construction de nid (Galhardo et al., 2009). Apporter un substrat approprié va également être une nécessité pour les poissons qui vivent sur les fonds et s’enfouissent comme les poissons plats ou certaines raies. Par exemple, la raie bouclée (Raja clavata), fréquemment exposée dans les aquariums publics, présente une préférence pour un substrat à base de sable plutôt que de gravier sur lequel elle va pouvoir se reposer ou s’enfouir. Pour cette espèce, la présence de ce substrat peut permettre de réduire l’expression de comportements stéréotypés (Greenway et al., 2016). Pour les espèces dont les alevins vont passer du temps posés sur le fond, l’ajout de substrat (comme un matelas en plastique) peut réduire les malformations, favoriser la croissance ou encore la survie (Näslund & Johnsson, 2016).
Les plantes et les tubes fournissent des abris visuels et des refuges aux poissons qui peuvent ainsi se soustraire, si besoin, aux interactions agonistiques ou à des stress dans l’environnement.
Figure 1. Exemple d’un environnement appauvri (a) et d’un enrichissement physique du milieu avec des plantes artificielles et des tubes en PVC posés sur le fond (b) dans un bassin de jeunes truites arc-en-ciel (Photos : © Valentin Brunet).
a. Effets sur le métabolisme, la sensibilité au stress et la santé
En plus de répondre aux besoins des espèces, l’enrichissement physique montre chez plusieurs espèces, des influences positives sur les fonctions métaboliques (ex. : croissance, santé) et la sensibilité au stress. Pour les espèces avec un système social hiérarchisé, les abris vont servir de barrières visuelles et de refuges. Les individus subordonnés vont pouvoir ainsi se soustraire de la vue des individus dominants et se protéger des agressions. Cet enrichissement permettrait d’apporter un certain état de sécurité et favoriserait un métabolisme propice à la croissance par la réduction des coûts métaboliques liés à la défense d’un territoire, à l’exposition à des stress et/ou à l’occurrence de blessures. Par exemple, chez le saumon atlantique (Salmo salar), la présence d’un abri, même s’il n’est pas utilisé, est suffisant pour diminuer le métabolisme de base et réduire le stress (Millidine et al., 2006). Chez le poisson Rhodeus ocellatus, fournir des repères visuels permet de délimiter des territoires, ce qui conduit à une réduction de l’agression entre individus rivaux (Smith, 2011). Comme pour d’autres espèces, l’ajout d’enrichissements (plantes, tubes, galets) dans l’environnement de jeunes truites arc-en-ciel (Oncorhynchus mykiss) favorise la croissance et réduit l’agressivité par rapport à des truites élevées sans enrichissements (Brunet et al., 2022). Chez les salmonidés, l’effet de couvercles plus ou moins partiels en surface sur la croissance varie entre les espèces. Par exemple, une couverture partielle favorise la croissance chez le saumon atlantique, alors que cela peut ne pas avoir d’influence sur la truite brune ou arc-en-ciel (Pickering et al., 1987). Chez la daurade royale (Sparus aurata), l’ajout d’un substrat de gravier favorise le fourragement et réduit les comportements agressifs. Cependant, les effets ne sont apparents qu’avec certaines couleurs de graviers (Batzina & Karakatsouli, 2012 ; Batzina et al., 2014). Chez la sole commune (Solea solea), l’ajout de sable réduit le rythme respiratoire et le métabolisme de base, suggérant un état plus calme qu’en l’absence de substrat (Howell & Canario, 1987).
Quel que soit le système d’élevage, les poissons peuvent être exposés à des situations anxiogènes imprédictibles auxquelles ils ne peuvent se soustraire comme des transferts, des actions de nettoyage, des pesées, des bruits soudains, des vaccinations… Appliquer une stratégie d’enrichissement peut également être favorable à court et à long terme en favorisant les capacités d’adaptation des animaux face à ces évènements. Par exemple, chez le brochet (Esox lucius) (mais pas Esox masquinongy), la présence de plantes dans l’environnement réduit les réponses de peur face à la présence d’un humain par rapport à des poissons maintenus dans un aquarium dépourvu d’enrichissements (Einfalt et al., 2013). Chez les salmonidés, une réduction du niveau basal de cortisol est communément considérée comme un signe d’amélioration du bien-être sur le long terme. Par exemple, il a été démontré que l’enrichissement physique (tubes, lamelles en PVC) entraîne une diminution des niveaux de cortisol chez le saumon atlantique ou le saumon chinook (Oncorhynchus tshawytscha). Chez la truite arc-en-ciel, l’enrichissement du milieu (gravier, plantes, couvercle) peut permettre une meilleure résilience. Suite à une stimulation nociceptive (injection sous cutanée d’acide acétique dans la bouche), les truites élevées dans un milieu enrichi récupèrent plus rapidement leur fréquence respiratoire et leur activité natatoire de base ainsi que leur niveau basal de cortisol par rapport à des truites maintenues dans un bassin appauvri (Jones et al., 2021 pour une synthèse). La présence d’abris réduit les comportements agressifs, et par conséquent la survenue de blessures (sources d’entrée des pathogènes). De plus, en réduisant également le stress, l’enrichissement favorise, sur le long terme, une meilleure santé des poissons. Par exemple, les juvéniles de saumon atlantique élevés dans des environnements enrichis ont montré un taux de survie plus élevé lors d’une infection de flavobactériose par rapport à des juvéniles élevés dans des conditions standard d’écloserie (Räihä et al., 2019).
b. Effets sur le comportement et les capacités cognitives
L’enrichissement peut également avoir des effets sur la flexibilité comportementale (c.-à-d. capacité d’adaptation face à des changements dans son environnement), le fonctionnement cérébral et les capacités d’apprentissage. Par exemple, les truites arc-en-ciel élevées dans un milieu enrichi vont exprimer moins de comportements de peur dans un environnement nouveau ou face à un objet nouveau, suggérant une flexibilité comportementale plus importante par rapport à des individus élevés dans un environnement appauvri (Brunet et al., 2022). D’une manière assez comparable aux mammifères, l’enrichissement du milieu peut favoriser la neurogenèse dans les zones cérébrales impliquées dans la mémoire, les apprentissages ou les émotions. Ainsi, des juvéniles de saumon atlantique maintenus dans un bassin enrichi vont présenter une neurogenèse plus importante au niveau du télencéphale et avoir de meilleures performances dans une tâche d’apprentissage spatial (sortir d’un labyrinthe) par rapport à des saumons maintenus dans un milieu appauvri (Salvanes et al., 2013). De même, l’enrichissement du milieu améliore les capacités d’apprentissage spatial, la mémoire et le nombre de cellules télencéphaliques chez le poisson rouge (Abreu et al., 2019). Chez la dorade, une couleur de gravier bleu ou rouge-marron va réduire l’agressivité ainsi que l’activité dopaminergique et sérotoninergique (des neurotransmetteurs impliqués dans de nombreux comportements en lien avec le bien-être) par rapport à un substrat vert ou un fond non enrichi (Batzina et al., 2014). Favoriser un bon développement cérébral et cognitif est un objectif particulièrement important pour les poissons élevés à des fins de repeuplement des populations naturelles. Issus d’élevages, les jeunes salmonidés montrent des taux réduits de survie par rapport aux jeunes éclos en milieu naturel notamment à cause d’un taux de prédation accru. Chez les jeunes saumons, un environnement enrichi couplé avec des simulations d’attaques de prédateurs favorise, en deux semaines, l’expression d’un comportement anti-prédateur approprié (s’abriter) (Roberts et al., 2011). La complexité de l’environnement naturel est impossible à reproduire en conditions d’élevage. Dans le cadre de la réintroduction, le défi consiste à identifier des stratégies d’enrichissement techniquement et économiquement réalisables qui favorisent le développement d’un phénotype au plus proche de celui des individus sauvages (Johnsson et al., 2014). « Les poissons destinés à être relâchés dans la nature [...] devraient être préparés à une vie en milieu sauvage, ce qui nécessite des compétences d’apprentissage bien développées, notamment pour la recherche de nourriture et l’évitement des prédateurs. Ces poissons devraient posséder le répertoire comportemental spécifique de l’espèce, similaire aux poissons sauvages » (Brännäs & Johnsson, 2008).
Chez le poisson zèbre, un milieu enrichi se rapprochant d’un milieu naturel, va favoriser la cohésion des groupes sociaux et la synchronie entre les individus (tous les individus s’engagent dans la même activité en même temps), un paramètre communément associé au bien-être positif chez les mammifères (Franks et al., 2018).
2.2. Les suspensions verticales
Étudié plus récemment, dans les bassins circulaires, l’apport des structures verticales suspendues va permettre de créer des micro-habitats par variations de la vitesse du courant. Ces suspensions peuvent être constituées d’un ensemble de barres en aluminium, de tiges angulaires, de cordes, ou encore de bouliers. Les poissons peuvent ainsi choisir des zones à vitesse d’eau plus réduite pour se reposer ou plus forte pour s’exercer. Dans ce contexte, l’enrichissement structurel ne fournit pas d’abri, mais ajoute de la complexité et de l’hétérogénéité à l’environnement. Chez le saumon chinook, l’ajout de tubes verticaux en PVC ou de balles de golf enfilées sur des tiges dans l’environnement favorise la croissance des jeunes par rapport à un environnement sans suspension (Rosburg et al., 2019). De même, chez la truite arc-en-ciel, plusieurs études montrent un effet bénéfique des suspensions en écloserie sur la croissance (Arechavala-Lopez et al., 2022 pour une synthèse). Chez le saumon atlantique, l’ajout de suspensions (plantes artificielles suspendues) ne va pas avoir d’effet sur le poids des animaux ou sur leur niveau de cortisol. Cependant, les jeunes saumons montrent plus de cohésion sociale, une flexibilité comportementale plus importante ainsi qu’un taux de renouvellement de la sérotonine cérébrale plus élevé, suggérant un état émotionnel plus positif (Prentice et al., 2025).
3. L’enrichissement sensoriel
L’enrichissement sensoriel a pour objectif de stimuler un ou plusieurs systèmes sensoriels chez les animaux. Les poissons élevés pour l’aquaculture représentent de nombreux taxons avec plus de 180 espèces d’eau douce, 145 espèces marines et 46 espèces diadromes (migratrices entre ces deux milieux) (FAO, 2020). Comparativement aux vertébrés terrestres, les connaissances sur l’écologie sensorielle* de chaque espèce restent très parcellaires et nécessitent d’être explorées. En effet, leurs systèmes sensoriels sont complexes : de nombreuses espèces peuvent percevoir, par exemple, les sons, les vibrations, les couleurs, les goûts, les odeurs, les courants, les champs électriques ou magnétiques, ou encore la pression de l’eau. Bien que quelques travaux aient été conduits sur l’influence de l’exposition à de la musique classique ou à des phéromones, nous ne développerons ici que deux types d’enrichissement sensoriels : l’enrichissement par la couleur et par des stimulations tactiles.
Chez un grand nombre d’espèces, d’élevage ou d’ornement, il a été montré que la couleur des parois des aquariums pouvait altérer ou favoriser la survie des alevins, la croissance, la santé ou l’agressivité des poissons. Par exemple, des parois bleues vont favoriser la croissance des jeunes turbots (Scophthalmus maximus) et des truites arc-en-ciel (McLean, 2021 pour une synthèse). Chez le poisson-clown rouge (Amphiprion frenatus), la couleur des parois va également jouer sur la capacité de résilience suite à un stress (exondation). Seuls les juvéniles élevés dans des aquariums avec des parois opaques blanches vont avoir un taux de cortisol plus élevé 15 minutes après le stress par rapport à des juvéniles maintenus dans des aquariums avec des parois jaunes, bleues ou noires (Dos Santos et al., 2023).
Les poissons disposent de récepteurs tactiles ainsi que d’une ligne latérale qui permet une perception fine des mouvements de l’eau. En conditions naturelles, les labres nettoyeurs sont connus pour ôter les parasites ou les tissus abîmés des poissons « clients ». Lors de ce processus, les labres fournissent également des stimulations tactiles. Chez le poisson chirurgien (Ctenochaetus striatus), des stimulations tactiles fournies par un modèle artificiel de labre réduisent le taux de cortisol suite à un stress (meilleure résilience) (Soares et al., 2011). Chez le tilapia, fournir des stimulations tactiles en plaçant des filaments en silicone dans l’environnement permettrait, sur le long terme, de contrebalancer l’effet négatif d’une forte densité et favoriserait la croissance (Gauy et al., 2023). Plus récemment, la diffusion quotidienne de bulles dans l’environnement de truites juvéniles a montré des effets bénéfiques en réduisant les comportements agressifs et en améliorant les capacités d’apprentissage spatial. Bien que cet enrichissement fournisse également une occupation et une hétérogénéité dans l’environnement, la motivation des truites pour interagir avec les bulles suggère une stimulation sensorielle plaisante (Amichaud et al., 2024). Le côté plaisant des stimulations tactiles reste à démontrer mais il est intéressant de noter que certaines espèces de poissons, comme certaines raies ou la carpe koï, peuvent rechercher activement le contact tactile avec les humains (Fife-Cook & Franks, 2021).
4. L’enrichissement social
L’enrichissement social est la possibilité d’avoir des contacts temporaires ou permanents avec des congénères de son espèce, d’autres espèces ou des stimuli sensoriels liés à des signaux sociaux (odeurs, sons…). Au vu de la diversité des espèces et des systèmes sociaux, la mise en place de ce type d’enrichissement nécessite une bonne connaissance de la biologie des espèces. Chez les espèces sociales, la présence de congénères en nombre suffisant est la base pour répondre aux besoins naturels en permettant par exemple, la formation de bancs plus ou moins synchronisés. En conditions expérimentales, le tilapia du Mozambique (Oreochromis mossambicus) montre une motivation importante pour rejoindre des congénères en fournissant des efforts pour ouvrir une trappe (Galhardo et al., 2011). Le tétra néon (Paracheirodon innesi) recherche le contact d’un faux tétra-robot mobile et la présence de ce robot réduit les réponses de peur dans un environnement nouveau (Romano & Stefanini, 2022). Chez le poisson zèbre, la vue de congénères est considérée comme une récompense en soi qui va stimuler les capacités d’apprentissage (Al-Imari & Gerlai, 2008). Les capacités d’apprentissage peuvent aussi s’améliorer par le mélange d’espèces. Par exemple, la présence d’une truite arc-en-ciel expérimentée peut favoriser l’apprentissage de l’omble à points blancs (Salvelinus leucomaenis) à utiliser un self-feeder (système d’auto-alimentation où les poissons actionnent un déclencheur pour obtenir de la nourriture) (Noble et al., 2012), cette espèce présentant des difficultés à réaliser spontanément cette tâche. En aquaculture, les paramètres zootechniques vont généralement être constants et basés sur les pratiques d’élevage qui vont limiter la possibilité de mélanger les classes d’âge ou les espèces. L’enrichissement peut s’envisager par la réduction des densités d’élevage mais, notamment chez les salmonidés, cela peut parfois conduire à des effets négatifs tels que l’augmentation des combats visant à établir une forte hiérarchie sociale et une augmentation du stress. Par exemple, chez la truite arc-en-ciel, un stress plus important est observé à faible densité (3,76 ± 0,06 kg/m3) qu’à plus forte densité (12,94 ± 0,14 kg/m3) (p. ex., Roy et al., 2021).
5. L’enrichissement cognitif
L’enrichissement cognitif consiste à enrichir la « vie psychique » de l’animal (ex. : réduire l’ennui) et à stimuler ses capacités cognitives. Cet enrichissement vise à favoriser l’engagement actif de l’animal avec son environnement en lui proposant, par exemple, de réaliser des apprentissages, des actions, mais aussi à apporter une certaine prévisibilité dans les évènements survenant dans son environnement (Kleiber et al., 2023 pour une synthèse).
L’enrichissement cognitif le plus étudié à ce jour utilise les capacités des poissons à apprendre par conditionnement classique (ou pavlovien) à associer une stimulation sensorielle neutre (ex. : son, lumière) avec la survenue d’un évènement négatif ou positif (ex. : la distribution de nourriture). Ce type d’enrichissement permet d’apporter de l’information aux animaux et de la prévisibilité qui leur permet ainsi de mieux s’adapter à l’évènement à venir. Étudié depuis longtemps chez les vertébrés terrestres, le fait de signaler à l’avance l’arrivée de nourriture par un stimulus neutre permet l’expression d’une anticipation positive. Cette anticipation positive est communément associée à une émotion positive en lien avec l’activation du système dopaminergique, la dopamine étant l’hormone associée au plaisir (Spruijt et al., 2001). Par exemple, des morues (Gadus morhua) entraînées à associer un signal lumineux à la distribution de nourriture vont présenter un comportement classique d’anticipation en se regroupant activement vers le lieu de distribution future de la nourriture dès l’activation du signal (Nilsson et al., 2008). Chez la truite arc-en-ciel, signaler la distribution de nourriture par la diffusion préalable de bulles permet l’expression de comportements d’anticipation, réduit l’agressivité et favorise sur le long terme les défenses immunitaires (Kleiber et al., 2022).
L’entraînement aux soins (ou médical) est également considéré comme un enrichissement cognitif qui va être bénéfique à la fois pour les animaux et les soigneurs. Basé sur les capacités d’apprentissage par conditionnement opérant (l’animal doit réaliser une action précise pour obtenir une récompense), cet entraînement est surtout mis en place dans les aquariums publics et a pour objectif d’obtenir la coopération des poissons pour la réalisation de soins sans contention (source de stress). Il est ainsi possible d’entraîner des raies et des requins à venir interagir volontairement avec les humains afin de pouvoir réaliser des actes comme des prélèvements sanguins ou des pesées (Janssen et al., 2017). L’utilisation de self-feeders, aussi basé sur un apprentissage par conditionnement opérant, va également permettre aux poissons d’interagir, par choix, avec leur environnement. Aussi considérée comme un enrichissement alimentaire, l’utilisation de self-feeders peut favoriser la croissance et réduire l’agressivité chez plusieurs espèces de poissons dont la truite (Suzuki et al., 2008).
L’enrichissement cognitif peut également consister à fournir des occupations aux poissons ou des tâches à résoudre dans la mesure de leurs capacités. Chez les vertébrés terrestres, de nombreuses espèces vont préférer réaliser des efforts pour accéder à de la nourriture plutôt que d’avoir un accès sans effort (contrafreeloading). Ce concept reste peu appliqué chez les poissons. Une étude récente montre que des poissons zèbres entraînés à pousser un couvercle pour accéder à de la nourriture vont s’adapter plus facilement à un environnement nouveau mais ils ne vont pas, pour autant, montrer de préférence pour ce mode de nourrissage (Gatto et al., 2024). Procurer de l’exercice physique aux poissons en jouant sur la vitesse du courant dans les bassins d’élevage constitue également un enrichissement occupationnel mais les résultats peuvent être contradictoires en fonction des protocoles et des espèces. Chez le saumon, utiliser un motif lumineux mobile pour stimuler l’exercice de nage peut avoir des effets bénéfiques sur la croissance et le niveau basal de cortisol (Herbert et al., 2011). Chez la truite arc-en-ciel, la diffusion de bulles, en plus de fournir un enrichissement tactile (voir partie 3) et de l’hétérogénéité dans l’environnement, peut également être une source d’occupation pour les poissons qui viennent interagir avec (Amichaud et al., 2024) (figure 2).
Le rideau de bulles structure l’environnement, apporte des stimulations sensorielles et peut également fournir une occupation aux animaux qui interagissent avec les bulles.
Figure 2. Exemple d’enrichissement cognitif, sensoriel et structurel par la diffusion de bulles dans un bassin de jeunes truites arc-en-ciel : (a) bassin avec le diffuseur de bulles inactif au fond du bassin (tube horizontal noir), (b) diffuseur de bulles activé (Photos : © Aude Kleiber).
6. Limites et perspectives
De par la grande diversité des espèces aquacoles maintenues sous la responsabilité des humains, la mise en place d’enrichissements demande une réflexion approfondie qui doit prendre en compte à la fois les besoins naturels de chaque espèce, les préférences des individus, le stade de vie, les capacités cognitives mais aussi la faisabilité technique et financière.
L’enrichissement physique, visant à favoriser l’expression de comportements naturels est une stratégie qui semble, d’après la littérature, pouvoir permettre d’aller vers du bien-être positif pour un ensemble d’espèces. Cependant, sa mise en place présente de nombreuses contraintes notamment en conditions expérimentales ou en aquaculture. L’immersion d’objets peut gêner le nettoyage automatique des bassins, la manipulation des poissons, ajouter du temps de nettoyage des objets, être source de blessures selon les matériaux ou de développement de pathogènes. De plus, si nous avons principalement reporté des effets bénéfiques de cet enrichissement, selon les espèces et la quantité d’enrichissements mis à disposition, des effets contradictoires peuvent apparaître avec, par exemple, une augmentation de l’agressivité pour accéder aux ressources (Woodward et al., 2019). L’effet de l’enrichissement peut également s’estomper avec le temps, avec les animaux qui vont s’habituer aux objets ou avoir peur lors de la mise en place (Zhang et al., 2023 pour une synthèse). Des études restent à mener pour déterminer dans quelle mesure le fait de déplacer ou de changer régulièrement les objets peut aussi influencer le bien-être ou au contraire le stress selon les espèces. Les structures suspendues peuvent présenter l’avantage d’être plus faciles à mettre en place. À défaut de pouvoir immerger des objets, placer des posters sur les parois ou le fond et jouer sur les couleurs sont aussi des pistes à explorer. Bien que de nombreuses limites soient soulevées, il reste encore de nombreuses pistes à explorer, comme la recherche autour de nouveaux matériaux immersibles moins risqués, l’étude de combinaisons d’enrichissements ou encore l’évolution des besoins en fonction des stades de vie. En aquaculture, l’investissement dans des pratiques d’enrichissement ne se traduit pas nécessairement par un gain de productivité et peut donc constituer un frein dans leur mise en place (p. ex., Rosengren et al., 2017). Une réflexion menée en amont peut permettre de le mettre en balance avec d’autres bénéfices, comme l’amélioration de l’image des produits auprès des consommateurs, notamment grâce à la mise en valeur de démarches concrètes mises en place en faveur du bien-être animal.
Chez les mammifères terrestres, l’ajout d’objets dans l’environnement est une stratégie aussi utilisée pour stimuler l’expression de jeu*, un comportement associé au plaisir. Chez le poisson, l’expression de comportements de jeu reste inexplorée bien que de plus en plus d’anecdotes soient reportées. Par exemple, chez le cichlidé à points blancs (Tropheus dubois), un comportement de manipulation d’objet a été constaté et répond à tous les critères du jeu (Burghardt et al., 2015). Des comportements de jeux sociaux ou de jeux locomoteurs sont aussi décrits (Burghardt, 2015). En conditions naturelles, certaines espèces de poissons, comme les saumons, effectuent des sauts par-dessus des objets flottants. Pour certains auteurs, ce comportement pourrait servir à se défaire de parasites mais aussi être un comportement de jeu locomoteur source de plaisir tactile (Fagen, 2017). Selon le mode d’élevage, la présence de couvercles ne permet pas l’expression de ce comportement mais des études plus fines des comportements de jeu en conditions naturelles pourraient donner des pistes pour de futurs aménagements pour favoriser leur expression.
Encore peu développées dans la littérature, les recherches sur l’enrichissement social pourraient s’élargir en considérant des approches en combinaison. Par exemple, en aquaculture, l’agressivité reste un point critique important que la réduction de densité ne semble pas forcément pouvoir résoudre. Combiner la réduction de densité avec des enrichissements physiques, occupationnels et/ou sensoriels pourrait éventuellement conduire à de nouvelles pistes de réflexion. D’un point de vue sensoriel, les stimulations tactiles ou les mouvements de l’eau semblent pouvoir apporter de nouvelles ouvertures. D’autres enrichissements sensoriels mériteraient d’être étudiés, comme les champs magnétiques. Chez les truites arc-en-ciel adultes, un ralentissement du rythme cardiaque peut s’observer en fonction des paramètres des champs magnétiques auxquels ils sont exposés (Hellinger & Hoffmann, 2009). En plus d’attirer l’attention sur l’importance de facteurs non visibles mais perceptibles par les poissons, ces stimuli sensoriels pourraient potentiellement constituer une source d’enrichissement.
L’enrichissement cognitif par l’apport de prévisibilité, d’un certain contrôle et d’occupations, apporte des pistes récentes de réflexions avec des éléments peut-être moins contraignants, comme la mise en place de signaux lumineux pour favoriser l’expression d’anticipation alimentaire. Comme évoqué précédemment, la diffusion de bulles constitue une piste intéressante par la combinaison de stimulations apportées (enrichissement physique, sensoriel, occupationnel et cognitif) et les contraintes d’entretien plus limitées. Pour Veissier et al. (2024), l’efficacité d’un enrichissement serait basée sur la possibilité donnée aux animaux d’acquérir de l’information sur leur environnement, de faire des choix, d’apprendre et de pouvoir avoir une certaine forme de contrôle sur leur environnement (figure 3). Or, chez l’épinoche (Gasterosteus aculeatus), l’entraînement précoce à résoudre des tâches (comme un labyrinthe) peut engendrer davantage de mortalité et ne va pas forcément développer ses futures capacités cognitives (Álvarez-Quintero et al., 2020). Ces résultats montrent la nécessité d’élargir les connaissances sur les capacités de chaque espèce avant de pouvoir mettre en place des stratégies d’enrichissements cognitifs appropriées.
Beaucoup plus étudiée chez les mammifères, l’interaction humain-animal peut également être considérée comme un enrichissement social. À ce jour, l’influence du comportement des humains en interaction avec les poissons en conditions expérimentale ou commerciale reste inexplorée. Conduire des recherches sur la manière dont les poissons perçoivent les humains pourrait peut-être apporter de nouvelles pistes de recherche. De même, transposer les pratiques d’entraînements aux soins pour les animaux maintenus longtemps en captivité (ex. : populations parentales) pourrait peut-être permettre d’apporter un enrichissement cognitif et réduire le stress des manipulations.
Il apparaît également important de considérer l’enrichissement du milieu à l’échelle transgénérationnelle. En effet, les conditions de vie des populations parentales peuvent jouer un rôle essentiel dans la construction comportementale des individus via divers mécanismes dont des effets maternels (Pitel et al., 2019 pour une synthèse). Par exemple, chez la truite arc-en-ciel, l’exposition maternelle à un stress de chaleur altère les capacités d’apprentissage spatial chez les descendants (Colson et al., 2019). Étudier l’influence de l’enrichissement de l’environnement parental pourrait également contribuer, en amont, à une meilleure capacité d’adaptation des descendants.
L’acquisition d’informations, notamment quand elle demande une action de la part de l’animal peut être une source d’émotions positives, comme le plaisir (émotion à court terme), et le traitement cognitif de l’information peut influencer le développement cérébral et favoriser les capacités d’adaptation sur le long terme. Les deux sont bénéfiques pour le bien-être animal.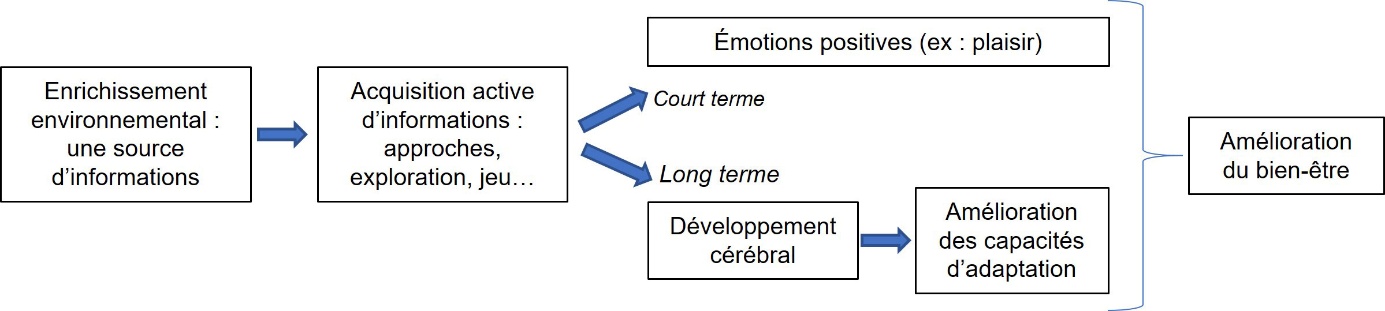
Figure 3. Schéma du concept d’enrichissement comme source d’informations pour l’animal, adapté de Veissier et al. (2024).
Conclusion
La prise en compte du bien-être des poissons a commencé récemment, notamment depuis la reconnaissance de leurs émotions et de leurs capacités cognitives complexes. Au niveau européen, le Centre européen de référence pour le bien-être des animaux aquatiques, EURCAW-Aqua, a vu le jour en 2024. Un de ses objectifs consiste à faciliter la recherche dans le domaine sous-développé du bien-être des animaux aquatiques. Comme souligné par le Conseil consultatif de l’aquaculture (https://aac-europe.org/fr/), les connaissances actuelles sur les comportements naturels des espèces aquatiques restent limitées, ce qui constitue un frein majeur pour l’évolution des conditions d’hébergement. Le Conseil consultatif recommande l’observation éthologique des populations sauvages pour apporter de nouvelles connaissances sur le répertoire comportemental des espèces nouvellement domestiquées, et ainsi de nouvelles pistes de réflexion. Bien que nous ayons évoqué quelques pistes pouvant potentiellement permettre d’aller vers du bien-être positif, de nombreuses pistes restent à explorer, comme la stimulation de systèmes sensoriels autres (ex. : magnéto et électroréception) ou l’adaptation du milieu en fonction des activités diurnes et nocturnes de chaque espèce (ex. : aménagement de zones de repos pour la nuit). De plus, générer des connaissances scientifiques sur les moyens d’identifier, pour chaque espèce, un état affectif positif constituera une étape majeure pour le bien-être des poissons. Comme suggéré par certains auteurs, il apparaît nécessaire d’explorer plus finement les capacités d’expression émotionnelles chez les poissons notamment par l’étude de la communication acoustique ou vibrationnelle, la signalisation chimique, les impulsions électriques, les changements de couleur ou encore la bioluminescence (Fife-Cook & Franks, 2019). En somme, il existe une grande diversité de possibilités pour les recherches futures visant à identifier les comportements révélateurs d’émotions positives chez les poissons afin d’atteindre l’objectif du positive welfare.
Glossaire
COST : Coopération européenne dans le domaine de la recherche scientifique et technique.
Écologie sensorielle : discipline qui étudie comment les animaux perçoivent, traitent et utilisent les stimuli sensoriels de leur environnement.
Jeu : Plus fréquente chez les juvéniles, l’expression de jeu est néanmoins répandue chez les adultes, particulièrement chez les mammifères et les oiseaux sous forme de jeux de manipulation d’objets, des jeux sociaux ou des jeux locomoteurs. Selon le cadre conceptuel posé par Burghardt (2015), un comportement de jeu doit répondre à cinq critères précis : 1) le comportement ne doit pas avoir de fonction immédiate ; 2) son expression doit être spontanée, renforçatrice en soi et non guidée par l’obtention d’une récompense ; 3) le pattern moteur diffère des comportements fonctionnels de l’espèce (p. ex. mouvements exagérés ou incomplets) ; 4) le comportement se répète de manière non stéréotypée et 5) il s’exprime seulement chez des animaux libres de stress, en bonne santé et dont les besoins vitaux sont remplis. L’expression de jeu apporterait de nombreux bénéfices psychologiques et moteurs et, selon les espèces, contribuerait à la cohésion des groupes sociaux.
Notes
- 1. Les mots suivis d’un astérisque à leur première occurrence dans le texte sont définis dans le glossaire.
Références
- Abreu, C. C., Fernandes, T. N., Henrique, E. P., Pereira, P. D. C., Marques, S. B., Herdeiro, S. L. S., Oliveira, F. R. R., Magalhães, N. G. M., Anthony, D. C., Melo, M. A. D., Guerreiro-Diniz, C., Diniz, D. G., & Picanço-Diniz, C. W. (2019). Small-scale environmental enrichment and exercise enhance learning and spatial memory of Carassius auratus, and increase cell proliferation in the telencephalon: an exploratory study. Brazilian Journal of Medical and Biological Research, 52(5). https://doi.org/10.1590/1414-431x20198026
- Al-Imari, L., & Gerlai, R. (2008). Sight of conspecifics as reward in associative learning in zebrafish (Danio rerio). Behavioural Brain Research, 189(1), 216-219. https://doi.org/10.1016/j.bbr.2007.12.007
- Álvarez-Quintero, N., Velando, A., & Kim, S.-Y. (2020). Long-Lasting negative effects of learning tasks during early life in the Three-Spined Stickleback. Frontiers in Ecology and Evolution, 8. https://doi.org/10.3389/fevo.2020.562404
- Amichaud, O., Lafond, T., Fazekas, G. L., Kleiber, A., Kerneis, T., Batard, A., Goardon, L., Labbé, L., Lambert, S., Milla, S., & Colson, V. (2024). Air bubble curtain improves the welfare of captive rainbow trout fry and fingerlings. Aquaculture, 586, 740828. https://doi.org/10.1016/j.aquaculture.2024.740828
- Arechavala-Lopez, P., Cabrera‐Álvarez, M. J., Maia, C. M., & Saraiva, J. L. (2022). Environmental enrichment in fish aquaculture: A review of fundamental and practical aspects. Reviews in Aquaculture, 14(2), 704-728. https://doi.org/10.1111/raq.12620
- Batzina, A., Dalla, C., Tsopelakos, A., Papadopoulou-Daifoti, Z., & Karakatsouli, N. (2014). Environmental enrichment induces changes in brain monoamine levels in gilthead seabream Sparus aurata. Physiology & Behavior, 130, 85-90. https://doi.org/10.1016/j.physbeh.2014.03.023
- Batzina, A., & Karakatsouli, N. (2012). The presence of substrate as a means of environmental enrichment in intensively reared gilthead seabream Sparus aurata: Growth and behavioral effects. Aquaculture, 370-371, 54-60. https://doi.org/10.1016/j.aquaculture.2012.10.005
- Botreau, R., Lesimple, C., Brunet, V., & Veissier, I. (2023). Review - Environmental enrichment in ruminants and equines: Introduction. EURCAW Ruminants & Equines. https://doi.org/10.5281/zenodo.7685132
- Brännäs, E., & Johnsson, J. I. (2008). Behaviour and welfare in farmed fish. In C. Magnhagen, V. A. Braithwaite, E. Forsgren, & B. G. Kapoor (Eds.), Fish Behaviour (pp. 593-627). CRC Press. https://doi.org/10.1201/b10757-21
- Brunet, V., Kleiber, A., Patinote, A., Sudan, P.-L., Duret, C., Gourmelen, G., Moreau, E., Fournel, C., Pineau, L., Calvez, S., Milla, S., & Colson, V. (2022). Positive welfare effects of physical enrichments from the nature-, functions- and feeling- based approaches in farmed rainbow trout (Oncorhynchus mykiss). Aquaculture, 550, 737825. https://doi.org/10.1016/j.aquaculture.2021.737825
- Burghardt, G. M. (2015). Play in fishes, frogs and reptiles. Current Biology, 25(1), R9-R10. https://doi.org/10.1016/j.cub.2014.10.027
- Burghardt, G. M., Dinets, V., & Murphy, J. B. (2015). Highly Repetitive Object Play in a Cichlid Fish (Tropheus duboisi). Ethology, 121(1), 38-44. https://doi.org/10.1111/eth.12312
- Colson, V., Cousture, M., Damasceno, D., Valotaire, C., Nguyen, T., Le Cam, A., & Bobe, J. (2019). Maternal temperature exposure impairs emotional and cognitive responses and triggers dysregulation of neurodevelopment genes in fish. PeerJ, 7, e6338. https://doi.org/10.7717/peerj.6338
- Dos Santos, T. M. L., De Oliveira Sousa, E. M., Tsuzuki, M. Y., De Oliveira Nuñer, A. P., & Barcellos, L. J. G. (2023). Tank color influences the response of tomato clownfish (Amphiprion frenatus) to an acute stress challenge. Fish Physiology and Biochemistry, 49(4), 577-584. https://doi.org/10.1007/s10695-023-01203-7
- Einfalt, L. M., Wojcieszak, D. B., & Wahl, D. H. (2013). Behavior, Growth and Habitat Selection of Hatchery Esocids Reared with Artificial Vegetation. Transactions of the American Fisheries Society, 142(2), 345-352. https://doi.org/10.1080/00028487.2012.741552
- Fagen, R. (2017). Salmonid Jumping and Playing: potential cultural and welfare implications. Animals, 7(6), 42. https://doi.org/10.3390/ani7060042
- FAO. (2020). The State of World Fisheries and Aquaculture 2020. Sustainability in action. FAO. https://doi.org/10.4060/ca9229en
- Fife-Cook, I., & Franks, B. (2019). Positive Welfare for Fishes: Rationale and Areas for Future Study. Fishes, 4(2), 31. https://doi.org/10.3390/fishes4020031
- Fife-Cook, I., & Franks, B. (2021). Koi (Cyprinus rubrofuscus) Seek Out Tactile Interaction with Humans: General Patterns and Individual Differences. Animals, 11(3), 706. https://doi.org/10.3390/ani11030706
- Franks, B., Graham, C., & Von Keyserlingk, M. a. G. (2018). Is Heightened-Shoaling a good candidate for positive emotional behavior in zebrafish? Animals, 8(9), 152. https://doi.org/10.3390/ani8090152
- Fricke, R., Eschmeyer, W. N., & Van der Laan, R. (2025, July 3). Eschmeyer’s Catalog of Fishes: Genera, Species, References. California Academy of Sciences. http://researcharchive.calacademy.org/research/ichthyology/catalog/fishcatmain.asp
- Galhardo, L., Almeida, O., & Oliveira, R. F. (2009). Preference for the presence of substrate in male cichlid fish: Effects of social dominance and context. Applied Animal Behaviour Science, 120(3-4), 224-230. https://doi.org/10.1016/j.applanim.2009.07.001
- Galhardo, L., Almeida, O., & Oliveira, R. F. (2011). Measuring motivation in a cichlid fish: An adaptation of the push-door paradigm. Applied Animal Behaviour Science, 130(1-2), 60-70. https://doi.org/10.1016/j.applanim.2010.12.008
- Gatto, E., Varracchio, C., Bertolucci, C., & Lucon-Xiccato, T. (2024). Puzzle feeder as a cognitive enrichment strategy determines long-term welfare improvements in a teleost fish. Applied Animal Behaviour Science, 279,106401. https://doi.org/10.1016/j.applanim.2024.106401
- Gauy, A. C. d. S., Bolognesi, M. C., & Gonçalves-De-Freitas, E. (2023). Body Tactile Stimulation Reduces the Effects of High Stocking Density on the Welfare of Nile Tilapia (Oreochromis niloticus). Fishes, 8(6), 320. https://doi.org/10.3390/fishes8060320
- Greenway, E., Jones, K. S., & Cooke, G. M. (2016). Environmental enrichment in captive juvenile thornback rays, Raja clavata (Linnaeus 1758). Applied Animal Behaviour Science, 182, 86-93. https://doi.org/10.1016/j.applanim.2016.06.008
- Hellinger, J., & Hoffmann, K.-P. (2009). Magnetic field perception in the Rainbow Trout, Oncorhynchus mykiss. Journal of Comparative Physiology A, 195(9), 873-879. https://doi.org/10.1007/s00359-009-0466-z
- Herbert, N. A., Kadri, S., & Huntingford, F. A. (2011). A moving light stimulus elicits a sustained swimming response in farmed Atlantic salmon, Salmo salar L. Fish Physiology and Biochemistry, 37(2), 317-325. https://doi.org/10.1007/s10695-011-9499-7
- Horinouchi, M., Mizuno, N., Jo, Y., Fujita, M., Suzuki, Y., Aranishi, F., & Sano, M. (2013). Habitat preference rather than predation risk determines the distribution patterns of filefish Rudarius ercodes in and around seagrass habitats. Marine Ecology Progress Series, 488, 255-266. https://doi.org/10.3354/meps10396
- Howell, B. R., & Canario, A. V. M. (1987). The influence of sand on the estimation of resting metabolic rate of juvenile sole, Solea solea (L.). Journal of Fish Biology, 31(2), 277-280. https://doi.org/10.1111/j.1095-8649.1987.tb05231.x
- Janssen, J. D., Kidd, A., Ferreira, A., & Snowden, S. (2017). Training and conditioning of elasmobranch in aquaria. In M. Smith, D. Warmolts, D. Thoney, R. Hueter, M. Murray, & J. Ezcurra (Eds.), The elasmobranch husbandry manual II: recent advances in the care of sharks, rays and their relatives (pp. 209-222). Ohio Bological Survey.
- Johnsson, J. I., Brockmark, S., & Näslund, J. (2014). Environmental effects on behavioural development consequences for fitness of captive‐reared fishes in the wild. Journal of Fish Biology, 85(6), 1946-1971. https://doi.org/10.1111/jfb.12547
- Jones, N. A. R., Webster, M. M., & Salvanes, A. G. V. (2021). Physical enrichment research for captive fish: Time to focus on the DETAILS. Journal of Fish Biology, 99(3), 704-725. https://doi.org/10.1111/jfb.14773
- Kistler, C., Hegglin, D., Würbel, H., & König, B. (2011). Preference for structured environment in zebrafish (Danio rerio) and checker barbs (Puntius oligolepis). Applied Animal Behaviour Science, 135(4), 318-327. https://doi.org/10.1016/j.applanim.2011.10.014
- Kleiber, A., Le-Calvez, J.-M., Kerneis, T., Batard, A., Goardon, L., Labbé, L., Brunet, V., Ferreira, V. H. B., Guesdon, V., Calandreau, L., & Colson, V. (2022). Positive effects of bubbles as a feeding predictor on behaviour of farmed rainbow trout. Scientific Reports, 12(1). https://doi.org/10.1038/s41598-022-15302-7
- Kleiber, A., Stomp, M., Rouby, M., Ferreira, V. H. B., Bégout, M.-L., Benhaïm, D., Labbé, L., Tocqueville, A., Levadoux, M., Calandreau, L., Guesdon, V., & Colson, V. (2023). Cognitive enrichment to increase fish welfare in aquaculture: A review. Aquaculture, 575, 739654. https://doi.org/10.1016/j.aquaculture.2023.739654
- Maia, C. M., Saraiva, J. L., & Gonçalves-De-Freitas, E. (2024). Fish welfare in farms: potential, knowledge gaps and other insights from the fair-fish database. Frontiers in Veterinary Science, 11. https://doi.org/10.3389/fvets.2024.1450087
- Maia, C. M., & Volpato, G. L. (2018). Individuality matters for substrate-size preference in the Nile tilapia juveniles. Journal of Applied Animal Welfare Science, 21(4), 316-324. https://doi.org/10.1080/10888705.2017.1423229
- McLean, E. (2021). Fish tank color: An overview. Aquaculture, 530, 735750. https://doi.org/10.1016/j.aquaculture.2020.735750
- Millidine, K. J., Armstrong, J. D., & Metcalfe, N. B. (2006). Presence of shelter reduces maintenance metabolism of juvenile salmon. Functional Ecology, 20(5), 839-845. https://doi.org/10.1111/j.1365-2435.2006.01166.x
- Näslund, J., & Johnsson, J. I. (2016). Environmental enrichment for fish in captive environments: effects of physical structures and substrates. Fish and Fisheries, 17(1), 1-30. https://doi.org/10.1111/faf.12088
- Nilsson, J., Kristiansen, T. S., Fosseidengen, J. E., Fernö, A., & van den Bos, R. (2008). Learning in cod (Gadus morhua): long trace interval retention. Animal Cognition, 11(2), 215-222. https://doi.org/10.1007/s10071-007-0103-6
- Noble, C., Flood, M. J., & Tabata, M. (2012). Using rainbow trout Oncorhynchus mykiss as self-feeding actuators for white-spotted charr Salvelinus leucomaenis: Implications for production and welfare. Applied Animal Behaviour Science, 138(1-2), 125-131. https://doi.org/10.1016/j.applanim.2012.02.013
- Pickering, A. D., Griffiths, R., & Pottinger, T. G. (1987). A comparison of the effects of overhead cover on the growth, survival and haematology of juvenile Atlantic salmon, Salmo salar L., brown trout, Salmo trutta L., and rainbow trout, Salmo gairdneri Richardson. Aquaculture, 66(2), 109-124. https://doi.org/10.1016/0044-8486(87)90226-2
- Pitel, F., Calenge, F., Aigueperse, N., Fabrellas, J. E., Coustham, V., Calandreau, L., Morisson, M., Chavatte-Palmer, P., & Ginane, C. (2019). Rôle de l’environnement précoce dans la variabilité des phénotypes et l’adaptation des animaux d’élevage à leur milieu. In R. Baumont (Coord.), INRA Productions Animales : Vol.32(2) Numéro spécial : De grands défis et des solutions pour l’élevage (pp. 247-262). https://doi.org/10.20870/productions-animales.2019.32.2.2467
- Prentice, P. M., Chivite Alcalde, M., Císař, P., & Rey Planellas, S. (2025). Early-life environmental enrichment promotes positive animal welfare for juvenile Atlantic salmon (Salmo salar) in aquaculture research. Scientific Reports, 15(1). https://doi.org/10.1038/s41598-025-88780-0
- Räihä, V., Sundberg, L.-R., Ashrafi, R., Hyvärinen, P., & Karvonen, A. (2019). Rearing background and exposure environment together explain higher survival of aquaculture fish during a bacterial outbreak. Journal of Applied Ecology, 56(7), 1741-1750. https://doi.org/10.1111/1365-2664.13393
- Rault, J., Bateson, M., Boissy, A., Forkman, B., Grinde, B., Gygax, L., Harfeld, J. L., Hintze, S., Keeling, L. J., Kostal, L., Lawrence, A. B., Mendl, M. T., Miele, M., Newberry, R. C., Sandøe, P., Špinka, M., Taylor, A. H., Webb, L. E., Whalin, L., & Jensen, M. B. (2025). A consensus on the definition of positive animal welfare. Biology Letters, 21(1), 20240382. https://doi.org/10.1098/rsbl.2024.0382
- Roberts, L. J., Taylor, J., & Garcia de Leaniz, C. (2011). Environmental enrichment reduces maladaptive risk-taking behavior in salmon reared for conservation. Biological Conservation, 144(7), 1972-1979. https://doi.org/10.1016/j.biocon.2011.04.017
- Romano, D., & Stefanini, C. (2022). Robot-Fish interaction helps to trigger social buffering in neon tetras: The potential role of social robotics in treating anxiety. International Journal of Social Robotics, 14(4), 963-972. https://doi.org/10.1007/s12369-021-00829-y
- Rosburg, A. J., Fletcher, B. L., Barnes, M. E., Treft, C. E., & Bursell, B. R. (2019). Vertically-Suspended environmental enrichment structures improve the growth of juvenile landlocked fall chinook salmon. International Journal of Innovative Studies in Aquatic Biology and Fisheries, 5(1). https://doi.org/10.20431/2454-7670.0501004
- Rosengren, M., Kvingedal, E., Näslund, J., Johnsson, J. I., & Sundell, K. (2017). Born to be wild: effects of rearing density and environmental enrichment on stress, welfare, and smolt migration in hatchery-reared Atlantic salmon. Canadian Journal of Fisheries and Aquatic Sciences, 74(3), 396-405. https://doi.org/10.1139/cjfas-2015-0515
- Roy, J., Terrier, F., Marchand, M., Herman, A., Heraud, C., Surget, A., Lanuque, A., Sandres, F., & Marandel, L. (2021). Effects of Low Stocking Densities on Zootechnical Parameters and Physiological Responses of Rainbow Trout (Oncorhynchus mykiss) Juveniles. Biology, 10(10), 1040. https://doi.org/10.3390/biology10101040
- Salena, M. G., Turko, A. J., Singh, A., Pathak, A., Hughes, E., Brown, C., & Balshine, S. (2021). Understanding fish cognition: a review and appraisal of current practices. Animal Cognition, 24(3), 395-406. https://doi.org/10.1007/s10071-021-01488-2
- Salvanes, A. G. V., Moberg, O., Ebbesson, L. O. E., Nilsen, T. O., Jensen, K. H., & Braithwaite, V. A. (2013). Environmental enrichment promotes neural plasticity and cognitive ability in fish. Proceedings of the Royal Society B: Biological Sciences, 280(1767), 20131331. https://doi.org/10.1098/rspb.2013.1331
- Smith, C. (2011). Good fences make good neighbours: the role of landmarks in territory partitioning in the rose bitterling (Rhodeus ocellatus). Behaviour, 148(2), 233-246. https://doi.org/10.1163/000579511x554233
- Sneddon, L. U. (2003). The evidence for pain in fish: the use of morphine as an analgesic. Applied Animal Behaviour Science, 83(2), 153-162. https://doi.org/10.1016/s0168-1591(03)00113-8
- Sneddon, L. U., & Brown, C. (2020). Mental capacities of fishes. In L. Johnson, A. Fenton, & A. Shriver (Eds.), Neuroethics and Nonhuman Animals (pp. 53-71). Springer, Cham. https://doi.org/10.1007/978-3-030-31011-0_4
- Soares, M. C., Oliveira, R. F., Ros, A. F. H., Grutter, A. S., & Bshary, R. (2011). Tactile stimulation lowers stress in fish. Nature Communications, 2(1). https://doi.org/10.1038/ncomms1547
- Spruijt, B. M., Van Den Bos, R., & Pijlman, F. T. A. (2001). A concept of welfare based on reward evaluating mechanisms in the brain: anticipatory behaviour as an indicator for the state of reward systems. Applied Animal Behaviour Science, 72(2), 145-171. https://doi.org/10.1016/s0168-1591(00)00204-5
- Sullivan, M., Lawrence, C., & Blache, D. (2016). Why did the fish cross the tank? Objectively measuring the value of enrichment for captive fish. Applied Animal Behaviour Science, 174, 181-188. https://doi.org/10.1016/j.applanim.2015.10.011
- Suzuki, K., Mizusawa, K., Noble, C., & Tabata, M. (2008). The growth, feed conversion ratio and fin damage of rainbow troutOncorhynchus mykissunder self-feeding and hand-feeding regimes. Fisheries Science, 74(4), 941-943. https://doi.org/10.1111/j.1444-2906.2008.01610.x
- Taylor, P. S., Schrobback, P., Verdon, M., & Lee, C. (2023). An effective environmental enrichment framework for the continual improvement of production animal welfare. Animal Welfare, 32. https://doi.org/10.1017/awf.2023.5
- Thompson, R. R., & Walton, J. C. (2004). Peptide Effects on Social Behavior: Effects of Vasotocin and Isotocin on Social Approach Behavior in Male Goldfish (Carassius auratus). Behavioral Neuroscience, 118(3), 620‑626. https://doi.org/10.1037/0735-7044.118.3.620
- Veissier, I., Lesimple, C., Brunet, V., Aubé, L., & Botreau, R. (2024). Review: Rethinking environmental enrichment as providing opportunities to acquire information. Animal, 18(9), 101251. https://doi.org/10.1016/j.animal.2024.101251
- Winberg, S., & Nilsson, G. E. (1993). Roles of brain monoamine neurotransmitters in agonistic behaviour and stress reactions, with particular reference to fish. Comparative Biochemistry and Physiology Part C : Pharmacology Toxicology and Endocrinology, 106(3), 597-614. https://doi.org/10.1016/0742-8413(93)90216-8
- Woodward, M. A., Winder, L. A., & Watt, P. J. (2019). Enrichment increases aggression in zebrafish. Fishes, 4(1), 22. https://doi.org/10.3390/fishes4010022
- Zhang, Z., Lin, W., Li, Y., Yuan, X., He, X., Zhao, H., Mo, J., Lin, J., Yang, L., Liang, B., Zhang, X., & Liu, W. (2023). Physical enrichment for improving welfare in fish aquaculture and fitness of stocking fish: A review of fundamentals, mechanisms and applications. Aquaculture, 574, 739651. https://doi.org/10.1016/j.aquaculture.2023.739651
Résumé
La reconnaissance d’une sensibilité émotionnelle, de capacités cognitives et d’une certaine forme de conscience chez les animaux sous la responsabilité des humains a profondément modifié la manière d’appréhender leur bien-être. S’il est impératif de fournir des conditions de vie répondant à leurs besoins comportementaux, il est également essentiel d’offrir des stimulations permettant à l’animal d’interagir activement avec son environnement afin de développer ses capacités d’adaptation, notamment par l’enrichissement du milieu de vie. En raison de la reconnaissance bien plus tardive des poissons en tant qu’êtres sensibles par rapport aux vertébrés terrestres, les connaissances actuelles sur les moyens d’améliorer leur bien-être par l’enrichissement du milieu restent parcellaires. Ce sujet devient un enjeu sociétal majeur en raison de l’intérêt croissant de la société et des filières pour le bien-être des poissons. Cette synthèse, non exhaustive, vise à exposer les pistes de recherche récentes concernant les poissons sous la dépendance des humains, que ce soit à des fins commerciales, récréatives, de conservation ou d’expérimentation. Après avoir défini ce que l’on entend par un enrichissement, nous aborderons les stratégies d’enrichissement physique, sensoriel, social ou cognitif actuellement explorées, avant d’évoquer les limites à leur mise en place ainsi que les perspectives futures. Les poissons représentent un bien plus grand nombre d’espèces que les vertébrés terrestres. Nous verrons que certains enrichissements offrent des pistes prometteuses, mais que de nombreuses connaissances restent à acquérir afin de développer des stratégies pertinentes adaptées à chaque espèce et stade de vie.
Pièces jointes
Pas de document complémentaire pour cet article##plugins.generic.statArticle.title##
 Vues: 1468
Vues: 1468
Téléchargements
 PDF: 204
PDF: 204
 XML: 47
XML: 47
Articles les plus lus par le même auteur ou la même autrice
- Alice DE BOYER DES ROCHES, Violaine COLSON, Raphaël GUATTEO, Claudia TERLOUW, David André BARRIÈRE, Pierre-Marie BOITARD, Dorothée LEDOUX, Catherine BELLOC, Pierre MORMÈDE, Karine PORTIER, Matthias KOHLHAUER, Fanny PILOT-STORCK, Vers une meilleure gestion de la douleur des mammifères et poissons destinés à la consommation humaine – Partie 1 : Concepts, mécanismes, causes, détection , INRAE Productions Animales: Vol. 38 No 4 (2025): Numéro spécial : Bien-être animal : avancées scientifiques et innovations pour des systèmes d’élevage durables
- Fanny PILOT-STORCK, Matthias KOHLHAUER, Violaine COLSON, Raphaël GUATTEO, Claudia TERLOUW, David André BARRIÈRE, Pierre-Marie BOITARD, Dorothée LEDOUX, Catherine BELLOC, Pierre MORMÈDE, Karine PORTIER, Alice DE BOYER DES ROCHES, Vers une meilleure gestion de la douleur des mammifères et poissons destinés à la consommation humaine – Partie 2 : Prise en charge , INRAE Productions Animales: Vol. 38 No 4 (2025): Numéro spécial : Bien-être animal : avancées scientifiques et innovations pour des systèmes d’élevage durables

