Le côté sombre de la résilience : révéler les dynamiques cachées du microbiote intestinal chez les chevaux – une solution agroécologique
Le microbiote intestinal joue un rôle crucial dans la santé et le bien-être des animaux. Nos travaux révèlent que des chevaux soumis à un stress chronique en raison de l’hébergement en box, d’une alimentation excessivement riche en concentrés, et d’un entraînement intensif, présentent une composition microbienne intestinale altérée. Le microbiote affiche une diminution de la diversité microbienne, ainsi qu’une prolifération de bactéries opportunistes, affectant leur état de santé et bien-être global. Afin d’atténuer ces effets, nous recommandons des pratiques agroécologiques favorisant le pâturage en groupe pour réduire le stress chronique et promouvoir un microbiote intestinal sain
Introduction
À travers l’Europe, la population équine a progressé rapidement depuis 1995 (Jez et al., 2015). En France, le nombre de chevaux s’est élevé à 1,2 million en 2025, représentant environ 20 % de la population équine totale en Europe. Cette croissance est alimentée par l’augmentation de la pratique équestre chez les jeunes et par la passion toujours croissante pour l’équitation de loisir et les paris hippiques. Cependant, cette augmentation des chiffres et de l’enthousiasme a un revers. Beaucoup de ces chevaux sont nourris avec des concentrés et sont logés principalement dans des boxes individuels, ce qui, bien que fournissant un environnement sûr (Ruet et al., 2019), limite les chevaux dans l’expression de leurs comportements naturels. Or, en tant qu’herbivores, les chevaux passent environ 17 à 67 % de leur temps à brouter (Arnold, 1984), ce qui favorise non seulement leur digestion mais aussi leur équilibre comportemental et physiologique. Cette restriction comportementale est mise en évidence par le modèle des cinq domaines (Fletcher et al., 2021), qui permet d’évaluer le bien-être animal en intégrant à la fois des critères physiologiques et des dimensions psychologiques. Ce modèle repose sur cinq aspects interconnectés : la nutrition, l’environnement, la santé, le comportement et l’expérience mentale. L’altération de ces domaines, notamment par l’isolement social et la restriction de mouvement, peut induire du stress chronique et des déséquilibres physiologiques, compromettant la santé globale des chevaux.
Nous avons démontré qu’au-delà de la détérioration du bien-être (Ruet et al., 2019), les chevaux logés en continu dans des boxes individuels et nourris avec des régimes hyperconcentrés subissent des altérations substantielles de leurs communautés microbiennes intestinales, suggérant le lien entre le bien-être et le microbiote intestinal (Mach et al., 2020). Le microbiote intestinal, composé de bactéries, d’archées, de virus, d’eucaryotes et de champignons, joue un rôle dans la santé animale à travers ses interactions complexes avec l’hôte. Ces interactions, probablement favorisées par la diversité génétique et fonctionnelle du microbiote, contribuent aux processus physiologiques et immunitaires essentiels (Mach et al., 2020). Le microbiote intestinal est très réactif aux changements environnementaux, aux conditions d’élevage, aux infections et aux facteurs propres à l’hôte (Fassarella et al., 2021). La composition du microbiote intestinal adulte peut notamment changer rapidement avec des changements alimentaires et des perturbations importantes telles que l’administration d’antibiotiques ou l’exposition à un stress chronique (Brugman et al., 2018).
Le stress chronique, par ses effets néfastes sur la santé intestinale (Kelly et al., 2015 ; Karl et al., 2018 ; Mayer, 2000), met en lumière l’importance de l’axe microbiote–intestin–cerveau, une relation bidirectionnelle complexe qui influence profondément le bien-être (Carabotti et al., 2015 ; O’Mahony et al., 2015 ; Martin et al., 2018). En effet, les altérations de la composition microbienne intestinale induites par le stress sont associées à une production modifiée de neuromédiateurs clés, tels que la sérotonine, dopamine, et le GABA (acide γ-aminobutyrique), qui sont essentiels à la régulation de l’anxiété et du comportement (Foster et al., 2017). De plus, les métabolites microbiens, tels que les acides gras à chaîne courte (SCFA), peuvent contribuer à la modulation des réponses neurophysiologiques et comportementales (Rhee et al., 2009 ; O’Mahony et al., 2015). Les métabolites microbiens peuvent aussi stimuler les nerfs sensoriels dans l’intestin, ce qui renforce l’activité de la dopamine dans le cerveau (Dohnalová et al., 2022). Cette interaction pourrait accroître la motivation à adopter différents comportements.
Par ailleurs, les catécholamines et d’autres hormones neuroendocriniennes modulent directement la croissance microbienne (Lyte et al., 2011). Que l’intestin soit un élément central de la santé et du bien-être est reconnu depuis l’Antiquité. Le médecin grec Hippocrate, qui a vécu entre 460 et 370 av. J.-C., est souvent crédité d’avoir dit : « Toutes les maladies commencent dans l’intestin », soulignant le rôle crucial de la santé intestinale dans la santé et le bien-être. Cette sagesse antique nous conduit au concept de résilience du microbiote, c’est-à-dire sa capacité à restaurer un équilibre fonctionnel après une perturbation, en conservant ses propriétés essentielles malgré les variations environnementales. À l’inverse, la résistance correspond à la capacité du microbiote à rester inchangé malgré les perturbations (Lozupone et al., 2012 ; Lloyd-Price et al., 2016).
La résilience du microbiote face aux stress biotiques et abiotiques est censée avoir des implications importantes pour la santé et le bien-être, garantissant sa capacité à s’adapter et à se restaurer face aux perturbations, tout en maintenant ses fonctions, structures et processus essentiels. Cette résilience, bien que généralement bénéfique, peut constituer un obstacle dans certaines circonstances. Un microbiote très résilient, mais dont l’impact est négatif pour l’hôte, peut être difficile à corriger (Bordenstein & Theis, 2015). Cet équilibre entre stabilité et adaptabilité souligne les complexités de la résilience du microbiote intestinal. Notre étude sur les chevaux de sport d’élite dans un état de stress chronique a révélé un microbiote résilient qui restait nuisible malgré une courte exposition à des changements environnementaux (Mach et al., 2020, 2021a). Nous avons montré que de courtes expositions à des environnements positifs, tels que le pâturage en groupe avec des congénères, ne suffisent pas à changer le microbiote vers un état plus équilibré et bénéfique pour la santé et le bien-être. Cela souligne l’importance d’une exposition prolongée et régulière à un environnement enrichissant pour favoriser des modifications durables du microbiote et soutenir le bien-être animal.
Dans cet article de synthèse, nous explorerons la relation complexe entre le microbiote intestinal et le bien-être animal, en soulignant le rôle crucial de la résilience du microbiote dans la promotion de la santé et du bien-être. De plus, nous recommandons l’accès au pâturage en groupe pour promouvoir des comportements naturels et réduire le stress chronique. Les pratiques agroécologiques, qui mettent l’accent sur le pâturage naturel et l’utilisation durable des terres, offrent un cadre optimal pour favoriser ces interactions positives. En intégrant ces pratiques, nous pouvons favoriser des communautés microbiennes intestinales bénéfiques, tout en soutenant la santé globale des chevaux dans un environnement respectueux de leur biologie et de leur bien-être.
1. Le microbiote intestinal : un acteur clé dans la santé équine
Le microbiote intestinal, composé de bactéries, archées, virus, eucaryotes et champignons, joue un rôle crucial dans la digestion, le renforcement du système immunitaire et la protection de la muqueuse intestinale (Noverr & Huffnagle, 2004 ; Nicholson et al., 2012 ; Donaldson et al., 2015). Il possède des effets antioxydants et favorise la régulation métabolique (Michaudel & Sokol, 2020) (figure 1). Les avancées en recherche multi-omiques ont détaillé la structure taxonomique, les fonctions et les profils métaboliques du microbiote intestinal, notamment son développement après la naissance, les différences selon les états de santé, les performances et la modélisation prédictive des maladies (Mach et al., 2017b ; Kauter et al., 2019 ; Mach et al., 2021b, 2022).
Figure 1. Le rôle du microbiote intestinal dans la santé équine.
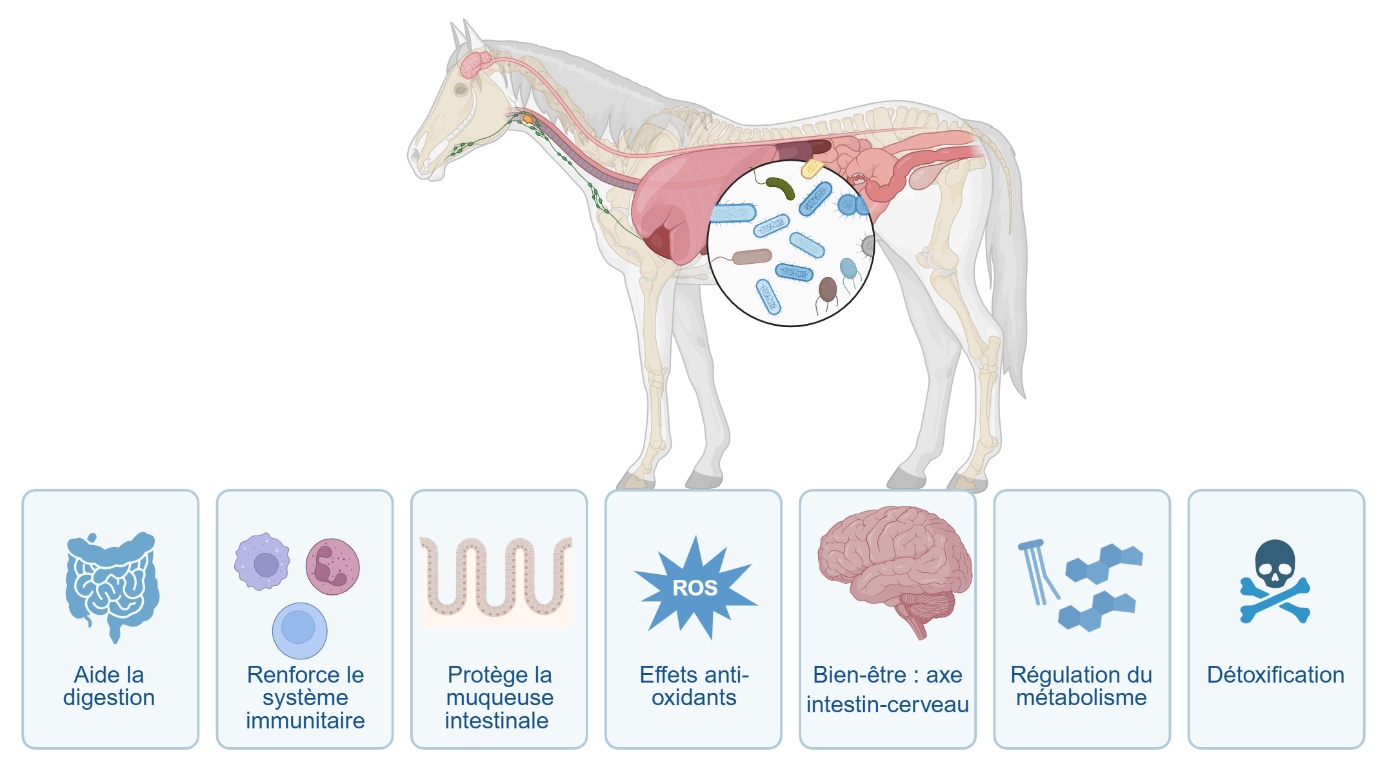
Chez les chevaux, nous avons récemment généré un catalogue des gènes microbiens intestinaux représentant plus de 25 millions de gènes non redondants, élargissant ainsi l’état actuel de diversité pour le microbiome intestinal équin (Mach et al., 2022). La construction de ce catalogue de génomes de micro-organismes a aussi multiplié par vingt le nombre de genres connus résidant dans le tractus gastro-intestinal des chevaux (Garrett et al., 2002 ; Yamano et al., 2008 ; Grønvold et al., 2010 ; Rodriguez et al., 2015 ; Schoster et al., 2016 ; Mach et al., 2017a ; Clark et al., 2018 ; Salem et al., 2018 ; Stewart et al., 2018 ; Destrez et al., 2019 ; Plancade et al., 2019 ; Walshe et al., 2019 ; Mach et al., 2020 ; Massacci et al., 2020 ; Mach et al., 2021a, 2021b ; Silvers et al., 2021 ; Theelen et al., 2021 ; Boisseau et al., 2023 ; Gomez et al., 2023 ; Park et al., 2024). Ce catalogue a également révélé un nombre sans précédent d’espèces procaryotes et eucaryotes, principalement issues des phylums Ascomycota, Ciliophora, Basidiomycota, Chytridiomycota, Evosea et Apicomplexa. De manière intéressante, ce catalogue a capturé un large éventail de fonctions spécifiques, suggérant que les microbiomes intestinaux équins possèdent des capacités fonctionnelles adaptées pour exploiter de manière remarquable l’énergie des ressources alimentaires, microbiennes, hôtes et pour la réparation tissulaire (Barton et al., 2018).
Le microbiome intestinal produit des milliers de métabolites qui peuvent potentiellement influencer de nombreux aspects de la physiologie de l’hôte et les activités de nutrition croisée entre micro-organismes (Donia & Fischbach, 2015 ; Husted et al., 2017 ; Mach & Fuster-Botella, 2017 ; Ticinesi et al., 2019 ; Mach et al., 2020, 2021b). Représentant un vaste réservoir de composés bioactifs (> 830 métabolites microbiens intestinaux identifiés chez les humains), le microbiote intestinal produit des molécules comme les SCFA, la vitamine B12, les acides aminés, l’histamine, ainsi que des neurotransmetteurs (Dohnalová et al., 2022). Ces métabolites peuvent agir localement dans l’intestin ou s’accumuler à des concentrations pouvant atteindre le millimolaire dans différents fluides corporels (Fischbach, 2018), influençant, par exemple, la performance athlétique (Li et al., 2025) et la fonction cérébrale et le comportement. À travers l’axe microbiote–intestin–cerveau, un réseau bidirectionnel qui influence les fonctions neurophysiologiques et comportementales, des métabolites produits par le microbiote tels que le butyrate, le propionate et l’acétate, peuvent influencer le fonctionnement psychologique. Ils exercent leurs effets sur le cerveau par des mécanismes directs via la circulation sanguine, ainsi que par des voies hormonales, immunitaires et neuronales indirectes (Dalile et al., 2019). De même, le tryptophane, précurseur de la sérotonine, est transformé par certaines bactéries intestinales, influençant directement la régulation de l’humeur et la réponse au stress (Deng et al., 2021). Par ailleurs, des espèces microbiennes comme Lactobacillus et Bifidobacterium participent à la production de GABA, un neurotransmetteur inhibiteur clé dans la régulation de l’anxiété et du comportement (Yunes et al., 2016). En outre, la dopamine, impliquée dans la régulation des fonctions cognitives, notamment la prise de décision, l’attention, la mémoire, la motivation, peut être modulée par certaines bactéries intestinales (González-Arancibia et al., 2019).
En termes généraux, le microbiote intestinal répond aux changements créés par l’environnement, les maladies et les facteurs liés à l’hôte. En effet, la composition du microbiote intestinal des chevaux adultes peut changer en quelques jours lorsqu’elle est confrontée à des changements alimentaires (Destrez et al., 2015, 2019 ; Salem et al., 2018). Ces changements influencent bien plus que la fonction digestive – ils jouent un rôle clé dans le comportement et la réactivité des chevaux. Par exemple, des études (Bulmer et al., 2019 ; Destrez et al., 2019) ont montré que des chevaux soumis à un régime riche en fibres consacrent davantage de temps à explorer leur environnement à la recherche de nourriture alors que ceux nourris avec un régime riche en amidon présentent des comportements de changement de rythme plus fréquents. En outre, de grandes perturbations, comme l’administration d’antibiotiques (Gomez et al., 2023) ou le stress physique, alimentaire et/ou social (Destrez et al., 2015 ; Mach et al., 2021b ; Silvers et al., 2021) peuvent altérer durablement le microbiote intestinal vers différents états stables, qu’ils soient « bénéfiques » ou non (Lozupone et al., 2012). Les dysbioses impliquent un déséquilibre dans la composition, la diversité et le fonctionnement des communautés microbiennes intestinales, souvent caractérisé par une réduction de la diversité microbienne et une prolifération de micro-organismes potentiellement pathogènes (Brüssow, 2020). Par exemple, une dysbiose induite par l’administration d’antibiotiques favorise la colonisation ou la prolifération de pathogènes, tels que Clostridioides (anciennement Clostridium) difficile (Barr et al., 2013). La dysbiose peut entraîner des troubles gastro-intestinaux, une perméabilité intestinale et un risque accru d’infections (Shin et al., 2015). Elle peut également impacter la santé mentale, contribuant à l’apparition d’états d’anxiété ou dépressifs via l’axe intestin–cerveau (Foster et al., 2017 ; Deng et al., 2021 ; Warren et al., 2024).
2. Stress : architecte du microbiote intestinal équin
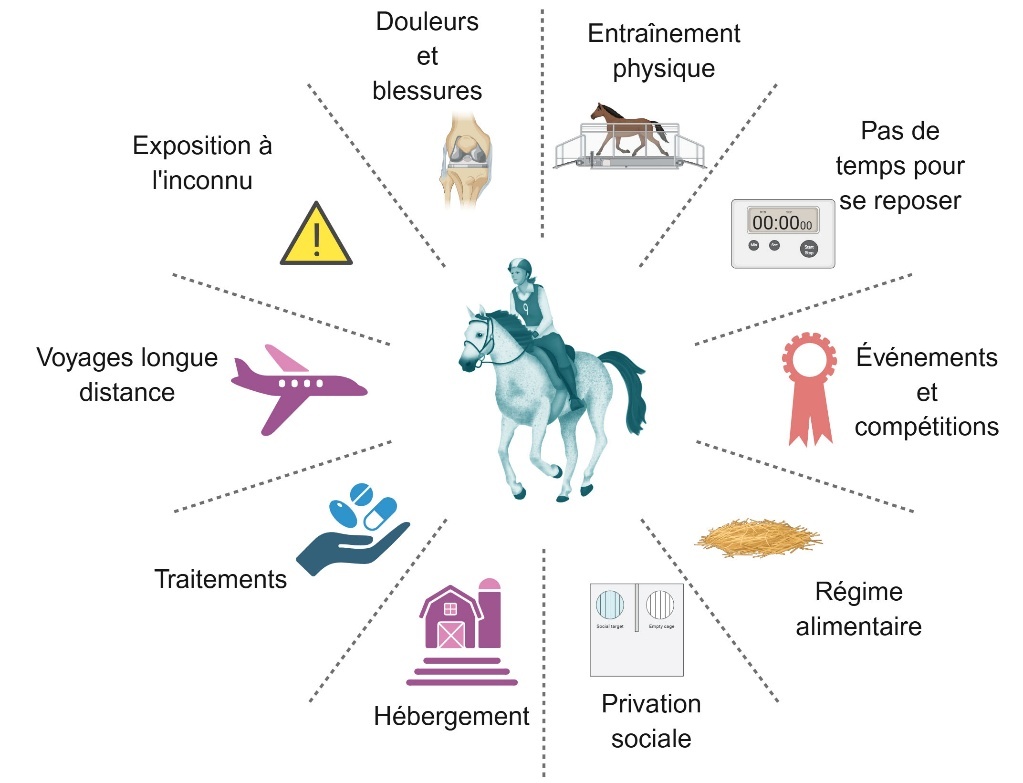
Le stress, qu’il soit biotique ou abiotique, influence les mécanismes adaptatifs des organismes en modulant divers processus physiologiques et biologiques. Il joue également un rôle dans la dynamique du microbiote intestinal, pouvant altérer sa composition et ses interactions avec l’hôte, ce qui peut avoir des implications sur la santé et l’homéostasie globale (Mach et al., 2021b ; Silvers et al., 2021 ; Park et al., 2024). Le stress est une réponse généralisée à des défis menaçant l’intégrité de l’organisme, induisant des changements physiologiques pouvant impacter les fonctions cognitives (Ulrich-Lai & Herman, 2009). Chez les chevaux, l’enfermement dans des boxes individuels pour des périodes prolongées, l’exposition à des environnements inconnus, les longs déplacements, les traitements médicaux, l’isolement social, des régimes alimentaires inadéquats, la participation à des événements et compétitions, le manque de repos et un entraînement intense induisent tous des réponses de stress physiologiques et comportementales (figure 2). Ces conditions de vie entraînent une activation prolongée de l’axe « hypothalamic-pituitary-adrenal » (HPA), responsable de la production de cortisol, l’hormone du stress. Une élévation persistante des niveaux de cortisol peut altérer la régulation du microbiote intestinal, entraînant une dysbiose qui affecte l’axe microbiote–intestin–cerveau (Ruet et al., 2019 ; Warren et al., 2024).
Figure 2. Facteurs de stress impactant le microbiote intestinal des chevaux.
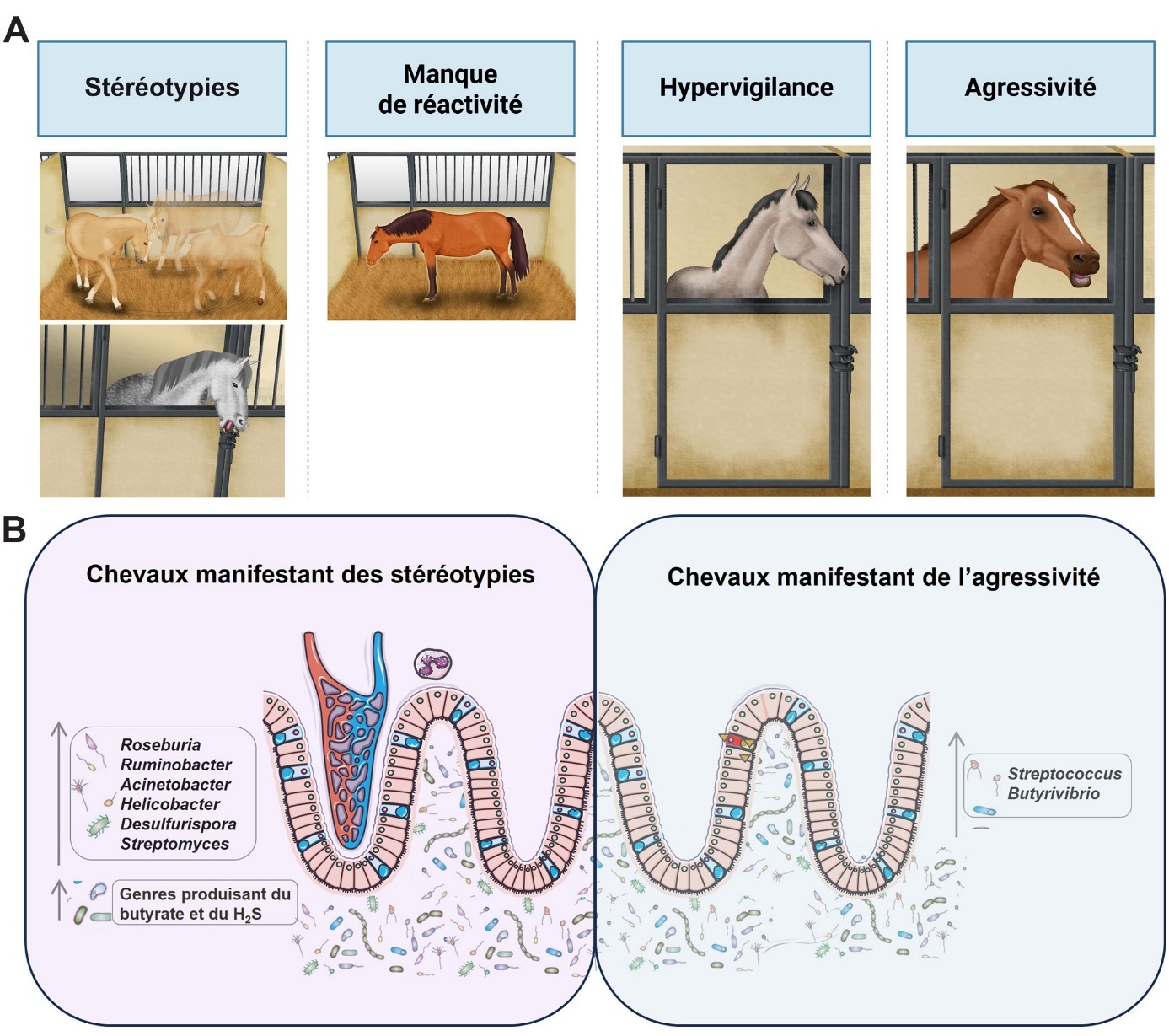
En étudiant une cohorte de 185 chevaux pendant huit mois, notre équipe a observé des manifestations de stress chronique chez les chevaux athlètes dues aux conditions de vie des animaux (logement individuel en box, alimentation concentrée, forte pression d’entraînement et d’événements) : 17 % des chevaux présentaient des stéréotypies, qu’elles soient orales ou liées à la locomotion. De plus, 99 % des individus ont montré une absence de réactivité à leur environnement au moins une fois au cours des huit mois d’observation. L’hypervigilance a été observée chez 75 % des individus au moins une fois durant l’étude, ces chevaux manifestant des signes d’alerte excessive et prolongée. Enfin, des comportements agressifs ont été détectés chez 43 % des chevaux, que ce soit envers d’autres individus ou des humains au moins une fois pendant l’étude (Mach et al., 2020) (figure 3A).
Le stress se manifeste non seulement par des effets comportementaux, mais compromet également l’intégrité de la barrière intestinale et perturbe le microbiote existant (Kelly et al., 2015 ; Bassett et al., 2019). Chez l’humain, de nombreuses études ont établi un lien entre la dysbiose et diverses pathologies psychiatriques ou mentales telles que la dépression, l’autisme, l’anxiété, la schizophrénie, la maladie de Parkinson et la maladie d’Alzheimer (Rhee et al., 2009 ; Luna & Foster, 2015 ; Burokas et al., 2017 ; Du et al., 2020). Des recherches démontrent également comment le microbiote joue un rôle dans les processus cognitifs, qui englobent l’ensemble des fonctions mentales impliquées dans la perception, la mémoire, l’apprentissage, la formation de concepts, le langage et l’attention (Bruce-Keller et al., 2017). Divers modèles animaux ont été essentiels pour identifier les profils caractéristiques de microbiote et les effets du stress sur les fonctions cognitives. Les souris axéniques et la dysbiose intestinale induite par des antibiotiques sont deux approches couramment utilisées pour établir un lien de causalité entre le microbiote intestinal et le cerveau (Fröhlich et al., 2016), évoquant le concept de l’axe microbiote–intestin–cerveau. Cet axe implique le système nerveux central (CNS), le système nerveux entérique (ENS), le métabolisme du tryptophane, le nerf vague, et le système immunitaire (Luna & Foster, 2015 ; Du et al., 2020). De plus, certains métabolites microbiens peuvent traverser la barrière hémato-encéphalique et altérer la fonction neuronale, influençant le comportement et l’état émotionnel.
Les chevaux, eux aussi, peuvent servir de modèles précieux pour étudier les troubles liés au stress. Les niveaux élevés d’exercice auxquels ils sont soumis, combinés au logement en boxes individuels et à une alimentation composée principalement de concentrés, augmentent significativement leur niveau de stress (Ruet et al., 2019). Cette combinaison unique de facteurs fait des chevaux un excellent modèle pour comprendre l’impact du stress chronique sur le microbiote intestinal.
Chez les chevaux, le rôle du microbiote intestinal dans les changements comportementaux a été avancé par Destrez et al. (2015), qui ont observé que la concentration de bactéries amylolytiques et l’abondance des Succinivibrionaceae étaient positivement corrélées au comportement d’alerte, considéré comme une forme d’hypervigilance, après un régime pauvre en fibres mais riche en amidon. Chez les poneys nourris avec des régimes riches en amidon, une réactivité comportementale accrue a été liée à des changements dans le microbiote intestinal, suggérant que la composition du microbiote intestinal et le comportement sont liés et s’influencent mutuellement (Bulmer et al., 2019). Notre équipe, à son tour, a démontré que chez les chevaux d’élite, des indicateurs comportementaux de bien-être, tels que les stéréotypies, l’hypervigilance et l’agressivité, ont été associés à des profils de microbiote intestinal différents (Mach et al., 2020) (figure 3B). Plus spécifiquement, l’abondance des genres Desulfurispora, Helicobacter, Acinetobacter, Ruminobacter, Pseudobacteroides, Roseburia et des membres de la famille Marinilabiliaceae était plus élevée chez les chevaux présentant des stéréotypies orales. En revanche, le genre Streptomyces était plus abondant chez ceux présentant des stéréotypies de locomotion. Une fréquence plus élevée d’agressivité était associée à une prolifération des genres Streptococcus et Butyrivibrio spp., mais inversement corrélée à la prévalence d’Anaeroplasma. Des premières indications suggèrent une association entre le genre Streptococcus et les réponses au stress chez les mammifères, mais des recherches approfondies restent nécessaires pour mieux comprendre ce lien (Nguyen et al., 2015). Les indices de diversité ont indiqué que l’hypervigilance était associée à un microbiote plus hétérogène. Bien qu’il n’y ait pas de différences dans le nombre d’espèces microbiennes entre les animaux, l’hypervigilance a induit des différences notables dans l’abondance de certaines bactéries comme Denitrobacterium et Dehalobacterium (Mach et al., 2020). Jusqu’à présent, aucune étude n’établit une association entre ces deux genres bactériens et le stress. Des expériences supplémentaires sont nécessaires pour corroborer ces résultats.
En plus d’analyser les profils de microbiote et le comportement, la caractérisation du stress chronique chez les individus a été évaluée par la mesure de la longueur des télomères et des niveaux de cortisol, ainsi que le profilage transcriptomique dans le sang. Ces paramètres fournissent une compréhension globale des changements physiologiques et moléculaires associés au stress chronique chez les chevaux (Foury et al., 2023). Cela montre comment le stress chronique est lié aux profils du microbiote intestinal et, à son tour, à la santé globale des chevaux. Des analyses complémentaires, telles que la métagénomique par « shotgun », la métatranscriptomique et la métabolomique, pourraient encore améliorer les résultats. Ces techniques avancées fourniraient des informations plus approfondies sur les capacités fonctionnelles du microbiote, les profils d’expression génétique et les changements métaboliques, offrant une vue plus holistique de l’impact du stress chronique sur l’axe microbiote–intestin–cerveau.
Figure 3. Manifestations du stress chez les chevaux d’élite.
3. Résilience dévoilée : son côté sombre
La résilience est la capacité d’un système à tolérer le stress avant de passer à un nouvel état avec des fonctions différentes (Lozupone et al., 2012 ; Holling & Robin, 2013 ; Sommer et al., 2017 ; Fassarella et al., 2021). Ainsi, la résilience du microbiote intestinal correspond à sa capacité à maintenir un équilibre fonctionnel face aux perturbations et à retrouver un état stable après des événements transitoires tels que les infections, les traitements antibiotiques, une disponibilité réduite en nutriments ou un stress. Cette faculté repose sur l’adaptabilité des communautés microbiennes et leur interaction dynamique avec l’hôte (Sommer et al., 2017). La résilience du microbiote intestinal est associée à des mécanismes biologiques complexes impliquant la compétition pour les ressources, la production de substances antimicrobiennes, l’inhibition métabolique des espèces opportunistes, la formation de biofilms favorisant la stabilité microbienne, ainsi que la régulation du comportement collectif via le « quorum sensing » (mode de communication bactérienne basé sur des signaux chimiques, permettant d’adapter leur comportement selon la densité de leur population) (Lozupone et al., 2012 ; Mach & Clark, 2017 ; Sommer et al., 2017). L’hôte contribue également, en libérant des antimicrobiens, en produisant du mucus et en contrôlant les propriétés du tractus gastro-intestinal (Mach, 2024).
Constatant un profil microbiotique moins diversifié chez les chevaux athlètes soumis à un stress chronique dû aux pressions physiques et émotionnelles continues des compétitions et de l’entraînement intensif (Mach et al., 2020), nous avons cherché à déterminer si ce microbiote était intrinsèquement résilient aux changements. Pour tester cette hypothèse, nous avons induit une perturbation environnementale positive – associant l’accès au pâturage et l’interaction sociale avec des congénères – pendant une courte période de 1,5 mois sur la moitié de notre cohorte. En particulier, 27 athlètes ont été suivis avant et après le pâturage, et comparés à 18 chevaux maintenus dans des boxes individuels. Nous avons ensuite évalué si cette intervention modifiait le microbiote, tant sur le plan de sa composition que de sa fonctionnalité (Mach et al., 2021a). Globalement, la composition et la diversité du microbiote des animaux envoyés au pâturage pendant une courte période n’ont pas changé. Bien que certains genres microbiens aient montré des variations, leur abondance est revenue à son niveau initial trois semaines après la réintégration en box, ce qui met en évidence une forte résilience microbienne et la difficulté d’établir une nouvelle structure écologique. L’adoption d’un microbiote différent nécessite de surmonter des barrières écologiques qui limitent la colonisation de nouvelles bactéries. Ces barrières résultent généralement d’interactions complexes entre les micro-organismes, le système immunitaire de l’hôte et les conditions environnementales du tractus intestinal (Zhang et al., 2009). Ce phénomène est particulièrement notable lorsque le microbiote est hautement résilient, surtout si sa composition et ses fonctions sont défavorables à l’hôte. Un microbiote stable mais nuisible peut être extrêmement difficile à modifier. Acquérir un écosystème intestinal avec un potentiel de résilience élevé rend difficile la gestion des interventions qui peuvent briser le cercle vicieux de l’apathie et du stress et rétablir la santé et le bien-être.
Ainsi, comprendre les mécanismes derrière cette résilience est crucial pour développer des stratégies efficaces pour promouvoir la santé intestinale et le bien-être général des chevaux. Ces résultats suggèrent que des pratiques de gestion à long terme sont nécessaires pour modifier le lien entre le comportement et l’écosystème intestinal. Ainsi, la résilience seule n’est pas toujours bénéfique pour la santé et la performance ; un microbiote diversifié et fonctionnel est tout aussi essentiel.
4. Adopter et appliquer des pratiques agroécologiques
Les effets délétères potentiels de la résilience du microbiote et ses implications pour la santé et le bien-être des chevaux soulignent le besoin urgent de stratégies de gestion alternatives alignées sur les principes agroécologiques.
L’agroécologie figure parmi les options les plus prometteuses pour atténuer les impacts négatifs de l’élevage sur l’environnement et développer des systèmes locaux reposant sur des méthodes d’élevage éthiquement acceptables (Dumont et al., 2025). L’agroécologie met l’accent sur des pratiques de gestion animale durables, favorisant la biodiversité, l’équilibre écologique et le bien-être. Elle intègre également des dimensions sociales et politiques essentielles, telles que l’organisation communautaire, l’autonomie des acteurs et l’accès aux ressources foncières (Dumont et al., 2025).
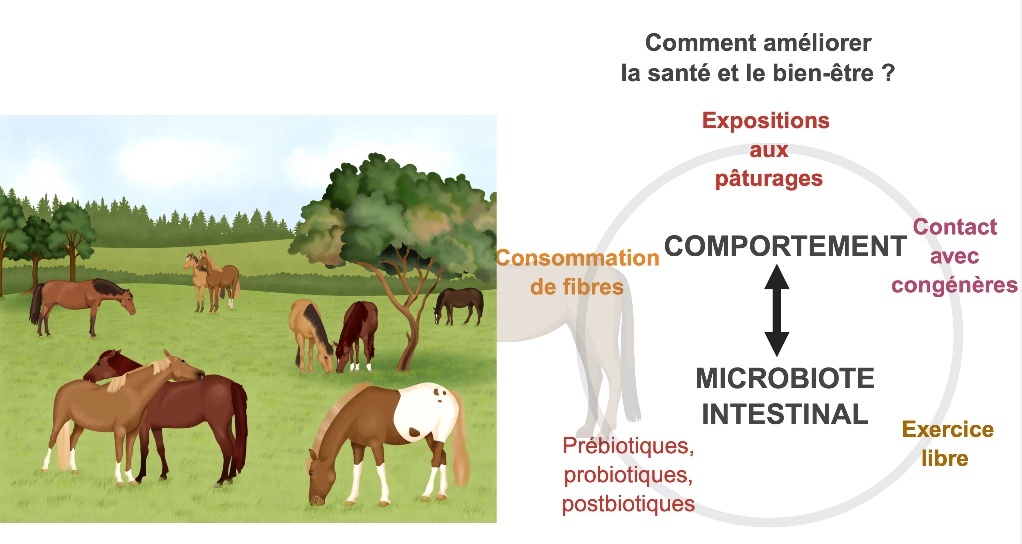
Pour les chevaux, cela signifie adopter notamment des pratiques de gestion alignées sur leurs comportements et besoins naturels. Permettre aux chevaux de passer plus de temps dans des pâturages avec leurs congénères peut significativement améliorer leur bien-être en réduisant le stress et en favorisant un microbiote intestinal plus sain. Comme l’expliquent Julliand et Grimm (2017), des régimes riches en fibres entraînent une augmentation de la diversité microbienne et des modifications du milieu intestinal, notamment une réduction de la matière sèche et de la production d’acide valérique. Ces mêmes auteurs ont également démontré qu’une alimentation riche en fibres favorise des comportements alimentaires naturels et réduit les réactions excitables, contribuant ainsi à la santé et au bien-être des chevaux (Raspa et al., 2022). Les systèmes basés sur le pâturage permettent aux chevaux de brouter, de socialiser et de s’engager dans des comportements naturels (figure 4). Ces environnements favorisent la santé globale et produisent des chevaux robustes et athlétiques. Par exemple, les chevaux élevés dans de tels systèmes sont très prisés pour la conduite traditionnelle dans la région de la Camargue (France) et leur endurance exceptionnelle dans les courses, comme les chevaux arabes dans la région du Causse (Jouven et al., 2016). En permettant aux chevaux de prospérer dans un habitat naturel, nous pouvons garantir qu’ils développent la force et l’agilité nécessaires pour ces activités exigeantes.
De plus, le pâturage des chevaux a un impact positif sur la préservation des habitats naturels, la diversité des espèces végétales et la fertilisation des sols, bénéficiant à l’ensemble de l’écosystème (Dumont et al., 2013). Les chevaux sont excellents pour contrôler les herbes compétitives et maintenir des zones ouvertes en pâturant. Comme l’ont avancé Fleurance et Dumont (2020) lors de leur présentation orale à l’EAAP, les chevaux sont des herbivores qui adaptent leur stratégie de pâturage en sélectionnant des zones de végétation courte à forte valeur écologique. Ce comportement favorise l’hétérogénéité du couvert végétal et contribue à la préservation des prairies naturelles. Les chevaux influencent donc directement la structure et la diversité des habitats herbacés, renforçant ainsi leur rôle écologique dans la gestion des paysages. De plus, le pâturage des chevaux entraîne une augmentation de l’abondance des légumineuses dans les zones de pâturage stable ainsi que certains effets sur la diversité des insectes. En particulier, le pâturage des chevaux crée une mosaïque de zones de hautes et de courtes herbes, soutenant une biodiversité élevée de plantes à fleurs et d’insectes pollinisateurs (Thulin et al., 2025) et bénéficiant à diverses espèces animales (Jouven et al., 2016). En Camargue, le pâturage des chevaux a permis de remplacer les plantes hautes et compétitives par des plantes plus petites et compétitives en nutriments, permettant ainsi à plus d’espèces de coexister. Cependant, les pratiques agricoles jouent également un rôle. Les modifications de la gestion des pâturages, de la densité de chargement et de la rotation du pâturage peuvent influencer la succession végétale et la stabilité des écosystèmes (Jouven et al., 2016). Dans le centre de la France, les chevaux ont surpassé les bovins dans le contrôle des espèces prairiales de faible valeur nutritive et ont favorisé celles de valeur nutritive moyenne. Les chevaux se sont également révélés plus efficaces que les moutons pour améliorer la valeur pastorale des prairies subméditerranéennes. Enfin, le pâturage des chevaux contribue à promouvoir la santé des sols en améliorant le cycle des nutriments et en réduisant l’érosion des sols.
En intégrant les principes agroécologiques dans la gestion des chevaux, nous pouvons créer des environnements qui soutiennent la diversité et la santé des animaux ainsi que celle de leurs écosystèmes. L’accès aux pâturages, la consommation de fibres, l’exercice libre et le contact social avec les congénères, jouent un rôle essentiel dans le bien-être et la résilience des équidés. En complément, l’ajout de probiotiques, prébiotiques et postbiotiques peut renforcer l’équilibre du microbiote intestinal, optimisant ainsi la santé digestive et immunitaire des chevaux. Cette approche combinée, offre une stratégie holistique visant à améliorer le bien-être des chevaux tout en préservant la durabilité des systèmes d’élevage.
Figure 4. Pratiques agroécologiques pour des chevaux et des écosystèmes en meilleure santé.
Conclusion
Le stress chronique et les pratiques d’élevage peuvent affecter la composition et la fonction du microbiote intestinal, entraînant des problèmes de santé et de bien-être importants. L’adoption des principes agroécologiques et le respect de leurs comportements naturels, tels que le pâturage prolongé et la socialisation, peuvent contribuer à la diversité du microbiote intestinal et favoriser leur santé et leur bien-être global.
Remerciements
L’auteur tient à exprimer sa gratitude envers Léa Lansade, Alice Ruet, Marie-Pierre Moisan, Aline Foury et le personnel de l’Institut français du cheval et de l’équitation (IFCE) et de l’Institut national de la recherche pour l’agriculture, l’alimentation et l’environnement (INRAE) de Jouy-en-Josas et Nouzilly (France). Je remercie particulièrement Patrick Galloux, Xavier Goupil, Isabelle Burgaud, Sophie Biau, le Colonel Patrick Teisserenc, Jean-Marie Yvon, Milena Trosh et tous les soigneurs d’animaux pour leur collaboration lors de l’expérimentation au Cadre noir de Saumur. La production des ensembles de données utilisés dans l’étude a été financée par des subventions du Fonds Éperon et de l’IFCE.
Notes
- 1. Cet article est issu d’une présentation aux Carrefours de l’innovation agronomique (« Élevages herbivores : les apports de la biodiversité, des sols aux territoires »), le 12 décembre 2024 à Rennes. https://ciag.hub.inrae.fr/les-carrefours-de-l-innovation/elevages-herbivores-les-apports-de-la-biodiversite-des-sols-aux-territoires
Références
- Arnold, G. W. (1984). Comparison of the time budgets and circadian patterns of maintenance activities in sheep, cattle and horses grouped together. Applied Animal Behaviour Science, 13(1-2), 19-30. doi:10.1016/0168-1591(84)90048-0
- Barr, B. S., Waldridge, B. M., Morresey, P. R., Reed, S. M., Clark, C., Belgrave, R., Donecker, J. M., & Weigel, D. J. (2013). Antimicrobial‐associated diarrhoea in three equine referral practices. Equine Veterinary Journal, 45(2), 154-158. doi:10.1111/j.2042-3306.2012.00595.x
- Barton, W., Penney, N. C., Cronin, O., Garcia-Perez, I., Molloy, M. G., Holmes, E., Shanahan, F., Cotter, P. D., & O’Sullivan, O. (2018). The microbiome of professional athletes differs from that of more sedentary subjects in composition and particularly at the functional metabolic level. Gut, 67(4), 625-633. doi:10.1136/gutjnl-2016-313627
- Bassett, S. A., Young, W., Fraser, K., Dalziel, J. E., Webster, J., Ryan, L., Fitzgerald, P., Stanton, C., Dinan, T. G., Cryan, J. F., Clarke, G., Hyland, N., & Roy, N. C. (2019). Metabolome and microbiome profiling of a stress-sensitive rat model of gut-brain axis dysfunction. Scientific Reports, 9(1), 14026. doi:10.1038/s41598-019-50593-3
- Boisseau, M., Dhorne-Pollet, S., Bars-Cortina, D., Courtot, É., Serreau, D., Annonay, G., Lluch, J., Gesbert, A., Reigner, F., Sallé, G., & Mach, N. (2023). Species interactions, stability, and resilience of the gut microbiota - Helminth assemblage in horses. IScience, 26(2), 106044. doi:10.1016/j.isci.2023.106044
- Bordenstein, S. R., & Theis, K. R. (2015). Host biology in light of the microbiome: Ten principles of holobionts and hologenomes. PLoS Biology, 13(8), e1002226. doi:10.1371/journal.pbio.1002226
- Bruce-Keller, A. J., Fernandez-Kim, S.-O., Townsend, R. L., Kruger, C., Carmouche, R., Newman, S., Salbaum, J. M., & Berthoud, H. R. (2017). Maternal obese-Type gut microbiota differentially impact cognition, anxiety and compulsive behavior in male and female offspring in mice. PLoS ONE, 12(4), e0175577. doi:10.1371/journal.pone.0175577
- Brugman, S., Ikeda-Ohtsubo, W., Braber, S., Folkerts, G., Pieterse, C. M. J., & Bakker, P. A. H. M. (2018). A comparative review on microbiota manipulation: lessons from fish, plants, livestock, and human research. Frontiers in Nutrition, 5, 80. doi:10.3389/fnut.2018.00080
- Brüssow, H. (2020). Problems with the concept of gut microbiota dysbiosis. Microbial Biotechnology, 13(2), 423-434. doi:10.1111/1751-7915.13479
- Bulmer, L. S., Murray, J.-A., Burns, N. M., Garber, A., Wemelsfelder, F., McEwan, N. R., & Hastie, P. M. (2019). High-starch diets alter equine faecal microbiota and increase behavioural reactivity. Scientific Reports, 9, 18621. doi:10.1038/s41598-019-54039-8
- Burokas, A., Arboleya, S., Moloney, R. D., Peterson, V. L., Murphy, K., Clarke, G., Stanton, C., Dinan, T. G., & Cryan, J. F. (2017). Targeting the Microbiota-Gut-Brain Axis: Prebiotics Have Anxiolytic and Antidepressant-like Effects and Reverse the Impact of Chronic Stress in Mice. Biological Psychiatry, 82, 472-487. doi:10.1016/j.biopsych.2016.12.031
- Carabotti, M., Scirocco, A., Maselli, M. A., & Severi, C. (2015). The gut-brain axis: Interactions between enteric microbiota, central and enteric nervous systems. Annals of Gastroenterology, 28(2), 203-209. http://www.annalsgastro.gr/index.php/annalsgastro/article/view/1959
- Clark, A., Sallé, G., Ballan, V., Reigner, F., Meynadier, A., Cortet, J., Koch, C., Riou, M., Blanchard, A., & Mach, N. (2018). Strongyle Infection and Gut Microbiota: Profiling of Resistant and Susceptible Horses Over a Grazing Season. Frontiers in Physiology, 9. doi:10.3389/fphys.2018.00272
- Dalile, B., Van Oudenhove, L., Vervliet, B., & Verbeke, K. (2019). The role of short-chain fatty acids in microbiota–gut–brain communication. Nature Reviews Gastroenterology & Hepatology, 16(8), 461-478. doi:10.1038/s41575-019-0157-3
- Deng, Y., Zhou, M., Wang, J., Yao, J., Yu, J., Liu, W., Wu, L., Wang, J., & Gao, R. (2021). Involvement of the microbiota-gut-brain axis in chronic restraint stress: disturbances of the kynurenine metabolic pathway in both the gut and brain. Gut Microbes, 13(1). doi:10.1080/19490976.2020.1869501
- Destrez, A., Grimm, P., Cézilly, F., & Julliand, V. (2015). Changes of the hindgut microbiota due to high-starch diet can be associated with behavioral stress response in horses. Physiology & Behavior, 149, 159-164. doi:10.1016/j.physbeh.2015.05.039
- Destrez, A., Grimm, P., & Julliand, V. (2019). Dietary-induced modulation of the hindgut microbiota is related to behavioral responses during stressful events in horses. Physiology & Behavior, 202, 94-100. doi:10.1016/j.physbeh.2019.02.003
- Dohnalová, L., Lundgren, P., Carty, J. R. E., Goldstein, N., Wenski, S. L., Nanudorn, P., Thiengmag, S., Huang, K.-P., Litichevskiy, L., Descamps, H. C., Chellappa, K., Glassman, A., Kessler, S., Kim, J., Cox, T. O., Dmitrieva-Posocco, O., Wong, A. C., Allman, E. L., Ghosh, S., … Thaiss, C. A. (2022). A microbiome-dependent gut–brain pathway regulates motivation for exercise. Nature, 612(7941), 739-747. doi:10.1038/s41586-022-05525-z
- Donaldson, G. P., Lee, S. M., & Mazmanian, S. K. (2015). Gut biogeography of the bacterial microbiota. Nature Reviews Microbiology, 14(1), 20-32. doi:10.1038/nrmicro3552
- Donia, M. S., & Fischbach, M. A. (2015). Small molecules from the human microbiota. Science, 349(6246). doi:10.1126/science.1254766
- Du, Y., Gao, X.-R., Peng, L., & Ge, J.-F. (2020). Crosstalk between the microbiota-gut-brain axis and depression. Heliyon, 6, E04097. https://doi.org/10.1016/j.heliyon.2020.e04097
- Dumont, B., Fortun-Lamothe, L., Jouven, M., Thomas, M., & Tichit, M. (2013). Prospects from agroecology and industrial ecology for animal production in the 21st century. Animal, 7(6), 1028-1043. doi:10.1017/S1751731112002418
- Dumont, B., Barlagne, C., Cassart, P., Duval, J. E., Fanchone, A., Gourdine, J.-L., Huguenin-Elie, O., Kazakova, Y., Klötzli, J., Lüscher, A., Oteros-Rozas, E., Pomies, D., Rivera Ferre, M. G., Rossing, W. A. H., Stefanova, V., Swartebroeckx, A., & Zagaria, C. (2025). Principles, barriers and enablers to agroecological animal production systems: a qualitative approach based on five case studies. Animal, 19, 101367. doi:10.1016/j.animal.2024.101367
- Fassarella, M., Blaak, E. E., Penders, J., Nauta, A., Smidt, H., & Zoetendal, E. G. (2021). Gut microbiome stability and resilience: Elucidating the response to perturbations in order to modulate gut health. Gut, 70(3), 595-605. doi:10.1136/gutjnl-2020-321747
- Fischbach, M. A. (2018). Microbiome: Focus on Causation and Mechanism. Cell, 174(4), 785-790. doi:10.1016/j.cell.2018.07.038
- Fletcher, K., Cameron, L., & Freeman, M. (2021). Contemplating the Five Domains model of animal welfare assessment: UK horse owner perceptions of equine well-being. Animal Welfare, 30(3), 259-268. doi:10.7120/09627286.30.3.003
- Fleurance, G., & Dumont, B. (2020). How do grazing horses shape biodiversidy - stressing the lack of evidence in mesophile grasslands [Oral communication]. 71th Annual Meeting of the European Federation of Animal Science, Virtual Meeting. https://docs.eaap.org/boa/2020_EAAP_Book_of_Abstracts.pdf
- Foster, J. A., Rinaman, L., & Cryan, J. F. (2017). Stress & the gut-brain axis: Regulation by the microbiome. Neurobiology of Stress, 7, 124-136. doi:10.1016/j.ynstr.2017.03.001
- Foury, A., Mach, N., Ruet, A., Lansade, L., & Moisan, M. P. (2023). Transcriptomic signature related to poor welfare of sport horses. Comprehensive Psychoneuroendocrinology, 16, 100201. doi:10.1016/j.cpnec.2023.100201
- Fröhlich, E. E., Farzi, A., Mayerhofer, R., Reichmann, F., Jačan, A., Wagner, B., Zinser, E., Bordag, N., Magnes, C., Fröhlich, E., Kashofer, K., Gorkiewicz, G., & Holzer, P. (2016). Cognitive impairment by antibiotic-induced gut dysbiosis: Analysis of gut microbiota-brain communication. Brain, Behavior, and Immunity, 56, 140-155. https://doi.org/10.1016/j.bbi.2016.02.020
- Garrett, L. A., Brown, R., & Poxton, I. R. (2002). A comparative study of the intestinal microbiota of healthy horses and those suffering from equine grass sickness. Veterinary Microbiology, 87(1), 81-88. doi:10.1016/S0378-1135(02)00018-4
- Gomez, D., Toribio, R., Caddey, B., Costa, M., Vijan, S., & Dembek, K. (2023). Longitudinal effects of oral administration of antimicrobial drugs on fecal microbiota of horses. Journal of Veterinary Internal Medicine, 37(6), 2562-2572. doi:10.1111/jvim.16853
- González-Arancibia, C., Urrutia-Piñones, J., Illanes-González, J., Martinez-Pinto, J., Sotomayor-Zárate, R., Julio-Pieper, M., & Bravo, J. A. (2019). Do your gut microbes affect your brain dopamine? Psychopharmacology, 236(5), 1611-1622. doi:10.1007/s00213-019-05265-5
- Grønvold, A.-M. R., L’Abée-Lund, T. M., Strand, E., Sørum, H., Yannarell, A. C., & Mackie, R. I. (2010). Fecal microbiota of horses in the clinical setting: Potential effects of penicillin and general anesthesia. Veterinary Microbiology, 145(3-4), 366-372. doi:10.1016/j.vetmic.2010.03.023
- Holling, C. S., & Robin, L. (2013). Resilience and Stability of Ecological Systems (1973). In L. Robin, S. Sörlin, & P. Warde (Eds.), The Future of Nature: Documents of Global Change (pp. 245–260). Yale University Press. https://doi.org/10.2307/j.ctt5vm5bn.29
- Husted, A. S., Trauelsen, M., Rudenko, O., Hjorth, S. A., & Schwartz, T. W. (2017). GPCR-Mediated Signaling of Metabolites. Cell Metabolism, 25(4), 777-796. doi:10.1016/j.cmet.2017.03.008
- Jez, C., Coudurier, B., Cressent, M., Mea, F., Perrier-Cornet, P., & Rossier, E. (2015). The French horse industry in 2030: scenarios to inform decision-making. In C. Vial, & R. Evans (Eds.), The new equine economy in the 21st century (pp. 157-166). Wageningen Academic. https://doi.org/10.3920/978-90-8686-824-7_14
- Jouven, M., Vial, C., & Fleurance, G. (2016). Horses and rangelands: perspectives in Europe based on a French case study. Grass and Forage Science, 71(2), 178-194. doi:10.1111/gfs.12204
- Julliand, V., & Grimm, P. (2017). The Impact of Diet on the Hindgut Microbiome. Journal of Equine Veterinary Science, 52, 23-28. doi:10.1016/j.jevs.2017.03.002
- Karl, J. P., Hatch, A. M., Arcidiacono, S. M., Pearce, S. C., Pantoja-Feliciano, I. G., Doherty, L. A., & Soares, J. W. (2018). Effects of psychological, environmental and physical stressors on the gut microbiota. Frontiers in Microbiology, 9. doi:10.3389/fmicb.2018.02013
- Kauter, A., Epping, L., Semmler, T., Antao, E.-M., Kannapin, D., Stoeckle, S. D., Gehlen, H., Lübke-Becker, A., Günther, S., Wieler, L. H., & Walther, B. (2019). The gut microbiome of horses: current research on equine enteral microbiota and future perspectives. Animal Microbiome, 1(1). doi:10.1186/s42523-019-0013-3
- Kelly, J. R., Kennedy, P. J., Cryan, J. F., Dinan, T. G., Clarke, G., & Hyland, N. P. (2015). Breaking down the barriers: the gut microbiome, intestinal permeability and stress-related psychiatric disorders. Frontiers in Cellular Neuroscience, 9. doi:10.3389/fncel.2015.00392
- Li, C., Li, X., Liu, K., Xu, J., Yu, J., Liu, Z., Mach, N., Ni, W., Liu, C., Zhou, P., Wang, L., & Hu, S. (2025). Multiomic analysis of different horse breeds reveals that gut microbial butyrate enhances racehorse athletic performance. Npj Biofilms and Microbiomes, 11(1), 87. doi:10.1038/s41522-025-00730-w
- Lloyd-Price, J., Abu-Ali, G., & Huttenhower, C. (2016). The healthy human microbiome. Genome Medicine, 8(1). doi:10.1186/s13073-016-0307-y
- Lozupone, C. A., Stomabaugh, J. I., Gordon, J. I., Jansson, J. K., & Knight, R. (2012). Diversity, stability and resilience of the human gut microbiota. Nature, 489(7415), 220-230. doi:10.1038/nature11550
- Luna, R. A., & Foster, J. A. (2015). Gut brain axis: Diet microbiota interactions and implications for modulation of anxiety and depression. Current Opinion in Biotechnology, 32, 35-41. doi:10.1016/j.copbio.2014.10.007
- Lyte, M., Vulchanova, L., & Brown, D. R. (2011). Stress at the intestinal surface: Catecholamines and mucosa-bacteria interactions. Cell and Tissue Research, 343(1), 23-32. doi:10.1007/s00441-010-1050-0
- Mach, N. (2024). The forecasting power of the mucin-microbiome interplay in livestock respiratory diseases. Veterinary Quarterly, 44(1), 1-18. doi:10.1080/01652176.2024.2340003
- Mach, N., & Clark, A. (2017). Micronutrient deficiencies and the human gut microbiota. Trends in Microbiology, 25(8), 607-610. doi:10.1016/j.tim.2017.06.004
- Mach, N., & Fuster-Botella, D. (2017). Endurance exercise and gut microbiota: A review. Journal of Sport and Health Science, 6(2), 179-197. doi:10.1016/j.jshs.2016.05.001
- Mach, N., Foury, A., Kittelmann, S., Reigner, F., Moroldo, M., Ballester, M., Esquerré, D., Rivière, J., Sallé, G., Gérard, P., Moisan, M.-P., & Lansade, L. (2017a). The Effects of Weaning Methods on Gut Microbiota Composition and Horse Physiology. Frontiers in Physiology, 8. doi:10.3389/fphys.2017.00535
- Mach, N., Ramayo-Caldas, Y., Clark, A., Moroldo, M., Robert, C., Barrey, E., López, J. M., & Le Moyec, L. (2017b). Understanding the response to endurance exercise using a systems biology approach: combining blood metabolomics, transcriptomics and miRNomics in horses. BMC Genomics, 18(1), 187. doi:10.1186/s12864-017-3571-3
- Mach, N., Ruet, A., Clark, A., Bars-Cortina, D., Ramayo-Caldas, Y., Crisci, E., Pennarun, S., Dhorne-Pollet, S., Foury, A., Moisan, M.-P., & Lansade, L. (2020). Priming for welfare: gut microbiota is associated with equitation conditions and behavior in horse athletes. Scientific Reports, 10(1), 8311. doi:10.1038/s41598-020-65444-9
- Mach, N., Lansade, L., Bars-Cortina, D., Dhorne-Pollet, S., Foury, A., Moisan, M.-P., & Ruet, A. (2021a). Gut microbiota resilience in horse athletes following holidays out to pasture. Scientific Reports, 11, 5007. doi:doi:10.1038/s41598-021-84497-y
- Mach, N., Moroldo, M., Rau, A., Lecardonnel, J., Le Moyec, L., Robert, C., & Barrey, E. (2021b). Understanding the Holobiont: Crosstalk Between Gut Microbiota and Mitochondria During Long Exercise in Horse. Frontiers in Molecular Biosciences, 8. doi:10.3389/fmolb.2021.656204
- Mach, N., Midoux, C., Leclercq, S., Pennarun, S., Le Moyec, L., Rué, O., Robert, C., Sallé, G., & Barrey, E. (2022). Mining the equine gut metagenome: poorly-characterized taxa associated with cardiovascular fitness in endurance athletes. Communications Biology, 5(1), 1032. doi:10.1038/s42003-022-03977-7
- Martin, C. R., Osadchiy, V., Kalani, A., & Mayer, E. A. (2018). The Brain-Gut-Microbiome Axis. Cellular and Molecular Gastroenterology and Hepatology, 6(2), 133-148. doi:10.1016/j.jcmgh.2018.04.003
- Massacci, F. R., Clark, A., Ruet, A., Lansade, L., Costa, M., & Mach, N. (2020). Inter-breed diversity and temporal dynamics of the faecal microbiota in healthy horses. Journal of Animal Breeding and Genetics, 137(1), 103-120. doi:10.1111/jbg.12441
- Mayer, E. A. (2000). The neurobiology of stress and gastrointestinal disease. Gut, 47(6), 861-869. doi:10.1136/gut.47.6.861
- Michaudel, C., & Sokol, H. (2020). The Gut Microbiota at the Service of Immunometabolism. Cell Metabolism, 32(4), 514-523. doi:10.1016/j.cmet.2020.09.004
- Nguyen, C. T., Park, S.-S., & Rhee, D.-K. (2015). Stress responses in Streptococcus species and their effects on the host. Journal of Microbiology, 53(11), 741-749. doi:10.1007/s12275-015-5432-6
- Nicholson, J. K., Holmes, E., Kinross, J., Burcelin, R., Gibson, G., Jia, W., & Pettersson, S. (2012). Host-Gut Microbiota Metabolic Interactions. Science, 336(6086), 1262-1267. doi:10.1126/science.1223813
- Noverr, M. C., & Huffnagle, G. B. (2004). Does the microbiota regulate immune responses outside the gut? Trends in Microbiology, 12(12), 562-568. doi:10.1016/j.tim.2004.10.008
- O’Mahony, S. M., Clarke, G., Borre, Y. E., Dinan, T. G., & Cryan, J. F. (2015). Serotonin, tryptophan metabolism and the brain-gut-microbiome axis. Behavioural Brain Research, 277, 32-48. doi:10.1016/j.bbr.2014.07.027
- Park, T., Yoon, J., Yun, Y., & Unno, T. (2024). Comparison of the fecal microbiota with high- and low performance race horses. Journal of Animal Science and Technology, 66(2), 425-437. doi:10.5187/jast.2023.e45
- Plancade, S., Clark, A., Philippe, C., Helbling, J.-C., Moisan, M.-P., Esquerré, D., Le Moyec, L., Le, Robert, C., Barrey, E., & Mach, N. (2019). Unraveling the effects of the gut microbiota composition and function on horse endurance physiology. Scientific Reports, 9(1), 9620. doi:10.1038/s41598-019-46118-7
- Raspa, F., Tarantola, M., Muca, E., Bergero, D., Soglia, D., Cavallini, D., Vervuert, I., Bordin, C., De Palo, P., & Valle, E. (2022). Does Feeding Management Make a Difference to Behavioural Activities and Welfare of Horses Reared for Meat Production? Animals, 12(14), 1740. doi:10.3390/ani12141740
- Rhee, S. H., Pothoulakis, C., & Mayer, E. A. (2009). Principles and clinical implications of the brain-gut-enteric microbiota axis. Nature Reviews Gastroenterology & Hepatology, 6(5), 306-314. doi:10.1038/nrgastro.2009.35
- Rodriguez, C., Taminiau, B., Brévers, B., Avesani, V., Van Broeck, J., Leroux, A., Gallot, M., Bruwier, A., Amory, H., Delmée, M., & Daube, G. (2015). Faecal microbiota characterisation of horses using 16 rdna barcoded pyrosequencing, and carriage rate of clostridium difficile at hospital admission. BMC Microbiology, 15(1), 181. doi:10.1186/s12866-015-0514-5
- Ruet, A., Lemarchand, J., Parias, C., Mach, N., Moisan, M.-P, Foury, A., Briant, C., & Lansade, L. (2019). Housing Horses in Individual Boxes Is a Challenge with Regard to Welfare. Animals, 9(9), 621. doi:10.3390/ani9090621
- Salem, S. E., Maddox, T. W., Berg, A., Antczak, P., Ketley, J. M., Williams, N. J., & Archer, D. C. (2018). Variation in faecal microbiota in a group of horses managed at pasture over a 12-month period. Scientific Reports, 8(1), 8510. doi:10.1038/s41598-018-26930-3
- Schoster, A., Mosing, M., Jalali, M., Staempfli, H. R., & Weese, J. S. (2016). Effects of transport, fasting and anaesthesia on the faecal microbiota of healthy adult horses. Equine Veterinary Journal, 48(5), 595-602. doi:10.1111/evj.12479
- Shin, N.-R., Whon, T. W., & Bae, J.-W. (2015). Proteobacteria: Microbial signature of dysbiosis in gut microbiota. Trends in Biotechnology, 33(9), 496-503. doi:10.1016/j.tibtech.2015.06.011
- Silvers, B. L., Leatherwood, J. L., Bradbery, A. N., Guy, C. P., Martinez, R. E., Much, M. L., Keshri, J., Dass, S. C., & White-Springer, S. H. (2021). 23 Forced exercise on gut microbiota and cytokines in young horses. Journal of Equine Veterinary Science, 100, 103486. doi:10.1016/j.jevs.2021.103486
- Sommer, F., Anderson, J. M., Bharti, R., Raes, J., & Rosenstiel, P. (2017). The resilience of the intestinal microbiota influences health and disease. Nature Reviews Microbiology, 15(10), 630-638. doi:10.1038/nrmicro.2017.58
- Stewart, H. L., Pitta, D., Indugu, N., Vecchiarelli, B., Engiles, J. B., & Southwood, L. L. (2018). Characterization of the fecal microbiota of healthy horses. American Journal of Veterinary Research, 79(8), 811-819. doi:10.2460/ajvr.79.8.811
- Theelen, M. J. P., Luiken, R. E. C., Wagenaar, J. A., Sloet van Oldruitenborgh-Oosterbaan, M. M., Rossen, J. W. A., & Zomer, A. L. (2021). The equine faecal microbiota of healthy horses and ponies in the netherlands: Impact of host and environmental factors. Animals, 11(6), 1762. doi:10.3390/ani11061762
- Thulin, C.-G., Chen, Y., & Garrido, P. (2025). Semi-Feral Horse Grazing Benefits the Grassland Diversity of Flowering Plants Including a Pollinator-Promoting Indicator Species. Animals, 15(6), 862. doi:10.3390/ani15060862
- Ticinesi, A., Lauretani, F., Tana, C., Nouvenne, A., Ridolo, E., & Meschi, T. (2019). Exercise and immune system as modulators of intestinal microbiome: Implications for the gut-muscle axis hypothesis. Exercise Immunology Review, 25(96), 84-95. http://eir-isei.de/2019/eir-2019-084-article.pdf
- Ulrich-Lai, Y. M., & Herman, J. P. (2009). Neural regulation of endocrine and autonomic stress responses. Nature Review. Neuroscience, 10(6), 397-409. doi:10.1038/nrn2647
- Walshe, N., Duggan, V., Cabrera-Rubio, R., Crispie, F., Cotter, P., Feehan, O., & Mulcahy, G. (2019). Removal of adult cyathostomins alters faecal microbiota and promotes an inflammatory phenotype in horses. International Journal for Parasitology, 49(6), 489-500. doi:10.1016/j.ijpara.2019.02.003
- Warren, A., Nyavor, Y., Beguelin, A., & Frame, L. A. (2024). Dangers of the chronic stress response in the context of the microbiota-gut-immune-brain axis and mental health: a narrative review. Frontiers in Immunology, 15. doi:10.3389/fimmu.2024.1365871
- Yamano, H., Koike, S., Kobayashi, Y., & Hata, H. (2008). Phylogenetic analysis of hindgut microbiota in Hokkaido native horses compared to light horses. Animal Science Journal, 79(2), 234-242. doi:10.1111/j.1740-0929.2008.00522.x
- Yunes, R. A., Poluektova, E. U., Dyachkova, M. S., Klimina, K. M., Kovtun, A. S., Averina, O. V., Orlova, V. S., & Danilenko, V. N. (2016). GABA production and structure of gadB / gadC genes in Lactobacillus and Bifidobacterium strains from human microbiota. Anaerobe, 42, 197-204. doi:10.1016/j.anaerobe.2016.10.011
- Zhang, C., Zhang, M., Wang, S., Han, R., Cao, Y., Hua, W., Mao, Y., Zhang, X., Pang, X., Wei, C., Zhao, G., Chen, Y., & Zhao, L. (2009). Interactions between gut microbiota, host genetics and diet relevant to development of metabolic syndromes in mice. The ISME Journal, 4(2), 232-241. doi:10.1038/ismej.2009.112
Résumé
Le microbiote intestinal, une communauté complexe de micro-organismes dans le tractus digestif, joue un rôle crucial dans la santé et bien-être des animaux. Bien qu'il s'adapte rapidement aux changements environnementaux, les perturbations liées au stress peuvent entraîner des modifications de la composition du microbiote difficiles à inverser. L'axe intestin-cerveau est partie prenante dans cette dynamique. Nos recherches montrent que des chevaux logés individuellement dans des boxes, sans possibilité de pâturage ni socialisation en groupe, nourris avec des régimes hyperconcentrés, et soumis à un entraînement intensif et à la compétition, présentent un stress chronique significatif. Ce stress chronique est associé à une diversité et une composition microbienne intestinale altérées. De plus, le microbiote intestinal de ces animaux stressés démontre une résilience, signifiant que malgré des tentatives de modification, il revient à son état initial. Cette stabilité constitue un obstacle majeur à la récupération, empêchant une réorganisation vers un état microbien plus équilibré et favorable pour l’hôte. L’application des principes agroécologiques, en offrant aux chevaux la possibilité de pâturer librement et de socialiser sur de longues périodes, peut réduire le stress et favoriser un microbiote intestinal diversifié, contribuant ainsi à leur santé et à leur bien-être global.
Pièces jointes
Pas de document complémentaire pour cet articleStatistiques de l'article
 Vues: 1817
Vues: 1817
Téléchargements
 PDF: 159
PDF: 159
 XML: 65
XML: 65

