Immunophénotypage et applications envisageables pour l’amélioration génétique des volailles (Full text available in English)
L'immunophénotypage est une technique qui mesure les paramètres immunitaires non seulement après un challenge mais également à l’état basal et représente donc une source d’indicateurs de l’immunocompétence. Cette synthèse présente les stratégies de mesure de l'immunocompétence, énumère les outils disponibles pour l'immunophénotypage et discute des applications envisageables pour l'amélioration génétique des volailles
Introduction
Certains animaux résistent mieux aux maladies, répondent mieux à la vaccination ou plus généralement montrent une robustesse plus importante au cours de leur vie. Comprendre ce qui détermine cette variabilité et en avoir des indicateurs mesurables permettrait d’envisager de nouveaux critères en sélection.
L’élaboration de programmes de sélection efficaces sur les caractères de production et l’application de règles sanitaires strictes en conditions d’élevage majoritairement bien contrôlées ont conduit à une amélioration hautement significative des performances zootechniques pendant les 30 dernières années (Siegel, 2014). Or, de nouvelles considérations liées au bien‐être animal, à la sécurité du consommateur et à la mise en place de nouvelles directives à l’échelle européenne ont conduit à supprimer l’usage des antibiotiques à des fins de croissance et à limiter la prophylaxie médicamenteuse, ainsi qu’à modifier les conditions d’élevage, avec la suppression des cages et plus d’accès au plein air. La demande évolue donc vers une production plus efficace, mais aussi plus durable et responsable, tout en répondant aux nouvelles attentes de la société en matière de santé et de bien-être des animaux. De plus, des pathologies chroniques ou émergentes existent en élevage et représentent des pertes économiques importantes que la profession souhaite réduire.
Il est parfois difficile de concilier ces différentes attentes. Par exemple, lors des épidémies d’influenza aviaire hautement pathogène, des restrictions de sortie sont mises en place pour contrôler l’épidémie. Il a également été établi que la sélection génétique des volailles en vue d'obtenir un taux de croissance supérieur s'est traduite par une diminution de la résistance aux maladies ou une réduction de la réponse immunitaire (van der Most et al., 2011).
Les vaccins vétérinaires sont essentiels à la protection de la santé animale et de la santé publique (Jorge & Dellagostin, 2017). Ils contribuent à minimiser les souffrances des animaux, à promouvoir une production alimentaire efficace et à réduire le besoin d'antibiotiques pour traiter les animaux. Ils permettent de prévenir la transmission et la propagation des maladies animales contagieuses, y compris les zoonoses qui peuvent être transmises de l'animal à l'homme ou entre animaux.
Certains animaux résistent mieux aux maladies, répondent mieux à la vaccination ou plus généralement montrent une robustesse plus importante au cours de leur vie. Il est important de comprendre pourquoi, afin de définir de bons prédicteurs pour introduire de nouveaux critères de santé dans les objectifs de sélection pour produire des animaux globalement plus résistants à des pathologies et stress divers, et développant une réponse immune efficace après vaccination.
L’immunophénotypage (ou mesure de paramètres immunitaires) permet non seulement de suivre l’évolution de la réponse immunitaire suite à un challenge immunitaire (vaccination, infection) mais également d’évaluer les effets potentiels sur l’immunité de perturbations d’autres natures que peuvent rencontrer les animaux en élevage, comme le stress, les variations climatiques ou les conditions d’élevage. Par ailleurs, immunophénotyper des animaux au cours de leur vie en conditions d’élevage, sans perturbation majeure identifiée a priori, peut renseigner sur leur statut immunitaire et potentiellement leur immunocompétence, c’est-à-dire leur capacité à déclencher une réponse immunitaire efficace en réponse à des pathogènes.
Nous allons revenir dans cet article sur les stratégies pour mesurer l’immunocompétence. Nous recenserons ensuite les outils disponibles pour l’immunophénotypage à des fins d’études génétiques sur les volailles. Enfin, nous discuterons des conditions pour envisager des applications pour l’amélioration génétique des volailles.
Sur le plan fonctionnel, le système immunitaire se compose d'un système immunitaire inné à réaction précoce et d'un système immunitaire adaptatif à réaction lente.
L'immunité innée constitue la première ligne de défense contre les infections.
- Elle comprend des barrières physiques et chimiques au niveau de la couche épithéliale des organes tels que la peau, le tractus gastro-intestinal et les voies respiratoires, qui empêchent la pénétration des microbes.
- L'immunité innée permet également d'éliminer les cellules endommagées et de débuter la réparation des tissus.
- Le système immunitaire inné combat les micro-organismes à l'aide de cellules telles que les macrophages, les granulocytes (cellules polymorphonucléaires telles que les hétérophiles), les thrombocytes, les basophiles, les éosinophiles et les cellules tueuses naturelles (NK).
- L'identification des pathogènes par ces cellules se fait au moyen de récepteurs qui reconnaissent des motifs moléculaires caractéristiques des micro-organismes. On parle de PRR (Pattern Recognition Receptor) pour désigner ces récepteurs cellulaires capables de reconnaître des motifs moléculaires caractéristiques des pathogènes, motifs appelés PAMP (Pathogen Associated Molecular Patterns).
- Lorsqu'elles détectent un danger, les cellules du système immunitaire inné réagissent en produisant ou en libérant des molécules telles que des défensines, des cytokines et des chimiokines qui coordonnent le recrutement et l'action d'une série de populations cellulaires spécialisées ayant des fonctions phagocytaires et lytiques. Ces réponses immunitaires innées sont principalement non spécifiques des pathogènes.
L'immunité adaptative est nécessaire pour se défendre contre des agents pathogènes spécifiques et permet de créer une mémoire immunitaire qui protège lors d’expositions futures.
Plusieurs mécanismes entrent en jeu :
- L’immunité humorale : l’antigène (agent infectieux) active directement les lymphocytes B qui possèdent des récepteurs spécifiques. Les lymphocytes B activés deviennent alors des plasmocytes qui sécrètent des anticorps spécifiques pour détruire l'antigène.
- L’immunité cellulaire : l’antigène est également présenté à des lymphocytes T par des cellules présentatrices d’antigènes (par exemple, les cellules dendritiques). Ces cellules activent les lymphocytes T, qui se différencient en lymphocytes T cytotoxiques (CD8+) pour détruire les cellules infectées.
- Les lymphocytes T peuvent aussi se différencier en lymphocytes T auxiliaires (CD4+), qui stimulent les lymphocytes B pour produire une plus grande quantité d’anticorps et de cellules mémoire.
1. Stratégies pour évaluer l’immunocompétence
1.1. Concept et définition de l’immunocompétence
L’immunocompétence représente « la capacité de l'organisme à produire une réponse immunitaire appropriée et efficace lorsqu'il est exposé à divers agents pathogènes » (Hine et al., 2014). C’est « une mesure de la capacité d’un organisme à minimiser les coûts d'adaptation d’une infection par quelque moyen que ce soit » (Owens & Wilson, 1999). C’est donc l’ensemble des fonctions immunitaires qui favorisent la résistance ou la tolérance aux maladies et contrôlent l’inflammation lors de maladies infectieuses ou de stress inflammatoires autres. L’immunocompétence contribue donc à la résilience, considérée comme la capacité d'un animal à maintenir sa productivité face à divers défis environnementaux, biotiques ou abiotiques (Bishop, 2012).
Plus récemment, le concept de résilience immunitaire est apparu. Il est défini comme la capacité de préserver ou de restaurer rapidement l’immunocompétence suite à un stress pathogénique ou d’une autre nature (Ahuja et al., 2023). L’immunocompétence est donc un concept à considérer tout au long de la vie des animaux.
Des stratégies de gestion intégrée de la santé incluant l’approche génétique pour améliorer l'immunocompétence et la résilience immunitaire auraient donc le potentiel de contribuer à réduire à la fois l’incidence et la gravité des maladies. Cela améliorerait la santé et le bien-être des animaux et permettrait de réduire le recours aux médicaments pour prévenir et traiter les maladies infectieuses.
1.2. Stratégies pour mesurer l’immunocompétence
a. Stratégie directe : résistance/tolérance à un pathogène particulier
Pour évaluer l’immunocompétence, des stratégies directes ciblent la résistance ou la tolérance des animaux à des agents pathogènes spécifiques. La stratégie repose sur l’hypothèse que même si les réponses immunitaires sont hautement spécifiques d’un antigène donné, la capacité à produire une réponse immunitaire fonctionnellement efficace pourrait être en grande partie un caractère générique. La mesure de la réponse immunitaire à un pathogène serait donc susceptible d’être représentative des réponses à d’autres pathogènes. Cependant, cela n’est pas toujours le cas. En effet, la réponse d’un animal à un agent pathogène donné n’est pas forcément liée à sa réponse à d’autres agents pathogènes comme démontré chez la drosophile et le criquet (Fellowes et al., 1999 ; Letendre et al., 2022). Parfois même, les mécanismes de réponses diffèrent et sont négativement corrélés. C’est ce qui a notamment été démontré historiquement chez les souris de Biozzi, des lignées sélectionnées pour produire des quantités d’anticorps élevées (H) ou faibles (L) en réponse à une injection d’érythrocytes de mouton (Biozzi et al., 1975). Si les souris H se sont révélées être plus résistantes aux infections par Trypanosoma cruzi (Kierszenbaum & Howard, 1976) ou Nematospiroides dubius (Jenkins & Carrington, 1981), elles se sont avérées être plus sensibles à Salmonella typhimurium (Plant & Glynn, 1982), Brucella (Cannat et al., 1978), Leishmania tropica (Hale & Howard, 1981) ou encore à une infection mycobactérienne (Lagrange et al., 1979). Par ailleurs, chez les bovins laitiers, Thompson-Crispi et al. (2012) ont rapporté une corrélation génétique défavorable entre la réponse immunitaire cellulaire (hypersensibilité retardée à Candida albicans) et les réponses humorales (anticorps produits suite à une immunisation par du lysozyme de blanc d’œuf de poule).
De plus, la sélection génétique pour la résistance à un pathogène pourrait avoir des effets contreproductifs à long terme en exerçant une pression de sélection qui pourrait entraîner des stratégies d’échappement par les pathogènes et réduire l’effet de la sélection pour la résistance à la maladie (Hulst et al., 2022). Cette stratégie directe semble donc risquée et des recherches supplémentaires sont nécessaires pour évaluer les effets sur le long terme de la sélection pour la résistance à une maladie spécifique sur la sensibilité à d’autres maladies.
b. Stratégie indirecte : mesure d’un panel de paramètres immunitaires
Une approche indirecte et supposée globale se concentre sur l’analyse de la variabilité individuelle d’un panel de paramètres immunitaires qui permettraient de prédire les réponses aux agents pathogènes dans leur ensemble. Le sang est une source précieuse d’informations sur l’ensemble du métabolisme de l’organisme et sur le statut immunitaire des animaux (Chaussabel, 2015). Étant de plus relativement facile d’accès, il constitue un compartiment de choix pour cette recherche de paramètres indicateurs d’immunocompétence.
Les paramètres mesurés doivent refléter les différents types d’immunité développés lors d’infections par des pathogènes ou lors d’une vaccination : immunité innée et adaptative (anticorps maternels passivement transmis, réponses humorales et cellulaires).
Différentes méthodes ont ainsi été proposées pour mesurer des index d’immunocompétence chez le bovin (Wilkie & Mallard, 1999 ; Reverter et al., 2021) ou le poulet de chair (Sivaraman & Kumar, 2013). Ces méthodes reposent notamment sur des mesures de réponses cellulaires et humorales suite à des vaccinations. Cependant la réponse à la vaccination ne reflète pas tout le potentiel immunitaire des animaux. Il n’est notamment pas évident qu’une réponse à une vaccination reflète entièrement ce qui se passe lors d’une infection. D’autre part, ces mesures (notamment de la réponse cellulaire à la vaccination) sont assez complexes à mettre en œuvre en routine.
D’autres paramètres tels que ceux décrits dans la suite, reflétant aussi d’autres volets de l’immunité pourraient être utilisés, en complémentarité, pour déterminer s’il existe des corrélations entre ces paramètres d’immunocompétence et les réponses à différents agents pathogènes, et l’importance de telles corrélations.
2. Immunophénotypage des volailles : quelles possibilités de mesures adaptées aux études génétiques ?
Pour que ces mesures soient adaptées aux études génétiques, il est important de pouvoir les réaliser sur un grand nombre d’individus et, idéalement, de suivre leur évolution tout au long de la vie des animaux. Cette quantité importante d’échantillons implique une gestion rigoureuse et beaucoup de savoir-faire pour la réalisation des prélèvements (Samour, 2009) (tubes de sang avec anticoagulants adaptés : généralement tubes héparinés pour des analyses fonctionnelles et tubes EDTA pour des mesures hématologiques, identification des animaux, traçabilité des prélèvements), la préparation des tubes de sang au laboratoire (préparation des plasmas, aliquotes et stockage) et la réalisation des différentes mesures. La durée et les conditions de stockage doivent être adaptées à chacune des mesures à réaliser. Il est aussi indispensable d’avoir des protocoles répétables et standardisés pour obtenir des données robustes. La faisabilité pratique et le coût des mesures sont également des critères non négligeables pour ces études.
Selon les espèces considérées, il existe plus ou moins d’outils disponibles pour mesurer ces paramètres au laboratoire. Pour certaines espèces, cela restreint les possibilités d’analyse ou leur précision. Nous proposons ici de recenser et de décrire certains paramètres immunitaires qui peuvent être mesurés chez le poulet, principalement dans le sang (figure 1).
Figure 1. Immunophénotypage chez le poulet.

2.1. Mesures directes dans le sang – monitoring
a. Analyse de la composition des cellules sanguines
L’analyse de la composition des cellules sanguines est utilisée en médecine humaine et vétérinaire pour évaluer l’état immunitaire et sanitaire d’un individu (Samour, 2009). Les granulocytes, les monocytes et les cellules tueuses naturelles (NK) sont impliqués dans la détection et l’élimination immédiate des agents pathogènes, ainsi que dans la transmission de signaux à d’autres cellules. Les lymphocytes B et T développent une réponse hautement spécifique à un antigène particulier et créent une mémoire immunologique avec la capacité de répondre très rapidement et efficacement aux agents pathogènes lors d’une seconde rencontre. Des changements dans les numérations ou dans les proportions des leucocytes d’un individu peuvent être un indice d’infections virales, bactériennes ou parasitaires, d’une immunosuppression induite par un toxique, d’un stress ou d’une inflammation aiguë (Fairbrother & O’Loughlin, 1990 ; Maxwell & Robertson, 1998 ; Samour, 2009).
La réalisation de formules sanguines par comptage automatisé avec un hémacytomètre est une technique rapide et précise utilisée chez les mammifères. Cependant, ces systèmes ne font pas la différence entre les érythrocytes, les thrombocytes et les leucocytes des oiseaux car toutes ces cellules sont nucléées. L’utilisation d’anticorps spécifiques des populations de cellules sanguines est donc nécessaire pour une analyse automatisée par cytométrie en flux chez les espèces aviaires. Selon les espèces, la disponibilité de ces anticorps est très inégale. Chez le poulet, plusieurs stratégies ont été développées (Fair et al., 2008 ; Seliger et al., 2012 ; Bílková et al., 2017). La figure 2 illustre le comptage et l’identification des cellules sanguines par cytométrie en flux à relativement haut-débit. Selon l’âge et la lignée des animaux, des différences peuvent être observées dans l’expression de certains marqueurs et la stratégie d’identification des cellules sanguines doit être adaptée.
Figure 2. Analyse de la composition des cellules sanguines chez le poulet par cytométrie en flux.
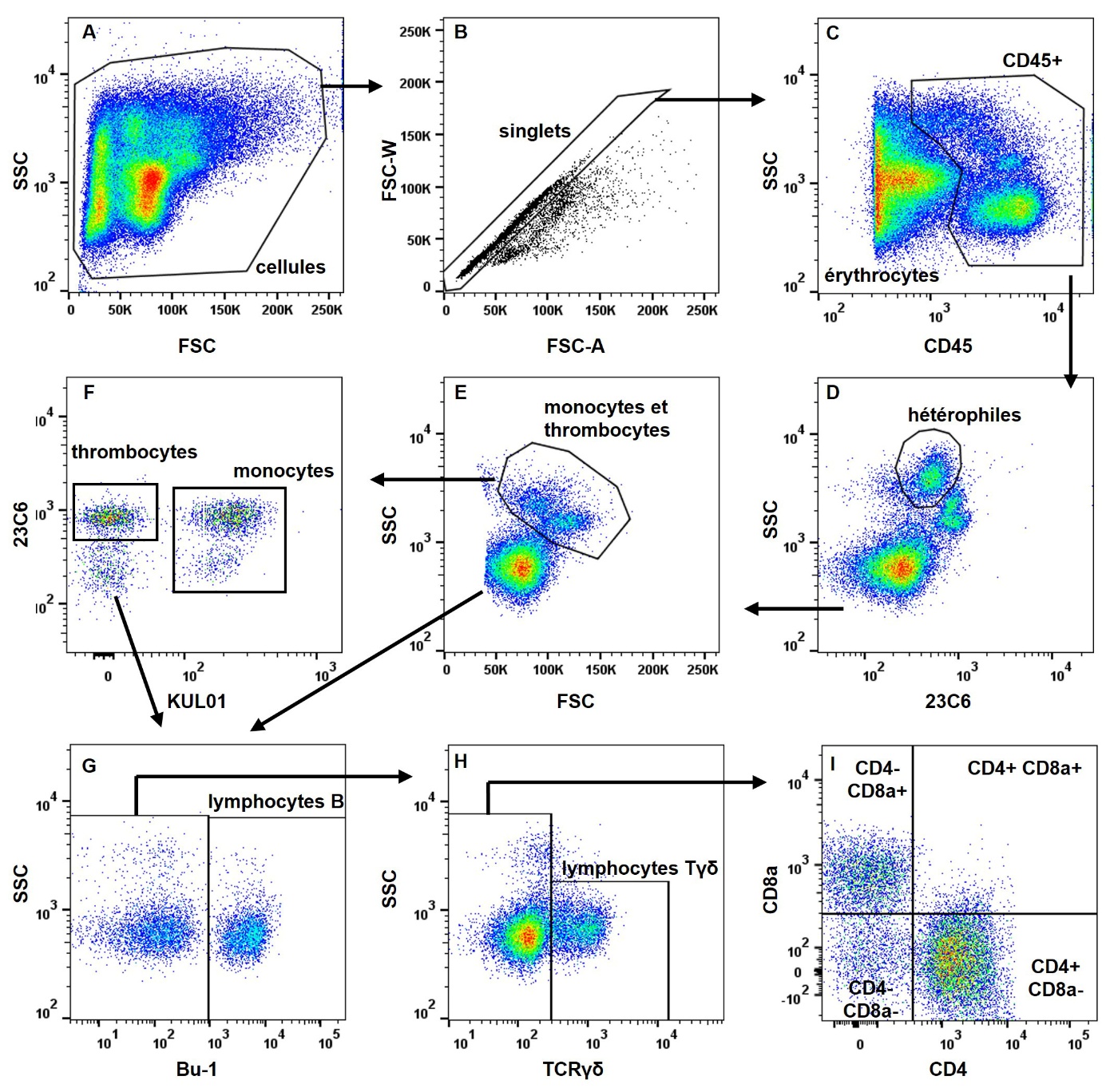
À partir de ces analyses, certains ratios calculés peuvent servir de marqueurs de stress comme le ratio hétérophiles/lymphocytes (Lentfer et al., 2015) ou de l’équilibre entre immunités humorale et cellulaire comme le ratio CD4/CD8. En effet, une balance vers les cellules T CD4+ représenterait une réponse dominée par les anticorps et une balance vers les cellules T CD8+ une réponse à médiation cellulaire. Chez l’homme, un ratio CD4/CD8 faible est associé à une altération de la fonction immunitaire, à une sénescence immunitaire et à une inflammation chronique (McBride & Striker, 2017).
En plus des données de comptage absolu ou de la proportion de chacun des types cellulaires, les niveaux d’expression de certains marqueurs peuvent également être des paramètres à considérer pour évaluer l’immunocompétence car ils sont révélateurs du statut d’activation des cellules par exemple l’expression de CD8a par les lymphocytes Tγδ (Pieper et al., 2011).
Des réactions croisées entre les anticorps dirigés contre différents marqueurs des cellules immunitaires du poulet comme le CD4 ou le CD8 et d’autres espèces aviaires ont été répertoriées mais nécessiteraient d’être confirmées (Lu et al., 2023). Quoiqu’il en soit, ces anticorps ne permettraient pas de réaliser des identifications aussi complètes et précises que celles possibles chez le poulet. Pour le canard, une analyse des différents leucocytes sanguins a été établie par cytométrie de flux en appliquant une combinaison d’anticorps monoclonaux nouvellement générés ainsi que des anticorps qui croisent avec le poulet (Jax et al., 2023). Chez la dinde, il est également possible d’utiliser les réactions croisées des anticorps avec le poulet (Lindenwald et al., 2019).
Pour les espèces pour lesquelles il n’y a pas d’anticorps spécifiques commercialisés ou croisant avec d’autres espèces, certaines stratégies d’analyse par cytométrie en flux basées sur la taille et la structure des cellules (en utilisant un colorant fluorescent pour la coloration des organelles) ont été proposées (Uchiyama et al., 2005). Enfin, la réalisation de frottis sanguins colorés peut s’avérer être la seule solution pour identifier les différents types cellulaires, mais c’est une technique plus laborieuse et moins précise qui nécessite une expertise pointue. L’émergence et la disponibilité d’algorithmes d’intelligence artificielle pour des analyses d’images peuvent considérablement aider à l’analyse de ces lames en routine (Sparavigna, 2017).
D’autres paramètres sont évalués lors de la réalisation de formules sanguines, notamment différentes caractéristiques des globules rouges (volume, teneur en hémoglobine…). Certaines de ces mesures sont assez facilement réalisables comme l’évaluation de l’hématocrite (la fraction du sang constituée de globules rouges) après centrifugation de tubes micro-hématocrites.
b. Mesures des taux d’anticorps
Trois classes d’immunoglobulines (IgA, IgM et IgY) existent et peuvent être mesurées chez le poulet. La présence d’anticorps homologues des IgE et IgD des mammifères a également été suspectée (Carlander et al., 1999) mais il n’existe pas d’anticorps spécifiques de ces classes d’Ig pour les doser. Les IgM sont les premiers anticorps exprimés au cours de la réponse immunitaire. Elles agissent en tant que récepteur à la surface des lymphocytes B et jouent un rôle important dans l’activation du système du complément. Les IgA ont un rôle de défense immunitaire dans les muqueuses. Les IgY aviaires sont génétiquement et structurellement différentes de leurs homologues mammifères, les IgG, mais sur le plan fonctionnel, elles jouent des rôles biologiques similaires. Ce sont toutes deux des immunoglobulines majeures qui assurent la défense contre les agents infectieux et apparaissent dans la circulation sanguine à des concentrations élevées à la suite d’une exposition à un antigène.
Différents types d’anticorps peuvent être mesurés à l’aide de tests ELISA (enzyme-linked immunosorbant assay) ou en fonction de leur activité, par exemple leur capacité à agglutiner des particules recouvertes d’antigènes (hémagglutination), à neutraliser des virus ou à favoriser la phagocytose (opsonisation).
La mesure des taux d’anticorps totaux des trois différents sous-types permet de refléter l’immunité humorale globale (Kramer et al., 2003). Les anticorps naturels sont des anticorps présents chez un individu sain sans qu’il soit nécessaire de l’exposer préalablement à un antigène exogène. Les anticorps naturels sont considérés comme une partie humorale de l’immunité innée. Ils présentent un large répertoire de spécificité et agissent comme une première ligne de défense contre les infections (Palma et al., 2018). Chez les poules pondeuses, des niveaux élevés d’anticorps naturels ont été associés à une plus grande probabilité de survie pendant la période de ponte (Star et al., 2007 ; Sun et al., 2011 ; Wondmeneh et al., 2015) et une protection contre l’infection à Escherichia coli (Berghof et al., 2019). Les anticorps spécifiques de pathogènes sont mesurés pour suivre les réponses humorales suite à des infections ou à des vaccinations. De nombreux kits de dosage ELISA sont commercialisés par différents fournisseurs, avec plus ou moins de possibilités selon les espèces de volaille.
c. Mesures de protéines plasmatiques ou d’activités enzymatiques et bactéricides
Des mesures des taux de protéines sériques ou plasmatiques totales peuvent être réalisées à l’aide de différentes méthodes. La réfractométrie pouvant être biaisée par la lipidémie, d’autres méthodes comme la méthode du biuret ou la méthode BCA (BiCinchoninic acid Assay) sont préférables. Une diminution des protéines totales peut indiquer une hémorragie chronique, une mauvaise absorption intestinale, une insuffisance hépatique ou rénale ou une immunodépression. À l’inverse, une déshydratation ou un état pathologique inflammatoire peut se traduire par une augmentation des protéines totales. Notons cependant qu’il faut considérer l’activité reproductrice des femelles qui entraîne également une augmentation des protéines totales (Harr, 2009).
Une électrophorèse des protéines sériques ou plasmatiques sépare les composants des protéines en six fractions principales en fonction de leur taille et de leur charge électrique (albumine, α1-, α2-, β1-, β2- et γ-globulines). Un automate permettant la réalisation d’électrophorèse capillaire peut être utilisé et permet d’obtenir une mesure à relativement haut-débit, nécessitant un faible volume d’échantillon. Les fractions d’α-globulines sont constituées de protéines inflammatoires de la phase aiguë telles que l’α-lipoprotéine, l’α1-antitypsine, l’α2-macroglobuline et l’haptoglobine. Les fractions β-globulines sont notamment composées de fibrinogène, de β-lipoprotéine, de transferrine et de protéines du complément. Des augmentations des teneurs en α- et β-globulines ont été décrites lors d’infections parasitaires, bactériennes et fongiques (Harr, 2009 ; Hamzic et al., 2015). La fraction γ-globuline contient principalement les immunoglobulines. Ces électrophorèses plasmatiques des protéines présentent l’avantage d’être utilisées pour toutes les espèces de volailles, car aucun réactif spécifique n’est nécessaire. L’interprétation des profils pourra cependant être différente selon les espèces.
Un examen plus précis de molécules particulières pour les différentes fonctions qu’elles exercent lors de la réponse immunitaire (innée et acquise) peut également être informatif. Ces molécules circulent à l’état basal et sont surexprimées lors d’une inflammation chronique, liée à une infection ou encore après une vaccination (Janmohammadi et al., 2020). Des dosages de protéines inflammatoires de la phase aigüe (protéine C-réactive, sérum amyloïde A protéine, haptoglobine ; O’Reilly & Eckersall, 2014), de certains composants du complément, ou encore de cytokines constitueraient donc une source potentielle de paramètres immunitaires d’immunocompétence.
Les activités de certaines de ces molécules peuvent aussi être mesurées comme des activités enzymatiques : lysozyme, peroxydase, espèces réactives de l’oxygène (Oke et al., 2024). Une mesure de l’activité bactéricide pourrait également permettre de mettre en évidence l’activité de peptides antimicrobiens (Cuperus et al., 2013).
d. Transcriptome ou protéome sanguin
Des approches sans a priori de mesure du transcriptome ou du protéome sanguin peuvent aussi être considérées comme une source de biomarqueurs d’immunocompétence (Burgess, 2004 ; Désert et al., 2016). Ces analyses sont très complètes mais très coûteuses pour les envisager à très grande échelle.
2.2. Paramètres mesurables suite à des stimulations ex vivo
Un autre type de mesures de paramètres immunitaires repose sur l’analyse des réponses des cellules suite à des stimulations ex vivo. Ces mesures nécessitent en général l’utilisation de cellules fraîches. Si elle est parfois techniquement possible, la congélation des cellules n’est pas indiquée car la variabilité du phénotype mesuré pourrait être impactée par la qualité de la congélation et induire un biais expérimental très fort. Ces mesures nécessitent donc un travail de laboratoire intense et contraint dans le temps.
a. Capacité de phagocytose
Le système immunitaire utilise le processus de phagocytose pour détruire les cellules infectées par des pathogènes. Il existe des méthodes relativement rapides permettant d’évaluer la capacité de phagocytose globale des cellules sanguines en évaluant l’internalisation d’un colorant, le rouge neutre (Song et al., 2022). La cytométrie en flux peut également permettre de mesurer la phagocytose de particules ou de bactéries marquées par un fluorochrome. Chez les espèces aviaires, la combinaison avec un marquage par un anticorps anti-CD45 est nécessaire. Les activités de phagocytose des différents types cellulaires identifiés par leur taille et structure sont alors mesurables (Naghizadeh et al., 2019).
b. Stimulations sang total
La réactivité des cellules sanguines à différents stimuli est considérée comme une mesure d’immunocompétence. Un large éventail de stimuli peut être utilisé comme des bactéries et des virus entiers ou des agonistes spécifiques des différents récepteurs de l’immunité innée (Duffy et al., 2014 ; Reid et al., 2021 ; Lesueur et al., 2022). Notons que, chez l’homme, il reste beaucoup de questions sur la nature de cette variation interindividuelle de la réponse immunitaire mais ces tests pourraient apporter une meilleure compréhension des différences de sensibilité individuelle aux maladies infectieuses, au développement de maladies inflammatoires chroniques ou à l’auto-immunité (Müller et al., 2024). Il en est de même chez les animaux d’élevage. L’adaptation de ce test aux volailles repose sur la possibilité de doser la signature cytokinique suite à ces stimulations. Chez le poulet, il existe des tests ELISA mesurant les cytokines une à une et même des dosages en multiplex. Le dosage Milliplex par exemple permet la quantification simultanée de l’ensemble des analytes suivants : les interférons (IFN) alpha et gamma, les interleukines 2, 6, 10, 16, 21, les protéines inflammatoires des macrophages 1β et 3a, RANTES (regulated on activation, normal T cell expressed and secreted), CSF-1 (colony stimulating factor-1), et le VEGF (vascular endothelial growth factor).
c. Activité des cellules T
L’activité des cellules T dans la circulation (échantillonnage non destructif) ou dans la rate ou les ganglions lymphatiques (échantillonnage destructif) peut être déterminée en mesurant leur capacité à proliférer ou à sécréter des cytokines produites en réponse à l’exposition à un mitogène ou à un antigène. Les tests de détection de l’IFNγ par ELISpot sont particulièrement sensibles et indiqués pour évaluer la réponse cellulaire à une vaccination (Hao et al., 2021).
3. Quelles applications sont envisageables pour l’amélioration génétique des volailles ?
3.1. Immunophénotypage : une source d’indicateurs d’immunocompétence
L’immunophénotypage des volailles permet de mesurer la réponse immunitaire induite lors d’une infection ou d’une vaccination. Parmi les nombreux paramètres immunitaires mesurables, si certains sont décrits comme étant modulés lors de ces perturbations, aucun d’entre eux ne mesure nécessairement l’efficacité de la réponse immunitaire. Toutefois, en comparant les paramètres cliniques et immunologiques au sein d’une population d’hôtes, il est possible d’identifier des critères de protection immunologiques robustes.
Une « bonne » réponse à une vaccination n’est pas nécessairement déterminée par une quantité importante d’anticorps produits. Si des seuils de séropositivité sont établis, la corrélation avec l’efficacité vaccinale n’est pas si simple. Par exemple, pour des pathogènes intracellulaires tels que Eimeria, la réponse des anticorps n’est pas un indicateur fiable de la protection contre la maladie. Le test de référence pour évaluer l’efficacité protectrice des vaccins reste encore de regarder leur réponse suite à une infection (présence et transmission du pathogène, signes cliniques et performances) (Soutter et al., 2020). La durée d’apparition et la persistance de l'immunité sont également importantes, bien que la pertinence de ces paramètres varie en fonction de la population cible (par exemple, si la durée d’apparition est plus recherchée chez les poulets de chair qui sont abattus très jeunes, chez les poules pondeuses, une réponse persistante est bénéfique sur un plus long terme).
Lors d’une infection, les réponses immunitaires devraient aussi être évaluées en fonction de l’efficacité avec laquelle elles protègent un individu. D’un point de vue immunologique, « plus » n’est pas nécessairement mieux. La réponse immunitaire maximale n’est pas nécessaire dans tous les cas. Parfois même, les dommages causés par l’emballement du système immunitaire sont importants. C’est le cas par exemple lors d’infection par le virus Influenza chez les poules mais pas chez les canards (Burggraaf et al., 2014). La recherche d’indicateurs de protection (à l’échelle de l’individu, mais aussi du troupeau voire du territoire) reste donc un enjeu pour mesurer des réponses efficaces aux vaccinations et aux infections. Dans ce contexte, les données d’immunophénotypage constituent une source importante d’indicateurs potentiels (Hamzic et al., 2015).
L’immunophénotypage des animaux à l’état basal pourrait permettre d’évaluer l’immunocompétence des animaux. Il n’est plus question de déterminer des indicateurs des réponses mais plutôt des prédicteurs de ces réponses. L’acquisition de connaissances sur des données d’immunophénotypage des animaux avant et après différentes perturbations est encore cruciale pour déterminer des paramètres indicateurs de l’immunocompétence. Des valeurs cibles et des optima de ces paramètres immunitaires restent donc encore à définir pour pouvoir les utiliser de manière efficace en sélection génétique.
3.2. Variabilité individuelle des paramètres immunitaires et déterminisme génétique
Pour déterminer si ces paramètres immunitaires peuvent être exploités dans les programmes de sélection, il est nécessaire de comprendre et déterminer ce que sont les caractéristiques d’un système immunitaire sain, quels sont les facteurs de variation – génétiques et environnementaux – des paramètres immunitaires mesurés, et quelle est l’importance de leur variation.
Chez différentes espèces, y compris la volaille, il existe une variabilité importante des réponses à la vaccination, aux infections ou à d’autres stress abiotiques. Il y a également une forte variabilité individuelle des paramètres immunitaires à l’état basal. Chez les poules, les effets du sexe (Minozzi et al., 2007 ; Jax et al., 2023), de l’âge (Song et al., 2021 ; Jax et al., 2023) ou encore du mode d’élevage sont souvent rapportés (Hofmann et al., 2020 ; Song et al., 2022 ; Sarrigeorgiou et al., 2023). Même s’ils sont significatifs, ces effets sont néanmoins généralement assez modérés. Par exemple, des poulets de chair élevés au sol ont montré 10 à 15 % de plus d’IgG ou d’activité du lysozyme que ceux élevés en cage (Song et al., 2022). Les effets du microbiote sur ces paramètres immunitaires sont également étudiés avec des modèles de perturbations par des antibiotiques (Schokker et al., 2017 ; Lecoeur et al., 2022 ; Song et al., 2022) ou encore par des analyses d’association (Aruwa et al., 2021 ; Borey et al., 2022).
Les effets de la génétique sont évalués par comparaison de différentes races ou par la sélection de lignées divergentes sur des caractères immunitaires mais également à l’échelle de la variabilité individuelle au sein de populations (mesures d’héritabilité pour évaluer la part attribuée à la génétique dans la variabilité des paramètres immunitaires, recherche de régions du génome qui influencent un caractère pour identifier les gènes impliqués).
a. Comparaison de races
En comparant des races élevées dans un même environnement il est possible de mettre en évidence l’effet de la génétique sur différents paramètres. Ces comparaisons reflètent une combinaison de sélection artificielle et naturelle agissant sur ces caractères liés à la santé et au stress. Cela a par exemple été démontré chez les poules pour la composition en cellules sanguines (Bílková et al., 2017), les anticorps naturels (Sun et al., 2011), ou d’autres paramètres (Kramer et al., 2003). Ainsi dans une comparaison de six races élevées dans un même environnement, au même âge, la composition des cellules sanguines s’est avérée être très variable, les lymphocytes représentant 54 à 75 % et les hétérophiles 31 à 14 % des leucocytes dans les races les plus extrêmes. Nous avons également récemment mis en évidence des différences de réponses à la vaccination (Lecoeur et al., 2024). La comparaison des paramètres immunitaires de races connues pour être plus ou moins résistantes à diverses infections permettrait d’identifier des profils généraux de similitude qui permettraient d’expliquer ces différences d’immunocompétence. D’autre part, ces différences entre races ou lignées pourraient être exploitées dans le cadre de croisements afin d’obtenir des animaux plus robustes.
b. Sélection de lignées divergentes
Plusieurs études rapportent la sélection divergente de volailles basée sur la quantification de paramètres immunitaires, montrant ainsi l’existence d’un contrôle génétique des variations de ces paramètres immunitaires. Ainsi, le rôle de la génétique de l’hôte dans la variation de la réponse vaccinale a été démontré par des sélections génétiques de poules pondeuses White Leghorn pour une réponse humorale élevée à une vaccination contre le virus de la maladie de Newcastle (NDV), une réponse immunitaire à médiation cellulaire élevée et une activité phagocytaire élevée (Pinard-van der Laan, 2002). D’autres expériences de sélection ont été menées sur la réponse anticorps (Dan Heller et al., 1992 ; Parmentier et al., 2004), la présence d’anticorps naturels (Berghof et al., 2019) ou le ratio H/L (Wang et al., 2023). Des sélections sur des index d’immunocompétence définis par plusieurs paramètres ont également été réalisées avec succès (Kean et al., 1994 ; Sivaraman & Kumar, 2013).
Avec ces expérimentations de sélection divergentes, il est ensuite possible d’étudier l’impact de cette sélection sur la santé et le bien-être des animaux. Ainsi il a été rapporté que la lignée sélectionnée pour la réponse humorale à la vaccination contre NDV avait également des réponses humorales accrues vis-à-vis d’autres vaccins commerciaux, et moins de leucocytes sanguins que la lignée témoin non sélectionnée (Zerjal et al., 2021). Dans cette étude, il a également été rapporté que les animaux sélectionnés avaient un poids corporel réduit. Une autre expérience de sélection sur la réponse anticorps suite à une immunisation par E. coli inactivée a montré que cette réponse était associée à une réponse anticorps élevée contre d’autres antigènes, ainsi qu’à une activité phagocytaire et une réponse cellulaire accrues (Dan Heller et al., 1992). La sélection sur des niveaux élevés d’anticorps naturels a entrainé une augmentation de la résistance à l’infection par E. coli (Berghof et al., 2019) et de la réponse humorale à certains antigènes (Berghof et al., 2018a). La sélection sur le ratio H/L a montré que la sélection pour un faible ratio de H/L améliorait la résistance aux salmonelles (Al-Murrani et al., 2002).
Notons que ces impacts peuvent être liés au déséquilibre de liaison et donc simplement parce que les régions impliquées sur le génome sont proches, mais elles peuvent aussi être corrélées car elles partagent des voies biologiques. Ainsi, par l’étude des gènes présents dans les régions divergentes, les causes des différences phénotypiques observées peuvent être recherchées. Par exemple, les auteurs suggèrent que la résistance aux salmonelles s’expliquerait par un renforcement de la fonction des hétérophiles chez la lignée avec un faible ratio H/L (Wang et al., 2023).
c. Estimations des héritabilités
Des estimations d’héritabilités ont été réalisées pour un certain nombre de paramètres immunitaires. Des héritabilités de la réponse anticorps, la réponse à médiation cellulaire T ou la phagocytose chez les poules pondeuses après des « challenges » in vivo ont été estimées entre 0 et 0,22 (Cheng et al., 1991). Les estimations d’héritabilité de la réponse anticorps contre différents pathogènes dans une étude de terrain, en condition d’infection naturelle, ont montré qu’elles étaient très différentes entre les deux populations étudiées et variaient entre 0,11 et 0,79 (Psifidi et al., 2016). Des héritabilités comprises entre 0,07 et 0,14 ont été estimées pour les anticorps naturels, variant selon l’isotype considéré (van der Klein et al., 2015) et pour les anticorps totaux de 0,06 pour les IgG, 0,22 pour les IgA et 0,23 pour les IgM (Berghof et al., 2018b).
Ces héritabilités sont donc variables selon les caractères et les populations étudiées. Finalement, assez peu d’études d’héritabilités ont été réalisées sur l’ensemble des paramètres immunitaires qu’il est possible d’immunophénotyper chez les volailles. Pour ceux qui l’ont été, le déterminisme génétique des paramètres immunitaires est généralement établi et montre donc qu’une sélection génétique est théoriquement possible pour ces caractères. Les caractères que l’on cherche à sélectionner ont un déterminisme généralement complexe : ils sont soumis à l’effet de nombreux gènes, généralement inconnus, et à des effets du milieu. La valeur génétique d’un individu pour un trait donné reflète l’effet de l’ensemble des gènes impliqués dans l’expression de ce trait. Il serait donc possible de mesurer ces caractères sur une population de référence phénotypée et génotypée, permettant d’établir les relations statistiques entre génotype et phénotype et par la sélection génomique, de prédire leur valeur génétique chez des candidats génotypés.
d. Études d’associations génétiques
Quelques études d’associations génétiques ont été conduites chez l’espèce Gallus et ont permis d’identifier de potentielles régions du génome (ou loci) de caractères quantitatifs de l’immunité (ces régions sont appelées QTL : Quantitative Trait Loci). Par exemple, pour les anticorps naturels et les anticorps totaux, une région du chromosome 4 a été trouvée comme significativement associée avec un variant causal probable dans le gène TLR1A (Berghof et al., 2018b). D’autres QTL potentiels pour l’immunité ont été associés aux titres d’anticorps naturels et acquis et à la réactivité du complément, mettant en évidence les rôles des gènes IL17A, IL12B et MHC dans la fonction immunitaire (Biscarini et al., 2010). Une autre étude a révélé des associations génétiques entre des régions du génome et des taux d’IgY, les quantités d’hétérophiles et de lymphocytes dans le sang, et les réponses anticorps à un vaccin contre le virus Influenza ou l’injection d’érythrocytes de mouton (Zhang et al., 2015).
e. Vers l’étude du déterminisme hologénétique des paramètres d’immunocompétence
Les microbiotes des animaux peuvent également avoir des effets sur ces paramètres immunitaires et sur la réponse des animaux aux infections. Il a été montré par exemple que l’administration d’antibiotiques ou de probiotiques exerce des effets immunomodulateurs sur des paramètres immunitaires, notamment dans le sang (Jankowski et al., 2022 ; Song et al., 2022). Par ailleurs, la prise en compte du microbiote en plus de la génétique a permis d’améliorer la prédiction de caractères immunitaires chez le porc (Calle-García et al., 2023). Intégrer ces informations sur les microbiotes et les interactions hôtes-microbiotes va nécessiter des évolutions dans les modèles d’évaluation génétique pour prendre en compte ce déterminisme hologénétique (Estellé, 2019).
3.3. Corrélations phénotypiques et génétiques entre immunocompétence et autres fonctions importantes
Les relations phénotypiques et génétiques entre l’immunocompétence et les caractéristiques de production doivent être évaluées à la lumière de la théorie de l’allocation des ressources, car l’investissement de ressources supplémentaires dans un domaine fonctionnel peut être préjudiciable à d’autres (Friggens et al., 2017). Il a notamment été établi que la sélection génétique des volailles en vue d’obtenir un taux de croissance supérieur ou de meilleures performances s’est traduite par une diminution de la résistance aux maladies ou une réduction de la réponse immunitaire (Bayyari et al., 1997 ; van der Most et al., 2011 ; Zerjal et al., 2021). Une étude a notamment comparé des paramètres d’immunocompétence de la souche de poulets de chair Ross 308 de 2001 avec ceux d’une souche témoin de 1957. La sélection génétique visant à améliorer les performances des poulets de chair s’est traduite par une diminution du volet adaptatif de la réponse immunitaire, mais une augmentation des réponses à médiation cellulaire et inflammatoire (Cheema et al., 2003).
Cependant d’autres études concluent différemment pour d’autres paramètres. Par exemple, Kean et al. (1994) ont montré qu’une sélection divergente pour des paramètres immunitaires n’a pas impacté des paramètres de production liés à la ponte. Psifidi et al. (2016) n’ont pas mis en évidence de corrélations génétiques significatives entre les caractéristiques de l’immunité, les signes cliniques de la maladie et les performances de production. Finalement, en comparant des lignées historiques et modernes, O’Reilly et al. (2018) ont montré que les concentrations en protéines inflammatoires de la phase aigüe n’ont pas été affectées par la sélection.
Il est donc nécessaire d’explorer les compromis entre fonctions immunitaires et performances dans les différentes études menées. Il sera primordial de connaître les corrélations génétiques des nouveaux caractères d’immunocompétence identifiés avec les autres critères de sélection de l’index synthétique afin d’optimiser les poids économiques donnés à chacun des caractères. Il apparaît nécessaire d’étudier également les relations entre immunité et bien-être des animaux, dans des contextes d’élevage durable.
Conclusion
L’exploitation de la variabilité spontanée des caractéristiques immunitaires pour améliorer génétiquement l’immunocompétence des animaux pourrait être une approche prometteuse en l’intégrant de manière complémentaire aux stratégies actuelles comme la vaccination pour promouvoir un élevage durable. Il faudrait néanmoins pouvoir cibler plus pertinemment les paramètres immunitaires qui définissent l’immunocompétence d’un animal et sa résilience immunitaire et intégrer toutes les connaissances acquises sur les paramètres qui les contrôlent et les compromis qui peuvent exister avec les autres caractères d’importance tels que la performance, le stress et le bien-être des animaux pour pouvoir les exploiter pour l’amélioration génétique des volailles. L’immunophénotypage des volailles a le potentiel de fournir une meilleure compréhension et caractérisation de la bonne santé des animaux, et une optimisation de leur immunocompétence. Des questions se posent également sur les stratégies de sélection qui devraient être appliquées pour ces caractères de compétence immunitaire. Quel poids donner à ces nouveaux caractères ? L’utilisation de modélisations épidémio-génétiques apparaît ici comme une approche intéressante pour y répondre. Plus globalement, l’impact économique lié aux coûts des nouvelles mesures à réaliser pour phénotyper l’immunocompétence et l’affectation potentielle des performances, et la gestion des risques sanitaires doivent également être considérés dans les réflexions.
Remerciements
Merci au Dr Marie-Hélène Pinard-van der Laan pour sa relecture et ses conseils. Merci au personnel des unités expérimentales qui veillent sur les animaux au quotidien. Merci également aux chercheurs et aux techniciens de l’équipe Génétique, Microbiote, Santé de l’unité INRAE GABI qui s’investissent sur ces questions de recherche.
Notes
- 1. Cet article est issu d’une synthèse invitée présentée aux 15e Journées de la Recherche Avicole et Palmipèdes à Foie Gras, les 20 et 21 mars 2024 à Tours (Blanc, 2024).
Références
- Ahuja, S. K., Manoharan, M. S., Lee, G. C., McKinnon, L. R., Meunier, J. A., Steri, M., Harper, N., Fiorillo, E., Smith, A. M., Restrepo, M. I., Branum, A. P., Bottomley, M. J., Orrù, V., Jimenez, F., Carrillo, A., Pandranki, L., Winter, C. A., Winter, L. A., Gaitan, A. A., … He, W. (2023). Immune resilience despite inflammatory stress promotes longevity and favorable health outcomes including resistance to infection. Nature Communications, 14(1), 3286. doi:10.1038/s41467-023-38238-6
- Al-Murrani, W. K., Al-Rawi, I. K., & Raof, N. M. (2002). Genetic resistance to Salmonella typhimurium in two lines of chickens selected as resistant and sensitive on the basis of heterophil/lymphocyte ratio. British Poultry Science, 43(4), 501-507. doi:10.1080/0007166022000004408
- Aruwa, C. E., Pillay, C., Nyaga, M. M., & Sabiu, S. (2021). Poultry gut health – microbiome functions, environmental impacts, microbiome engineering and advancements in characterization technologies. Journal of Animal Science and Biotechnology, 12(1), 1-15. doi:10.1186/s40104-021-00640-9
- Bayyari, G., Huff, W., Rath, N., Balog, J., Newberry, L., Villines, J., Skeeles, J., Anthony, N., & Nestor, K. (1997). Effect of the genetic selection of turkeys for increased body weight and egg production on immune and physiological responses. Poultry Science, 76(2), 289-296. doi:10.1093/ps/76.2.289
- Berghof, T. V. L., Arts, J. A. J., Bovenhuis, H., Lammers, A., van der Poel, J. J., & Parmentier, H. K. (2018a). Antigen-dependent effects of divergent selective breeding based on natural antibodies on specific humoral immune responses in chickens. Vaccine, 36(11), 1444-1452. doi:10.1016/j.vaccine.2018.01.063
- Berghof, T. V. L., Visker, M. H. P. W., Arts, J. A. J., Parmentier, H. K., van der Poel, J. J., Vereijken, A. L. J., & Bovenhuis, H. (2018b). Genomic region containing Toll-like receptor genes has a major impact on total IgM antibodies including KLH-binding IgM natural antibodies in chickens. Frontiers in Immunology, 8. doi:10.3389/fimmu.2017.01879
- Berghof, T. V. L., Matthijs, M. G. R., Arts, J. A. J., Bovenhuis, H., Dwars, R. M., van der Poel, J. J., Visker, M. H. P. W., & Parmentier, H. K. (2019). Selective breeding for high natural antibody level increases resistance to avian pathogenic Escherichia coli (APEC) in chickens. Developmental & Comparative Immunology, 93, 45-57. doi:10.1016/j.dci.2018.12.007
- Bílková, B., Bainová, Z., Janda, J., Zita, L., & Vinkler, M. (2017). Different breeds, different blood: Cytometric analysis of whole blood cellular composition in chicken breeds. Veterinary Immunology and Immunopathology, 188, 71-77. doi:10.1016/j.vetimm.2017.05.001
- Biozzi, G., Stiffel, C., Mouton, D., & Bouthillier, Y. (1975). Selection of lines of mice with high and low antibody responses to complex immunogens. In B. Benacerraf (Ed.), Immunogenetics and Immunodeficiency (p. 179-227). Springer. https://doi.org/10.1007/978-94-011-6135-0_5
- Biscarini, F., Bovenhuis, H., Van Arendonk, J. A. M., Parmentier, H. K., Jungerius, A. P., & Van Der Poel, J. J. (2010). Across‐line SNP association study of innate and adaptive immune response in laying hens. Animal Genetics, 41(1), 26-38. doi:10.1111/j.1365-2052.2009.01960.x
- Bishop, S. C. (2012). A consideration of resistance and tolerance for ruminant nematode infections. Frontiers in Genetics, 3, 168. doi:10.3389/fgene.2012.00168
- Blanc, F. (2024). Immunophénotypage et applications envisageables pour l’amélioration génétique des volailles [Communication]. 15e Journées de la Recherche Avicole et Palmipèdes à Foie Gras, Tours. https://hal.inrae.fr/hal-04515238v1
- Borey, M., Bed’Hom, B., Bruneau, N., Estellé, J., Larsen, F., Blanc, F., Pinard-van der Laan, M.-H., Dalgaard, T., & Calenge, F. (2022). Caecal microbiota composition of experimental inbred MHC-B lines infected with IBV differs according to genetics and vaccination. Scientific Reports, 12(1), 9995. doi:10.1038/s41598-022-13512-7
- Burgess, S. C. (2004). Proteomics in the chicken: tools for understanding immune responses to avian diseases. Poultry Science, 83(4), 552-573. doi:10.1093/ps/83.4.552
- Burggraaf, S., Karpala, A. J., Bingham, J., Lowther, S., Selleck, P., Kimpton, W., & Bean, A. G. D. (2014). H5N1 infection causes rapid mortality and high cytokine levels in chickens compared to ducks. Virus Research, 185, 23-31. doi:10.1016/j.virusres.2014.03.012
- Calle-García, J., Ramayo-Caldas, Y., Zingaretti, L. M., Quintanilla, R., Ballester, M., & Pérez-Enciso, M. (2023). On the holobiont ‘predictome’ of immunocompetence in pigs. Genetics Selection Evolution, 55(1), 29. doi:10.1186/s12711-023-00803-4
- Cannat, A., Bousquet, C., & Serre, A. (1978). Response of high and low antibody producer to Brucella. Annales d’immunologie, 129 C(5), 669-683. http://www.ncbi.nlm.nih.gov/pubmed/104653
- Carlander, D., Stålberg, J., & Larsson, A. (1999). Chicken Antibodies. Upsala Journal of Medical Sciences, 104(3), 179-189. doi:10.3109/03009739909178961
- Chaussabel, D. (2015). Assessment of immune status using blood transcriptomics and potential implications for global health. Seminars in Immunology, 27(1), 58-66. doi:10.1016/j.smim.2015.03.002
- Cheema, M., Qureshi, M., & Havenstein, G. (2003). A comparison of the immune response of a 2001 commercial broiler with a 1957 randombred broiler strain when fed representative 1957 and 2001 broiler diets. Poultry Science, 82(10), 1519-1529. doi:10.1093/ps/82.10.1519
- Cheng, S., Rothschild, M. F., & Lamont, S. J. (1991). Estimates of Quantitative Genetic Parameters of Immunological Traits in the Chicken. Poultry Science, 70(10), 2023-2027. doi:10.3382/ps.0702023
- Cuperus, T., Coorens, M., van Dijk, A., & Haagsman, H. P. (2013). Avian host defense peptides. Developmental & Comparative Immunology, 41(3), 352-369. doi:10.1016/j.dci.2013.04.019
- Dan Heller, E., Leitner, G., Friedman, A., Uni, Z., Gutman, M., & Cahaner, A. (1992). Immunological parameters in meat-type chicken lines divergently selected by antibody response to Escherichia coli vaccination. Veterinary Immunology and Immunopathology, 34(1-2), 159-172. doi:10.1016/0165-2427(92)90159-N
- Désert, C., Merlot, E., Zerjal, T., Bed’hom, B., Härtle, S., Le Cam, A., Roux, P.-F., Baéza, E., Gondret, F., Duclos, M. J., & Lagarrigue, S. (2016). Transcriptomes of whole blood and PBMC in chickens. Comparative Biochemistry and Physiology Part D: Genomics and Proteomics, 20, 1-9. doi:10.1016/j.cbd.2016.06.008
- Duffy, D., Rouilly, V., Libri, V., Hasan, M., Beitz, B., David, M., Urrutia, A., Bisiaux, A., LaBrie, S. T., Dubois, A., Boneca, I. G., Delval, C., Thomas, S., Rogge, L., Schmolz, M., Quintana-Murci, L., & Albert, M. L. (2014). Functional analysis via standardized whole-blood stimulation systems defines the boundaries of a healthy immune response to complex stimuli. Immunity, 40(3), 436-450. doi:10.1016/j.immuni.2014.03.002
- Estellé, J. (2019). Benefits from the joint analysis of host genomes and metagenomes: Select the holobiont. Journal of Animal Breeding and Genetics, 136(2), 75-76. doi:10.1111/jbg.12383
- Fairbrother, A., & O’Loughlin, D. (1990). Differential white blood cell values of the Mallard (Anas Platyrhynchos) across different ages and reproductive states. Journal of Wildlife Diseases, 26(1), 78-82. doi:10.7589/0090-3558-26.1.78
- Fair, J. M., Taylor-McCabe, K. J., Shou, Y., & Marrone, B. L. (2008). Immunophenotyping of chicken peripheral blood lymphocyte subpopulations: Individual variability and repeatability. Veterinary Immunology and Immunopathology, 125(3-4), 268-273. doi:10.1016/j.vetimm.2008.05.012
- Fellowes, M. D. E., Kraaijeveld, A. R., & Godfray, H. C. J. (1999). Cross-resistance following artificial selection for increased defense against parasitoids in Drosophila melanogaster. Evolution, 53(3), 966-972. doi:10.1111/j.1558-5646.1999.tb05391.x
- Friggens, N. C., Blanc, F., Berry, D. P., & Puillet, L. (2017). Review: Deciphering animal robustness. A synthesis to facilitate its use in livestock breeding and management. Animal, 11(12), 2237-2251. doi:10.1017/S175173111700088X
- Hale, C., & Howard, J. G. (1981). Immunological regulation of experimental cutaneous leishmaniasis. 2. Studies with Biozzi high and low responder lines of mice. Parasite Immunology, 3(1), 45-55. doi:10.1111/j.1365-3024.1981.tb00384.x
- Hamzic, E., Bed’Hom, B., Juin, H., Hawken, R., Abrahamsen, M. S., Elsen, J. M., Servin, B., Pinard-van der Laan, M.-H., & Demeure, O. (2015). Large-scale investigation of the parameters in response to Eimeria maxima challenge in broilers. Journal of Animal Science, 93(4), 1830-1840. doi:10.2527/jas2014-8592
- Hao, X., Zhang, F., Yang, Y., & Shang, S. (2021). The Evaluation of Cellular Immunity to Avian Viral Diseases: Methods, Applications, and Challenges. Frontiers in Microbiology, 12. doi:10.3389/fmicb.2021.794514
- Harr, K. E. (2009). Diagnostic Value of Biochemistry. In G. J. Harrison & T. L. Lightfoot (Eds.), Clinical Avian Medicine (Vol. II, p. 611-630). Spix Publishing, Inc.
- Hine, B. C., Mallard, B. A., Ingham, A. B., & Colditz, I. G. (2014). Immune competence in livestock. In S. Hermesch & S. Dominik (Eds.), Breeding Focus 2014 – Improving Resilience. Animal Genetics and Breeding Unit, University of New England, Armidale, NSW, Australia.
- Hofmann, T., Schmucker, S. S., Bessei, W., Grashorn, M., & Stefanski, V. (2020). Impact of housing environment on the immune system in chickens: A review. Animals, 10(7), 1138. doi:10.3390/ani10071138
- Hulst, A. D., Bijma, P., & De Jong, M. C. M. (2022). Can breeders prevent pathogen adaptation when selecting for increased resistance to infectious diseases? Genetics Selection Evolution, 54(1), 73. doi:10.1186/s12711-022-00764-0
- Jankowski, J., Tykałowski, B., Stępniowska, A., Konieczka, P., Koncicki, A., Matusevičius, P., & Ognik, K. (2022). Immune Parameters in Chickens Treated with Antibiotics and Probiotics during Early Life. Animals, 12(9), 1133. doi:10.3390/ani12091133
- Janmohammadi, A., Sheikhi, N., Nazarpak, H. H., & Nikbakht Brujeni, G. (2020). Effects of vaccination on acute-phase protein response in broiler chicken. PLoS ONE, 15(2), e0229009. doi:10.1371/journal.pone.0229009
- Jax, E., Werner, E., Müller, I., Schaerer, B., Kohn, M., Olofsson, J., Waldenström, J., Kraus, R. H. S., & Härtle, S. (2023). Evaluating Effects of AIV Infection Status on Ducks Using a Flow Cytometry-Based Differential Blood Count. Microbiology Spectrum, 11(4), 1-15. doi:10.1128/spectrum.04351-22
- Jenkins, D. C., & Carrington, T. S. (1981). Nematospiroides dubius: the course of primary, secondary and tertiary infections in high and low responder Biozzi mice. Parasitology, 82(2), 311-318. doi:10.1017/S003118200005705X
- Jorge, S., & Dellagostin, O. A. (2017). The development of veterinary vaccines: a review of traditional methods and modern biotechnology approaches. Biotechnology Research and Innovation, 1(1), 6-13. doi:10.1016/j.biori.2017.10.001
- Kean, R. P., Cahaner, A., Freeman, A. E., & Lamont, S. J. (1994). Direct and Correlated Responses to Multitrait, Divergent Selection for Immunocompetence. Poultry Science, 73(1), 18-32. doi:10.3382/ps.0730018
- Kierszenbaum, P., & Howard, J. G. (1976). Mechanisms of resistance against experimental Trypanosoma cruzi infection: the importance of antibodies and antibody-forming capacity in the Biozzi high and low responder mice. The Journal of Immunology, 116(5), 1208-1211. doi:10.4049/jimmunol.116.5.1208
- Kramer, J., Visscher, A. H., Wagenaar, J. A., Cornelissen, J. B. J. W., & Jeurissen, S. H. M. (2003). Comparison of natural resistance in seven genetic groups of meat-type chicken. British Poultry Science, 44(4), 577-585. doi:10.1080/00071660310001616174
- Lagrange, P. H., Hurtrel, B., & Thickstun, P. M. (1979). Immunological behavior after mycobacterial infection in selected lines of mice with high or low antibody responses. Infection and Immunity, 25(1), 39-47. doi:10.1128/iai.25.1.39-47.1979
- Lecoeur, A., Blanc, F., Gourichon, D., Bruneau, N., Burlot, T., Calenge, F., & Pinard-van der Laan, M.-H. (2022). Combined effect of genetics and gut microbiota on variations in vaccine response in hens. 12th World Congress on Genetics Applied to Livestock Production (WCGALP), Rotterdam. https://hal.inrae.fr/hal-03798383v1
- Lecoeur, A., Blanc, F., Gourichon, D., Bruneau, N., Burlot, T., Pinard-van der Laan, M.-H., & Calenge, F. (2024). Host genetics drives differences in cecal microbiota composition and immune traits of laying hens raised in the same environment. Poultry Science, 103(5), 103609. doi:10.1016/j.psj.2024.103609
- Lentfer, T. L., Pendl, H., Gebhardt-Henrich, S. G., Fröhlich, E. K. F., & Von Borell, E. (2015). H/L ratio as a measurement of stress in laying hens - methodology and reliability. British Poultry Science, 56(2), 157-163. doi:10.1080/00071668.2015.1008993
- Lesueur, J., Walachowski, S., Barbey, S., Cebron, N., Lefebvre, R., Launay, F., Boichard, D., Germon, P., Corbiere, F., & Foucras, G. (2022). Standardized whole blood assay and bead-based cytokine profiling reveal commonalities and diversity of the response to bacteria and TLR ligands in cattle. Frontiers in Immunology, 13. doi:10.3389/fimmu.2022.871780
- Letendre, C., Duffield, K. R., Sadd, B. M., Sakaluk, S. K., House, C. M., & Hunt, J. (2022). Genetic covariance in immune measures and pathogen resistance in decorated crickets is sex and pathogen specific. Journal of Animal Ecology, 91(7), 1471-1488. doi:10.1111/1365-2656.13709
- Lindenwald, R., Pendl, H., Scholtes, H., Schuberth, H. J., & Rautenschlein, S. (2019). Flow-cytometric analysis of circulating leukocyte populations in turkeys: Establishment of a whole blood analysis approach and investigations on possible influencing factors. Veterinary Immunology and Immunopathology, 210, 46-54. doi:10.1016/j.vetimm.2019.03.006
- Lu, M., Lee, Y., & Lillehoj, H. S. (2023). Evolution of developmental and comparative immunology in poultry: The regulators and the regulated. Developmental & Comparative Immunology, 138, 104525. doi:10.1016/j.dci.2022.104525
- Maxwell, M. H., & Robertson, G. W. (1998). The avian heterophil leucocyte: a review. World’s Poultry Science Journal, 54(2), 155-178. doi:10.1079/WPS19980012
- McBride, J. A., & Striker, R. (2017). Imbalance in the game of T cells: What can the CD4/CD8 T-cell ratio tell us about HIV and health? PLoS Pathogens, 13(11), e1006624. doi:10.1371/journal.ppat.1006624
- Minozzi, G., Parmentier, H. K., Nieuwland, M. G. B., Bed’Hom, B., Minvielle, F., Gourichon, D., & Pinard-van der Laan, M.-H. (2007). Antibody responses to keyhole limpet hemocyanin, lipopolysaccharide, and newcastle disease virus vaccine in F2 and backcrosses of white leghorn lines selected for two different immune response traits. Poultry Science, 86(7), 1316-1322. doi:10.1093/ps/86.7.1316
- Müller, S., Kröger, C., Schultze, J. L., & Aschenbrenner, A. C. (2024). Whole blood stimulation as a tool for studying the human immune system. European Journal of Immunology, 54(2). doi:10.1002/eji.202350519
- Naghizadeh, M., Larsen, F. T., Wattrang, E., Norup, L. R., & Dalgaard, T. S. (2019). Rapid whole blood assay using flow cytometry for measuring phagocytic activity of chicken leukocytes. Veterinary Immunology and Immunopathology, 207, 53-61. doi:10.1016/j.vetimm.2018.11.014
- O’Reilly, E. L., & Eckersall, P. D. (2014). Acute phase proteins: A review of their function, behaviour and measurement in chickens. World’s Poultry Science Journal, 70(1), 27-44. doi:10.1017/S0043933914000038
- O’Reilly, E. L., Bailey, R. A., & Eckersall, P. D. (2018). A comparative study of acute-phase protein concentrations in historical and modern broiler breeding lines. Poultry Science, 97(11), 3847-3853. doi:10.3382/ps/pey272
- Oke, O. E., Akosile, O. A., Oni, A. I., Opowoye, I. O., Ishola, C. A., Adebiyi, J. O., Odeyemi, A. J., Adjei-Mensah, B., Uyanga, V. A., & Abioja, M. O. (2024). Oxidative stress in poultry production. Poultry Science, 103(9), 104003. doi:10.1016/j.psj.2024.104003
- Owens, I. P. F., & Wilson, K. (1999). Immunocompetence: a neglected life history trait or conspicuous red herring? Trends in Ecology & Evolution, 14(5), 170-172. doi:10.1016/S0169-5347(98)01580-8
- Palma, J., Tokarz-Deptuła, B., Deptuła, J., & Deptuła, W. (2018). Natural antibodies – Facts known and unknown. Central European Journal of Immunology, 43(4), 466-475. doi:10.5114/ceji.2018.81354
- Parmentier, H. K., Lammers, A., Hoekman, J. J., de Vries Reilingh, G., Zaanen, I. T. A., & Savelkoul, H. F. J. (2004). Different levels of natural antibodies in chickens divergently selected for specific antibody responses. Developmental & Comparative Immunology, 28(1), 39-49. doi:10.1016/S0145-305X(03)00087-9
- Pieper, J., Methner, U., & Berndt, A. (2011). Characterization of avian γδ T-cell subsets after Salmonella enterica serovar typhimurium infection of chicks. Infection and Immunity, 79(2), 822-829. doi:10.1128/IAI.00788-10
- Pinard-van der Laan, M.-H. (2002). Immune modulation: The genetic approach. Veterinary Immunology and Immunopathology, 87(3-4), 199-205. doi:10.1016/S0165-2427(02)00075-2
- Plant, J. E., & Glynn, A. A. (1982). Genetic control of resistance to Salmonella typhimurium infection in high and low antibody responder mice. Clinical and Experimental Immunology, 50(2), 283-290. http://www.ncbi.nlm.nih.gov/pubmed/6817955
- Psifidi, A., Banos, G., Matika, O., Desta, T. T., Bettridge, J., Hume, D. A., Dessie, T., Christley, R., Wigley, P., Hanotte, O., & Kaiser, P. (2016). Genome-wide association studies of immune, disease and production traits in indigenous chicken ecotypes. Genetics Selection Evolution, 48(1), 74. doi:10.1186/s12711-016-0252-7
- Reid, C., Beynon, C., Kennedy, E., O’Farrelly, C., & Meade, K. G. (2021). Bovine innate immune phenotyping via a standardized whole blood stimulation assay. Scientific Reports, 11(1), 17227. doi:10.1038/s41598-021-96493-3
- Reverter, A., Hine, B. C., Porto-Neto, L., Li, Y., Duff, C. J., Dominik, S., & Ingham, A. B. (2021). ImmuneDEX: a strategy for the genetic improvement of immune competence in Australian Angus cattle. Journal of Animal Science, 99(3), skaa384. doi:10.1093/jas/skaa384
- Samour, J. (2009). Diagnostic value of hematology. In G. J. Harrison & T. Lightfoot (Eds.), Clinical Avian Medicine (Vol. II, p. 587-610). Spix Publishing, Inc.
- Sarrigeorgiou, I., Stivarou, T., Tsinti, G., Patsias, A., Fotou, E., Moulasioti, V., Kyriakou, D., Tellis, C., Papadami, M., Moussis, V., Tsiouris, V., Tsikaris, V., Tsoukatos, D., & Lymberi, P. (2023). Levels of circulating IgM and IgY natural antibodies in broiler chicks: Association with genotype and farming systems. Biology, 12(2), 304. doi:10.3390/biology12020304
- Schokker, D., Jansman, A. J. M., Veninga, G., de Bruin, N., Vastenhouw, S. A., de Bree, F. M., Bossers, A., Rebel, J. M. J., & Smits, M. A. (2017). Perturbation of microbiota in one-day old broiler chickens with antibiotic for 24 hours negatively affects intestinal immune development. BMC Genomics, 18(1), 241. doi:10.1186/s12864-017-3625-6
- Seliger, C., Schaerer, B., Kohn, M., Pendl, H., Weigend, S., Kaspers, B., & Härtle, S. (2012). A rapid high-precision flow cytometry based technique for total white blood cell counting in chickens. Veterinary Immunology and Immunopathology, 145(1-2), 86-99. doi:10.1016/j.vetimm.2011.10.010
- Siegel, P. B. (2014). Evolution of the Modern Broiler and Feed Efficiency. Annual Review of Animal Biosciences, 2(1), 375-385. doi:10.1146/annurev-animal-022513-114132
- Sivaraman, G. K., & Kumar, S. (2013). Immunocompetence index selection of broiler chicken lines for disease resistance and their impact on survival rate. Veterinary World, 6(9), 628-631. doi:10.14202/vetworld.2013.628-631
- Song, B., Tang, D., Yan, S., Fan, H., Li, G., Shahid, M. S., Mahmood, T., & Guo, Y. (2021). Effects of age on immune function in broiler chickens. Journal of Animal Science and Biotechnology, 12(1), 42. doi:10.1186/s40104-021-00559-1
- Song, B., Li, P., Xu, H., Wang, Z., Yuan, J., Zhang, B., Lv, Z., Song, Z., & Guo, Y. (2022). Effects of rearing system and antibiotic treatment on immune function, gut microbiota and metabolites of broiler chickens. Journal of Animal Science and Biotechnology, 13(1), 144. doi:10.1186/s40104-022-00788-y
- Soutter, F., Werling, D., Tomley, F. M., & Blake, D. P. (2020). Poultry coccidiosis: Design and interpretation of vaccine studies. Frontiers in Veterinary Science, 7. doi:10.3389/fvets.2020.00101
- Sparavigna, A. C. (2017). Measuring the blood cells by means of an image segmentation. Philica. https://hal.science/hal-01654006
- Star, L., Frankena, K., Kemp, B., Nieuwland, M. G. B., & Parmentier, H. K. (2007). Natural humoral immune competence and survival in layers. Poultry Science, 86(6), 1090-1099. doi:10.1093/ps/86.6.1090
- Sun, Y., Parmentier, H. K., Frankena, K., & van der Poel, J. J. (2011). Natural antibody isotypes as predictors of survival in laying hens. Poultry Science, 90(10), 2263-2274. doi:10.3382/ps.2011-01613
- Thompson-Crispi, K. A., Sewalem, A., Miglior, F., & Mallard, B. A. (2012). Genetic parameters of adaptive immune response traits in Canadian Holsteins. Journal of Dairy Science, 95(1), 401-409. doi:10.3168/jds.2011-4452
- Uchiyama, R., Moritomo, T., Kai, O., Uwatoko, K., Inoue, Y., & Nakanishi, T. (2005). Counting absolute number of lymphocytes in quail whole blood by flow cytometry. Journal of Veterinary Medical Science, 67(4), 441-444. doi:10.1292/jvms.67.441
- van der Klein, S. A. S., Berghof, T. V. L., Arts, J. A. J., Parmentier, H. K., van der Poel, J. J., & Bovenhuis, H. (2015). Genetic relations between natural antibodies binding keyhole limpet hemocyanin and production traits in a purebred layer chicken line. Poultry Science, 94(5), 875-882. doi:10.3382/ps/pev052
- van der Most, P. J., de Jong, B., Parmentier, H. K., & Verhulst, S. (2011). Trade‐off between growth and immune function: a meta‐analysis of selection experiments. Functional Ecology, 25(1), 74-80. doi:10.1111/j.1365-2435.2010.01800.x
- Wang, J., Zhang, J., Wang, Q., Zhang, Q., Thiam, M., Zhu, B., Ying, F., Elsharkawy, M. S., Zheng, M., Wen, J., Li, Q., & Zhao, G. (2023). A heterophil/lymphocyte-selected population reveals the phosphatase PTPRJ is associated with immune defense in chickens. Communications Biology, 6(1), 196. doi:10.1038/s42003-023-04559-x
- Wilkie, B., & Mallard, B. (1999). Selection for high immune response: an alternative approach to animal health maintenance? Veterinary Immunology and Immunopathology, 72(1-2), 231-235. doi:10.1016/S0165-2427(99)00136-1
- Wondmeneh, E., Van Arendonk, J. A. M., Van der Waaij, E. H., Ducro, B. J., & Parmentier, H. K. (2015). High natural antibody titers of indigenous chickens are related with increased hazard in confinement. Poultry Science, 94(7), 1493-1498. doi:10.3382/ps/pev107
- Zerjal, T., Härtle, S., Gourichon, D., Guillory, V., Bruneau, N., Laloë, D., Pinard-van der Laan, M.-H., Trapp, S., Bed’hom, B., & Quéré, P. (2021). Assessment of trade-offs between feed efficiency, growth-related traits, and immune activity in experimental lines of layer chickens. Genetics Selection Evolution, 53(1), 44. doi:10.1186/s12711-021-00636-z
- Zhang, L., Li, P., Liu, R., Zheng, M., Sun, Y., Wu, D., Hu, Y., Wen, J., & Zhao, G. (2015). The identification of loci for immune traits in chickens using a genome-wide association study. PLoS ONE, 10(3), e0117269. doi:10.1371/journal.pone.0117269
Résumé
L'élevage, en particulier celui des volailles, est soumis à des pressions sociétales et environnementales considérables, notamment en ce qui concerne le bien-être des animaux et la durabilité des pratiques agricoles. En outre, des maladies chroniques et émergentes peuvent entraîner d’importantes pertes économiques. L'amélioration de la robustesse et de la résistance des animaux aux agents pathogènes devient donc une priorité. Dans ce contexte, le suivi de la réponse immunitaire des volailles est essentiel pour évaluer leur santé. L'immunophénotypage est une technique qui mesure des paramètres immunologiques après une stimulation de l’immunité, par une vaccination ou une infection. Il peut s’agir aussi de mesurer des paramètres renseignant sur l'immunocompétence des animaux à l’état basal. L’immunocompétence peut être évaluée en mesurant la résistance ou la tolérance à un pathogène particulier ou en analysant un panel de paramètres immunitaires. Certaines mesures sont directement effectuées à partir des cellules sanguines et du plasma, et permettent de déterminer la composition des cellules sanguines, les taux d'anticorps (totaux, naturels ou spécifiques), les protéines plasmatiques, les activités enzymatiques et bactéricides. D'autres paramètres, mesurables par stimulation ex vivo, évaluent la capacité de phagocytose, la réponse à la stimulation du sang total ou la réactivité des lymphocytes T. Il est essentiel de définir des corrélats de protection, c’est-à-dire des mesures précises qui sont significativement liées à la protection contre la maladie après une vaccination ou lors d’une infection. L'intégration des connaissances sur les paramètres qui contrôlent la réponse immunitaire et les compromis qui peuvent exister avec d'autres caractéristiques importantes telles que la performance, le stress et le bien-être des animaux est également cruciale si l'on veut les exploiter pour l'amélioration génétique des volailles. L'exploitation de la variabilité spontanée des caractéristiques immunitaires pour améliorer génétiquement l'immunocompétence des animaux pourrait être une approche prometteuse, intégrée de manière complémentaire aux stratégies actuelles telles que la vaccination pour promouvoir la durabilité de l’élevage.
Pièces jointes
Pas de document complémentaire pour cet articleStatistiques de l'article
 Vues: 1917
Vues: 1917
Téléchargements
 PDF: 219
PDF: 219
 XML: 64
XML: 64

