Enterococcus cecorum, un agent pathogène opportuniste des volailles : mieux le connaître pour une meilleure maîtrise en élevage (Full text available in English)
Enterococcus cecorum est devenu un agent pathogène majeur des volailles au niveau mondial. Cette bactérie est à l’origine de troubles locomoteurs qui entraînent une surmortalité, un usage accru d’antibiotiques et des pertes économiques, particulièrement dans les élevages de poulets de chair à croissance rapide. Cet article synthétise l’état des connaissances à la fois épidémiologiques, zootechniques et fondamentales pour une meilleure maîtrise et prévention de la maladie dans les élevages
Introduction
Les maladies affectant les volailles sont généralement le résultat de multiples facteurs, qu'ils soient d’origine environnementale ou génétique, liés aux pratiques d’élevage ou dépendant de la sensibilité et du statut immunitaire des animaux. En l’espace de cinq décennies, la croissance des poulets de chair a été multipliée par cinq entre 29 et 35 jours d’âge (Zuidhof et al., 2014). Cette augmentation rapide de la masse corporelle des oiseaux soumet le squelette à des contraintes mécaniques pouvant favoriser l’invasion et la colonisation du système articulaire par des bactéries opportunistes à l’origine d’infections osseuses le plus souvent associées à Staphylococcus aureus, Escherichia coli ou Enterococcus cecorum (Wideman, 2016 ; Wijesurendra et al., 2017). Au cours des quinze dernières années, les pathologies locomotrices à E. cecorum ont progressivement atteint un niveau préoccupant dans les élevages de poulets de chair en affectant à la fois la santé et le bien-être des animaux.
Cette revue tente d’établir un lien entre les connaissances actuelles physiologiques et moléculaires de E. cecorum et la pathologie dans les élevages. Elle aborde également les modes de transmission possibles, les méthodes de détection et les traitements actuels ainsi que les mesures préventives zootechniques et de biosécurité pour contenir la propagation de cette bactérie dans et entre les élevages. Enfin, elle évoque des pistes de recherche et de développement pour la maîtrise de ce pathogène dans les élevages (figure 1).
Figure 1. Voies d’infection possibles par E. cecorum et mesures préventives.
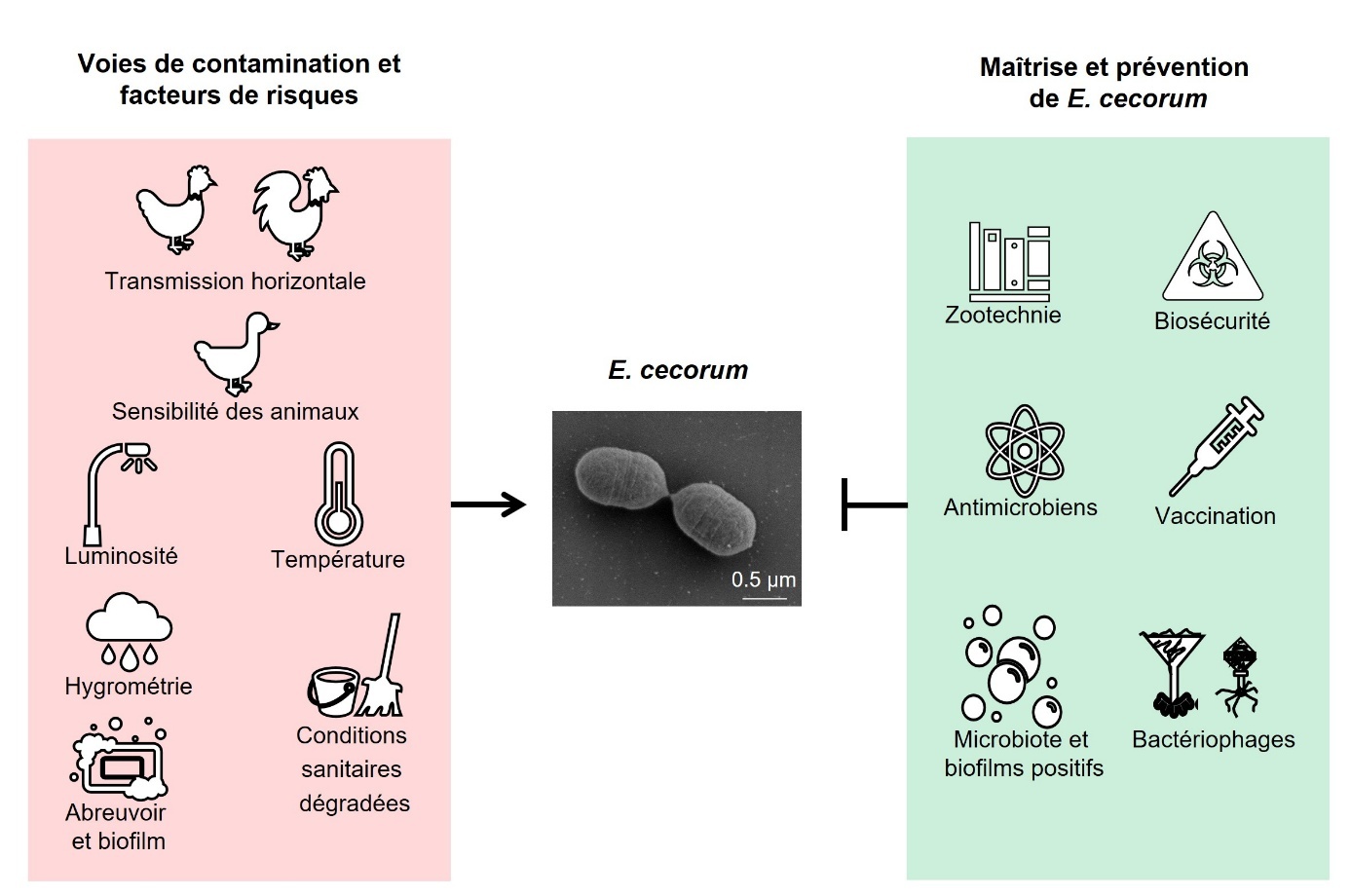
1. Un pathogène opportuniste en élevage de poulet de chair
1.1. E. cecorum, un agent bactérien commensal du tractus intestinal des volailles
L’agent bactérien E. cecorum a été décrit pour la première fois en 1983 en Belgique, lorsqu’il a été isolé du contenu cæcal d’un poulet mort, sous le nom de Streptococcus cecorum (Devriese et al., 1983). C’est en 1989 qu’il a été reclassé au sein du genre Enterococcus qui rassemble plus de 75 espèces de bactéries ubiquitaires retrouvées dans le microbiote intestinal des animaux terrestres, y compris des oiseaux (Parks et al., 2020 ; Schwartzman et al., 2024).
E. cecorum est une bactérie à Gram positif qui se présente sous la forme de coques ou cocci. Elle est anaérobie facultative et non sporulée (Jung et al., 2018). C’est une bactérie commensale du microbiote intestinal des volailles, en particulier des poulets (Devriese et al., 1991b). On la retrouve également dans le tractus intestinal d’autres animaux tels que les porcs, les bovins, les chevaux, les canards et les dindes (Devriese et al., 1991a ; Scupham et al., 2008). E. cecorum a également la capacité de former des biofilms sur des surfaces inertes (Grund et al., 2022 ; Laurentie et al., 2023a), et est un agent opportuniste à l’origine de pathologies locomotrices chez les volailles (Jung et al., 2018).
1.2. Les signes cliniques
Les pathologies à E. cecorum sont principalement observées chez les poulets, bien qu’il y ait également des cas signalés dans d’autres productions avicoles, comme les canards ou les dindes (Dolka et al., 2017 ; Souillard et al., 2022). Elles se manifestent par des signes généraux, tels qu’une diminution de la consommation alimentaire, une hétérogénéité de croissance, une déshydratation des animaux et une augmentation de la mortalité comprise entre 7 et plus de 10 % (Robbins et al., 2012 ; Jung & Rautenschlein, 2014). Une première phase septicémique se traduit par des lésions de péricardites, périhépatites fibrineuses et splénomégalies (Jung & Rautenschlein, 2014). Les troubles locomoteurs et les boiteries apparaissent le plus souvent à partir de trois à quatre semaines d’âge (Stalker et al., 2010 ; Jung & Rautenschlein, 2014 ; Borst et al., 2017). Le signe caractéristique de la pathologie locomotrice chez les poulets infectés par E. cecorum est l’observation d’une position assise des animaux sur les jarrets (Jung et al., 2018). Typique d’une spondylarthrite à entérocoques, ce signe résulte d’une paralysie causée par l’apparition d’une lésion inflammatoire au niveau de la vertèbre thoracique libre qui comprime la moelle épinière (Jung & Rautenschlein, 2014). Des lésions d’arthrites, de synovites et de nécrose des têtes fémorales sont également observées (Stalker et al., 2010 ; Borst et al., 2012 ; Jung & Rautenschlein, 2014). Les lésions septicémiques et osseuses sont à l’origine de saisies à l’abattoir avec des taux pouvant atteindre 9,75 % (Jung & Rautenschlein, 2014). Les pathologies à E. cecorum entraînent ainsi de lourdes pertes économiques dans les élevages.
1.3. Historique et épidémiologie
E. cecorum est apparu comme un agent pathogène des volailles au début des années 2000. Les premiers cas rapportés ont été signalés en Écosse (Wood et al., 2002) et aux Pays-Bas (Devriese et al., 2002), puis plus largement dans d’autres pays d’Europe (Makrai et al., 2011 ; Szeleszczuk et al., 2013 ; AMCRA, 2021) et en Amérique du Nord (Stalker et al., 2010 ; Borst et al., 2012). En France, une recrudescence des pathologies associées à E. cecorum a également été observée chez les volailles ces 15 dernières années. Notamment, une émergence de cette bactérie a été notée à travers les données du Réseau national d’observations épidémiologiques en aviculture (RNOEA). En 2006, Enterococcus ne représentait que 0,4 % de tous les agents pathogènes signalés alors que cette proportion a atteint 12,9 % en 2020 (Souillard et al., 2022). La plupart des maladies associées à Enterococcus ont été observées chez les poulets de chair, particulièrement touchés par des troubles locomoteurs à E. cecorum dont l’incidence a augmenté de 6 % en 2017 à 14,8 % en 2022. E. cecorum est le second agent pathogène transmis chez le poulet de chair derrière E. coli, représentant respectivement 16,3 % et 63,6 % de l’ensemble des agents pathogènes signalés au réseau en 2022 dans cette production (n = 4 289). Cette forte augmentation peut s’expliquer en partie par une vigilance accrue des vétérinaires sur le terrain ainsi que l’amélioration des méthodes de diagnostic en laboratoire depuis les années 2010 (Dolka et al., 2017 ; Karunarathna et al., 2017 ; Suyemoto et al., 2017 ; Tessin et al., 2024). Cependant, la pathologie à E. cecorum est, aujourd’hui, une maladie majeure de la production de poulet de chair dans le monde.
1.4. Pathogenèse
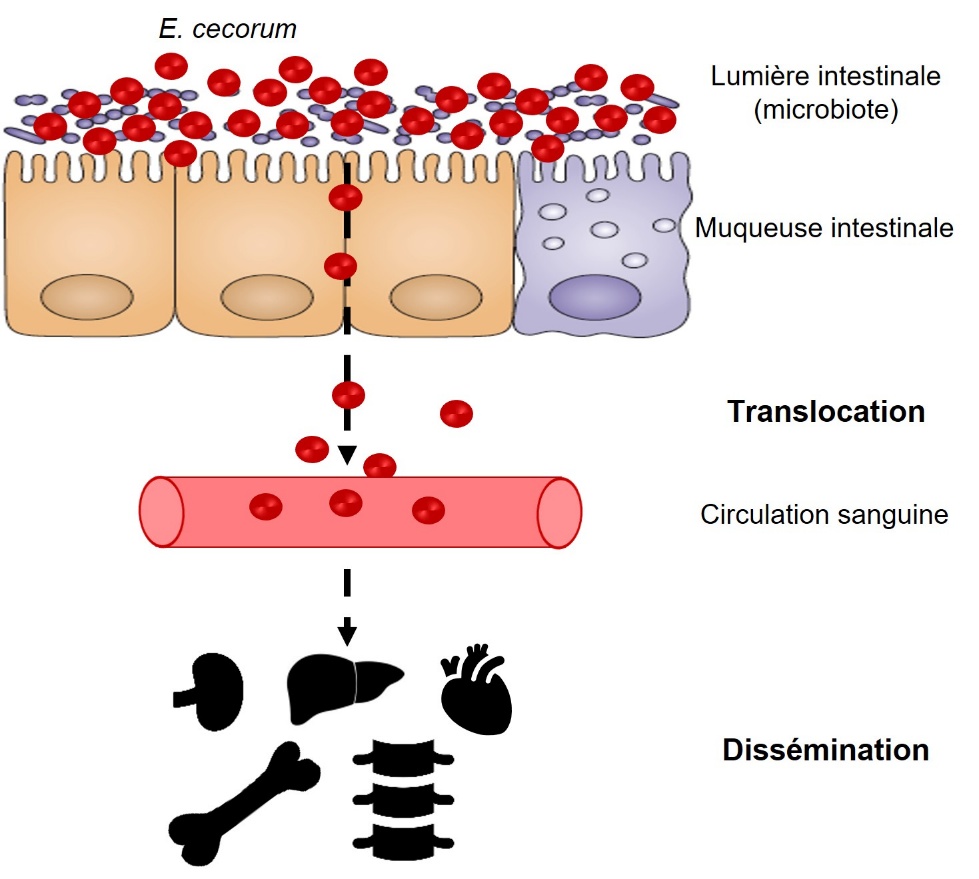
Les souches cliniques de E. cecorum semblent être adaptées pour coloniser l’intestin dès le premier jour de vie des animaux, tandis que les isolats commensaux ne semblent pas coloniser l’intestin à un niveau détectable avant la troisième semaine de vie (Devriese et al., 1991b ; Borst et al., 2017) (figure 2). En effet, Borst et al. (2017) ont montré que dans des élevages présentant des épisodes cliniques à E. cecorum, la bactérie était détectée dans le contenu intestinal dès la première semaine de vie chez 60 % des animaux. À l’inverse, E. cecorum n’était détectable qu’à partir de la troisième semaine de vie pour 30 % des animaux dans les élevages ne présentant pas d’épisode infectieux (Borst et al., 2017). Selon le modèle actuel, la bactérie pénétrerait dans la circulation sanguine après avoir colonisé l’intestin et traversé la muqueuse intestinale, expliquant sa détection dans des organes au niveau du cœur, du foie ou de la rate durant la phase précoce d’infection (figure 3). C’est au cours de cette étape de bactériémie que E. cecorum atteindrait les sites osseux, notamment les vertèbres thoraciques, les têtes fémorales et les articulations, pour entraîner des lésions inflammatoires à l’origine de boiteries et de paralysies (Borst et al., 2017). La résistance d’isolats cliniques de E. cecorum à des concentrations élevées de lysozyme pourraient leur conférer un avantage écologique lors de la colonisation précoce des poussins (Manders et al., 2024).
Figure 2. Association temporelle entre la présence de E. cecorum et les signes cliniques.
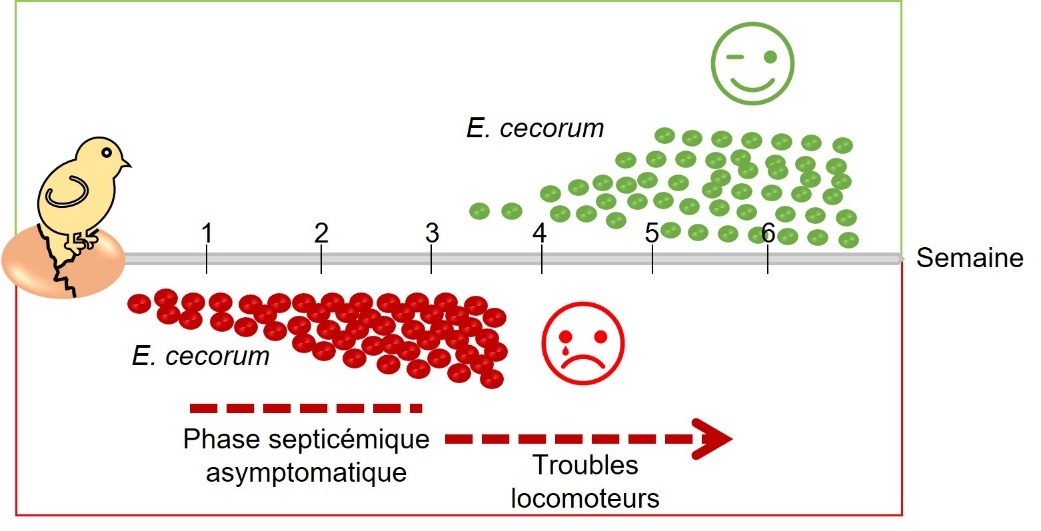
Figure 3. Modèle d’infection du poussin par E. cecorum.
1.5. Virulence ou opportunisme
Plusieurs études épidémiologiques moléculaires basées sur les profils d’électrophorèse en champ pulsé d’isolats commensaux et cliniques des États-Unis, du Canada, de la Belgique, des Pays-Bas, de l’Allemagne et de la Pologne ont montré que les isolats commensaux présentent une plus grande diversité que les isolats cliniques, ce qui suggère l’évolution de clones spécifiques ayant un potentiel pathogène plus élevé (Kense & Landman, 2011 ; Boerlin et al., 2012 ; Borst et al., 2012 ; Robbins et al., 2012 ; Huang et al., 2023). L’étude génomique d’une centaine de souches cliniques d’origine aviaire collectées en France entre 2007 et 2017, a confirmé le caractère clonal des isolats cliniques aviaires qui appartiennent à un clade phylogénétique retrouvé aux États-Unis et en Europe (Laurentie et al., 2023a). Plus récemment, l’étude phylogénétique d’une trentaine de souches cliniques d’élevages américains, isolées d’animaux septicémiques au cours des trois premières semaines de vie semble remettre en cause le caractère clonal des isolats cliniques responsables de boiteries par la mise en évidence d’un clone associé à la septicémie (Rhoads et al., 2024). Les mutations identifiées dans sept gènes conservés entre toutes les souches semblent refléter une adaptation à l’hôte. On ne peut actuellement pas exclure l’émergence d’un nouveau clone responsable de septicémie. Il serait intéressant d’évaluer le potentiel infectieux de ces souches et de déterminer leur capacité à induire des boiteries.
Malgré ces avancées, la distinction entre les souches cliniques et commensales reste un défi. L’identification de gènes préférentiellement retrouvés dans les isolats cliniques pourrait aider à distinguer des isolats non cliniques (Borst et al., 2015 ; Huang et al., 2023 ; Laurentie et al., 2023a). Par exemple, la capsule est un facteur d’échappement à la phagocytose. La fréquence élevée dans les isolats cliniques de certains gènes de la capsule suggère un rôle dans la virulence (Huang et al., 2023 ; Laurentie et al., 2023a). D’autres gènes préférentiellement retrouvés dans les génomes des isolats cliniques et codant des fonctions susceptibles de conférer des capacités métaboliques alternatives pour survivre et se multiplier chez l’hôte pourraient contribuer à la virulence (Borst et al., 2015 ; Laurentie et al., 2023a ; Rhoads et al., 2024). Actuellement, aucun modèle d’infection ne permet de distinguer les isolats cliniques des isolats non cliniques ni d’étudier l’impact de gènes spécifiques sur la virulence. Le test de létalité sur des œufs embryonnés de poulet a montré des variations significatives de mortalité et de lésions entre les isolats, mais sa pertinence et sa fiabilité nécessitent d’être consolidées en raison de disparités entre les études (Borst et al., 2014 ; Ekesi et al., 2021 ; Dolka et al., 2022 ; Huang et al., 2023 ; Laurentie et al., 2023a). L’inoculation orale chez des oiseaux âgés de deux semaines s’est révélée être plus efficace que l’inoculation par voie intraveineuse ou des sacs aériens pour reproduire les lésions de la colonne vertébrale, comme en témoigne l’examen macroscopique et microscopique pour les lésions spinales (Martin et al., 2011). L’équipe de A. Jung en Allemagne a décrit un modèle d’infection par voie orale chez des poussins d’un jour au plus proche des conditions de terrain. Bien que ce modèle ait reproduit la phase septique et les signes cliniques tardifs dans au plus 20 % des oiseaux infectés, seul un des deux isolats cliniques testés s’est révélé virulent (Schreier et al., 2021). Récemment, un modèle d’infection in ovo à 18 jours de développement embryonnaire a permis de détecter la bactérie au niveau de la tête fémorale et de la vertèbre thoracique libre chez plus de 60 % des oiseaux (Arango et al., 2023). Cependant, la présence de E. cecorum n’ayant pas été recherchée dans le microbiote intestinal il n’est pas possible de déterminer si l’infection osseuse résulte de l’infection initiale ou de la colonisation intestinale précoce. La distinction des isolats commensaux et cliniques de E. cecorum reste un obstacle en raison du manque d’outils moléculaires ou phénotypiques permettant de les différencier de manière fiable.
1.6. L’antibiorésistance
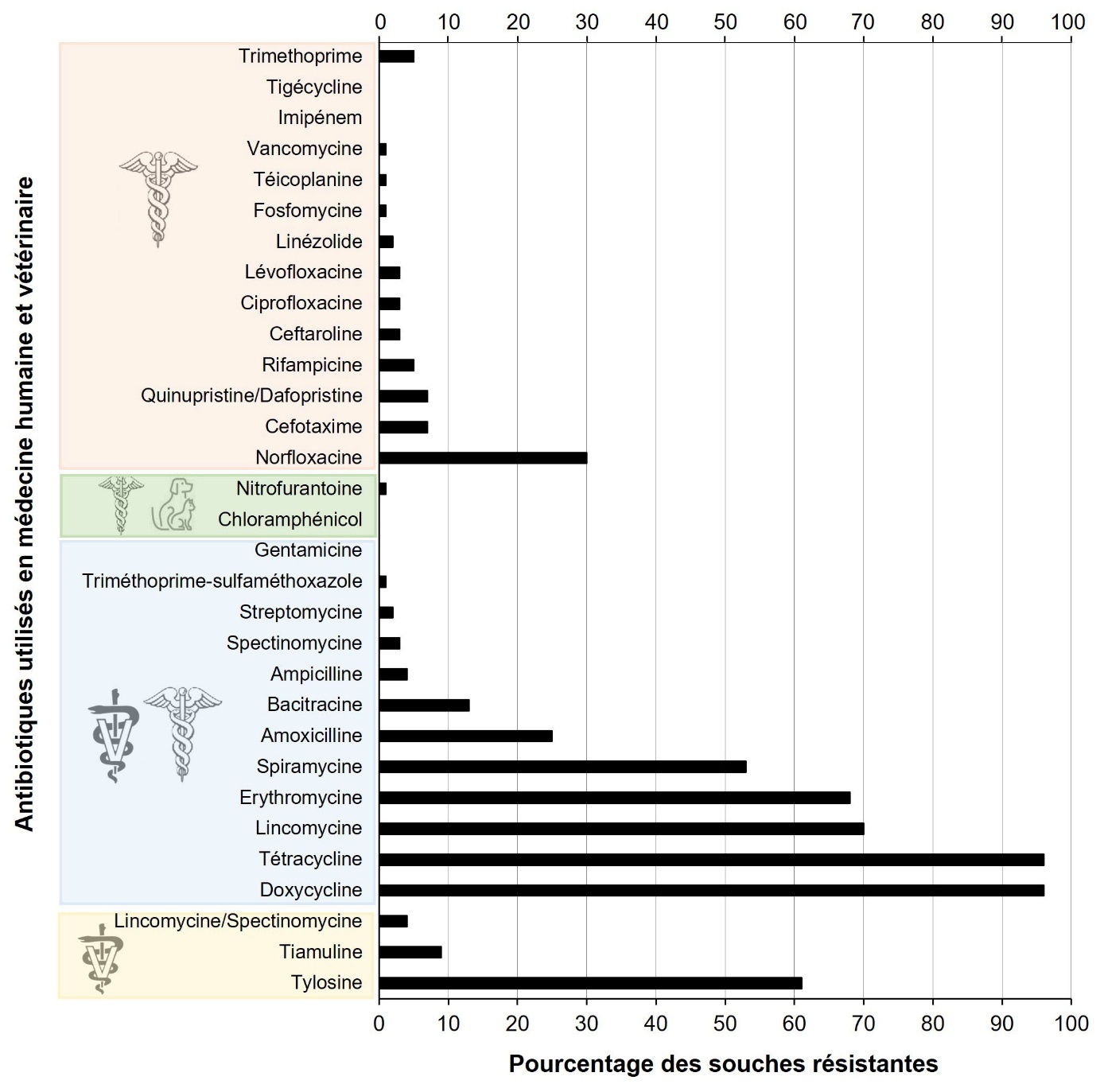
Plusieurs études nord-américaines et européennes montrent une forte prévalence des résistances aux tétracyclines (>70 %) dans les isolats cliniques et non cliniques de E. cecorum alors que la résistance aux macrolides (érythromycine, spiramycine et tylosine) est plus fréquente dans les isolats cliniques (Jung et al., 2018 ; Laurentie et al., 2023b). À l’inverse, la résistance à la lincomycine est plus répandue dans les isolats d’origine non clinique qui possèdent des profils de résistance aux antibiotiques plus étendus que ceux des isolats cliniques (Boerlin et al., 2012 ; Borst et al., 2012 ; Jackson et al., 2015 ; Laurentie et al., 2023b). En France, 43,3 % des isolats apparaissent résistants à plus de trois classes d’antibiotiques, contre 1,4 % d’isolats sensibles à la vingtaine de molécules testées (Laurentie et al., 2023b). Toutefois, les souches d’origine clinique restent majoritairement sensibles aux antimicrobiens autorisés pour les volailles. De même, il est rassurant de constater que la résistance aux antimicrobiens d’importance critique en médecine humaine tels que la vancomycine, la gentamicine, la tigécycline, le linézolide et la daptomycine est peu répandue chez E. cecorum (Laurentie et al., 2023b) (figure 4). Ces tendances sont validées par la distribution des gènes de résistance dans les génomes (Sharma et al., 2020 ; Laurentie et al., 2023b ; Huang et al., 2024). Les gènes de résistance aux tétracyclines (tet(M) et tet(L)), aux macrolides (erm(B)) et dans une moindre mesure à la bacitracine (opéron bcr) sont les plus fréquents. Des mutations chromosomiques dans les gènes gyrA et parC expliqueraient plus de 65 % des résistances aux quinolones (Laurentie et al., 2023b) et dans un gène pbp2 pourrait contribuer à la résistance à l’ampicilline (Huang et al., 2024). Alors qu’aucun plasmide n’a été décrit chez E. cecorum, les gènes de résistance les plus fréquents sont portés par des éléments génétiques complexes qui possèdent toutes les caractéristiques d’éléments mobiles.
Figure 4. Distribution des résistances aux antibiotiques de souches E. cecorum.
1.7. Facteurs prédisposants chez les animaux
La sensibilité des animaux peut influencer le développement des pathologies locomotrices à E. cecorum. L’augmentation du poids corporel des volailles peut entraîner des contraintes mécaniques sur leur appareil locomoteur, conduisant à des lésions osseuses avec une colonisation par des bactéries opportunistes (Wideman, 2016). Un développement anormal du système locomoteur, comme des lésions précoces d’ostéochondrose, pourrait également prédisposer les volailles aux infections à E. cecorum (Borst et al., 2017). Néanmoins, aucune étude comparative sur la prédisposition à l’infection en fonction du taux de croissance des lignées n’a été publiée à ce jour. Une diminution de l’immunité des animaux ou des infections concomitantes pourraient aussi jouer un rôle dans le développement de la maladie. L’hypothèse d’une altération de la barrière intestinale favorisant une translocation de la bactérie a été évoquée, en relation avec des infections intercurrentes (E. coli ou des parasites Eimeria) ou des modifications du microbiote (Borst et al., 2017). Cependant, la co-infection par E. cecorum avec un mélange de trois espèces de Eimeria spp., dont Eimeria tenella, a récemment été associée à une diminution de l’incidence de la bactériémie à E. cecorum et de la gravité de la spondylarthrite (Borst et al., 2019). Ce résultat pourrait s’expliquer par une modification du microbiote intestinal d’autant qu’il a été récemment montré qu’une souche de E. tenella contribuait à la diversification du microbiote cæcal et au renforcement de la muqueuse intestinale (Zhou et al., 2020). Le stress thermique à l’origine d’une modification de la composition du microbiote intestinal pourrait également altérer l’intégrité de la muqueuse intestinale et favoriser la translocation de E. cecorum (Schreier et al., 2022b). Si aucun de ces facteurs ne suffit à promouvoir l’infection par E. cecorum, leur combinaison pourrait y contribuer.
2. Quelle(s) voie(s) de transmission ?
2.1. Transmission verticale
Les modalités de contamination des volailles et les voies d’introduction de E. cecorum dans les élevages sont encore peu comprises. La possibilité d’une transmission verticale a été étudiée avec des résultats peu concluants. En effet, les profils génomiques et métabolomiques de E. cecorum d’oiseaux reproducteurs et les isolats cliniques de leur descendance n’ont pas montré de concordance et la bactérie n’a pas été retrouvée dans l’environnent des couvoirs (Kense & Landman, 2011 ; Robbins et al., 2012). De plus, l’infection expérimentale de poulets reproducteurs n’a pas permis de détecter la présence de la bactérie dans les œufs (Thofner & Christensen, 2016). Alors que la transmission verticale d’espèces du genre Enterococcus a été montrée, elle ne concernerait pas E. cecorum (Shterzer et al., 2023). Les recherches sont pour le moment limitées et nécessitent d’être poursuivies pour explorer la possibilité d’une voie de transmission verticale de la bactérie dans les élevages de poulets de chair.
2.2. Transmission horizontale
La transmission horizontale peut résulter de contacts directs entre animaux ou de manière indirecte notamment par le biais de matériel contaminé. Les oiseaux excrètent E. cecorum dans les fientes, et peuvent ainsi se contaminer par voie oro-fécale (Borst et al., 2017). De plus, la bactérie pourrait être transmise par inhalation de poussière contaminée présente dans les bâtiments d’élevage (Jung & Rautenschlein, 2014). La fréquence des récidives dans les élevages comme rapportée en Belgique (Herdt et al., 2008) et en France (Potier et al., 2024) suggère qu’il pourrait exister des réservoirs biologiques tels que des ténébrions, ou des rongeurs…, ou environnementaux avec des zones de persistance dans l’élevage particulièrement difficiles à nettoyer et désinfecter tels que les circuits d’alimentation, de ventilation et de chauffage ainsi que les pipettes d’abreuvement, les mangeoires ou les fissures du sol (Luyckx et al., 2015 ; Tessin et al., 2024). Une étude récente montre une prévalence accrue en été (Dunnam et al., 2023). La bactérie survit sur différents substrats (litière, poussière, plastique) à différentes températures et taux d’humidité notamment sur la litière à 15 °C et 32 % d’humidité (Grund et al., 2021). Les deux souches cliniques de l’étude ont révélé une survie prolongée par rapport à la souche commensale. Bien que E. cecorum n’ait pas été isolé dans l’environnement d’élevages atteints par la bactérie (Robbins et al., 2012 ; Grund et al., 2022), la présence d’ADN du gène 16S de E. cecorum a été détectée dans les systèmes d’abreuvement (Grund et al., 2022) mais aussi après nettoyage dans le circuit d’entrée d’air et le sas sanitaire (Tessin et al., 2024). Il est donc nécessaire de poursuivre les recherches afin de mieux comprendre les voies de contamination des animaux et d’identifier les sites de persistance de la bactérie dans les élevages.
3. Diagnostic et traitement
3.1. Diagnostic de la maladie
Des signes tels que des boiteries, éventuellement associées à des paralysies caractérisées par une position « assise sur les jarrets », une augmentation de la mortalité et des lésions d’arthrites, de nécrose des têtes fémorales ou de spondylarthrite évoquent une infection à E. cecorum. D’autres agents bactériens, comme E. coli, peuvent également provoquer ces signes cliniques et lésionnels chez les volailles. Une analyse bactériologique est donc nécessaire pour confirmer le diagnostic d’une infection à E. cecorum. L’isolement de E. cecorum à partir des lésions est classiquement réalisé en présence de CO2 (5 %) sur un milieu gélosé au sang éventuellement additionné de colistine et d’acide nalidixique pour inhiber la croissance des bactéries à Gram négatif. L’identification est actuellement assurée par spectrométrie de masse de type MALDI-TOF (matrix-assisted laser desorption–ionisation time-of-flight), plus simple et fiable que l’identification par PCR (Karunarathna et al., 2017). Cette évolution a certainement contribué à l’augmentation de l’identification des espèces de Enterococcus et E. cecorum en pathologie aviaire depuis 2006 (Souillard et al., 2022).
3.2. Traitement
Les antibiogrammes de E. cecorum sont établis selon les référentiels de E. faecalis ou E. faecium (Borst et al., 2012 ; Jackson et al., 2015 ; Dolka et al., 2016). Des valeurs seuils épidémiologiques (Epidemiological cut-offs ou ECOFFs) ont été provisoirement établies pour une vingtaine d’antibiotiques chez E. cecorum (Laurentie et al., 2023b). Une étape de validation par d’autres laboratoires sur une collection de souches élargie est nécessaire pour leur ajustement et approbation par le Comité européen des tests de sensibilité aux agents antimicrobiens (EUCAST). Une meilleure évaluation de l’antibiorésistance des souches devrait aider à améliorer l’efficacité des traitements et ainsi mieux maîtriser l’usage des antibiotiques en élevage.
Actuellement, lorsque le diagnostic d’une infection à E. cecorum est confirmé, un traitement antibiotique précoce doit être rapidement mis en place pour limiter la propagation de l’infection au sein d’un lot de volailles. En effet, le traitement est inefficace sur des oiseaux déjà atteints de lésions et de paralysie. Si le choix de l’antibiotique est basé sur les résultats de l’antibiogramme, les dérivés de la pénicilline, en particulier l’amoxicilline, sont couramment utilisés (Devriese et al., 2002 ; Herdt et al., 2008 ; Jung et al., 2018) avec parfois la nécessité de traitements répétés au cours d’un lot. Cependant, en raison de récidives fréquentes dans certains élevages et au regard de la gravité de la maladie, le recours à un traitement antibiotique durant la première semaine de vie des animaux a été suggéré pour contrôler la maladie avec une utilisation d’amoxicilline et/ou tylosine (Herdt et al., 2008) ou de lincospectine (Schreier et al., 2022a). Conformément au règlement (UE) no 2019/6, qui encadre l’utilisation des antibiotiques pour les animaux dans un objectif de lutte contre l’antibiorésistance, l’utilisation de médicaments antimicrobiens dans un lot de volailles à des fins prophylactiques doit rester exceptionnelle « lorsque le risque d’infection ou de maladie infectieuse est très élevé et que les conséquences ont toutes les chances d’être graves » (article 107 du règlement (UE) no 2019/6). Pour maîtriser la maladie, il est essentiel d’intervenir sur les conditions d’apparition des infections à E. cecorum afin de mettre en place des moyens préventifs basés sur la conduite des élevages et les mesures sanitaires.
4. Quelles pistes de prévention en élevage de volailles ?
4.1. Conduite d’élevage pour limiter le risque
Diverses mesures zootechniques ont été proposées pour limiter le risque d’apparition des pathologies à E. cecorum (figure 1). Parmi celles-ci, l’ajustement des programmes d’éclairage afin de ralentir la croissance des animaux au cours des premières semaines de vie pourrait atténuer l’impact de la maladie (Jung et al., 2018). Une période d’obscurité insuffisante dans les bâtiments a été identifiée comme une pratique à risque. Moins de six heures de coupure lumineuse à dix jours d’âge constitueraient une pratique aggravante (Remiot et al., 2019). De plus, renforcer la résistance du squelette et limiter les contraintes mécaniques sur le système locomoteur pourraient contribuer à réduire le risque de lésions osseuses et d’infections à E. cecorum. Des conditions de démarrage maîtrisées avec une litière de qualité, un renouvellement d’air suffisant et une maîtrise de la température pourraient également limiter les risques d’apparition de la maladie (Remiot et al., 2019 ; Schreier et al., 2022b). La prévention de la maladie implique également de prévenir les troubles digestifs et les infections intercurrentes qui pourraient favoriser l’infection, comme la coccidiose (Borst et al., 2017) ou des maladies immunodépressives telles que la maladie de Gumboro (Sary et al., 2018). Enfin, la fréquence des récidives suggère que E. cecorum persiste dans l’environnement, dont les bâtiments d’élevages, même si la présence de bactéries viables n’est pas démontrée faute d’un milieu de culture sélectif (Tessin et al., 2024). La présence de E. cecorum dans les systèmes d’abreuvement fait encore débat (Grund et al., 2022 ; Tessin et al., 2024). Il a par ailleurs été montré qu’un nettoyage et une désinfection insuffisants pouvaient constituer un facteur de risque (Remiot et al., 2019) et que l’ADN de E. cecorum pouvait être détecté après le nettoyage/désinfection des bâtiments au niveau du sas sanitaire, des canalisations et des arrivées d’air (Tessin et al., 2024). La persistance potentielle de E. cecorum dans l’environnement et sa détection après les opérations de nettoyage/désinfection des bâtiments nécessitent un renforcement des mesures de biosécurité (respect du sas et des protocoles de changement de tenue et de lavage des mains, désinfection du matériel) et d’hygiène (désinfection des bâtiments et des canalisations d’eau) pour mieux prévenir la maladie.
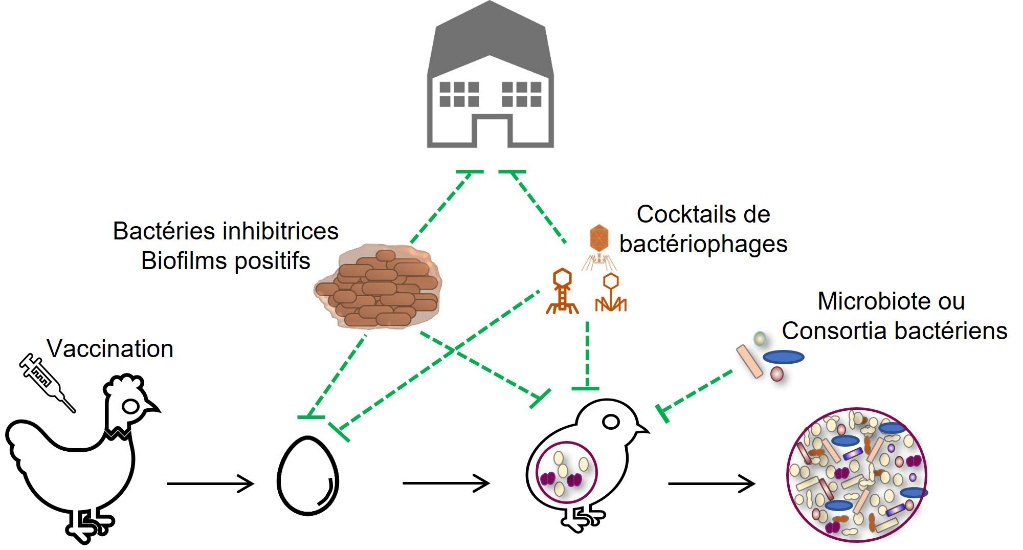
Une alternative pour prévenir la prolifération de bactéries indésirables dans les élevages consiste également à utiliser des mélanges de bactéries pour former un film protecteur au niveau des bâtiments avant la mise en place des oiseaux (Guéneau et al., 2022a) (figure 5). L’application d’un mélange de souches de Bacillus spp. et de Pediococcus spp. pourrait restreindre le développement des entérobactéries et des entérocoques (Guéneau et al., 2022b). Cette mesure pourrait contribuer à une meilleure gestion de l’hygiène de l’environnement des oiseaux. Une rotation des produits de désinfection (biocides) et des biofilms bactériens entre deux lots devrait réduire le risque d’émergence de souches résistantes à ces mesures.
4.2. Des pistes pour la prévention
La vaccination des volailles pourrait être un outil précieux pour maîtriser les pathologies à E. cecorum dans les élevages (figure 1). Cependant, il n'existe actuellement aucun vaccin commercial disponible et des recherches sont en cours. Il a notamment été montré que la vaccination de poules reproductrices avec un vaccin inactivé polyvalent contre E. cecorum n’a pas permis de prévenir la maladie chez les poussins (Borst et al., 2019). Des méthodes sérologiques ELISA doivent encore être développées pour évaluer les réponses sérologiques aux infections et à la vaccination par E. cecorum chez les poules reproductrices et les poussins (Jung & Rautenschlein, 2020 ; Silberborth et al., 2024).
La transmission verticale naturelle du microbiote du poulet est perturbée par les pratiques d’élevage actuelles qui suppriment le contact entre adulte et descendance. Ainsi, les animaux acquièrent à partir de leur environnement un microbiote peu diversifié et mal défini. Cette perturbation précoce de la colonisation peut conduire à un déséquilibre du microbiote ou dysbiose et/ou à un défaut de maturation de la muqueuse intestinale et du système immunitaire, pouvant influer sur les performances de production et la résistance aux pathogènes (Rubio, 2019 ; Rychlik, 2020). Le développement du microbiote initial est en effet essentiel pour induire une bonne réponse immunitaire (Rodrigues et al., 2021). Alors que le rôle du microbiote intestinal sur le potentiel infectieux de E. cecorum n’est pas établi, la détection intestinale des isolats cliniques les deux premières semaines et l’efficacité d’un traitement précoce à la lincospectine dans la prévention de l’infection suggèrent une fenêtre d’intervention pour promouvoir la barrière écologique du microbiote et la barrière mucosale (Hankel et al., 2021 ; Schreier et al., 2022a) (figure 5). Parmi les différentes stratégies envisagées en élevage pour stimuler la barrière écologique du microbiote intestinal, l’utilisation de souches probiotiques telles que les Bacillus pour leur activité antagoniste est une des plus anciennes (Cutting, 2011). Différentes souches de Bacillus ont été isolées pour leur activité inhibitrice contre E. cecorum (Medina Fernández et al., 2019 ; Penaloza-Vazquez et al., 2019 ; Sandvang et al., 2024). Leur efficacité dépend des souches probiotiques et de l’isolat de E. cecorum ciblé. Des travaux complémentaires sont nécessaires pour étudier leur efficacité in vivo et caractériser les molécules inhibitrices. La compréhension du rôle du microbiote dans la pathogenèse de E. cecorum est un prérequis pour développer de nouvelles stratégies préventives pouvant reposer sur le transfert de microbiote sain ou l’implantation de consortia de bactéries probiotiques ou commensales aviaires.
Des cocktails de bactériophages sont aussi proposés dans certains pays d’Europe et en Amérique du Nord comme compléments alimentaires ou probiotiques (Bacteriophage.news., s. d. ; Gigante & Atterbury, 2019 ; Abd-El Wahab et al., 2023). Les phages lysent les bactéries. Ils ont l’avantage d’avoir un spectre d’hôte limité qui réduit les effets collatéraux sur les bactéries du microbiote ciblé. Leur utilisation en cocktail diminue également le risque d’émergence de souches résistantes. À ce jour, aucun phage virulent spécifique de E. cecorum n’a été décrit mais cette approche mérite d’être envisagée en raison de la similitude génétique des souches cliniques. L’administration de ces phages au cours des deux premières semaines d’élevage pourrait contribuer à prévenir ou retarder la colonisation précoce des isolats infectieux. Cependant, quelles que soient les méthodes alternatives envisagées, il est essentiel de procéder à une évaluation de leurs conséquences environnementales sur la santé humaine, animale, l’écologie microbienne environnementale et le risque d’émergence de souches résistantes.
Figure 5. Voies de recherche pour prévenir la prolifération de E. cecorum dans les locaux d’élevages et l’environnement des poussins.
Conclusion
À l’instar de nombreux agents pathogènes opportunistes, la virulence de E. cecorum est d’origine multifactorielle. Son émergence relativement récente suggère un lien direct avec l’évolution des pratiques d’élevages qui pourraient avoir contribué à la sélection d’un clone particulièrement adapté à la production du poulet de chair à croissance rapide. Les connaissances zootechniques, épidémiologiques et fondamentales sur la physiologie et la pathogenèse de E. cecorum doivent impérativement être renforcées pour, à terme, proposer des mesures de prévention et de maîtrise de la maladie. La compréhension des voies de transmission et de contamination des élevages implique de disposer d’outils de détection rapide permettant de différencier les souches cliniques et non cliniques. Le développement d’un modèle animal robuste reproduisant au moins la phase précoce de l’infection est nécessaire pour comprendre l’interaction de E. cecorum avec le microbiote et son hôte à l’aide d’approches globales (métagénomique, métabolomique et protéomique). Les connaissances générées devraient permettre de définir des stratégies préventives afin de limiter l’usage des antibiotiques et la pression de sélection associée mais aussi de réduire l’impact clinique, la souffrance animale et les pertes économiques dans les élevages.
Contribution des auteurs
Tous les auteurs ont participé à la rédaction de l’article, coordonnés et supervisés par Pascale Serror.
Remerciements
J. Laurentie a bénéficié d’une bourse de l’ANSES et d’INRAE. Le travail à l’origine de cette synthèse a été soutenu par le métaprogramme GISA d’INRAE (projet CecoType), le ministère de l’Agriculture (DGAL) à travers le programme Ecoantibio2 numéro 2018-180 et le département Microbiologie et chaîne alimentaire (Mica) d’INRAE.
Notes
- 1. Cet article a fait l'objet d'une présentation aux 15e Journées de la Recherche Avicole et Palmipèdes à Foie gras, les 20-21 mars 2024 à Tours (Souillard et al., 2024)
Références
- Abd-El Wahab, A., Basiouni, S., El-Seedi, H. R., Ahmed, M. F. E., Bielke, L. R., Hargis, B., Tellez-Isaias, G., Eisenreich, W., Lehnherr, H., Kittler, S., Shehata, A. A., & Visscher, C. (2023). An overview of the use of bacteriophages in the poultry industry: Successes, challenges, and possibilities for overcoming breakdowns. Frontiers in Microbiology, 14, 1136638. doi:10.3389/fmicb.2023.1136638
- AMCRA. (2021). Mesures pour un bon usage des antibiotiques lors d'un traitement de groupe chez la volaille (Rapport). Centre de connaissances antimicrobial consumption and resistance in animals. https://amcra.be/swfiles/files/Advies_Groepsbehandelingen_Pluimvee_Finaal_FR_goedgekeurd-RvB_finaal.pdf
- Arango, M., Forga, A., Liu, J., Zhang, G., Gray, L., Moore, R., Coles, M., Atencio, A., Trujillo, C., Latorre, J. D., Tellez-Isaias, G., Hargis, B., & Graham, D. (2023). Characterizing the impact of Enterococcus cecorum infection during late embryogenesis on disease progression, cecal microbiome composition, and early performance in broiler chickens. Poultry Science, 102(11), 103059. doi:10.1016/j.psj.2023.103059
- Bacteriophage.news. (s. d.). Updated bacteriophage product database [Base de données]. Retrieved from https://www.bacteriophage.news/phage-products/
- Boerlin, P., Nicholson, V., Brash, M., Slavic, D., Boyen, F., Sanei, B., & Butaye, P. (2012). Diversity of Enterococcus cecorum from chickens. Veterinary Microbiology, 157(3-4), 405-411. doi:10.1016/j.vetmic.2012.01.001
- Borst, L. B., Suyemoto, M. M., Robbins, K. M., Lyman, R. L., Martin, M. P., & Barnes, H. J. (2012). Molecular epidemiology of Enterococcus cecorum isolates recovered from enterococcal spondylitis outbreaks in the southeastern United States. Avian Pathology, 41(5), 479-485. doi:10.1080/03079457.2012.718070
- Borst, L. B., Suyemoto, M. M., Keelara, S., Dunningan, S. E., Guy, J. S., & Barnes, H. J. (2014). A chicken embryo lethality assay for pathogenic Enterococcus cecorum. Avian Diseases, 58(2), 244-248. doi:10.1637/10687-101113-Reg.1
- Borst, L. B., Suyemoto, M. M., Scholl, E. H., Fuller, F. J., & Barnes, H. J. (2015). Comparative genomic analysis identifies divergent genomic features of pathogenic Enterococcus cecorum including a type IC CRISPR-cas system, a capsule locus, an epa-like locus, and putative host tissue binding proteins. PLoS ONE, 10(4), e0121294. doi:10.1371/journal.pone.0121294
- Borst, L. B., Suyemoto, M. M., Sarsour, A. H., Harris, M. C., Martin, M. P., Strickland, J. D., Oviedo, E. O., & Barnes, H. J. (2017). Pathogenesis of enterococcal spondylitis caused by Enterococcus cecorum in broiler chickens. Veterinary Pathology, 54(1), 61-73. doi:10.1177/0300985816658098
- Borst, L. B., Suyemoto, M. M., Chen, L. R., & Barnes, H. J. (2019). Vaccination of breeder hens with a polyvalent killed vaccine for pathogenic Enterococcus cecorum does not protect offspring from enterococcal spondylitis. Avian Pathology, 48(1), 17-24. doi:10.1080/03079457.2018.1536819
- Cutting, S. M. (2011). Bacillus probiotics. Food Microbiology, 28(2), 214-220. doi:10.1016/j.fm.2010.03.007
- Devriese, L. A., Dutta, G. N., Farrow, J. A. E., Van De Kerckhove, A., & Phillips, B. A. (1983). Streptococcus cecorum, a new species isolated from chickens. International Journal of Systematic and Evolutionary Microbiology, 33(4), 772-776. doi:10.1099/00207713-33-4-772
- Devriese, L. A., Ceyssens, K., & Haesebrouck, F. (1991a). Characteristics of Enterococcus cecorum strains from the intestines of different animal species. Letters in Applied Microbiology, 12(4), 137-139. doi:10.1111/j.1472-765X.1991.tb00524.x
- Devriese, L. A., Hommez, J., Wijfels, R., & Haesebrouck, F. (1991b). Composition of the enterococcal and streptococcal intestinal flora of poultry. Journal of Applied Bacteriology, 71(1), 46-50. doi:10.1111/j.1365-2672.1991.tb04661.x
- Devriese, L. A., Cauwerts, K., Hermans, K., & Wood, A. M. (2002). Enterococcus cecorum septicemia as a cause of bone and joint lesions resulting in lameness in broiler chickens. Vlaams Diergeneeskundig Tijdschrift, 71(3), 219-221. https://www.scopus.com/inward/record.uri?eid=2-s2.0-0036558345&partnerID=40&md5=f1dea35caef06ce66a8742ba10a7bbef
- Dolka, B., Chrobak-Chmiel, D., Makrai, L., & Szeleszczuk, P. (2016). Phenotypic and genotypic characterization of Enterococcus cecorum strains associated with infections in poultry. BMC Veterinary Research, 12(1), 129. doi:10.1186/s12917-016-0761-1
- Dolka, B., Chrobak-Chmiel, D., Czopowicz, M., & Szeleszczuk, P. (2017). Characterization of pathogenic Enterococcus cecorum from different poultry groups: Broiler chickens, layers, turkeys, and waterfowl. PLoS ONE, 12(9), e0185199. doi:10.1371/journal.pone.0185199
- Dolka, B., Czopowicz, M., Dolka, I., & Szeleszczuk, P. (2022). Chicken embryo lethality assay for determining the lethal dose, tissue distribution and pathogenicity of clinical Enterococcus cecorum isolates from poultry. Scientific Reports, 12(1), 10675. doi:10.1038/s41598-022-14900-9
- Dunnam, G., Thornton, J. K., & Pulido-Landinez, M. (2023). Characterization of an Emerging Enterococcus cecorum outbreak causing severe systemic disease with concurrent leg problems in a broiler integrator in the Southern United States. Avian Diseases, 67(2), 137-144. doi:10.1637/aviandiseases-D-22-00085
- Ekesi, N. S., Hasan, A., Parveen, A., Shwani, A., & Rhoads, D. D. (2021). Embryo lethality assay as a tool for assessing virulence of isolates from bacterial chondronecrosis with osteomyelitis in broilers. Poultry Science, 100(11), 101455. doi:10.1016/j.psj.2021.101455
- Gigante, A., & Atterbury, R. J. (2019). Veterinary use of bacteriophage therapy in intensively-reared livestock. Virology Journal, 16(1), 155. doi:10.1186/s12985-019-1260-3
- Grund, A., Rautenschlein, S., & Jung, A. (2021). Tenacity of Enterococcus cecorum at different environmental conditions. Journal of Applied Microbiology, 130(5), 1494-1507. doi:10.1111/jam.14899
- Grund, A., Rautenschlein, S., & Jung, A. (2022). Detection of Enterococcus cecorum in the drinking system of broiler chickens and examination of its potential to form biofilms. European Poultry Science, 86. doi:10.1399/eps.2022.346
- Guéneau, V., Plateau-Gonthier, J., Arnaud, L., Piard, J. C., Castex, M., & Briandet, R. (2022a). Positive biofilms to guide surface microbial ecology in livestock buildings. Biofilm, 4, 100075. doi:10.1016/j.bioflm.2022.100075
- Guéneau, V., Rodiles, A., Frayssinet, B., Piard, J. C., Castex, M., Plateau-Gonthier, J., & Briandet, R. (2022b). Positive biofilms to control surface-associated microbial communities in a broiler chicken production system - a field study. Frontiers in Microbiology, 13, 981747. doi:10.3389/fmicb.2022.981747
- Hankel, J., Bodmann, B., Todte, M., Galvez, E., Strowig, T., Radko, D., Antakli, A., & Visscher, C. (2021). Comparison of chicken cecal microbiota after metaphylactic treatment or following administration of feed additives in a broiler farm with enterococcal spondylitis history. Pathogens, 10(8), 1068. doi:10.3390/pathogens10081068
- Herdt, P., Defoort, P., Steelant, J., Swam, H., Tanghe, L., Goethem, S., & Vanrobaeys, M. (2008). Enterococcus cecorum osteomyelitis and arthritis in broiler chickens. Vlaams Diergeneeskundig Tijdschrift, 78(1), 44-48. doi:10.21825/vdt.87495
- Huang, Y., Eeckhaut, V., Goossens, E., Rasschaert, G., Van Erum, J., Roovers, G., Ducatelle, R., Antonissen, G., & Van Immerseel, F. (2023). Bacterial chondronecrosis with osteomyelitis related Enterococcus cecorum isolates are genetically distinct from the commensal population and are more virulent in an embryo mortality model. Veterinary research, 54(1), 13. doi:10.1186/s13567-023-01146-0
- Huang, Y., Boyen, F., Antonissen, G., Vereecke, N., & Van Immerseel, F. (2024). The Genetic landscape of antimicrobial resistance genes in Enterococcus cecorum broiler isolates. Antibiotics, 13(5), 409. doi:10.3390/antibiotics13050409
- Jackson, C. R., Kariyawasam, S., Borst, L. B., Frye, J. G., Barrett, J. B., Hiott, L. M., & Woodley, T. A. (2015). Antimicrobial resistance, virulence determinants and genetic profiles of clinical and nonclinical Enterococcus cecorum from poultry. Letters in Applied Microbiology, 60(2), 111-119. doi:10.1111/lam.12374
- Jung, A., & Rautenschlein, S. (2014). Comprehensive report of an Enterococcus cecorum infection in a broiler flock in Northern Germany. BMC Veterinary Research, 10, 311. doi:10.1186/s12917-014-0311-7
- Jung, A., Chen, L. R., Suyemoto, M. M., Barnes, H. J., & Borst, L. B. (2018). A review of Enterococcus cecorum infection in poultry. Avian Diseases, 62(3), 261-271. doi:10.1637/11825-030618-Review.1
- Jung, A., & Rautenschlein, S. (2020). Development of an in-house ELISA for detection of antibodies against Enterococcus cecorum in Pekin ducks. Avian Pathology, 49(4), 355-360. doi:10.1080/03079457.2020.1753653
- Karunarathna, R., Popowich, S., Wawryk, M., Chow-Lockerbie, B., Ahmed, K. A., Yu, C., Liu, M., Goonewardene, K., Gunawardana, T., Kurukulasuriya, S., Gupta, A., Willson, P., Ambrose, N., Ngeleka, M., & Gomis, S. (2017). Increased incidence of enterococcal infection in nonviable broiler chicken embryos in Western Canadian hatcheries as detected by matrix-assisted laser desorption/ionization-time-of-flight mass spectrometry. Avian Diseases, 61(4), 472-480. doi:10.1637/11678-052317-Reg.1
- Kense, M. J., & Landman, W. J. M. (2011). Enterococcus cecorum infections in broiler breeders and their offspring: Molecular epidemiology. Avian Pathology, 40(6), 603-612. doi:10.1080/03079457.2011.619165
- Laurentie, J., Loux, V., Hennequet-Antier, C., Chambellon, E., Deschamps, J., Trotereau, A., Furlan, S., Darrigo, C., Kempf, F., Lao, J., Milhes, M., Roques, C., Quinquis, B., Vandecasteele, C., Boyer, R., Bouchez, O., Repoila, F., Le Guennec, J., Chiapello, H., … Serror, P. (2023a). Comparative genome analysis of Enterococcus cecorum reveals intercontinental spread of a lineage of clinical poultry Isolates. mSphere, 8(2), e0049522. doi:10.1128/msphere.00495-22
- Laurentie, J., Mourand, G., Grippon, P., Furlan, S., Chauvin, C., Jouy, E., Serror, P., & Kempf, I. (2023b). Determination of epidemiological cutoff values for antimicrobial resistance of Enterococcus cecorum. Journal of Clinical Microbiology, 61(3), e01445-22. doi:10.1128/jcm.01445-22
- Luyckx, K. Y., Van Weyenberg, S., Dewulf, J., Herman, L., Zoons, J., Vervaet, E., Heyndrickx, M., & De Reu, K. (2015). On-farm comparisons of different cleaning protocols in broiler houses. Poultry Science, 94(8), 1986-1993. doi:10.3382/ps/pev143
- Makrai, L., Nemes, C., Simon, A., Ivanics, É., Dudás, Z., Fodor, L., & Glávits, R. (2011). Association of Enterococcus cecorum with vertebral osteomyelitis and spondylolisthesis in broiler parent chicks. Acta Veterinaria Hungarica, 59(1), 11-21. doi:10.1556/AVet.59.2011.1.2
- Manders, T., Benedictus, L., Spaninks, M., & Matthijs, M. (2024). Enterococcus cecorum lesion strains are less sensitive to the hostile environment of albumen and more resistant to lysozyme compared to cloaca strains. Avian Pathology, 53(2), 106-114. doi:10.1080/03079457.2023.2286985
- Martin, L. T., Martin, M. P., & Barnes, H. J. (2011). Experimental reproduction of enterococcal spondylitis in male broiler breeder chickens. Avian Diseases, 55(2), 273-278. doi:10.1637/9614-121410-Reg.1
- Medina Fernández, S., Cretenet, M., & Bernardeau, M. (2019). In vitro inhibition of avian pathogenic Enterococcus cecorum isolates by probiotic Bacillus strains. Poultry Science, 98(6), 2338-2346. doi:10.3382/ps/pey593
- Parks, D. H., Chuvochina, M., Chaumeil, P. A., Rinke, C., Mussig, A. J., & Hugenholtz, P. (2020). A complete domain-to-species taxonomy for Bacteria and Archaea. Nature Biotechnology, 38(9), 1079-1086. doi:10.1038/s41587-020-0501-8
- Penaloza-Vazquez, A., Ma, L. M., & Rayas-Duarte, P. (2019). Isolation and characterization of Bacillus spp. strains as potential probiotics for poultry. Canadian Journal of Microbiology, 65(10), 762-774. doi:10.1139/cjm-2019-0019
- Potier, P. H., Rigomier, P., Moalic, P. Y., & Bourgeon, F. (2024). Étude préliminaire de la diversité moléculaire d’Enterococcus cecorum dans les élevages bretons [Communication]. 15e Journées de la Recherche Avicole et Palmipèdes à Foie Gras, Tours.
- Remiot, P., Panaget, G., Chataigner, E., & Chevalier, D. (2019). Enterococcus cecorum chez le poulet de chair : enquête en élevage pour identifier des pratiques zootechniques à risque [Communication]. 13e Journées de la Recherche Avicole et Palmipèdes à Foie Gras, Tours. https://www.itavi.asso.fr/publications/enterococcus-cecorum-chez-le-poulet-de-chair-enquete-en-elevage-pour-identifier-des-pratiques-zootechniques-a-risque?search=Enterococcus%20cecorum%20chez%20&order=score
- Rhoads, D. D., Pummill, J., & Alrubaye, A. A. K. (2024). Molecular genomic analyses of Enterococcus cecorum from sepsis outbreaks in broilers. Microorganisms, 12(2), 250. doi:10.3390/microorganisms12020250
- Robbins, K. M., Suyemoto, M. M., Lyman, R. L., Martin, M. P., Barnes, H. J., & Borst, L. B. (2012). An outbreak and source investigation of enterococcal spondylitis in broilers caused by Enterococcus cecorum. Avian Diseases, 56(4), 768-773. doi:10.1637/10253-052412-Case.1
- Rodrigues, D. R., Wilson, K. M., & Bielke, L. R. (2021). Proper immune response depends on early exposure to gut microbiota in broiler chicks. Frontiers in Physiology, 12, 758183. doi:10.3389/fphys.2021.758183
- Rubio, L. A. (2019). Possibilities of early life programming in broiler chickens via intestinal microbiota modulation. Poultry Science, 98(2), 695-706. doi:10.3382/ps/pey416
- Rychlik, I. (2020). Composition and function of chicken gut microbiota. Animals, 10(1), 103. doi:10.3390/ani10010103
- Sandvang, D., Capern, L. C., Meuter, A., & Betz, S. (2024). Évaluation in vitro de la capacité d’inhibition d’un probiotique triple souche de bacillus sur des isolats cliniques d’Enterococcus cecorum [Communication]. 15e Journées de la Recherche Avicole et Palmipèdes à Foie Gras, Tours, 595-599.
- Sary, K., Brochu-Morin, M. E., & Boulianne, M. (2018). Enterococcus cecorum chez la volaille. Une maladie en émergence au Québec (Bulletin zoosanitaire). RAIZO. https://cdn-contenu.quebec.ca/cdn-contenu/adm/min/agriculture-pecheries-alimentation/sante-animale/surveillance-controle/raizo/reseau-aviaire/Bulletinzoosanitaire_enterococcuscecorum_volaille_MAPAQ.pdf
- Schreier, J., Rautenschlein, S., & Jung, A. (2021). Different virulence levels of Enterococcus cecorum strains in experimentally infected meat-type chickens. PLoS ONE, 16(11), e0259904. doi:10.1371/journal.pone.0259904
- Schreier, J., Karasova, D., Crhanova, M., Rychlik, I., Rautenschlein, S., & Jung, A. (2022a). Influence of lincomycin-spectinomycin treatment on the outcome of Enterococcus cecorum infection and on the cecal microbiota in broilers. Gut Pathogens, 14(1), 3. doi:10.1186/s13099-021-00467-9
- Schreier, J., Rychlik, I., Karasova, D., Crhanova, M., Breves, G., Rautenschlein, S., & Jung, A. (2022b). Influence of heat stress on intestinal integrity and the cæcal microbiota during Enterococcus cecorum infection in broilers. Veterinary Research, 53(1), 110. doi:10.1186/s13567-022-01132-y
- Schwartzman, J. A., Lebreton, F., Salamzade, R., Shea, T., Martin, M. J., Schaufler, K., Urhan, A., Abeel, T., Camargo, I. L. B. C., Sgardioli, B. F., Prichula, J., Frazzon, A. P. G., Giribet, G., Tyne, D. V., Treinish, G., Innis, C. J., Wagenaar, J. A., Whipple, R. M., Manson, A. L., … Gilmore, M. S. (2024). Global diversity of enterococci and description of 18 previously unknown species. Proceedings of the National Academy of Sciences of the United States of America, 121(10), e2310852121. doi:10.1073/pnas.2310852121
- Scupham, A. J., Patton, T. G., Bent, E., & Bayles, D. O. (2008). Comparison of the cecal microbiota of domestic and wild turkeys. Microbial Ecology, 56(2), 322-331. doi:10.1007/s00248-007-9349-4
- Sharma, P., Gupta, S. K., Barrett, J. B., Hiott, L. M., Woodley, T. A., Kariyawasam, S., Frye, J. G., & Jackson, C. R. (2020). Comparison of antimicrobial resistance and pan-genome of clinical and non-clinical Enterococcus cecorum from poultry using whole-genome sequencing. Foods, 9(6), 686. doi:10.3390/foods9060686
- Shterzer, N., Rothschild, N., Sbehat, Y., Dayan, J., Eytan, D., Uni, Z., & Mills, E. (2023). Vertical transmission of gut bacteria in commercial chickens is limited. Animal Microbiome, 5(1), 50. doi:10.1186/s42523-023-00272-6
- Silberborth, A., Schnug, J., Rautenschlein, S., & Jung, A. (2024). Serological monitoring of Enterococcus cecorum specific antibodies in chickens. Veterinary Immunology and Immunopathology, 269, 110714. doi:10.1016/j.vetimm.2023.110714
- Souillard, R., Laurentie, J., Kempf, I., Le Caër, V., Le Bouquin, S., Serror, P., & Allain, V. (2022). Increasing incidence of Enterococcus-associated diseases in poultry in France over the past 15 years. Veterinary Microbiology, 269, 109426. doi:10.1016/j.vetmic.2022.109426
- Souillard, R., Laurentie, J., Repoila, F., Kempf, I., & Serror, P. (2024). Enterococcus cecorum, un agent pathogène opportuniste des volailles : mieux le connaitre pour une meilleure maitrise en élevage [Communication]. 15e Journées de la Recherche Avicole et Palmipèdes à Foie Gras, Tours. https://hal.inrae.fr/hal-04547075v1
- Stalker, M. J., Brash, M. L., Weisz, A., Ouckama, R. M., & Slavic, D. (2010). Arthritis and osteomyelitis associated with Enterococcus cecorum infection in broiler and broiler breeder chickens in Ontario, Canada. Journal of Veterinary Diagnostic Investigation, 22(4), 643-645. doi:10.1177/104063871002200426
- Suyemoto, M. M., Barnes, H. J., & Borst, L. B. (2017). Culture methods impact recovery of antibiotic-resistant Enterococci including Enterococcus cecorum from pre- and postharvest chicken. Letters in Applied Microbiology, 64(3), 210-216. doi:10.1111/lam.12705
- Szeleszczuk, P., Dolka, B., Zbikowski, A., Dolka, I., & Peryga, M. (2013). First case of enterococcal spondylitis in broiler chickens in Poland. Medycyna Weterynaryjna, 69(5), 298-303. https://www.scopus.com/inward/record.uri?eid=2-s2.0-84877952513&partnerID=40&md5=58c76d2664df507d9d3b7c1b11fb18f5
- Tessin, J., Jung, A., Silberborth, A., Rohn, K., Schulz, J., Visscher, C., & Kemper, N. (2024). Detection of Enterococcus cecorum to identify persistently contaminated locations using faecal and environmental samples in broiler houses of clinically healthy flocks. Avian Pathology, 53(4), 312-320. doi:10.1080/03079457.2024.2334682
- Thofner, I., & Christensen, J. P. (2016). Investigation of the pathogenesis of Enterococcus cecorum after intravenous, intratracheal or oral experimental infections of broilers and broiler breeders [Conférence]. VETPATH, Prato (Italy).
- Wideman, R. F. (2016). Bacterial chondronecrosis with osteomyelitis and lameness in broilers: A review. Poultry Science, 95(2), 325-344. doi:10.3382/ps/pev320
- Wijesurendra, D. S., Chamings, A. N., Bushell, R. N., Rourke, D. O., Stevenson, M., Marenda, M. S., Noormohammadi, A. H., & Stent, A. (2017). Pathological and microbiological investigations into cases of bacterial chondronecrosis and osteomyelitis in broiler poultry. Avian Pathology, 46(6), 683-694. doi:10.1080/03079457.2017.1349872
- Wood, A. M., MacKenzie, G., McGillveray, N. C., Brown, L., Devriese, L. A., & Baele, M. (2002). Isolation of Enterococcus cecorum from bone lesions in broiler chickens [2]. Veterinary Record, 150(1), 27. https://www.scopus.com/inward/record.uri?eid=2-s2.0-0037021879&partnerID=40&md5=f90786da573d92519c7acc5bf77457af
- Zhou, B. H., Jia, L. S., Wei, S. S., Ding, H. Y., Yang, J. Y., & Wang, H. W. (2020). Effects of Eimeria tenella infection on the barrier damage and microbiota diversity of chicken cecum. Poultry Science, 99(3), 1297-1305. doi:10.1016/j.psj.2019.10.073
- Zuidhof, M. J., Schneider, B. L., Carney, V. L., Korver, D. R., & Robinson, F. E. (2014). Growth, efficiency, and yield of commercial broilers from 1957, 1978, and 2005. Poultry Science, 93(12), 2970-2982. doi:10.3382/ps.2014-04291
Résumé
En moins de 20 ans, Enterococcus cecorum est devenu l’un des agents pathogènes majeurs dans les élevages de poulets de chair et de répartition mondiale. Cette bactérie opportuniste, commensale de l’intestin des volailles, est responsable de pathologies locomotrices pouvant entraîner de la mortalité dans les élevages. Elle est à l’origine d’une dégradation du bien-être animal, d’une utilisation accrue d’antibiotiques et de pertes économiques. Cette revue tente d’établir un lien entre les pathologies à E. cecorum et les connaissances actuelles physiologiques et moléculaires de la bactérie. Les analyses génomiques indiquent notamment que les isolats cliniques de E. cecorum seraient adaptés à la colonisation intestinale du poussin dès les premiers jours de vie. À l’inverse, les souches commensales coloniseraient l’intestin plus tardivement, au plus tôt durant la troisième semaine de vie. Les voies de contamination des élevages et les facteurs de risque qui pourraient favoriser l’infection à E. cecorum sont probablement multiples : transmission verticale et horizontale, paramètres zootechniques, pratiques de biosécurité et sensibilité des animaux. Cette revue présente également quelques pistes en cours de développement pour mieux maîtriser E. cecorum au sein des élevages et prévenir les infections.
Pièces jointes
Pas de document complémentaire pour cet articleStatistiques de l'article
 Vues: 3764
Vues: 3764
Téléchargements
 PDF: 474
PDF: 474
 XML: 107
XML: 107

