Comportement social du porc domestique et son importance pour le bien-être animal en élevage (Full text available in English)
Le porc est une espèce sociale qui évolue au sein de groupes dont la structure est régulée par un large éventail d’interactions agonistiques et non agonistiques. La possibilité pour le porc d’exprimer un répertoire social complet et d’évoluer au sein de groupes stables est primordiale pour le maintien de son bien-être en élevage. Elle doit être prise en compte dans la gestion des groupes d’animaux et la conception des systèmes d’élevage.
Introduction
Au cours des dernières décennies, le maintien du bien-être animal en élevage est devenu une préoccupation sociale majeure en Europe. Bien que le concept de bien-être animal ait été redéfini à de nombreuses reprises au cours du siècle dernier, la possibilité pour les animaux domestiques d’exprimer les comportements typiques à l’espèce est apparue dès les années soixante comme un critère nécessaire au bien-être animal (Thorpe, 1969). En 1993, le Farm Animal Welfare Council (1993) a défini le bien-être animal comme un état respectant cinq grandes libertés, à savoir i) l’absence de faim, de soif ou de malnutrition, ii) l’absence d’inconfort physique, iii) l’absence de douleur, blessures ou maladies, iv) l’absence de peur et de détresse, et v) la possibilité d’exprimer les comportements typiques à l’espèce. En 2018, l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (ANSES) a proposé de redéfinir le bien-être animal comme « l’état mental et physique positif lié à la satisfaction de ses besoins physiologiques et comportementaux, ainsi que de ses attentes. Cet état varie en fonction de la perception de la situation par l’animal » (ANSES, 2018). Alors que l’importance de l’expression des comportements typiques de l’espèce est également incluse dans cette définition, ce concept propose d’évaluer le bien-être du point de vue de l’individu, en prenant en compte sa perception mentale de l’environnement qui l’entoure, qui varie en fonction de son expérience, de ses capacités sensorielles et cognitives, et de ses attentes. Par ailleurs, le concept d’état mental positif implique, non seulement de limiter les expériences déplaisantes susceptibles de générer des émotions négatives (douleur, peur, anxiété), mais également d’offrir à l’animal des opportunités de vivre des expériences positives, procurant du plaisir et de la satisfaction.
À l’instar de la majorité des animaux d’élevage, le porc est une espèce sociale qui évolue au sein de groupes dont la structure et l’organisation sont maintenues par un ensemble d’interactions agonistiques (agressions, évitements) et non agonistiques (p. ex. contacts du groin, flairages ; Rault, 2012). La possibilité pour les animaux d’exprimer l’ensemble de leurs comportements sociaux et d’évoluer au sein de groupes stables est donc vraisemblablement primordiale au maintien du bien-être des porcs en favorisant l’établissement d’états mentaux positifs, et devrait être prise en compte dans les pratiques de gestion des groupes d’animaux et lors de la conception des systèmes. Or, dans les élevages porcins intensifs, l’expression des comportements sociaux et la structure des groupes peuvent être fortement perturbées par un certain nombre de pratiques, comme des allotements fréquents, et par des modes de conduite inadaptés, comme la constitution de groupes de grande taille caractérisés par une densité élevée et une forte homogénéité en poids ou en âge.
Des connaissances approfondies sur la structure sociale au sein des groupes de porcs en élevage, ainsi que sur les comportements sociaux exprimés par le porc à différents stades de vie sont nécessaires pour mieux comprendre leur importance pour le maintien du bien-être animal et pour une bonne gestion des groupes d’animaux en élevage (Gonyou, 2001). Néanmoins, jusqu’aux années deux mille, les travaux sur le bien-être des animaux d’élevage avaient principalement pour objectif la réduction du mal-être, et les efforts de recherche sur les comportements sociaux ont porté presque exclusivement sur l’étude des comportements agonistiques, comme les combats et les agressions. Dans le même temps, peu de travaux se sont intéressés à l’étude des comportements non agonistiques, comme les flairages sociaux. Ainsi, l’étude des fonctions biologiques de ces comportements non agonistiques, et de leur importance potentielle pour la cohésion sociale du groupe et le bien-être des individus qui le composent, reste encore une voie de recherche largement inexplorée.
Dans cette revue, après avoir présenté brièvement les caractéristiques sociales des groupes de porcs en conditions de liberté, je décrirai l’ensemble des comportements agonistiques et non agonistiques décrits chez le porc domestique, en me basant sur des études disponibles réalisées en conditions de (semi-)liberté ou d’élevage intensif. Ensuite, j’aborderai l’impact des conditions ou pratiques d’élevage sur l’expression des comportements sociaux des porcs. Enfin, je conclurai la revue en discutant de l’importance des comportements non agonistiques pour le maintien du bien-être en élevage en ouvrant sur les perspectives de recherche dans ce domaine.
1. Organisation et structure des groupes sociaux de porcs
1.1. Organisation sociale des groupes de porcs
Dans des conditions de liberté ou de semi-liberté, les porcs domestiques adoptent la même organisation sociale que les sangliers ou les cochons retournés à l’état sauvage (Podgórski et al., 2014), et évoluent au sein de groupes matriarcaux relativement stables composés d’une à quatre femelles et de leur progéniture, constituée d’une ou de plusieurs portées les plus récentes (Gonyou, 2001 ; Graves, 1984). Le porc est une espèce nidicole. Ainsi, entre 48 et 24 heures avant la mise bas, la femelle s’éloigne du groupe et part à la recherche d’un site propice à la construction d’un nid pour accueillir ses porcelets. La truie et ses porcelets restent ensuite généralement séparés du groupe pendant la première semaine après la mise bas (Jensen, 1986). Les porcelets commencent à explorer l’extérieur du nid avec la mère à partir de la seconde semaine de vie (Jensen, 1988), et s’éloignent ensuite progressivement du nid et de la mère dans les semaines qui suivent pour rejoindre les autres truies et porcelets du groupe. Cela s’accompagne d’une diminution progressive de la fréquence des tétées et une augmentation des contacts sociaux avec les porcelets issus d’autres portées (Petersen et al., 1989). Le sevrage, c’est-à-dire l’arrêt de l’alimentation lactée au profit d’un aliment solide, est progressif et s’étale sur plusieurs semaines, les porcelets étant totalement sevrés en moyenne entre 13 et 19 semaines d’âge, bien qu’une variation importante (entre 9 et 22 semaines) ait été rapportée en fonction des conditions et méthodes utilisées (Newberry & Wood-Gush, 1985 ; Jensen & Recén, 1989 ; Stolba & Wood-Gush, 1989 ; Jensen & Stangel, 1992). Les mâles juvéniles quittent le groupe autour de sept à huit mois pour former des petits groupes de deux ou trois mâles. Les mâles deviennent ensuite progressivement des mâles solitaires (à trois ans, les groupes de mâles sont extrêmement rares), qui ne rejoindront les groupes de truies qu’épisodiquement lorsque les femelles seront sexuellement réceptives (Graves, 1984 ; Gonyou, 2001).
1.2. Hiérarchie sociale au sein des groupes de porcs
Deux principaux types de structures sociales ont été décrits et étudiés chez le porc : l’ordre de tétée pour les porcelets non sevrés et la hiérarchie de dominance par la suite, sans qu’aucun lien n’ait été démontré entre ces deux ordres hiérarchiques (Ewbank, 1976).
Dès les premiers jours de vie, les porcelets nouveau-nés établissent un ordre de tétée en se battant pour obtenir l’accès aux tétines. Les porcelets les plus gros ont alors tendance à se positionner préférentiellement sur les tétines les plus antérieures et les plus postérieures pendant les tétées, et à ensuite défendre leur position, laissant ainsi l’accès aux tétines centrales aux porcelets les plus petits (Ewbank, 1976). Cette préférence pour les tétines situées aux extrémités pourrait s’expliquer par le fait que les tétines antérieures seraient plus grosses et plus espacées les unes des autres (et donc plus accessibles), et que les tétines antérieures et postérieures produiraient plus de lait, comparées aux tétines centrales, ce qui pourrait néanmoins être un effet direct d’une plus forte stimulation de la part de porcelets plus gros et plus vigoureux (Ewbank, 1976). L’ordre de tétée se stabilise habituellement dans la première semaine de vie.
Outre l’ordre de tétée chez les porcelets non sevrés, les groupes de porcs sont structurés sur la base d’une hiérarchie de dominance quasi linéaire, i.e. impliquant l’existence de quelques relations triangulaires, qui est établie précocement et qui repose sur des relations de dominance-subordination (Meese & Ewbank, 1973 ; Puppe et al., 2008). Ces relations de dominance-subordination se mettent en place à la suite d’interactions agonistiques, regroupant des agressions physiques, des menaces et des évitements (Meese & Ewbank, 1973), répétées entre une paire d’individus et caractérisées par une issue constante en faveur d’un des deux membres de la paire. L’animal sortant régulièrement vainqueur de l’interaction acquiert alors un statut de dominant, et celui sortant régulièrement perdant obtient un statut de subordonné. Dans des conditions optimales de liberté ou semi-liberté, une fois que l’ordre hiérarchique est établi, généralement dans les 24 à 48 heures suivant la perturbation sociale (i.e. départ d’un animal dominant ou arrivée de nouveaux individus au sein du groupe), il est maintenu sans que les animaux n’aient recours à de l’agression physique. En effet, les animaux subordonnés ont alors plutôt tendance à esquiver systématiquement les confrontations avec les individus dominants, évitant ainsi une escalade des attaques de la part de ces individus. Le rang hiérarchique ne semble pas dépendre du sexe ou du poids des individus, et cette structure hiérarchique s’observe aussi bien dans les groupes de femelles que dans les groupes de jeunes mâles (Meese & Ewbank, 1973).
2. Interactions sociales agonistiques
2.1. Description
Les comportements agonistiques regroupent les comportements agressifs et les réponses d’évitement et de fuite vis-à-vis de ces agressions (Meese & Ewbank, 1973). Les comportements agressifs avec contact incluent les morsures, les coups de tête et les coups d’épaule (Jensen, 1980 ; Samarakone & Gonyou, 2009). Lors des combats mutuels, qui sont des agressions bilatérales entre deux individus, les animaux se tiennent alors côte à côte (position parallèle) ou bien face à face (position antiparallèle) et se poussent violemment en se donnant des coups d’épaule et des coups de tête, et en se mordant ou en tentant de se mordre mutuellement le cou, la tête ou les flancs (figure 1a). Les comportements agressifs sans contact comprennent, quant à eux, les tentatives de morsures et les menaces, lors desquelles l’animal initie un mouvement vif de la tête ou de l’avant du corps en direction d’un autre animal avec la bouche ouverte ou fermée, ou encore les poursuites, pendant lesquelles l’animal poursuit un autre animal en fuite (Rault, 2016a).
Figure 1. Différentes interactions sociales chez le porc.

2.2. Fonctions principales
Comme mentionné plus haut, les comportements agressifs avec contact, et en particulier les agressions bilatérales, surviennent principalement lors d’évènements venant perturber la stabilité sociale, par exemple lors de l’arrivée d’un ou de plusieurs individus dans le groupe (Ewbank, 1976). Dans ces conditions, les porcs non familiers s’engagent dans des combats mutuels intenses afin d’établir leur position hiérarchique (Puppe et al., 2008 ; Peden et al., 2018). La résolution des combats est habituellement rapide, avec l’établissement d’un nouvel ordre hiérarchique dans les 24 à 48 heures suivant le début des combats (Meese & Ewbank, 1973 ; Ewbank, 1976). Bien que sources de dépenses énergétiques importantes, de stress et de blessures pour les animaux, ces combats mutuels intenses sont nécessaires. En permettant la mise en place initiale de l’ordre hiérarchique, ces combats participent à l’établissement d’une stabilité sociale, qui permet de diminuer les interactions agressives directes futures au sein du groupe (Puppe et al., 2008). En effet, une fois l’ordre hiérarchique établi, chaque individu connaît sa position par rapport à chacun des autres membres du groupe par reconnaissance interindividuelle, et l’ordre est alors généralement maintenu par des réponses d’évitement de la part des subordonnés, plutôt que par des combats (Jensen, 1980). Ainsi, les agressions sont relativement rares, voire inexistantes, au sein des groupes stables (Stolba & Wood-Gush, 1989). Des agressions occasionnelles peuvent néanmoins survenir, notamment lors de la défense de ressources privilégiées, comme l’aliment, par les individus dominants du groupe (Graves, 1984) ou bien lors de la défense du nid après la mise bas par la truie allaitante.
3. Interactions sociales non agonistiques
3.1. Description
Les porcs expriment de nombreuses interactions non agonistiques, parfois appelées interactions sociopositives, même si leur caractère « positif » reste encore à confirmer. L’interaction non agonistique qui a reçu le plus d’intérêt est le flairage social, qui consiste pour un animal à sentir ou à toucher une partie du corps d’un congénère avec son groin, et qui implique donc un rapprochement et une proximité étroite entre les deux individus impliqués. Plusieurs types de flairages sociaux ont été décrits chez le porc, comme les flairages groin à groin (figure 1b) et les flairages d’une partie du corps et de la tête (figures 1c et 1d ; Jensen, 1980 ; Camerlink & Turner, 2013 ; Camerlink et al., 2021 ; Clouard et al., 2022, 2023). Ces flairages sociaux sont souvent des contacts brefs, de l’ordre de la seconde, et peuvent être réalisés dans des séquences de comportements plus durables, par exemple lors de jeux sociaux ou au cours d’un déplacement, ce qui les rend parfois difficile à mesurer de manière fiable.
Les porcs pratiqueraient également le toilettage social, à l’instar d’autres espèces d’ongulés sauvages, comme les antilopes et les cerfs (Spruijt et al., 1992), ou domestiques, comme les chevaux et les bovins (Val-Laillet et al., 2009). Le toilettage consiste à frotter le museau contre le corps d’un autre animal, et à lécher ou à mordiller doucement la peau ou les poils de manière systématique avec les lèvres ou les dents (Spruijt et al., 1992 ; Camerlink et al., 2021 ; Clouard et al., 2024b). Les porcs expriment généralement ce comportement lors de séquences de quelques dizaines de secondes. Alors que le toilettage social a été observé chez le porc en conditions de semi-liberté et en élevage intensif (Stolba & Wood-Gush, 1989 ; Camerlink & Turner, 2013 ; Camerlink et al., 2021, 2022 ; Clouard et al., 2024b), son existence ne fait pas consensus (Špinka, 2009) et, pendant longtemps, le toilettage social n’a pas été distingué du flairage social dans les éthogrammes des études sur le comportement social du porc (Camerlink & Turner, 2013 ; Clouard et al., 2022). Depuis quelques années, cependant, les éthologues se questionnent sur l’intérêt de l’identifier comme un comportement à part entière (Camerlink et al., 2021, 2022 ; Clouard et al., 2024b). En effet, il a été démontré que la prévalence de toilettage social était bien moindre que celle des flairages chez le porc (Camerlink et al., 2021, 2022 ; Clouard et al., 2024b), ce qui semble suggérer que ces deux comportements sont bien distincts à la fois sur le plan mécanistique et fonctionnel.
Que cela soit dans des situations sociales stables ou après un allotement, dans des conditions de semi-liberté ou d’élevage intensif, et quel que soit l’âge des individus, les interactions non agonistiques sont naturellement plus nombreuses que les interactions agonistiques (Stolba & Wood-Gush, 1989 ; Camerlink et al., 2021 ; Clouard et al., 2022). De fait, les interactions non agonistiques sont très fréquentes, puisque les contacts groin-corps et groin-groin peuvent représenter jusqu’à 78 % de toutes les interactions sociales observées chez les porcelets (Clouard et al., 2022, 2023), même si les prévalences diffèrent entre les études en fonction des comportements sociaux considérés et des méthodes d’observations utilisées (Camerlink et al., 2021). Cette forte prévalence des interactions non agonistiques suggère que ces comportements revêtent une importance biologique majeure pour le porc.
3.2. Fonctions principales présumées
En l’état actuel des connaissances, les fonctions précises des contacts non agonistiques n’ont pas été clairement établies, mais plusieurs hypothèses convaincantes ont été émises, suggérant un rôle dans la reconnaissance individuelle et la communication sociale, les relations d’affinité, la diminution du stress, ou encore le besoin intrinsèque d’exploration (Camerlink & Turner, 2013).
a. Reconnaissance individuelle et communication sociale
La reconnaissance interindividuelle est une capacité cognitive indispensable au maintien d’une structure et d’une organisation sociale stable. Les contacts du groin jouent vraisemblablement un rôle important dans les processus de reconnaissance des congénères, mais également dans la communication sociale, via la détection, la reconnaissance, et le traitement de nombreux signaux olfactifs (Clouard & Bolhuis, 2017). En effet, le porc peut reconnaître ses congénères sur la base d’informations olfactives seules (Kristensen et al., 2001). L’ocytocine est une hormone stimulant la mémoire olfactive et la reconnaissance sociale (Ferguson et al., 2001). Camerlink et al. (2016) ont montré que, suite à une séparation, la fréquence des interactions groin à groin lors de la réunion des individus, mais pas celles des interactions groin à corps, était réduite par une administration d'ocytocine. Les porcs traités à l'ocytocine seraient ainsi plus aptes à reconnaître leurs congénères, et auraient donc besoin de recourir à moins de contacts groin à groin pour recueillir des indices olfactifs sociaux. Ces résultats suggèrent que les contacts groin à groin participeraient aux processus de reconnaissance sociale via la collecte d’indices olfactifs nécessaires (Camerlink & Turner, 2013 ; Clouard et al., 2024b). En accord avec cette théorie, nous avons observé que le fait de sevrer des porcelets en mélangeant les portées, comme cela se pratique souvent en élevage, augmentait de près de trois fois la fréquence des contacts groin à groin entre des porcelets le jour du sevrage comparé au lendemain, alors que la fréquence des contacts groin à corps restait inchangée, ce qui pourrait confirmer le rôle des contacts groin à groin pour la reconnaissance sociale (résultats non publiés).
Outre la communication entre juvéniles ou adultes, les contacts groin à groin joueraient un rôle important dans la communication mère-jeunes. Contrairement à d’autres animaux d’élevage, comme les bovins ou les ovins, la truie n’effectue pas de toilettage ou de léchage de ses porcelets (Whatson & Bertram, 1983). Ainsi, que ce soit en conditions de liberté ou en élevage intensif, la truie communique essentiellement avec ses petits via des vocalisations, des flairages et des contacts du groin (Whatson & Bertram, 1983 ; Jensen, 1986, 1988 ; Gonyou, 2001). Les porcelets initient eux aussi fréquemment des contacts groin à groin avec leur mère, principalement lors des épisodes de tétées, avant le début de massage prététée et, plus fréquemment encore, dans les minutes suivant l’éjection de lait (Whatson & Bertram, 1983 ; Jensen, 1988 ; Jensen et al., 1991). Les contacts groin à groin avant tétée, en favorisant une bonne reconnaissance des porcelets par leur mère, pourraient s’avérer particulièrement bénéfiques aux porcelets de la portée en évitant que la mère n’allaite des porcelets d’autres portées (Whatson & Bertram, 1983). En plus de jouer un rôle dans la reconnaissance sociale, les contacts groin à groin pourraient être impliqués dans la communication sociale, et notamment celle liée aux besoins nutritionnels. En effet, alors que la fréquence de contacts jeunes-mère observés avant la tétée reste stable au cours de la lactation, celle observée après l’éjection de lait tend à augmenter dans le temps (Jensen et al., 1991). Par ailleurs, les contacts groin à groin seraient moins fréquents lors des allaitements non nutritifs (i.e. sans éjection de lait) que lors des allaitements nutritifs (Whatson & Bertram, 1983), suggérant un lien direct entre contacts jeunes-mère et obtention de lait pendant la tétée. Néanmoins, bien que plusieurs pistes soient évoquées, les fonctions de ces contacts, présents chez le porc domestique en captivité ou à l’état sauvage, restent encore largement à élucider.
b. Relations d’affinité
La structure des groupes est caractérisée par d’autres composantes que la dominance, par exemple l’affinité ou le leadership (cf. Ewbank, 1976 ; Khatiwada et al., 2024), qui n’ont été que peu ou pas étudiées chez le porc. Les relations d’affinité sont considérées comme une composante fondamentale des structures sociales, au regard de leur rôle pour le maintien de la cohésion sociale. Les relations d’affinité non liées à la reproduction, parfois aussi appelées « amitiés », sont définies comme des schémas d’interactions ou d’associations spatiales où des individus d’un groupe réalisent davantage d’interactions affiliatives bidirectionnelles entre eux, comme le toilettage, ou passent plus de temps à proximité l’un de l’autre pendant différentes activités en synchronie, comme le repos ou le pâturage, plutôt qu’avec d’autres membres du groupe (Brent et al., 2014). À l’instar des bovins (Reinhardt & Reinhardt, 1981) ou de leurs cousins sauvages (Podgórski et al., 2014), les porcs exprimeraient eux aussi des relations préférentielles d’affinité. Des études observationnelles en conditions de semi-liberté ont montré que les porcelets exprimaient des préférences sociales de court terme pour les porcelets issus d’une même portée sur la base des proximités au repos, de la synchronisation comportementale, et des interactions non agonistiques, comme le flairage ou le jeu (Newberry & Wood-Gush, 1986 ; Petersen et al., 1989 ; Jensen & Stangel, 1992). Plus récemment, des études réalisées dans des conditions expérimentales contrôlées et/ou s’appuyant sur des méthodes d’analyse des réseaux sociaux (encadré 1) semblent confirmer l’existence de relations sociales préférentielles au sein de groupes de porcs pour les flairages du corps (Goumon et al., 2020) et le toilettage (figure 2 ; Clouard et al., 2024b). A contrario, les flairages groin à groin étaient exprimés de manière aléatoire au sein des groupes (Goumon et al., 2020 ; Clouard et al., 2024b). Ainsi, le toilettage ou le flairage du corps pourraient jouer un rôle important dans le développement et le maintien de relations d’affinité au sein des groupes de porcs (Camerlink & Turner, 2013 ; Goumon et al., 2020), contrairement aux contacts groin à groin qui pourraient être davantage impliqués dans la communication sociale (cf. partie précédente ; Clouard et al., 2024b). De plus, le toilettage social était exprimé par moins de membres du groupe comparé aux interactions groin à groin ou groin à corps, ce qui laisse à penser que le toilettage jouerait un rôle dans le renforcement ou le maintien de liens sociaux spécifiques, entre certains individus du groupe (Clouard et al., 2024b), plutôt que dans la cohésion sociale à l’échelle du groupe comme proposé par d’autres auteurs (Camerlink & Turner, 2013). Ainsi, certaines interactions non agonistiques, comme le toilettage, pourraient participer au développement et au maintien des relations d’affinité chez le porc. Des études complémentaires sont néanmoins nécessaires pour confirmer ces hypothèses, et mieux comprendre et caractériser ces relations d’affinité et leur rôle pour le bien-être du porc en élevage (cf. paragraphe 5.2).
Figure 2. Réseaux sociaux illustrant les liens entre animaux lors du toilettage des congénères au sein d’un groupe de 12 porcs suivi (a) en post-sevrage et (b) en engraissement (Clouard et al., 2024b).

L'analyse des réseaux sociaux (« social network analysis ») est une méthode puissante pour identifier et quantifier les relations sociales au sein des groupes d’animaux (Wasserman & Faust, 1994 ; Whitehead, 2008) et a été largement appliquée dans des champs disciplinaires variés, comme l’économie, l’informatique ou la sociologie. Face au développement rapide de logiciels accessibles et la publication d’articles et d’ouvrages décrivant l’intérêt de cette approche pour les sciences comportementales, l’analyse des réseaux sociaux connaît un récent essor dans le domaine de l’éthologie appliquée (Makagon et al., 2012) et plus particulièrement dans la recherche sur le bien-être des animaux d’élevage (Foris et al., 2021 ; Clouard et al., 2024b).
L’analyse des réseaux sociaux repose sur la représentation graphique des relations entre les individus, appelés nœuds, et les interactions entre eux, appelées liens (Wasserman & Faust, 1994). Ces représentations graphiques, ou sociogrammes (figure 2), permettent de visualiser la présence ou l'absence d’interactions (p. ex. agression, toilettage) entre chaque membre du groupe. Ces sociogrammes peuvent également donner des informations plus complexes. Dans les réseaux pondérés (« weighed network »), la force des interactions, qui peut être calculée sur la base de la fréquence ou de la durée des interactions entre deux individus, est représentée par l’épaisseur des liens. Dans les réseaux dirigés (« directed network »), la direction des interactions est représentée par l’ajout de flèches à l’extrémité des liens afin d’indiquer l’émetteur et le receveur de l’interaction. Enfin, les caractéristiques des individus, comme leur âge, leur rang de dominance ou leur sexe, peuvent être ajoutées au sociogramme en attribuant des couleurs ou des tailles différentes aux nœuds (Makagon et al., 2012).
L’analyse des réseaux sociaux permet de calculer différents paramètres (« social network metrics »), à l’échelle du groupe ou de l’individu, qui aident à quantifier certains concepts sociaux clés.
À l’échelle du groupe, la densité, qui est la proportion des liens existants par rapport aux liens possibles, renseigne sur le degré auquel tous les individus d’un groupe interagissent les uns avec les autres. La réciprocité informe sur le degré auquel les individus partagent des interactions réciproques, tandis que le coefficient de « clustering » ou d’agglomération mesure la probabilité que deux nœuds soient connectés sachant qu’ils sont connectés à un même nœud. La tendance des nœuds à former des groupes fortement interconnectés, donne des informations sur la solidité et l'unité du groupe. Enfin, l’assortativité, obtenue à l’aide du calcul d’un coefficient d’assortativité comparant les attributs des nœuds connectés, permet de déterminer dans quelle mesure des individus du groupe sont préférentiellement connectés à des individus partageant ou non des caractéristiques communes (p. ex. sexe, âge, statut de dominance). Les paramètres mesurés à l’échelle du groupe donnent donc des indications sur la cohésion sociale, la solidité ou le niveau d’unité du groupe (p. ex. présence de sous-groupes interconnectés ou non). Appliqués aux groupes de porcs en élevage, ils peuvent par exemple permettre de suivre l’évolution des structures sociales suite à des modifications des groupes (retrait ou ajout d’individus) ou d’évaluer l’impact de certaines conditions d’élevage (p. ex. densité, enrichissement) sur la structure sociale. Ces paramètres peuvent également permettre d’identifier les déterminants individuels des préférences sociales au sein du groupe, à savoir, si les porcs s’associent ou interagissent préférentiellement avec des animaux du même rang social ou du même sexe, par exemple.
À l’échelle de l’individu, différents paramètres de centralité (« centrality ») informent sur l'importance d'un individu dans le réseau. La centralité de degré (« degree »), qui est le nombre de liens directs qu’un individu partage avec les autres individus du groupe, renseigne sur la place de certains individus dans le groupe (p. ex. individus très connectés et centraux). Dans les réseaux dirigés, on distingue degré entrant (nombre d’interactions dirigées vers l’individu) et degré sortant (nombre d’interactions émises par l’individu). La centralité de proximité (« closeness »), qui est la distance minimale qui connecte un individu aux autres membres du groupe, renseigne sur la propension d’un individu à communiquer avec l’ensemble du groupe sans passer par de nombreux intermédiaires. Elle diffère du degré dans la mesure où, alors que le degré ne prend en compte que les relations directes, la proximité prend en compte à la fois les relations directes et les relations indirectes. La centralité d’intermédiarité (« betweenness »), qui est le nombre de fois où un individu se trouve sur le plus court chemin entre d’autres individus, permet d’identifier les individus qui relient différents sous-groupes. Les paramètres mesurés à l’échelle individuelle permettent donc d’identifier des animaux clés jouant des rôles importants dans le maintien de la cohésion sociale ou dans la transmission des comportements. Pour le porc en élevage, ils permettent d’identifier les animaux centraux qui jouent un rôle important dans le maintien de la cohésion du groupe, ou les animaux qui propagent les comportements le plus rapidement et au plus grand nombre au sein du groupe.
En conclusion, l'analyse des réseaux sociaux offre un cadre méthodologique robuste et standardisé pour mieux comprendre et caractériser les interactions sociales à l’échelle individuelle et les dynamiques sociales à l’échelle du groupe chez le porc en élevage. En quantifiant des paramètres sociaux clés, cette approche pourrait aider à créer des conditions ou des pratiques d'élevage qui respectent les affinités sociales ou qui limitent la propagation de comportements indésirables, comme l’agressivité ou le cannibalisme, favorisant ainsi le bien-être animal.
c. Réduction du stress
Les interactions non agonistiques pourraient également jouer un rôle dans l’apaisement de tensions et dans la diminution du stress au sein des groupes. En effet, des travaux ont suggéré que l’émission importante de contacts tactiles non agonistiques serait une stratégie d’adaptation mise en place par certains individus afin de trouver de l’apaisement face à des situations susceptibles d’induire un état de stress important, comme les situations associées à l’élevage intensif, p. ex. allotements, fortes densités, peu d’espace disponible (Temple et al., 2011). En accord avec cette hypothèse, des porcs qui subissent des contacts négatifs avec des humains expriment plus d’interactions sociales après cet évènement stressant (Rault, 2016b). L’augmentation des contacts du groin après un conflit ou des expériences négatives pourrait participer à l’apaisement des tensions sociales via un phénomène de soutien social (Boissy et al., 2007 ; Rault, 2012), concept selon lequel la présence d’un congénère aurait des effets bénéfiques sur la capacité d’un individu à s’adapter à un challenge. Enfin, il est possible que les comportements non agonistiques, comme le toilettage, soient directement liés aux relations de dominance au sein du groupe (Rault, 2019), comme cela a été montré chez les bovins (Mülleder et al., 2003 ; Val-Laillet et al., 2009). Selon ce postulat, les animaux subordonnés pourraient exprimer davantage de comportements non agonistiques dans le but d’apaiser les tensions, de gagner l’accès à certaines ressources ou de réduire les risques d’agression de la part des dominants. Néanmoins, l’existence de ces associations entre comportements non agonistiques et dominance, qui pourraient être fortement influencées par le contexte social (Rault, 2019), reste à démontrer chez le porc (Camerlink & Turner, 2013).
3.3. Autres comportements non agonistiques
Outre les contacts tactiles du groin, le porc exprime d’autres comportements sociaux considérés comme non agonistiques ou sociopositifs, comme le fait de maintenir une proximité spatiale et de se synchroniser lors de différentes activités comme le repos ou l’exploration. Les porcs passent notamment beaucoup de temps à dormir ou à se reposer en étant en contact physique les uns avec les autres (figure 3 ; Goumon et al., 2020 ; Camerlink et al., 2022 ; Clouard et al., 2024b). Or, il semblerait que les porcs ne se couchent pas au hasard, et expriment des préférences dans le choix de leurs partenaires lors du repos (Stookey & Gonyou, 1998 ; Durrell et al., 2004 ; Clouard et al., 2024b). Cela pourrait suggérer que les proximités sociales jouent un rôle dans l’affinité sociale au même titre que le toilettage ou les flairages sociaux. Néanmoins, différentes études ont rapporté une absence de corrélation entre l’expression de ces interactions non agonistiques et les proximités spatiales (Goumon et al., 2020 ; Camerlink et al., 2022 ; Clouard et al., 2024b). Ce manque de corrélation pourrait indiquer que ces deux types de comportement social reflètent différents aspects de la socialité (Pearce et al., 2017 ; Camerlink et al., 2022). Une autre hypothèse qui a été avancée pour expliquer ce manque de corrélation serait que, dans des environnements confinés et socialement denses, les préférences identifiées sur la base des proximités spatiales pourraient ne refléter en fait qu’une préférence commune pour certains espaces de vie, en lien avec la température, l’humidité ou la luminosité, par exemple (Camerlink & Turner, 2013 ; Goumon et al., 2020).
Chez les individus juvéniles, le jeu social vient s’ajouter aux contacts du groin et aux proximités spatiales. Les individus juvéniles s’engagent dans différents types de jeux (jeux d’objet, locomoteurs et sociaux ; Horback, 2014), avec un pic d’activité de deux à six semaines d’âge (Newberry et al., 1988 ; Clouard et al., 2022). Les jeux sociaux sont caractérisés par une succession d’interactions sociales et de comportements locomoteurs effectués de manière simultanée par deux individus ou plus, de manière tonique et non coordonnée. Lors de ces épisodes de jeux, les porcelets sautent ou pivotent sur eux-mêmes, secouent vivement la tête, courent autour de la loge, tournent autour de congénères ou les bousculent, avec ou sans tentatives de morsures (Newberry et al., 1988). Parmi les jeux sociaux, les porcelets s’engagent dans des jeux de combats, caractérisés par des poussées et des bousculades des congénères avec ou sans morsures. Ces jeux de combat, qui bien que parfois difficiles à distinguer de vrais combats, sont néanmoins caractérisés par une intensité et une tension corporelle moins fortes que pendant les vrais combats, et sont souvent précédés et débutés par des « signaux de jeu », tels que le fait de pivoter sur soi-même et de secouer vivement la tête (Newberry et al., 1988). Les mâles s’engagent davantage dans les jeux sociaux, particulièrement les jeux de combats, que les femelles (Weller et al., 2019 ; Clouard et al., 2022). Ce dimorphisme sexuel dans l’expression du jeu chez les juvéniles serait particulièrement observé chez les espèces pour lesquelles l’environnement social et les rôles sociaux des mâles et des femelles diffèrent fortement dans la vie adulte, comme c’est le cas chez le porc (Weller et al., 2019). Les jeux sociaux aideraient le porcelet à acquérir des compétences sociales importantes pour ses interactions sociales futures, comme la reconnaissance sociale, ou à développer des capacités physiques et locomotrices nécessaires pour s’engager dans des combats efficaces (Bekoff, 1984 ; Dobao et al., 1985 ; Kristensen et al., 2001). Ainsi, en aidant l’animal à développer ces compétences sociales, le jeu social faciliterait son intégration dans le groupe et participerait donc au maintien de la cohésion sociale (Bekoff, 1984 ; Newberry et al., 1988).

4. Impact des conditions d’élevage sur les comportements sociaux
En élevage, les porcs sont élevés dans des conditions très différentes de celles observées à l’état semi-naturel, notamment en termes de taille et de composition des groupes sociaux, d’environnement physique, ou de stabilité sociale. Ces conditions spécifiques à l’élevage peuvent affecter la capacité des porcs à exprimer l’ensemble de leur répertoire social, et avoir des conséquences délétères sur leur bien-être.
4.1. Mélanges sociaux : le cas particulier du sevrage
En élevage porcin, les animaux sont soumis à des allotements successifs au cours de leur vie. Ces allotements engendrent des bouleversements majeurs de l’équilibre des groupes d’animaux. Les truies primipares sont souvent introduites dans le groupe de femelles gestantes après l’insémination pour renouveler le cheptel à hauteur de 20 à 30 % suite au départ des truies réformées. Chez le porc charcutier, un allotement est souvent réalisé en début d’engraissement afin de constituer des lots d’animaux de même sexe ou de poids similaire, qui faciliteront la conduite du troupeau et le départ à l’abattage en même temps. Enfin, le sevrage constitue peut-être le bouleversement le plus important pour le porc en élevage, et a fait l’objet de nombreux travaux de recherche. Le sevrage en conditions naturelles se définit comme le passage d’une alimentation principalement lactée à une alimentation exclusivement solide. En élevage conventionnel, le sevrage est généralement réalisé de manière particulièrement précoce et soudaine et n’implique pas que des changements alimentaires. Les porcelets sont séparés de leur mère du jour au lendemain entre 21 et 28 jours après la naissance. En parallèle de cette séparation maternelle, les porcelets sont généralement relogés dans de nouveaux hébergements et mélangés avec des porcelets issus d’autres portées. Ces allotements génèrent une augmentation transitoire des combats qui, bien que nécessaire à l’établissement de la hiérarchie, peut être exacerbée par des conditions d’hébergement inadéquates (peu d’espace disponible, densité trop élevée, groupes homogènes) et engendrer des blessures et lésions parfois importantes. La nécessité de s’adapter simultanément à des changements d’ordres nutritionnel, environnemental et social peut engendrer un stress considérable chez certains animaux, particulièrement lorsque ces changements sont réalisés précocement par rapport à ce qui s’observe en conditions « naturelles ». Cet état de stress favorise l’émergence de comportements sociaux anormaux, comme des comportements de tétée redirigés vers les congénères (« belly nosing ») ou d’autres comportements de manipulations orales des congénères (mordillement et morsures des oreilles ou de la queue ; Metz & Gonyou, 1990). Ces comportements peuvent être une source de stress pour les autres membres du groupe lorsqu’ils sont réalisés de manière répétée et durable sur les mêmes victimes. Par ailleurs, une absence ou une baisse importante des comportements de jeux est souvent rapportée dans les jours ou semaines suivant un sevrage précoce (Clouard et al., 2023). L’augmentation des comportements agonistiques, au détriment des comportements de jeux et non agonistiques, est un indicateur fort de l’impact délétère de cette pratique sur le bien-être animal.
Différentes stratégies génétiques, nutritionnelles ou relatives à la gestion des groupes ont été testées pour limiter l’agression et le stress lors des regroupements sociaux. Parmi ces stratégies, qui ont été décrites en détail dans la revue de Peden et al. (2018), la sociabilisation précoce a reçu un intérêt particulier. Cette stratégie consiste à mettre en contact des porcelets issus de différentes portées pendant la période de lactation (D’Eath, 2005 ; Salazar et al., 2018). La socialisation précoce imite donc les situations observées dans des conditions naturelles, en permettant aux porcelets d’interagir et de se familiariser progressivement avec les porcelets d’autres portées et de former ainsi des relations sociales dès les premières semaines de vie, notamment via les jeux de combats (D’Eath, 2005 ; Salazar et al., 2018). En stimulant l’apprentissage social et en augmentant les compétences sociales des porcelets (cf. paragraphe 3.3), ces jeux de combat précoces avec des porcelets d’autres portées permettraient aux animaux d’avoir des combats plus efficaces (c.-à-d. plus courts et générant moins de blessures) et d’établir la hiérarchie de dominance plus rapidement lors des allotements ultérieurs, notamment au moment du sevrage (Salazar et al., 2018). Cette meilleure efficacité dans la formation de la hiérarchie de dominance, associée à la formation d’un nouveau groupe constitué de porcelets qui se connaissent déjà, permettrait de réduire les effets néfastes associés au sevrage, en diminuant les agressions (en termes de durée ou d’intensité), et en atténuant ainsi les lésions corporelles et le stress (p. ex. baisse du cortisol périphérique). La sociabilisation précoce serait donc une stratégie pertinente pour améliorer le bien-être des porcelets, sans pour autant impacter leurs performances productives au sevrage (D’Eath, 2005 ; Salazar et al., 2018).
Différentes pratiques nécessitant des aménagements plus ou moins importants peuvent être mises en place pour effectuer une sociabilisation précoce. Certains élevages se contentent d’ouvrir les cloisons entre deux cases de maternité bloquées adjacentes, ou d’installer des séparations amovibles et d’ouvrir les portes des cases pour donner l’accès au couloir aux porcelets (D’Eath, 2005 ; Salazar et al., 2018). D’autres systèmes, demandant un investissement économique plus conséquent, ont également été testés, comme les systèmes d’allaitement collectif qui associent socialisation précoce, sevrage tardif, et enrichissement du milieu physique et social (van Nieuwamerongen et al., 2015 ; Verdon et al., 2020). En plus d’avoir des conséquences positives sur la prise de poids en post-sevrage, l’enrichissement social et physique qu’apportent ces systèmes permettrait d’augmenter les comportements de jeu et de diminuer les comportements de manipulation orale et l’agression en post-sevrage comparé à des systèmes en loges de maternité individuelles conventionnelles. En plus de la variabilité dans le type de systèmes utilisés, une large variation a également été observée concernant l’âge au début de la sociabilisation, qui peut varier entre 7 et 14 jours selon les études et expliquer les effets observés (D’Eath, 2005 ; Salazar et al., 2018 ; Verdon et al., 2020). Par ailleurs, les conséquences de ces pratiques sur la truie, son bien-être et sa productivité n’ont pas été bien caractérisées, et certaines études suggèrent que la socialisation précoce entraînerait des ruptures des épisodes d’allaitement et des allaitements croisés (Verdon et al., 2020). Ainsi, bien que cette pratique soit appliquée dans certains élevages, des études supplémentaires sont nécessaires pour lever les doutes qui persistent encore chez certains éleveurs, notamment concernant l’impact négatif de cette pratique sur la charge de travail, ou le risque de transmission des pathogènes (Peden et al., 2018).
4.2. Taille, composition et densité des groupes sociaux
Les porcs sont amenés à évoluer au sein de groupes formés par l’éleveur bien différents des groupes observés en conditions semi-naturelles. En effet, la composition, la taille et la densité des groupes sont généralement prédéterminées pour maximiser les gains économiques, optimiser l’utilisation de l’espace et faciliter la gestion des animaux (Estevez et al., 2007). Ces facteurs liés à la gestion des groupes influenceraient les comportements sociaux, et pourraient notamment favoriser la survenue d’une agressivité excessive pouvant engendrer de sévères blessures et un niveau de stress élevé (Estevez et al. 2007).
Tout d’abord, les porcs en élevage sont fréquemment maintenus dans des groupes homogènes, composés uniquement d’animaux au même stade physiologique, et parfois même du même sexe ou du même poids (Estevez et al., 2007). Or, ces situations de grande homogénéité sociale peuvent être à l’origine d’une difficulté à établir la hiérarchie en l’absence d’animaux plus âgés ou plus lourds qui auraient autrement assis leur dominance assez facilement, ce qui peut générer une agressivité excessive et durable (Andersen et al., 2000). Chez les porcs en engraissement, les combats sont plus courts entre individus de poids contrastés que chez des animaux de poids équivalents (Andersen et al., 2000). Chez les truies gestantes, la place dans la hiérarchie est fortement corrélée à la parité et au poids des truies, mais seulement dans les groupes caractérisés par une grande hétérogénéité en termes de parité ou de poids (Lanthony et al., 2022), confirmant ainsi que l’hétérogénéité faciliterait l’établissement et le maintien de la hiérarchie. La taille des groupes semblerait également avoir un impact non négligeable sur les comportements sociaux, en particulier l’agression. Une diminution de l’agressivité a été observée avec l’augmentation de la taille des groupes (Estevez et al., 2007 ; Samarakone & Gonyou, 2009). Parmi les nombreuses théories avancées pour expliquer ce phénomène (Estevez et al. 2007), la théorie des « contrats à terme pour la non-agression » suggère que la formation d’une hiérarchie ne serait bénéfique que pour des groupes de petite taille (observés dans des conditions naturelles). Dans des grands groupes, les animaux développeraient alors d’autres stratégies pour maintenir la stabilité sociale et de faibles niveaux d’agression, en créant par exemple des sous-groupes d’animaux qui seraient régis par des hiérarchies « locales ». Néanmoins, l’impact de l’hétérogénéité ou de la taille des groupes sur l’agressivité serait très dépendant des conditions de compétition pour les ressources ou de la densité. En effet, l’agressivité observée dans le cas de regroupements sociaux ou de gestion des groupes inadaptée peut être exacerbée par des conditions de logement défavorables, par exemple si les accès à la nourriture, à l’eau ou aux aires de repos sont insuffisants (Andersen et al., 2000 ; Estevez et al., 2007 ; Samarakone & Gonyou, 2009). Ces résultats, qui soulignent l’importance de limiter la compétition pour l’accès aux ressources, suggèrent que les porcs adapteraient leur stratégie sociale en fonction de leur environnement social, illustrant le caractère plastique du comportement social qui ne dépendrait pas seulement des relations de dominance/subordination au sein des groupes (Estevez et al., 2007 ; Samarakone & Gonyou, 2009).
4.3. Qualité de l’environnement
Certains paramètres liés aux infrastructures pourraient également impacter les comportements sociaux chez le porc en élevage.
La provision d’un espace disponible suffisant serait un facteur crucial à la bonne expression des comportements sociaux. Comme mentionné précédemment, lors des mélanges sociaux, les porcs s’engagent dans des combats virulents. Or, le manque d’espace peut entraîner une incapacité physique à réaliser ces combats de manière efficace, et également empêcher l’animal subordonné de fuir le combat. L’impossibilité d’exprimer un comportement de soumission qui mettrait fin au combat peut alors engendrer des combats prolongés en l’absence de vainqueur clairement identifié (Gonyou, 2001). En élevage conventionnel, lorsque la provision d’espace supplémentaire n’est pas envisageable sur le plan économique ou technique, une solution alternative pour réduire les agressions consisterait à aménager les espaces de vie compartimentés afin d’offrir aux animaux la possibilité de s’isoler et de fuir les interactions agonistiques, en ajoutant par exemple des cloisons opaques permettant de créer des espaces séparés dans la loge. Les effets bénéfiques de ces stratégies restent toutefois encore à confirmer (Bulens et al., 2017).
Des travaux ont également mis en évidence un effet de la qualité de l’environnement sur l’expression des comportements sociaux. L’accès à des environnements complexes ou enrichis permettrait notamment de réduire les comportements sociaux indésirables. Par exemple, des truies gestantes élevées en conditions enrichies, avec plus d’espace disponible et de la paille accumulée montraient moins d’agressions que des truies élevées sur caillebottis (Lopes et al., 2023). Pendant la période de lactation, des porcelets hébergés dans des loges de maternité libres interagissent plus fréquemment avec la truie, via notamment des contacts du groin, jouent davantage et expriment moins de comportements de manipulation orale des congénères que des porcelets hébergés dans des cases de contention (Singh et al., 2017). De même, des porcelets élevés en maternité et/ou au sevrage dans des conditions enrichies, caractérisées par plus d’espace disponible et un accès à des matériaux d’enrichissement ou à de la paille, exprimaient moins de manipulations orales des congénères telles que le « belly nosing » ou les morsures de queue, d’oreille et d’autres parties du corps que des animaux élevés en conditions conventionnelles appauvries (Beattie et al., 2000 ; Bolhuis et al., 2005 ; Oostindjer et al., 2011). Enfin, des porcelets élevés en plein air, pendant la période de lactation ou après le sevrage, passaient moins de temps à exprimer du « belly nosing », à manipuler oralement et à agresser leurs congénères que des animaux élevés en bâtiment (Hötzel et al., 2004).
L’expression des comportements non agonistiques semblerait également être fortement impactée par la qualité de l’environnement. Par exemple, dans un environnement enrichi (avec plus d’espace disponible et de la paille au sol), des porcelets sous la mère ou sevrés expriment davantage de jeux sociaux locomoteurs (Bolhuis et al., 2005), mais autant (Bolhuis et al., 2005) voire moins de contacts avec les congénères (flairages, massages, mordillements doux des congénères ; Beattie et al., 2000) que des animaux élevés en conditions appauvries. De même, chez le porc ibérique en engraissement, la prévalence des comportements sociaux positifs, comme le flairage et le toilettage, était bien moins élevée dans des systèmes d’élevage extensifs (2,3 %) caractérisés par une densité moindre et un accès prolongé à l’extérieur que dans des conditions d’élevage intensives (10 % ) (Temple et al., 2011). Enfin, chez la truie gestante, l’accès à un environnement plus spacieux et à de la paille accumulée est associé à une prévalence réduite de flairages sociaux (Lopes et al., 2023). Cette diminution de l’expression des flairages sociaux dans des environnements enrichis pourrait suggérer que ces comportements d’exploration des congénères refléteraient, du moins en partie, la forte motivation intrinsèque du porc à explorer son environnement, congénères compris. Dans des conditions où l’environnement n’offre pas la possibilité aux animaux d’exprimer leur comportement d’exploration et de fouissage, comme en élevage intensif en bâtiment, les animaux auraient donc tendance à combler ce besoin en redirigeant ces comportements exploratoires vers les congénères (Camerlink et al., 2016 ; Clouard et al., 2024b). En accord avec ce postulat, des corrélations fortes ont été mises évidence entre l’exploration de l’environnement et le flairage social (contacts groin à groin et groin à corps), même en présence de substrat d’exploration (Camerlink & Turner, 2013).
Enfin, les conditions d’ambiance, comme la qualité de l’air ou la luminosité, influenceraient les comportements sociaux des animaux élevés en bâtiment. Par exemple, dans des salles caractérisées par des forts taux d’ammoniac atmosphérique, des porcs sevrés passaient moins de temps à se nourrir en contact que dans des salles à faible taux d’ammoniac, suggérant une réduction de la synchronisation du groupe et une diminution de la tolérance à l'égard des congénères (O’Connor et al., 2010). Dans ces conditions défavorables, les porcs exprimaient également moins de comportements de jeux et étaient plus agressifs (O’Connor et al., 2010 ; Parker et al., 2010). En outre, l’effet délétère de ces fortes concentrations d'ammoniac atmosphérique sur l'agressivité était exacerbé par des conditions de faible luminosité (Parker et al., 2010). Ces perturbations des comportements sociaux seraient liées à l’impact négatif de mauvaises conditions d’ambiance, comme un air pollué et une faible luminosité, sur la capacité des animaux à percevoir des signaux olfactifs ou visuels nécessaires à la communication et à la reconnaissance sociale (O’Connor et al., 2010 ; Parker et al., 2010). En bâtiment, l’accumulation de grandes quantités de contaminants dans l’air, en combinaison avec la poussière, pourrait notamment masquer d'autres signaux olfactifs (Jones et al., 2001) et favoriserait l’inflammation de l’organe voméronasal (Hellekant & Danilova, 1999), compromettant alors l’intégrité et la fonctionnalité des muqueuses nasales et des récepteurs olfactifs. En accord avec ces hypothèses, chez le porc, une association positive a été mise en évidence entre le niveau d’inflammation de l’organe voméronasal et la sévérité et le nombre de lésions cutanées, suggérant des combats plus intenses ou plus nombreux consécutifs à une difficulté à établir un ordre hiérarchique (Hellekant & Danilova, 1999). Par ailleurs, l'exposition chronique à des niveaux élevés d'ammoniac aérien a modifié les préférences de porcs pour des individus familiers ou non familiers. Les effets d’une pollution atmosphérique chronique sur les préférences sociales pourraient résulter directement d’une altération des mécanismes de reconnaissance sociale (Kristensen et al., 2001) ou, indirectement, d’une détérioration de l’état émotionnel (douleur, mal-être) qui perturberait le comportement social. Ces études confirment ainsi l’importance de la qualité de l’air sur les mécanismes de communication ou discrimination sociales chez le porc.
5. Perspectives de recherche sur les comportements sociaux pour l’amélioration du bien-être animal
Depuis le début des recherches sur le bien-être animal en élevage, les travaux se sont principalement focalisés sur la réduction du mal-être des animaux d’élevage, en identifiant les situations ou pratiques susceptibles de générer des états émotionnels négatifs. Ainsi, l’impact des conditions et pratiques d’élevage (p. ex. allotements, caractéristiques des groupes d’animaux, conditions d’hébergement) sur l’expression des comportements agonistiques, tels que l’agression ou les manipulations orales des congénères (p. ex. morsures de queue ou d’oreilles), a été particulièrement bien caractérisé, tandis que les comportements non agonistiques ont jusqu’ici reçu un intérêt plus limité. Cependant, les deux dernières décennies ont été marquées par une évolution majeure des perceptions sociétales et scientifiques relatives au bien-être animal. Il est désormais reconnu que limiter les expériences négatives et la souffrance des animaux ne suffit pas à garantir leur bien-être. Le concept émergent de « positive welfare » postule que le bien-être animal ne peut être garanti qu’en procurant à l’animal l’opportunité de vivre des expériences positives et gratifiantes, leur permettant de ressentir des émotions positives (Rault et al., 2023, 2025). Or, pour les espèces sociales, ces expériences positives incluent vraisemblablement l’opportunité de vivre au sein de groupes stables, de développer et de maintenir des liens sociaux, et d’exprimer des interactions sociales positives. Ces éléments sont donc essentiels pour promouvoir le bien-être animal en élevage (Boissy et al., 2007). Dans ce contexte, des avancées majeures ont été réalisées concernant les comportements non agonistiques du porc, et l’influence des conditions d’élevage sur leur expression (cf. partie 4).
5.1. Vers une meilleure compréhension des fonctions des comportements non agonistiques
Malgré ces avancées, des efforts supplémentaires sont nécessaires pour comprendre pleinement la fonction des comportements non agonistiques et leur importance pour le maintien du bien-être en élevage. Plusieurs axes de recherche méritent une attention particulière.
Il serait crucial de mieux caractériser les contextes d’expression de chaque type de comportements non agonistiques pour mieux comprendre leurs fonctions, en étudiant leurs expressions spécifiques dans des systèmes d’élevage variés, tels que les systèmes intensifs conventionnels, les systèmes intensifs enrichis ou les systèmes extensifs. Par exemple, une fréquence élevée de flairages des congénères en milieu appauvri, comparée à celle observée dans des milieux enrichis ou permettant l’accès à l’extérieur, confirmerait que l’expression de ces comportements est fortement influencée par la motivation intrinsèque des porcs à explorer, et ce même en l’absence de substrat adéquat. En revanche, une fréquence élevée de comportements de toilettage mutuel ou de fortes proximités spatiales en élevage extensif pourrait souligner leur importance pour le maintien des liens sociaux et de la cohésion sociale. De la même manière, l’analyse de l’expression des différents types de comportements non agonistiques suite à des évènements perturbant le groupe social (p. ex. allotements, augmentation de la compétition pour certaines ressources) permettrait de mieux comprendre leur fonction. Par ailleurs, une meilleure compréhension de l’évolution simultanée des comportements agonistiques et non agonistiques dans des situations générant de la compétition ou de la frustration pourrait clarifier leur rôle. Par exemple, dans un groupe social stable, une augmentation des contacts du groin lors d’une situation de compétition pour une ressource (p. ex. diminution du nombre d’auges) accompagnée d’une diminution des interactions agonistiques pourrait confirmer le rôle de ces contacts dans la réduction des tensions sociales au sein du groupe, comme suggéré chez le bovin (Val-Laillet et al., 2009) ou le porc (Camerlink & Turner, 2013).
En conclusion, approfondir notre compréhension des comportements non agonistiques, de leurs fonctions et de leurs contextes d’expression constitue une étape essentielle pour améliorer le bien-être des porcs en élevage. Ces recherches permettront de mieux intégrer le concept de « positive welfare » dans les pratiques d’élevage.
5.2. Importance du maintien des relations d’affinité pour le bien-être
Outre l’acquisition de connaissances sur les fonctions des comportements non agonistiques et de l’impact des pratiques d’élevage sur leur expression, il est essentiel de confirmer l’existence de relations d’affinité chez le porc, et d’explorer leur rôle, leur dynamique dans le temps, et leur contribution potentielle au bien-être animal.
Comme décrit dans le paragraphe 3.2, à l’instar des ruminants (p. ex. Foris et al., 2021), les porcs semblent exprimer des préférences sociales plus ou moins durables à travers certains comportements non agonistiques (Durrell et al., 2004 ; Goumon et al., 2020 ; Camerlink et al., 2022 ; Clouard et al., 2024b). Cependant, la majorité des études a identifié ces préférences sur la base seule des proximités pendant l’exploration (Goumon et al., 2020) ou le repos (Stookey & Gonyou, 1998 ; Durrell et al., 2004 ; Goumon et al., 2020 ; Camerlink et al., 2022). Or, chez le porc, les préférences sociales observées sur la base des proximités spatiales ne sont pas corrélées à celles observées lors de l’expression de contacts sociaux, comme le toilettage ou les contacts groin à groin (Camerlink et al., 2022 ; Clouard et al., 2024b), ce qui suggère que les proximités spatiales seraient influencées par des facteurs non sociaux. Par exemple, dans les systèmes d’élevage en bâtiment, ces proximités sociales pourraient refléter, plutôt que des liens d’affinité, des préférences communes pour une aire spécifique qui offrirait un meilleur confort thermique ou un environnement favorable. De plus, ces préférences sociales ne semblent pas toujours robustes ou stables dans le temps et entre les contextes. En effet, elles ne persistaient pas à un changement de loge (Durrell et al., 2004), bien que des exceptions aient été rapportées récemment (Clouard et al., 2024b), elles sembleraient varier selon les activités considérées (Goumon et al., 2020), et évolueraient en fonction de l’âge (Camerlink et al., 2022). Des recherches à long terme incluant des mesures de proximités spatiales et des contacts sociaux dans des environnements non confinés sont donc nécessaires pour mieux caractériser la stabilité et la durabilité des relations sociales chez le porc. Enfin, les relations d’affinité ont été étudiées principalement chez les porcs sevrés et en croissance (Durrell et al., 2004 ; Goumon et al., 2020 ; Camerlink et al., 2022 ; Clouard et al., 2024b). Il serait donc pertinent de confirmer l’existence de ces relations chez des animaux à un autre stade physiologique, comme les truies gestantes, qui évoluent généralement au sein du même groupe social sur plusieurs gestations successives (Clouard et al., 2024a).
En plus de confirmer l’existence de relations sociales d’affinité, il serait important d’identifier les facteurs individuels qui sous-tendent leur établissement, leur maintien et leur évolution. Des études observationnelles sur des populations en semi-liberté ont montré que les animaux qui ont été élevés ensemble depuis le plus jeune âge expriment davantage de comportements affiliatifs entre eux qu’avec d’autres (Newberry & Wood-Gush, 1986), suggérant un impact important de la familiarité ou du lien de parenté. Plus récemment, des études reposant sur l’analyse des réseaux sociaux ont permis d’élargir le champ de connaissances, mais en rapportant parfois des résultats contradictoires. Par exemple, alors que plusieurs études n’observent aucun effet de la familiarité, du degré de parenté ou du sexe sur les préférences sociales lors du repos (Durrell et al., 2004 ; Goumon et al., 2020), nous avons récemment démontré que des porcelets sevrés ou en engraissement ont tendance à se coucher préférentiellement à proximité d’individus issus de la même portée ou de même sexe (Clouard et al., 2024b). Enfin, les porcs en croissance auraient tendance à préférer flairer (Goumon et al., 2020) ou toiletter (Clouard et al., 2024b) des individus de rang de dominance différents.
Ces connaissances pourraient permettre de repenser certaines pratiques d’élevage pour mieux prendre en compte les relations d’affinité en élevage et favoriser le bien-être animal. Maintenir des partenaires privilégiés ensemble, en limitant les allotements sociaux, pourrait par exemple limiter l’agression et le stress observés en élevage. Une stratégie prometteuse serait de garder les animaux issus d’une même portée ensemble tout au long de leur vie, du naissage à l’engraissement, en passant par le post-sevrage. La prise en compte de ces relations d’affinité pourrait également permettre d’amplifier les effets du soutien social sur le stress. Le soutien social décrit le phénomène par lequel la simple présence d’un ou plusieurs partenaires permet d’atténuer les effets négatifs d’évènements stressants sur un individu cible (Cohen & Wills, 1985 ; Rault, 2012). Or, la présence d’un congénère pris au hasard ne serait pas toujours suffisante à réduire le stress de l’individu cible, et il semblerait que le soutien social soit plus efficace entre animaux familiers (Kanitz et al., 2014) ou partageant un fort lien d’affinité (Boissy & Le Neindre, 1990). Ainsi, maintenir ensemble des paires ou des groupes d’animaux partageant des liens préférentiels pourrait aider à diminuer le stress lors des pratiques stressantes, par exemple lors du transport ou lors de manipulations à l’élevage (p. ex. pesées, vaccinations ; Gonyou, 2001 ; Rault, 2012).
En conclusion, il est impératif de poursuivre les recherches pour comprendre l’impact de la rupture des liens d’affinité sur l’état émotionnel des animaux en élevage et, au contraire, évaluer le bénéfice du maintien de ces liens sociaux préférentiels pour réduire le stress et améliorer le bien-être, notamment lors de pratiques stressantes. Ces travaux permettront d’optimiser les pratiques d’élevage en renforçant le rôle du soutien social pour le bien-être des animaux.
5.3. Caractérisation de la variabilité individuelle des comportements sociaux
À l’instar de nombreux comportements, le comportement social des animaux d’élevage est soumis à une grande variabilité interindividuelle. Chez le porc en engraissement, certains animaux seraient par exemple plus socialement motivés que d’autres (Hemsworth et al., 2011), et certains animaux auraient tendance à promouvoir ou limiter la cohésion sociale au sein de leur groupe via leur niveau d’expression de flairage sociaux, d’agression ou de proximité sociale (Camerlink et al., 2014). De même, certains porcs présenteraient des propensions différentes à se battre : les porcs les plus agressifs étaient les animaux les plus actifs et s’impliquant le plus dans les interactions sociales, alors que les porcs les moins agressifs étaient les animaux les moins actifs et s’impliquant peu dans les interactions sociales (Mendl et al., 1992). Récemment, nous avons mis en évidence, chez des porcelets non sevrés, l’existence de profils sociaux se distinguant par leur niveau d’engagement social, avec des animaux socialement actifs (qui émettent les interactions sociales), des animaux socialement inactifs et faiblement sollicités, et des « éviteurs » fortement sollicités, mais ne répondant pas aux sollicitations sociales. Ces profils sociaux étaient associés à des caractéristiques individuelles, comme le sexe, mais aussi le niveau général d’activité et l’état de santé (Clouard et al., 2022). Ces travaux viennent confirmer l’existence de profils sociaux contrastés, associés à des différences d’activité ou de caractéristiques individuelles déjà mis en évidence chez d’autres animaux d’élevage, comme le mouton (Miranda-de la Lama et al., 2019), la chèvre (Miranda-de la Lama et al., 2011) ou la vache (Mülleder et al., 2003). Par ailleurs, notre étude semble indiquer que certains traits sociaux, comme le niveau de « sociabilité » ou la « motivation sociale », caractérisés par les niveaux d’expression du flairage social ou du jeu social, pourraient être des traits stables et présents dès le plus jeune âge, alors que les comportements sociaux liés à la dominance ou au sexe (agression, évitement), pourraient être plus instables dans le jeune âge et acquis avec l’expérience (Turner, 2011 ; Clouard et al., 2022).
Une meilleure compréhension de la variabilité interindividuelle des comportements sociaux, et notamment des rôles sociaux, pourrait faciliter la gestion des groupes en élevage. Par exemple, Camerlink et al. (2014) ont mis en évidence l’influence de certains individus du groupe sur la cohésion sociale, mesurée par les distances interindividuelles. Ainsi, les animaux exprimant peu de flairages sociaux et caractérisés par de nombreuses lésions corporelles, une forte inactivité et un poids élevé semblaient réduire la cohésion sociale au sein du groupe, alors que des animaux qui exprimaient beaucoup de flairages sociaux et caractérisés par peu de lésions corporelles, une forte activité et un poids faible étaient plus susceptibles d’approcher leurs congénères et de favoriser la cohésion sociale. Par ailleurs, les groupes de porcs seraient également structurés autour de hiérarchies de leadership, qui est défini comme la capacité d’un animal à influencer les activités de ses congénères (Miranda-de la Lama & Mattiello, 2010). En effet, certains individus du groupe auraient tendance à initier systématiquement certaines activités, tandis que les autres membres suivent (Ewbank, 1976). Ces leaders ne seraient pas nécessairement les animaux les plus gros ou les plus dominants, mais les femelles auraient tendance à être plus souvent leaders que les mâles (Ewbank, 1976 ; Khatiwada et al., 2024). Caractériser et identifier ces animaux leaders pourrait faciliter la gestion des groupes en élevage, en facilitant par exemple l’apprentissage social par observation, lors des changements d’hébergement, pour l’utilisation des nouvelles technologies (p. ex. distributeurs automatiques d’aliment) ou pour l’acceptation d’aliments nouveaux. Chez les chèvres, par exemple, il est recommandé que les individus leaders, qui sont souvent des chèvres âgées, portent une cloche pour favoriser la cohésion du groupe lors du pâturage (Miranda-de la Lama & Mattiello, 2010)
Une meilleure caractérisation de la variabilité interindividuelle des comportements sociaux pourrait également avoir des implications pour la sélection génétique. En effet, l’identification de traits sociaux stables suggère qu’il pourrait être possible de sélectionner des animaux pour des traits sociaux désirables (ou contre des traits indésirables). Des stratégies de phénotypage génétique sur la base de critères sociaux ont déjà été développées et testées dans le but de réduire l’agressivité et les comportements sociaux indésirables dans la population, mais ces stratégies se sont révélées très coûteuses et difficilement applicables en pratique (Turner, 2011 ; Peden et al., 2018). Des solutions alternatives ont été proposées, comme la sélection génétique d’animaux sur la base d’effets génétiques indirects (Peden et al., 2018). Ces effets génétiques indirects, aussi appelés effets génétiques sociaux ou associatifs, se réfèrent aux effets génétiques qu’un individu a sur le phénotype de ses congénères, et reposent sur la théorie selon laquelle la performance d’un individu n’est pas influencée que par son propre génotype, mais également par celui des individus avec lesquels il interagit. Or, la sélection d’animaux ayant des effets génétiques indirects positifs sur la productivité pourrait également permettre de réduire des comportements sociaux indésirables, comme l’agression ou les morsures de queue à l’échelle du groupe (p. ex. Camerlink et al., 2013). Ces stratégies présentent l’avantage de ne pas nécessiter de phénotypage supplémentaire coûteux, mais les estimations de ces effets indirects ne sont pas encore clairement établies (Peden et al., 2018).
À l’instar de la sélection génétique pour la réduction de l’agressivité, l’acquisition de connaissances sur les traits de socialité pourrait permettre de sélectionner génétiquement des animaux avec des niveaux élevés de socialité, de tolérance sociale ou de coopération sociale, ce qui pourrait avoir des conséquences importantes pour leur bien-être et la productivité des filières. De meilleures aptitudes sociales pourraient donner des avantages à ces animaux, comme une meilleure résilience face aux challenges tels que les allotements, caractérisée par un niveau de stress plus faible et de meilleures performances. D’après Camerlink et al. (2014), lors des regroupements sociaux, il serait plus efficace d’avoir, au sein des groupes, des animaux qui s’adaptent bien aux challenges sociaux, notamment via de bonnes capacités à établir un ordre hiérarchique rapidement, plutôt que des niveaux faibles d’agression. La sélection génétique indirecte d’animaux présentant des niveaux de socialité favorables pourrait avoir des effets positifs sur les performances des congénères. En effet, des porcs dotés d’un profil génétique social positif auraient un effet positif sur la croissance des congénères, suggérant des effets bénéfiques à l’échelle du groupe (Nielsen et al., 2018), et ces effets seraient sous la dépendance du degré de familiarité entre les individus (Bijma, 2014)
Conclusion
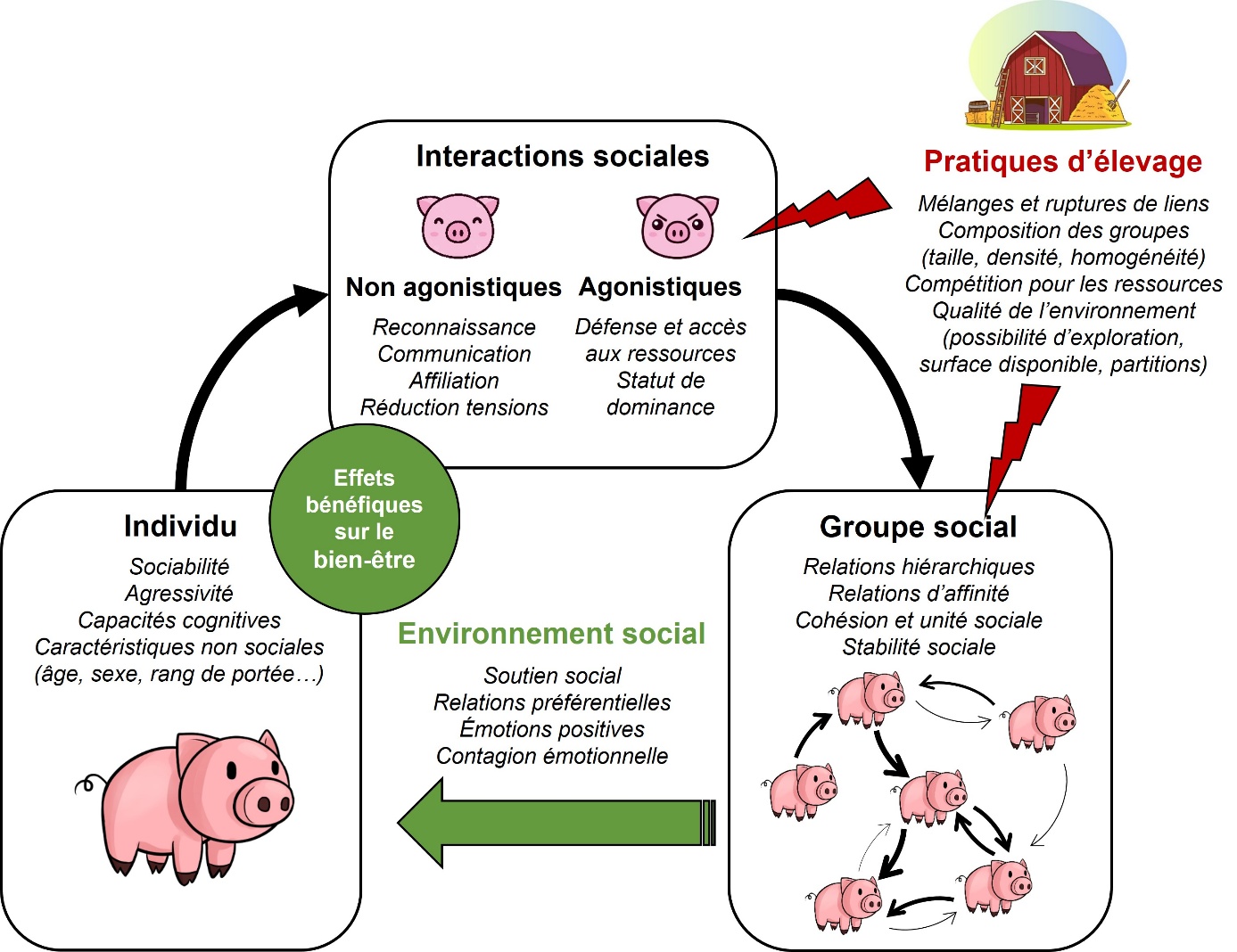
Le comportement social du porc a été largement étudié par la communauté scientifique, ce qui nous a fourni des informations essentielles pour comprendre les interactions entre comportement social, environnement social, pratiques d’élevage, et bien-être animal (figure 4). Néanmoins, les connaissances sur les interactions non agonistiques sont à approfondir, notamment pour mieux comprendre leur rôle dans la communication sociale ou dans les relations d’affinité, identifier l’impact des pratiques d’élevage sur ces comportements, et déterminer leur importance pour le maintien du bien-être animal en élevage porcin. Cette meilleure connaissance du comportement social du porc pourrait permettre d’envisager de mettre en place des pratiques de gestion innovantes en élevage. Il s’agirait par exemple d’offrir aux animaux de meilleures opportunités d’interagir positivement entre eux, de maintenir leurs liens sociaux ou de choisir leurs partenaires sociaux, ou bien de mettre en place des programmes de socialisation précoce, consistant à mélanger des portées différentes avant le sevrage, qui permettraient de favoriser le développement d’individus socialement compétents et mieux adaptés aux challenges futurs. Enfin, la possibilité pour les animaux d’exprimer un répertoire social complet, et d’évoluer au sein de groupes stables semble être primordiale pour le maintien du bien-être en élevage et doit être prise en compte lors de la conception des systèmes de demain.
Remerciements
Je remercie vivement Elodie Merlot et Armelle Prunier pour leur relecture attentive de cette synthèse et leurs suggestions pertinentes, ainsi que les deux relecteurs anonymes pour leurs commentaires éclairés. L’ensemble de ces retours a fortement contribué à améliorer la qualité de l’article.
Notes
- 1.
Références
- Andersen, I. L., Andenæs, H., Bøe, K. E., Jensen, P., & Bakken, M. (2000). The effects of weight asymmetry and resource distribution on aggression in groups of unacquainted pigs. Applied Animal Behaviour Science, 68(2), 107-120. doi:10.1016/s0168-1591(00)00092-7
- ANSES. (2018). Bien-être animal : contexte, définition et évaluation (Avis de l’ANSES, saisine no 2016-SA-0288). Agence nationale de sécurité sanitaire de l’alimentation de l’environnement et du travail. https://www.anses.fr/fr/content/avis-de-lanses-relatif-au-bien-etre-animal-contexte-definition-et-evaluation
- Beattie, V. E., O’Connell, N. E., & Moss, B. W. (2000). Influence of environmental enrichment on the behaviour, performance and meat quality of domestic pigs. Livestock Production Science, 65(1-2), 71-79. doi:10.1016/S0301-6226(99)00179-7
- Bekoff, M. (1984). Social Play Behavior. BioScience, 34(4), 228-233. doi:10.2307/1309460
- Bijma, P. (2014). The quantitative genetics of indirect genetic effects: a selective review of modelling issues. Heredity, 112(1), 61-69. doi:10.1038/hdy.2013.15
- Boissy, A., & Le Neindre, P. (1990). Social influences on the reactivity of heifers: Implications for learning abilities in operant conditioning. Applied Animal Behaviour Science, 25(1-2), 149-165. doi:10.1016/0168-1591(90)90077-Q
- Boissy, A., Manteuffel, G., Jensen, M. B., Moe, R. O., Spruijt, B., Keeling, L. J., Winckler, C., Forkman, B., Dimitrov, I., Langbein, J., Bakken, M., Veissier, I., & Aubert, A. (2007). Assessment of positive emotions in animals to improve their welfare. Physiology & Behavior, 92(3), 375-397. doi:10.1016/j.physbeh.2007.02.003
- Bolhuis, J. E., Schouten, W. G. P., Schrama, J. W., & Wiegant, V. M. (2005). Behavioural development of pigs with different coping characteristics in barren and substrate-enriched housing conditions. Applied Animal Behaviour Science, 93(3-4), 213-228. doi:10.1016/j.applanim.2005.01.006
- Brent, L. J. N., Chang, S. W. C., Gariépy, J.-F., & Platt, M. L. (2014). The neuroethology of friendship. Annals of the New York Academy of Sciences, 1316(1), 1-17. doi:10.1111/nyas.12315
- Bulens, A., Van Beirendonck, S., Van Thielen, J., Buys, N., & Driessen, B. (2017). Hiding walls for fattening pigs: Do they affect behavior and performance? Applied Animal Behaviour Science, 195, 32-37. doi:10.1016/j.applanim.2017.06.009
- Camerlink, I., & Turner, S. P. (2013). The pig’s nose and its role in dominance relationships and harmful behaviour. Applied Animal Behaviour Science, 145(3-4), 84-91. doi:10.1016/j.applanim.2013.02.008
- Camerlink, I., Turner, S. P., Bijma, P., & Bolhuis, J. E. (2013). Indirect genetic effects and housing conditions in relation to aggressive behaviour in pigs. PLoS ONE, 8(6), e65136. doi:10.1371/journal.pone.0065136
- Camerlink, I., Turner, S. P., Ursinus, W. W., Reimert, I., & Bolhuis, J. E. (2014). Aggression and affiliation during social conflict in pigs. PLoS ONE, 9(11), e113502. doi:10.1371/journal.pone.0113502
- Camerlink, I., Reimert, I., & Bolhuis, J. E. (2016). Intranasal oxytocin administration in relationship to social behaviour in domestic pigs. Physiology & Behavior, 163, 51-55. doi:10.1016/j.physbeh.2016.04.054
- Camerlink, I., Proßegger, C., Kubala, D., Galunder, K., & Rault, J.-L. (2021). Keeping littermates together instead of social mixing benefits pig social behaviour and growth post-weaning. Applied Animal Behaviour Science, 235, 105230. doi:10.1016/j.applanim.2021.105230
- Camerlink, I., Scheck, K., Cadman, T., & Rault, J.-L. (2022). Lying in spatial proximity and active social behaviours capture different information when analysed at group level in indoor-housed pigs. Applied Animal Behaviour Science, 246, 105540. doi:10.1016/j.applanim.2021.105540
- Clouard, C., & Bolhuis, J. E. (2017). Olfactory behaviour in farm animals. In B. L. Nielsen (Ed.) Olfaction in animal behaviour and welfare (161-175). CABI Books. https://doi.org/10.1079/9781786391599.0161
- Clouard, C., Resmond, R., Prunier, A., Tallet, C., & Merlot, E. (2022). Exploration of early social behaviors and social styles in relation to individual characteristics in suckling piglets. Scientific Reports, 12(1), 2318. doi:10.1038/s41598-022-06354-w
- Clouard, C., Resmond, R., Vesque-Annear, H., Prunier, A., & Merlot, E. (2023). Pre-weaning social behaviours and peripheral serotonin levels are associated with behavioural and physiological responses to weaning and social mixing in pigs. Applied Animal Behaviour Science, 259, 105833. doi:10.1016/j.applanim.2023.105833
- Clouard, C., Chambeaud, J., & Merlot, E. (2024a). Exploration of positive social relationships in group-housed gestating sows. 9th International Conference on the Welfare Assessment of Animals at Farm Level (WAFL), Florence Italy. https://hal.science/hal-04693554v1
- Clouard, C., Foreau, A., Goumon, S., Tallet, C., Merlot, E., & Resmond, R. (2024b). Evidence of stable preferential affiliative relationships in the domestic pig. Animal Behaviour, 213, 95-105. doi:10.1016/j.anbehav.2024.04.009
- Cohen, S., & Wills, T. A. (1985). Stress, social support, and the buffering hypothesis. Psychological Bulletin, 98(2), 310-357. doi:10.1037/0033-2909.98.2.310
- D’Eath, R. B. (2005). Socialising piglets before weaning improves social hierarchy formation when pigs are mixed post-weaning. Applied Animal Behaviour Science, 93(3-4), 199-211. doi:10.1016/j.applanim.2004.11.019
- Dobao, M. T., Rodrigañez, J., & Silio, L. (1985). Choice of companions in social play in piglets. Applied Animal Behaviour Science, 13(3), 259-266. doi:10.1016/0168-1591(85)90049-8
- Durrell, J. L., Sneddon, I. A., O’Connell, N. E., & Whitehead, H. (2004). Do pigs form preferential associations? Applied Animal Behaviour Science, 89(1-2), 41-52. doi:10.1016/j.applanim.2004.05.003
- Estevez, I., Andersen, I.-L., & Nævdal, E. (2007). Group size, density and social dynamics in farm animals. Applied Animal Behaviour Science, 103(3-4), 185-204. doi:10.1016/j.applanim.2006.05.025
- Ewbank, R. (1976). Social hierarchy in suckling and fattening pigs: A review. Livestock Production Science, 3(4), 363-372. doi:10.1016/0301-6226(76)90070-1
- Farm Animal Welfare Council. (1993). Second report on priorities for research and development in farm animal welfare. Department of Environment, Food and Rural Affairs.
- Ferguson, J. N., Aldag, J. M., Insel, T. R., & Young, L. J. (2001). Oxytocin in the medial amygdala is essential for social recognition in the mouse. The Journal of Neuroscience, 21(20), 8278-8285. doi:10.1523/JNEUROSCI.21-20-08278.2001
- Foris, B., Haas, H.-G., Langbein, J., & Melzer, N. (2021). Familiarity influences social networks in dairy cows after regrouping. Journal of Dairy Science, 104(3), 3485-3494. doi:10.3168/jds.2020-18896
- Gonyou, H. W. (2001). The social behaviour of pigs. In L. J. Keeling & H. W. Gonyou (Eds.), Social behaviour in farm animals (pp. 147-176). CABI Books. https://doi.org/10.1079/9780851993973.0147
- Goumon, S., Illmann, G., Leszkowová, I., Dostalová, A., & Cantor, M. (2020). Dyadic affiliative preferences in a stable group of domestic pigs. Applied Animal Behaviour Science, 230, 105045. doi:10.1016/j.applanim.2020.105045
- Graves, H. B. (1984). Behavior and ecology of wild and feral swine (Sus Scrofa). Journal of Animal Science, 58(2), 482-492. doi:10.2527/jas1984.582482x
- Hellekant, G., & Danilova, V. (1999). Taste in domestic pig, Sus scrofa. Journal of Animal Physiology and Animal Nutrition, 82(1), 8-24. doi:10.1046/j.1439-0396.1999.00206.x
- Hemsworth, P. H., Smith, K., Karlen, M. G., Arnold, N. A., Moeller, S. J., & Barnett, J. L. (2011). The choice behaviour of pigs in a Y maze: Effects of deprivation of feed, social contact and bedding. Behavioural Processes, 87(2), 210-217. doi:10.1016/j.beproc.2011.03.007
- Horback, K. (2014). Nosing around: play in pigs. Animal Behavior and Cognition, 1(2), 186-196. doi:10.12966/abc.05.08.2014
- Hötzel, M. J., Pinheiro Machado, L. C., Wolf, F. M., & Costa, O. A. D. (2004). Behaviour of sows and piglets reared in intensive outdoor or indoor systems. Applied Animal Behaviour Science, 86(1-2), 27-39. doi:10.1016/j.applanim.2003.11.014
- Jensen, P. (1980). An ethogram of social interaction patterns in group-housed dry sows. Applied Animal Ethology, 6(4), 341-350. doi:10.1016/0304-3762(80)90134-0
- Jensen, P. (1986). Observations on the maternal behaviour of free-ranging domestic pigs. Applied Animal Behaviour Science, 16(2), 131-142. doi:10.1016/0168-1591(86)90105-X
- Jensen, P. (1988). Maternal behaviour and mother–Young interactions during lactation in free-ranging domestic pigs. Applied Animal Behaviour Science, 20(3-4), 297-308. doi:10.1016/0168-1591(88)90054-8
- Jensen, P., & Recén, B. (1989). When to wean – Observations from free-ranging domestic pigs. Applied Animal Behaviour Science, 23(1-2), 49-60. doi:10.1016/0168-1591(89)90006-3
- Jensen, P., Stangel, G., & Algers, B. (1991). Nursing and suckling behaviour of semi-naturally kept pigs during the first 10 days postpartum. Applied Animal Behaviour Science, 31(3-4), 195-209. doi:10.1016/0168-1591(91)90005-I
- Jensen, P., & Stangel, G. (1992). Behaviour of piglets during weaning in a seminatural enclosure. Applied Animal Behaviour Science, 33(2-3), 227-238. doi:10.1016/S0168-1591(05)80010-3
- Jones, J. B., Wathes, C. M., Persaud, K. C., White, R. P., & Jones, R. B. (2001). Acute and chronic exposure to ammonia and olfactory acuity for n-butanol in the pig. Applied Animal Behaviour Science, 71(1), 13-28. doi:10.1016/s0168-1591(00)00168-4
- Kanitz, E., Hameister, T., Tuchscherer, M., Tuchscherer, A., & Puppe, B. (2014). Social support attenuates the adverse consequences of social deprivation stress in domestic piglets. Hormones and Behavior, 65(3), 203-210. doi:10.1016/j.yhbeh.2014.01.007
- Khatiwada, S., Turner, S. P., Farish, M., & Camerlink, I. (2024). Leadership amongst pigs when faced with a novel situation. Behavioural Processes, 222, 105099. doi:10.1016/j.beproc.2024.105099
- Kristensen, H. H., Jones, R. B., Schofield, C. P., White, R. P., & Wathes, C. M. (2001). The use of olfactory and other cues for social recognition by juvenile pigs. Applied Animal Behaviour Science, 72(4), 321-333. doi:10.1016/s0168-1591(00)00209-4
- Lanthony, M., Danglot, M., Špinka, M., & Tallet, C. (2022). Dominance hierarchy in groups of pregnant sows: Characteristics and identification of related indicators. Applied Animal Behaviour Science, 254, 105683. doi:10.1016/j.applanim.2022.105683
- Lopes, M. M., Clouard, C., Chambeaud, J., Brien, M., Villain, N., Gerard, C., Herault, F., Vincent, A., Louveau, I., Resmond, R., & Merlot, E. (2023). Impact de l’enrichissement du milieu de vie des truies gestantes sur leur comportement et la réponse transcriptionnelle de leurs cellules immunitaires sanguines. 55e Journées de la Recherche Porcine, Saint-Malo. doi:10.1016/j.anscip.2023.06.012
- Makagon, M. M., McCowan, B., & Mench, J. A. (2012). How can social network analysis contribute to social behavior research in applied ethology? Applied Animal Behaviour Science, 138(3-4), 152-161. doi:10.1016/j.applanim.2012.02.003
- Meese, G. B., & Ewbank, R. (1973). The establishment and nature of the dominance hierarchy in the domesticated pig. Animal Behaviour, 21(2), 326-334. doi:10.1016/S0003-3472(73)80074-0
- Mendl, M., Zanella, A. J., & Broom, D. M. (1992). Physiological and reproductive correlates of behavioural strategies in female domestic pigs. Animal Behaviour, 44(6), 1107-1121. doi:10.1016/S0003-3472(05)80323-9
- Metz, J. H. M., & Gonyou, H. W. (1990). Effect of age and housing conditions on the behavioural and haemolytic reaction of piglets to weaning. Applied Animal Behaviour Science, 27(4), 299-309. doi:10.1016/0168-1591(90)90126-X
- Miranda-de la Lama, G. C., & Mattiello, S. (2010). The importance of social behaviour for goat welfare in livestock farming. Small Ruminant Research, 90(1-3), 1-10. doi:10.1016/j.smallrumres.2010.01.006
- Miranda-de la Lama, G. C., Sepúlveda, W. S., Montaldo, H. H., María, G. A., & Galindo, F. (2011). Social strategies associated with identity profiles in dairy goats. Applied Animal Behaviour Science, 134(1-2), 48-55. doi:10.1016/j.applanim.2011.06.004
- Miranda-de la Lama, G. C., Pascual-Alonso, M., Aguayo-Ulloa, L., Sepúlveda, W. S., Villarroel, M., & María, G. A. (2019). Social personality in sheep: Can social strategies predict individual differences in cognitive abilities, morphology features, and reproductive success? Journal of Veterinary Behavior, 31, 82-91. doi:10.1016/j.jveb.2019.03.005
- Mülleder, C., Palme, R., Menke, C., & Waiblinger, S. (2003). Individual differences in behaviour and in adrenocortical activity in beef-suckler cows. Applied Animal Behaviour Science, 84(3), 167-183. doi:10.1016/j.applanim.2003.08.007
- Newberry, R. C., & Wood-Gush, D. G. M. (1985). The suckling behaviour of domestic pigs in a semi-natural environment. Behaviour, 95(1-2), 11-25. doi:10.1163/156853985x00028
- Newberry, R. C., & Wood-Gush, D. G. M. (1986). Social relationships of piglets in a semi-natural environment. Animal Behaviour, 34(5), 1311-1318. doi:10.1016/S0003-3472(86)80202-0
- Newberry, R. C., Wood-Gush, D. G. M., & Hall, J. W. (1988). Playful behaviour of piglets. Behavioural Processes, 17(3), 205-216. doi:10.1016/0376-6357(88)90004-6
- Nielsen, H. M., Ask, B., & Madsen, P. (2018). Social genetic effects for growth in pigs differ between boars and gilts. Genetics Selection Evolution, 50(1), 4. doi:10.1186/s12711-018-0375-0
- O’Connor, E. A., Parker, M. O., McLeman, M. A., Demmers, T. G., Lowe, J. C., Cui, L., Davey, E. L., Owen, R. C., Wathes, C. M., & Abeyesinghe, S. M. (2010). The impact of chronic environmental stressors on growing pigs, Sus scrofa (Part 1): stress physiology, production and play behaviour. Animal, 4(11), 1899-1909. doi:10.1017/S1751731110001072
- Oostindjer, M., van den Brand, H., Kemp, B., & Bolhuis, J. E. (2011). Effects of environmental enrichment and loose housing of lactating sows on piglet behaviour before and after weaning. Applied Animal Behaviour Science, 134(1-2), 31-41. doi:10.1016/j.applanim.2011.06.011
- Parker, M. O., O’Connor, E. A., McLeman, M. A., Demmers, T. G. M., Lowe, J. C., Owen, R. C., Davey, E. L., Wathes, C. M., & Abeyesinghe, S. M. (2010). The impact of chronic environmental stressors on growing pigs, Sus scrofa (Part 2): social behaviour. Animal, 4(11), 1910-1921. doi:10.1017/S1751731110001084
- Pearce, E., Wlodarski, R., Machin, A., & Dunbar, R. I. M. (2017). Variation in the β-endorphin, oxytocin, and dopamine receptor genes is associated with different dimensions of human sociality. Proceedings of the National Academy of Sciences, 114(20), 5300-5305. doi:10.1073/pnas.1700712114
- Peden, R. S. E., Turner, S. P., Boyle, L. A., & Camerlink, I. (2018). The translation of animal welfare research into practice: The case of mixing aggression between pigs. Applied Animal Behaviour Science, 204, 1-9. doi:10.1016/j.applanim.2018.03.003
- Petersen, H. V., Vestergaard, K., & Jensen, P. (1989). Integration of piglets into social groups of free-ranging domestic pigs. Applied Animal Behaviour Science, 23(3), 223-236. doi:10.1016/0168-1591(89)90113-5
- Podgórski, T., Lusseau, D., Scandura, M., Sönnichsen, L., & Jędrzejewska, B. (2014). Long-lasting, kin-directed female interactions in a spatially structured wild boar social network. PLoS ONE, 9(6), e99875. doi:10.1371/journal.pone.0099875
- Puppe, B., Langbein, J., Bauer, J., & Hoy, S. (2008). A comparative view on social hierarchy formation at different stages of pig production using sociometric measures. Livestock Science, 113(2-3), 155-162. doi:10.1016/j.livsci.2007.03.004
- Rault, J.-L. (2012). Friends with benefits: Social support and its relevance for farm animal welfare. Applied Animal Behaviour Science, 136, 1-14. doi:10.1016/j.applanim.2011.10.002
- Rault, J.-L. (2016a). Social interaction patterns according to stocking density and time post-mixing in group-housed gestating sows. Animal Production Science, 57(5), 896-902. doi:10.1071/AN15415
- Rault, J.-L. (2016b). Effects of positive and negative human contacts and intranasal oxytocin on cerebrospinal fluid oxytocin. Psychoneuroendocrinology, 69, 60-66. doi:10.1016/j.psyneuen.2016.03.015
- Rault, J.-L. (2019). Be kind to others: Prosocial behaviours and their implications for animal welfare. Applied Animal Behaviour Science, 210, 113-123. doi:10.1016/j.applanim.2018.10.015
- Rault, J.-L., Newberry, R. C., & Šemrov, M. Z. (2023). Editorial: Positive welfare: from concept to implementation. Frontiers in Animal Science, 4. doi:10.3389/fanim.2023.1289659
- Rault, J.-L., Bateson, M., Boissy, A., Forkman, B., Grinde, B., Gygax, L., Harfeld, J. L., Hintze, S., Keeling, L. J., Kostal, L., Lawrence, A. B., Mendl, M. T., Miele, M., Newberry, R. C., Sandøe, P., Špinka, M., Taylor, A. H., Webb, L. E., Whalin, L., & Jensen, M. B. (2025). A consensus on the definition of positive animal welfare. Biology Letters, 21(1), 20240382. doi:10.1098/rsbl.2024.0382
- Reinhardt, V., & Reinhardt, A. (1981). Cohesive relationships in a cattle herd (Bos indicus). Behaviour, 77(3), 121-151. doi:10.1163/156853981x00194
- Salazar, L. C., Ko, H.-L., Yang, C.-H., Llonch, L., Manteca, X., Camerlink, I., & Llonch, P. (2018). Early socialisation as a strategy to increase piglets’ social skills in intensive farming conditions. Applied Animal Behaviour Science, 206, 25-31. doi:10.1016/j.applanim.2018.05.033
- Samarakone, T. S., & Gonyou, H. W. (2009). Domestic pigs alter their social strategy in response to social group size. Applied Animal Behaviour Science, 121(1), 8-15. doi:10.1016/j.applanim.2009.08.006
- Singh, C., Verdon, M., Cronin, G. M., & Hemsworth, P. H. (2017). The behaviour and welfare of sows and piglets in farrowing crates or lactation pens. Animal, 11(7), 1210-1221. doi:10.1017/S1751731116002573
- Špinka, M. (2009). Behaviour of pigs. In P. Jensen (Ed.), The ethology of domestic animals: an introductory text, modular texts (pp. 177-191), CABI Books. https://doi.org/10.1079/9781845935368.0177
- Spruijt, B. M., van Hooff, J. A., & Gispen, W. H. (1992). Ethology and neurobiology of grooming behavior. Physiological Reviews, 72(3), 825-852. doi:10.1152/physrev.1992.72.3.825
- Stolba, A., & Wood-Gush, D. G. M. (1989). The behaviour of pigs in a semi-natural environment. Animal Science, 48(2), 419-425. doi:10.1017/S0003356100040411
- Stookey, J. M., & Gonyou, H. W. (1998). Recognition in swine: Recognition through familiarity or genetic relatedness? Applied Animal Behaviour Science, 55(3-4), 291-305. doi:10.1016/S0168-1591(97)00046-4
- Temple, D., Manteca, X., Velarde, A., & Dalmau, A. (2011). Assessment of animal welfare through behavioural parameters in Iberian pigs in intensive and extensive conditions. Applied Animal Behaviour Science, 131(1-2), 29-39. doi:10.1016/j.applanim.2011.01.013
- Thorpe, W. H. (1969). Welfare of domestic animals. Nature, 224(5214), 18-20. doi:10.1038/224018a0
- Turner, S. P. (2011). Breeding against harmful social behaviours in pigs and chickens: State of the art and the way forward. Applied Animal Behaviour Science, 134(1-2), 1-9. doi:10.1016/j.applanim.2011.06.001
- Val-Laillet, D., Guesdon, V., von Keyserlingk, M. A. G., de Passillé, A. M., & Rushen, J. (2009). Allogrooming in cattle: Relationships between social preferences, feeding displacements and social dominance. Applied Animal Behaviour Science, 116(2-4), 141-149. doi:10.1016/j.applanim.2008.08.005
- van Nieuwamerongen, S. E., Soede, N. M., van der Peet-Schwering, C. M. C., Kemp, B., & Bolhuis, J. E. (2015). Development of piglets raised in a new multi-litter housing system vs. conventional single-litter housing until 9 weeks of age. Journal of Animal Science, 93(11), 5442-5454. doi:10.2527/jas.2015-9460
- Verdon, M., Morrison, R. S., & Rault, J.-L. (2020). The welfare and productivity of sows and piglets in group lactation from 7, 10, or 14 d postpartum. Journal of Animal Science, 98(3), skaa037. doi:10.1093/jas/skaa037
- Wasserman, S., & Faust, K. (1994). Social network analysis: methods and applications. Cambridge University Press. https://doi.org/10.1017/CBO9780511815478
- Weller, J. E., Camerlink, I., Turner, S. P., Farish, M., & Arnott, G. (2019). Socialisation and its effect on play behaviour and aggression in the domestic pig (Sus scrofa). Scientific Reports, 9(1), 4180. doi:10.1038/s41598-019-40980-1
- Whatson, T. S., & Bertram, J. M. (1983). Some observations on mother-infant interactions in the pig (Sus scrofa). Applied Animal Ethology, 9(3-4), 253-261. doi:10.1016/0304-3762(83)90005-6
- Whitehead, H. (2008). Analyzing animal societies: quantitative methods for vertebrate social analysis. University of Chicago Press. https://doi.org/10.7208/chicago/9780226895246.001.0001
Résumé
Le porc est une espèce sociale, qui évolue au sein de groupes dont la structure hiérarchique est régulée par un ensemble d’interactions agonistiques, comme les agressions, et non agonistiques, comme les contacts du groin. Cette revue vise à i) faire un bilan des connaissances sur le comportement social du porc domestique, ii) décrire l’impact de certaines pratiques d’élevage sur l’expression de ces comportements, et iii) proposer des perspectives de recherche sur le comportement social pour améliorer le bien-être animal en élevage. De nombreuses conditions et pratiques d’élevage, comme les allotements successifs, la constitution de groupes de taille ou de composition inadéquates, et des infrastructures inadaptées, impactent les comportements et les relations sociales entre les porcs. Jusqu’à récemment, la recherche sur le comportement social du porc s’était principalement focalisée sur les interactions agonistiques. Ainsi, leur rôle dans les relations de dominance et la défense des ressources, ainsi que l’impact des pratiques d’élevage sur ces comportements, ont été particulièrement bien caractérisés. Au contraire, les comportements non agonistiques ont reçu un intérêt beaucoup plus récent. Pourtant, leur prévalence est bien plus élevée que celle des comportements agonistiques, et ils seraient impliqués dans de nombreux processus biologiques, comme la reconnaissance et la communication sociale, l’affinité ou la réduction du stress. En favorisant des états mentaux positifs, ces comportements pourraient être d’une importance capitale pour le maintien du bien-être des porcs en élevage, et il est nécessaire de mieux comprendre leurs fonctions et déterminants. Ces connaissances devraient être prises en compte pour faire évoluer les pratiques dans les systèmes d’élevage.
Pièces jointes
Pas de document complémentaire pour cet articleStatistiques de l'article
 Vues: 2202
Vues: 2202
Téléchargements
 PDF: 354
PDF: 354
 XML: 71
XML: 71

