Intérêts des cultures in vitro de cellules souches et d’organoïdes dans le cadre d’études toxicologiques (Full text available in English)
Chapeau
Les approches biologiques et notamment toxicologiques sont rendues difficiles que ce soit avec l’utilisation des modèles animaux ou avec les études sur des lignées cellulaires. Premièrement les réponses des modèles animaux peuvent être très éloignées de l’espèce pour laquelle est faite l’étude et deuxièmement les lignées cellulaires, qui sont par nature transformées, peuvent également donner des réponses éloignées de la physiologie. L’utilisation des cellules souches et des organoïdes in vitro est prometteuse pour répondre à certaines de ces difficultés.
Introduction
La toxicité de notre environnement et son impact sur la santé préoccupent de plus en plus la population. Une intoxication correspond à une « introduction ou bio-accumulation d’une substance toxique dans l’organisme » : le but de la toxicologie est donc de comprendre et de prédire les effets indésirables des médicaments et autres xénobiotiques. Un xénobiotique est défini comme une molécule présente dans un organisme vivant mais qui lui est étrangère ; il n’est ni produit par l’organisme lui-même ni par l’intermédiaire de son alimentation naturelle. Un xénobiotique peut être capable de perturber le fonctionnement normal d’un individu et de conduire à un effet nocif pour l’organisme. Ces substances peuvent être des polluants de l’environnement, des additifs alimentaires ou encore des médicaments.
Les nombreux polluants de l'environnement auxquels nous sommes exposés peuvent intégrer la chaîne trophique, notamment les plantes, puis les prédateurs primaires et secondaires, catégorie à laquelle l'être humain appartient. Parmi ces toxiques environnementaux figurent les Polluants Organiques Persistants, tels que les polychlorobiphényles (PCB) et les dioxines. Ces molécules s'accumulent au niveau cellulaire, notamment au niveau des adipocytes ce qui rend leur élimination très difficile (La Rocca et Mantovani, 2006). D'autres types de polluants, comme les métaux lourds et les pesticides, peuvent également poser des problèmes sanitaires. Les toxiques naturels peuvent aussi poser des problèmes comme par exemple les empoisonnements plus fréquents aux toxines produites par les cyanobactéries qui explosent avec le réchauffement climatique (Abeysiriwardena et al., 2018).
Les médicaments sont également considérés comme des xénobiotiques et sont donc fortement concernés par les études toxicologiques. En effet, les médicaments sont par essence des substances bioactives qui peuvent être toxiques lorsqu'elles ne sont pas utilisées à bon escient ou pas adaptées à l'organisme cible. Ainsi, les substances développées pour l'espèce humaine ne sont pas forcément, loin s'en faut, compatibles avec un usage vétérinaire. Les médicaments que l'on achète en vente libre peuvent être très dangereux pour les animaux de compagnie. L'aspirine, l'ibuprofen sont deux exemples de composés pharmaceutiques très toxiques chez le chat et le chien puisqu'ils peuvent conduire jusqu'au coma. Les enzymes dégradant les molécules dans l'organisme ne sont peu ou pas présentes chez ces espèces : avec des doses aussi faibles que 50 mg/kg de sévères complications au foie et aux reins peuvent advenir chez le chien (Tauk et Foster, 2016). Un autre exemple concret de différences inter-espèces de susceptibilité est celui des souris chargées au paracétamol placées sur l'île de Guam pour réduire considérablement le nombre de spécimen de serpent Boiga irregularis (Johnston et al., 2002).
Les études toxicologiques sont donc nécessaires pour évaluer le bénéfice-risque des futurs médicaments et l’éventuelle toxicité des pesticides sur les espèces non-cibles avant ou après leur mise sur le marché.
D’un point de vue éthique, les xénobiotiques ne peuvent être testés chez l’humain. Seules des évaluations cliniques, des tests psychométriques ou neurosensoriels, des examens électrophysiologiques ou d’imagerie peuvent être réalisés. Ainsi diverses approches expérimentales ont été développées à savoir les modèles in vivo, in vitro et in silico.
Les modèles in silico sont des expérimentations par ordinateur : elles stockent, compulsent, échangent et utilisent des informations provenant d'expériences in vitro et in vivo précédemment effectuées. De telles méthodes numériques permettent de prédire la toxicocinétique d'une molécule tout en réduisant le coût et la durée des études. Différents modèles in silico ont ainsi été mis en place pour décrire la relation entre la structure chimique et l'activité d'un composé à savoir les modèles de relation structure-activité (SAR, Structure–Activity Relationship et les modèles quantitatifs de relation structure-activité (QSAR, Quantitative Structure–Activity Relationship). Dans le modèle de toxicocinétique classique ou mono-compartimental il est possible de prédire la concentration du toxique en fonction du temps et de la dose d'exposition. Dans le modèle de pharmacocinétique basée sur la physiologie (PBPK pour Physiologically Based Pharmaco Kinetic modelling), il est nécessaire de se reposer sur une connaissance réelle du système en subdivisant l'organisme en compartiments reliés entre eux par un fluide circulant (Coumoul et al., 2023).
Les modèles in vivo les plus utilisés sont le rat, la souris, le lapin, le cochon d'Inde, le cochon nain car ils présentent des similitudes physiologiques et moléculaires avec l'humain. Néanmoins, les effets d'une substance toxique peuvent varier en fonction du temps d'exposition, de la dose et de la voie d'exposition. En accord avec les lignes directrices de l'OCDE, quatre protocoles sont mis en place dans les études toxicologiques pour tester : la toxicité aigüe, la toxicité subaigüe, la toxicité sub-chronique, et la toxicité chronique (Coumoul et al., 2023). Pour les médicaments et l'Autorisation de la Mise sur le Marché (AMM) les essais pré-cliniques sont conduits sur des organismes modèles (le plus souvent rongeurs) dans des conditions expérimentales et les essais cliniques sont réalisés sur l'espèce cible.
L’expérimentation animale permet d’étudier sur un même individu les effets d’une molécule toxique sur la physiologie et le métabolisme dans son ensemble pouvant prédire la toxicité chez l’humain. L’impact toxicologique d’une substance est généralement étudié suivant le concept d’ADME : l’Absorption, la Distribution dans l’organisme, la Métabolisation et l’Élimination. Ces processus reflètent la capacité d’un organisme à gérer un xénobiotique, à le bio-accumuler ou à l’éliminer. D’un individu à un autre et d’une espèce à une autre, les variations peuvent être importantes et donc engendrer une réponse différente de l’organisme à un toxique ou traitement médicamenteux.
Ces tests in vivo nécessitent un grand nombre d'animaux et dans le cadre de la protection animale, le principe des 3R (Replace/Reduce/Refine) défini en 1959 par Russell et Burch, est devenu est un des principes fondamentaux de recherche sous-tendu par les exigences de la directive 2010/63/CE1. Cette règle des 3R consiste donc à remplacer l'expérimentation animale dès que possible et à optimiser les méthodologies employées à cette fin pour garantir un niveau de résultats scientifiques élevé. De plus, la réglementation européenne REACH (Registration, Evaluation, Authorisation and restriction of CHemicals) pour l'enregistrement, l'évaluation, l'autorisation et la restriction des substances chimiques favorise également les méthodes in vitro et in silico (Jean-Quartier et al., 2018).
C’est dans ce contexte que se place toute l’importance des méthodes in vitro qui se sont développées au cours des dernières décennies. Il existe deux grands modèles de culture cellulaire pour tester la toxicologie de xénobiotiques.
Les cultures primaires dérivent directement de cellules issues d’un organisme. Ces cellules sont isolées par dissociation mécanique et /ou chimiques notamment grâce à des enzymes. Elles ont un nombre de divisions cellulaires limitées, ce qui rend ces modèles de culture assez proches de l’état physiologique des cellules dans l’organisme. Parmi les cultures primaires, les cultures de cellules souches sont un outil précieux notamment en médecine. En effet ce sont des cellules indifférenciées et pluripotentes qui peuvent donner différents types de cellules selon les milieux de culture. Ce type de culture a connu une forte expansion avec les cellules souches pluripotentes induites (iPSC) : ces cellules découvertes en 2006 par Shinya Yamanaka (prix Nobel de médecine en 2012) permettent l’obtention de différents types cellulaires à partir cette fois d’une cellule somatique unique. Quant aux lignées cellulaires, elles dérivent de cellules cancéreuses ou ont été immortalisées par transfection d’un oncogène viral à partir de culture primaire. Dans ce cas, le nombre de divisions cellulaires est proche de l’infini et la même culture peut être entretenue longtemps sans risque de dérives. Elles permettent d’obtenir des résultats plus reproductibles, rapidement et ce à moindre coût.
Il existe différents types de méthode de culture : les cultures en monocouches de cellules en deux dimensions (2D) et les cultures en 3 dimensions (3D). Si la culture en 2D favorise la prolifération et donc son étude, elle ne reproduit pas l'ensemble des conditions de l'organisme vivant (Yamada et Cukierman, 2007 ; Costa et al., 2016). La culture en 3D permet de mieux préserver la différenciation cellulaire via les interactions avec l'environnement. Des modèles de co-culture en 3D permettent l'association de différents types cellulaires favorisant les interactions et les communications intercellulaires normalement présentes in vivo. Grâce à ces modèles in vitro de nombreux paramètres toxicologiques peuvent être évalués pour étudier l'impact d'une molécule et ainsi déterminer la cytotoxicité, la génotoxicité, les modifications du métabolisme énergétique ou encore des processus de différenciation. L'utilisation de lignées humaines permet l'extrapolation des données à l'humain.
Ainsi, parmi ces différents modèles cellulaires, les cultures primaires de cellules souches ou la culture d’organoïdes (cf. paragraphe 2) apparaissent comme de bons compromis : d’une part pour réduire le nombre d’animaux, d’autre part pour réduire certains biais expérimentaux. Ces modèles de cultures cellulaires sont particulièrement intéressants pour l’étude des effets toxiques des polluants environnementaux et des mécanismes cellulaires sous-jacents.
1. La toxicologie et les polluants environnementaux
Approches méthodologiques
Depuis le 20ème siècle, de nombreux scandales sanitaires ont permis la mise en place de règlementations plus contraignantes vis-à-vis des xénobiotiques tels que les métaux lourds comme le mercure, les pesticides comme le glyphosate ou encore les perturbateurs endocriniens, comme les phtalates. Devant la multiplicité des substances chimiques à évaluer et la nécessité de limiter le recours à l’expérimentation animale, les concepts ont évolué. La toxicologie intègre maintenant de nouveaux paramètres permettant une évaluation plus fine des risques liés à notre environnement tels que les relations dose-réponse (LOAEL : Lowest Observed Adverse Effect Level ; NOAEL : No Observable Adverse Effect Level) ainsi que les Valeurs Toxicologiques de Référence (VTR). On s’est également orienté vers un cadre de toxicologie/écotoxicologie prédictive : le but étant d’établir des relations de causalité crédibles et de développer des outils/modèles quantitatifs d’extrapolation. C’est dans cette démarche que s’est développé le concept d’Adverse Outcome Pathways (AOP) ou « voie de signalisation néfaste » en français.
La notion d'AOP est une construction conceptuelle (figure 1) décrivant les connaissances existantes concernant le lien causal entre un événement moléculaire déclencheur direct et la production d'un effet défavorable pour un individu (Ankley et al., 2010).
Un AOP correspond donc à une série d'évènements concernant les différents niveaux biologiques : moléculaire, cellulaire, tissulaire à l'échelle individuelle ou populationnelle. Elle permet de caractériser, d'organiser et de définir des relations prédictives entre des évènements clés et des effets indésirables pertinents pour l'évaluation du risque. L'information peut être basée sur des modèles in vitro, in vivo, ou in silico (Ankley et al., 2010 ; Coumoul et al., 2023). Ce concept d'AOP permet d'identifier plus rapidement les tests à réaliser in vitro ou in vivo : 3 la connaissance de la structure chimique et biochimique du polluant offrant la possibilité d'identifier les voies qui sont susceptibles d'être perturbées.
Figure 1. Concept d'une AOP (d'après Ankley et al., 2010).

Les expositions précoces et leur impact sur le développement
La prise en compte de la période d'exposition (précocité), de la toxicité des faibles doses et de l'exposition chronique est essentielle. Plusieurs facteurs peuvent interagir avec ces fenêtres temporelles, et les conséquences peuvent ne pas être nécessairement immédiates, mais se manifester plus tard dans la vie (Andersen, 2003 ; Hale et al., 2014 ; Vaudin et al., 2022). Il existe de plus en plus de preuves que de nombreux composés inhibent et impactent le développement normal foeto-embryonnaire (méthylmercure, dioxines, pesticides, biphényles polychlorés - PCB, nanoparticules, hydrocarbures aromatiques polycycliques -HAP ; métaux lourds). Ces composés chimiques se retrouvent dans l'environnement, dans les aliments, seuls ou mélangés, et peuvent agir comme des agents neurotoxiques et/ou des perturbateurs neuro-endocriniens, via leurs effets cytotoxiques, pro-inflammatoires et pro-oxydants (Roegge et Schantz, 2006 ; Dietert, 2012 ; Dridi et al., 2014).
Pour prendre l'exemple du système nerveux, pendant les périodes pré et postnatales, le cerveau en développement présente des mises en place structurelles et cellulaires très fortement sensibles et vulnérables aux risques d'expositions toxiques, notamment environnementales (Andersen, 2003 ; Ingber et Pohl, 2016). Le mode de vie maternel avec son exposition environnementale comme alimentaire est l'un des facteurs les plus importants interférant dans le développement du cerveau immature (Lauritzen et al., 2001 ; Fall, 2009 ; Hale et al., 2014). Le régime alimentaire maternel pré- et/ou postnatal peut agir en altérant ou en reprogrammant le développement du cerveau par la régulation épigénétique des voies inflammatoires telles que l'hypométhylation des gènes inflammatoires, par la dérégulation de l'axe hypothalamo-hypophyso-surrénalien (HPA), et par l'activation des cellules microgliales qui induisent des mécanismes inflammatoires en produisant des pro-cytokines inflammatoires (Spencer, 2013).
Les dérégulations du métabolisme cellulaire, induites par les expositions environnementales, pourraient conditionner plusieurs effets tardifs tout au long de la vie, avec l’augmentation du risque d'apparition de pathologies, y compris des troubles neuropsychiatriques tels que des troubles du comportement et déficits cognitifs et neurologiques (maladies neurodégénératives) à l'âge adulte (Andersen, 2003 ; Bilbo et Schwarz, 2009 ; Bolton et Bilbo, 2014).
Ces dérèglements peuvent être d'origine maternelle, placentaire et/ou fœtale et peuvent agir de manière différentielle et sélective entre les sexes (Hale et al., 2014 ; Hagberg et al., 2015). Les polluants auxquels les individus sont exposés précocement peuvent traverser les barrières protectrices, telles que le placenta, l'intestin ainsi que la barrière hémato-encéphalique (BHE), et être également disponibles dans le lait maternel, provoquant ainsi une reprogrammation périnatale cérébrale via l'inflammation précoce (Li et al., 2013).
Les multi-expositions et leur impact sur le développement
Un défi important est le cas de l'évaluation des risques sanitaires des multi-expositions à un mélange (cocktail) de micro-contaminants chimiques de l'environnement et des aliments. Avec un modèle souris in vivo il a été montré qu'une exposition périnatale à un mélange de PCB à de faibles doses environnementales induit chez les souris, devenues adultes, un stress oxydatif corrélé à des troubles du comportement social et à une augmentation de l'anxiété ; ces effets étant sexe et âge dépendant (Karkaba et al., 2017). Cette étude montre qu'il y a un lien entre les effets endocriniens suite à l'exposition de ce mélange de polluants et les comportements sociaux anormaux dans la descendance. Également, une récente étude de 2022 a démontré in vivo chez la souris adulte qu'une exposition à un mélange de polluants (phtalates) présents dans l'environnement pouvait favoriser le développement de maladies neurodégénératives ainsi que perturber le fonctionnement des cellules nerveuses, en perturbant l'axe glio-neurovasculaire (Ahmadpour et al., 2022).
Ces effets délétères ainsi que les stress inflammatoires et oxydatifs au début de la vie peuvent donc être des facteurs causaux plausibles pour l'apparition de troubles du comportement observés chez l'animal, tel que cela a été montré chez le modèle murin pour la dépression. Une hyperactivité chez les souris adultes d'âge moyen ainsi qu'un déficit cognitif uniquement chez les souris femelles d'âge moyen de la progéniture ont également été rapportés. Ce dernier point a suggéré que le sexe jouait un rôle important dans la détermination de la nature des altérations apparues (Dridi et al., 2021).
2. Limitation des modèles in vivo et développement des modèles in vitro
Les différents tests expérimentaux mis en place pour étudier l'impact de ces expositions impliquent souvent l'utilisation de modèles animaux, en période de gestation (exposition in utero) et également en période de lactation (Laugeray et al., 2017). De plus, le relevé des observations se fait sur différentes fonctions systémiques ce qui augmente le nombre d'animaux utilisés. Lorsqu'il s'agit d'étudier la toxicologie de xénobiotiques sur les animaux de rente, les animaux sauvages ou sur l'humain, ces études in vivo deviennent extrêmement compliquées à mettre en œuvre pour des questions éthiques et financières. Dans la logique des AOP et de la règle des 3R des méthodes in vitro sont couramment utilisées pour tenter d'expliquer les mécanismes moléculaires sous-jacents. De plus, des modèles plus simplifiés et rapides appuyés par des outils de traitement de données et de modélisations sont très attendus par la communauté scientifique. Avec les avancées technologiques et scientifiques, les modèles in vitro sont associés à des outils avancés de « bio-omiques » : la génomique pour l'étude des gènes et des modifications épigénétiques, la transcriptomique pour l'étude des molécules d'ARN, la protéomique pour l'étude des protéines et encore la métabolomique pour l'étude des réponses métabolomiques (Karahahil, 2016 ; Pieters et al., 2021). Ces techniques génèrent beaucoup de données et contribuent à rendre l'évaluation prédictive plus rapide et fiable pour caractériser le danger de ces expositions (D'Almeida et al., 2020). Les multiples données générées via ces modèles peuvent être analysées et des outils informatiques peuvent permettre la mise en évidence de la forte significativité des résultats obtenus en comparaison aux données obtenues sur des tests in vivo chez l'animal.
2.1. Les modalités d’utilisation des cellules souches comme modèle d’étude in vitro
Les tests in vitro toxicologiques à grande échelle sur la différenciation des cellules ou la définition des NOAEL et LOAEL ont été rendus possibles grâce à l'avancée de la recherche et des connaissances fondamentales portant sur les cellules souches, ainsi que des avancées techniques qui y ont été associées. Les cellules Embryonnaires Souches (ES) sont caractérisées par leur capacité à s'auto-renouveler et par leur pluripotence, c'est-à-dire la capacité à donner naissance à des lignées cellulaires différenciées (Jervis et al., 2019 ; Zhao et al., 2021). Il a été démontré que ces cellules souches cultivées in vitro avec les facteurs de croissance et de différenciation requis, en présence de composants de la matrice extracellulaire, peuvent proliférer tout en conservant leur « caractère souche ». Il est également possible d'utiliser des protocoles impliquant des iPSC : pour ces cellules on induit une dédifférenciation d'une cellule somatique en cellule souche. Il est ensuite possible de réorienter leur différenciation, par exemple en cellules souches cérébrales (Neural Stem Cells, NSC) (figure 2). Comme cela sera décrit plus loin, elles peuvent également permettre la production de structures tridimensionnelles (3D) auto-organisées.
Figure 2. Cultures de cellules souches cérébrales (NSC).

A : Photographie d’une immunocytologie en fluorescence d’une culture de NSC avant différenciation. Les NSC sont constituées de trois populations : en orange, cellules GFAP (Glial fibrillary acidic protein)+/Nestin+ (cellules souches proprement dites, B1) ; En vert, cellules Nestin+ (progéniteurs intermédiaires C), en rouge, cellules GFAP+ (Astrocytes) ; en Bleu le DAPI (noyaux cellulaires)
B : Photographie d'une culture de NSC après différenciation : ici orientation de la différenciation en épendymocytes qui se produit en absence de facteurs de croissance. En rouge, actine, en vert, tubuline-polyglutamylée. Les touffes ciliées des épendymocytes sont fortement polyglutamylées. (Feat-Vetel et al., 2018)
2.2. Utilisation des cellules souches pour des cultures 2D
Des modèles de cultures 2D de cellules ES peuvent déjà fournir un bon outil d'évaluation de la toxicité et de l'impact d'un médicament, d'un mélange de micro-contaminants ou encore de toxines sur le fonctionnement cellulaire (Chen et al., 2021). De nombreuses données peuvent être obtenues en analysant par exemple les capacités de différenciation cellulaire, en quantifiant différents biomarqueurs à l'aide d'outils moléculaires impliquant des approches « omiques » ou encore en collectant des données biochimiques (Danoy et al., 2021). Ainsi l'objectif majeur de ce type d'approche est d'enrichir les données scientifiques sur l'impact des expositions aux mélanges de contaminants pour faire avancer les études des mécanismes de toxicité, améliorer la prédiction de ces effets toxiques et contribuer à renforcer l'évaluation des risques et la régulation en matière de sécurité sanitaire de l'environnement et des aliments.
Les résultats peuvent par ailleurs contribuer à comprendre l'étiologie en vue d'évaluer les conséquences des expositions précoces et chroniques à des contaminants environnementaux à faibles doses dans un modèle réduit, fiable et rapide en regard des modèles in vivo. Les données générées peuvent alors également contribuer à fournir des données supplémentaires pour établir des valeurs limites d'exposition (valeurs toxicologiques de référence) à différents mélanges de contaminants. La culture cellulaire de ces cellules souches est donc un modèle précieux pour l’étude des effets de xénobiotiques.
Au laboratoire, nous avons mis en place un modèle de culture de NSC. Ce modèle permet d'évaluer les potentiels effets délétères de toxiques de l'environnement à l'échelle cellulaire (Feat-Vetel et al., 2018 ; Méresse et al., 2022). Par exemple, nous pouvons visualiser la translocation du facteur nucléaire NF-κB ce qui est difficilement abordable avec un modèle in vivo (figure 3).
Figure 3. Applications immunocytologiques à partir des cultures de NSC.

A : Mise en évidence de la translocation nucléaire du facteur NF-κB après stimulation avec un lipopolysaccharide (LPS) représentant un signal pro-inflammatoire. Le facteur NF-κB est présent au niveau cytoplasmique : en présence de signal pro-inflammatoire reconnu par la cellule, il subit une translocation dans le noyau cellulaire et y active l’expression de gènes impliqués dans les processus inflammatoires. En rouge, cellules GFAP (Glial fibrillary acidic protein) + ; en vert, facteur NF-κB phosphorylé ; en bleu le DAPI. Les noyaux verts et bleus montrent la translocation.
B : Mise en évidence de la prolifération cellulaire. En rouge, marqueur Ki67 montrant les noyaux des cellules en phase proliférative ; en vert, marqueur IBA1 mettant en évidence les cellules microgliales (macrophages résidents du système nerveux).
L'une des limites des cultures classiques en deux dimensions, est qu'elles ne peuvent pas être maintenues longtemps. Classiquement, les cellules primaires organisées en monocouche sont rarement cultivées au-delà d'un mois de culture. Cela rend difficile l'évaluation des effets à moyen et long terme. Par ailleurs, les structurations en 2D sont très limitées et les effets protecteurs des barrières, tels que la BHE, ne peuvent être pris en compte dans cette situation. Autre limite, s'il est possible d'avoir plusieurs types cellulaires à partir d'une culture de cellule souche en 2D, ils ne sont pas structurés comme dans l'organe in vivo. Certains types ne sont pas présents et les interactions entre certaines cellules ne sont pas possibles. L'évolution des techniques in vitro, l'utilisation de matrices extra-cellulaires synthétiques et la somme des connaissances des systèmes d'induction, ont progressivement conduit à l'élaboration de système de culture permettant la production de structures cellulaires en trois dimensions, s'approchant de « micro-organes in vitro » appelés organoïdes. Ces modèles, plus délicats à mettre en place que les cultures 2D conventionnelles, amenuisent l'écart entre les cultures cellulaires 2D et les modèles animaux « complets » (Hess et al., 2010). En 2021, une étude a mis en avant les différences majeures entre les cultures 2D et les cultures 3D (tableau 1, Habanjar et al., 2021).
Tableau 1. Tableau comparatif entre les modèles de culture 2D et les modèles de culture 3D (Habanjar et al., 2021).
Caractéristiques |
2D |
3D |
|---|---|---|
Interactions |
Cellules – cellules (co-culture) |
Cellules – cellules |
Formes cellulaires |
Plates, extensibles |
La structure naturelle est préservée |
Interface |
Exposition homogène de toutes |
Exposition hétérogène : la couche |
Différenciation cellulaire |
Modérément/pauvrement |
Différenciées |
Prolifération cellulaire |
Taux de prolifération supérieure |
Le taux de prolifération dépend |
Sensibilité aux traitements |
Haute |
Modérée |
Coût |
Moindre |
Élevé |
2.3. Utilisation des cellules souches pour des cultures 3D
a. Les organoïdes
Si les approches in vitro en 2D avec des cellules souches comportent de nombreux intérêts, la production d'organoïdes 3D en apporte encore davantage. D'une part, il est plus proche physiologiquement de la réalité in vivo : les interactions inter-cellules y sont équivalentes ; d'autre part en raison de leur capacité à être maintenus en culture dans le temps, les organoïdes permettent un suivi longitudinal. Les organoïdes sont des structures cellulaires tridimensionnelles auto-organisées et auto-renouvelables qui miment les organes par leur structure et leur fonction. C'est pourquoi dans la plupart des études actuelles (Lancaster et Knoblich, 2014 ; Rossi et al., 2018) pour définir des « organoïdes » il est nécessaire de trouver ces caractéristiques d'auto-renouvellement et d'auto-organisation de structures multicellulaires contenant de multiples cellules spécifiques d'organes d'une manière similaire à celle observées in vivo. Selon le milieu de culture et les facteurs de croissance associés différents types d'organoïdes sont possibles (Scalise et al., 2021).
Les organoïdes peuvent être générés à partir de cellules souches adultes (Sato et al., 2009), des cellules souches embryonnaires (Hasegawa et al., 2016) ou de cellules souches pluripotentes induites (iPSC). Ces iPSC sont générées par « reprogrammation » de cellules somatiques différenciées (par exemple, des fibroblastes de la peau) pour retrouver leur pluripotence (Takahashi et Yamanaka, 2006). Bien que le terme « organoïde » ait été utilisé dans la littérature depuis des décennies pour toute structure 3D en culture, il existe maintenant une définition plus précise. Dans le cas des NSC, l'utilisation des neurosphères (organoïde cérébral) permet d'étudier tous les types cellulaires du système nerveux central (SNC) tels que les différents sous-types de neurones et également les cellules gliales à savoir les oligodendrocytes et les astrocytes (figure 4).
Figure 4. Photographie en contraste de phase d’une neurosphère, organoïde cérébral, obtenue à partir d’une culture de NSC. Il s’agit du regroupement de cellules souches en trois dimensions qui vont conduire à la différenciation des différents types cellulaires cérébraux, et ainsi conduire à l’obtention d’un organoïde cérébral.

La neurotoxicité développementale (DNT) induite par les polluants environnementaux est un risque à considérer pour la santé humaine. Jusqu'à présent, la plupart des tests DNT sont effectués sur des animaux. En plus d'être difficilement extrapolables à l'être humain, ces tests in vivo prennent du temps, sont coûteux et utilisent un grand nombre d'animaux. Afin d'étudier les processus basiques du développement cérébral, les neurosphères permettent l'étude de la prolifération cellulaire, la différenciation, l'apoptose mais également la migration cellulaire (Fritsche et al., 2011). Ce modèle de culture permet également l'étude de la migration des neurones immatures, les neuroblastes, qui migrent durant neurogénèse adulte (figure 5).
Figure 5. Mise en évidence de neuroblastes dans les neurosphères. Immunocytologie à partir de neurosphères déposées sur une matrice de Matrigel®.
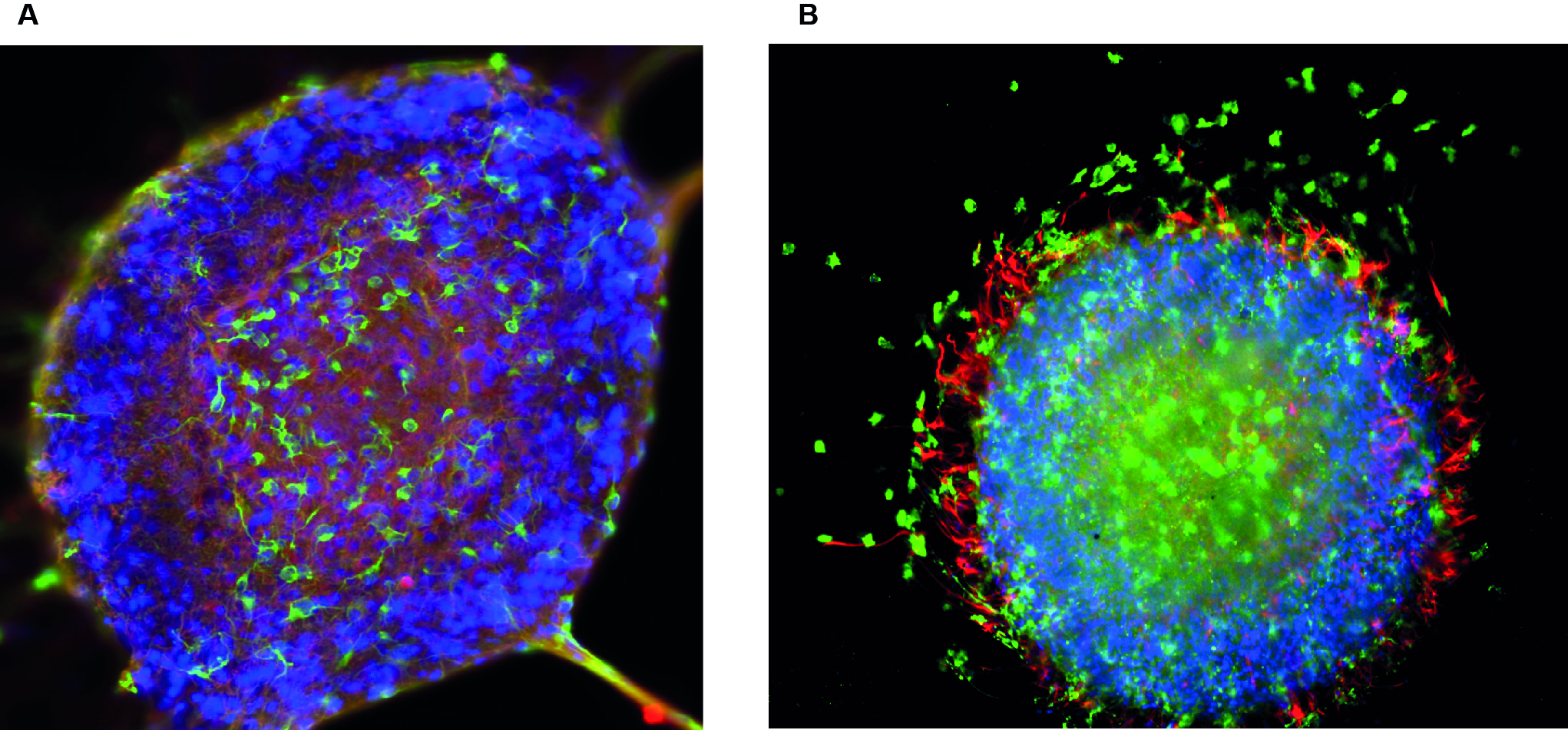
L'adoption généralisée et croissante des technologies basées sur les organoïdes dans la recherche biomédicale humaine témoigne de leur énorme potentiel dans la recherche fondamentale, translationnelle et appliquée. De la même manière, il semble y avoir de nombreuses possibilités d'application de recherche pour les organoïdes provenant d'animaux de rente et de compagnie (Lee et al., 2021). En outre, les organoïdes en tant que modèles in vitro offrent une grande possibilité de réduire l'utilisation d'animaux de laboratoire. Le développement de systèmes de culture in vitro d'organoïdes a transformé la recherche biomédicale, car ils fournissent un système de culture cellulaire reproductible qui représente une version simplifiée d'un organe. Comme la majorité des agents infectieux pénètrent dans l'organisme ou résident au niveau des surfaces muqueuses, les organoïdes dérivés de sites muqueux telles que les voies gastro-intestinales, respiratoires et urogénitales promettent de transformer la recherche sur les interactions hôte-pathogène. En effet ils permettent des études détaillées des processus d'infection précoce qui sont difficiles à aborder avec des modèles animaux.
b. Les organoïdes et leurs nombreuses applications
Une étude récente a démontré la faisabilité de générer des organoïdes à partir de tissu d'iléon bovin, car les organoïdes ainsi dérivés exprimaient bien des gènes associés aux types de cellules de l'épithélium intestinal (Hamilton et al., 2018). Dans cette étude actuelle, conformément aux principes des 3R, les chercheurs visent à réduire et à remplacer l'utilisation d'animaux dans les expériences. Les organoïdes constituent donc un nouvel outil in vitro prometteur pour la recherche animale et vétérinaire. Par exemple, le développement d'organoïdes gastriques et intestinaux d'ovins a permis l'étude des interactions hôte-pathogène chez les ruminants. Les premières observations publiées d'un helminthe infectant les organoïdes gastriques et intestinaux par compétition avec le nématode parasite du mouton Teladorsagia circumcincta, illustrent l'utilité de ces organoïdes pour des expériences de co-culture d'agents pathogènes (Smith et al., 2021). Enfin, la polarité des organoïdes de caillette et d'iléon peut être inversée pour rendre la surface apicale directement accessible aux agents pathogènes ou à leurs produits, comme le montre l'infection d'organoïdes apicaux par la bactérie zoonotique Salmonella enterica serovar Typhimurium (Forbester et al., 2015). Ce système de culture in vitro est à la fois simple et fiable pour la génération et le maintien d'organoïdes intestinaux et gastriques de petits ruminants.
En outre, il a été montré que les organoïdes peuvent être cryoconservés (Lu et al., 2017) et les cultures peuvent être restaurées à partir de stocks cryoconservés, en conservant une fonctionnalité similaire à celle du tissu d'origine. Ceci permet le stockage à long terme de lignées organoïdes, réduisant ainsi le nombre d'animaux nécessaires comme source de tissus (Puschmann et al., 2017). Les cultures d'organoïdes peuvent généralement être maintenues pendant de très longues périodes (des mois, voire plus d'un an), comme cela a été démontré pour les organoïdes dérivés, par exemple, de l'intestin, de l'estomac, du foie et du pancréas, ainsi que pour les organoïdes dérivés des iPSC (Barker et al., 2010 ; Buske et al., 2012 ; Broutier et al., 2016).
Les cultures d'organoïdes peuvent rester fidèles à leur tissu d'origine et être capables de récapituler la pathologie de la maladie lorsqu'elles sont cultivées avec des tissus provenant de patients cliniques (Gao et al., 2014). Ils se prêtent aussi à la manipulation génétique (Miyoshi et Stappenbeck, 2013), à l'imagerie en direct, à l'analyse de l'expression génétique, au séquençage et à l'analyse épigénétique, ainsi qu'à d'autres analyses biologiques standard. Les organoïdes contiennent plusieurs types de cellules mais la topologie des tissus et les interactions entre les cellules ressemblent fortement aux caractéristiques clés de l'organe ou du tissu in vivo (Gjorevski et al., 2014), contrairement aux lignées cellulaires. En effet les lignées cellulaires sont généralement dérivées de tumeurs et présentent donc facilement des aberrations chromosomiques et des mutations (Kasai et al., 2016) : ces modifications affectent la croissance, le métabolisme et la physiologie et sont connues pour évoluer au cours de leurs repiquages in vitro, créant des problèmes de reproductibilité (Ben-David et al., 2018). Les organoïdes présentent également un avantage par rapport aux explants tissulaires ou aux cultures de cellules primaires, qui subissent la sénescence, la mort cellulaire et la nécrose sur des périodes relativement courtes, ayant pour conséquence une faible reproductibilité et précision des expériences biologiques. Comme les organoïdes peuvent être dérivés de cellules ou de tissus provenant de différents organismes, ils peuvent être utilisés pour tester la réponse aux médicaments spécifique à l'espèce ou à l'individu (Pasch et al., 2019). Pour les animaux d'élevage, les organoïdes spécifiques aux animaux peuvent donc être utilisés pour le phénotypage in vitro de paramètres d'intérêt (Clark et al., 2020).
3. Exemple de l’étude des effets de pesticides sur les cellules cérébrales
Au sein du laboratoire, les cellules souches utilisées en tant que modèle in vitro de toxicité ont été isolées à partir de la zone ventriculaire sous-ventriculaire (V-SVZ). Ces études ont recherché les potentiels effets délétères d'herbicide, le glufosinate d'ammonium (Feat-Vetel et al., 2018) ainsi que ceux d'une toxine environnementale, la β-N-méthylamino-L-alanine (BMAA) (Méresse et al., 2022).
3.1. Les cellules souches cérébrales issues de la zone ventriculaire sous-ventriculaire
La zone ventriculaire sous-ventriculaire (V-SVZ) est située au bord des ventricules cérébraux et est composée de cellules souches neurales multipotentes (cellules de type B1) qui peuvent se différencier en différents types de cellules comme les astrocytes, les oligodendrocytes, les cellules épendymaires (cellules de type E) et les cellules progénitrices neurales amplificatrices de transit (cellules de type C) (Doetsch et al., 1997 ; Menn et al., 2006 ; Ortega et al., 2013). Les cellules de type C peuvent à leur tour donner naissance à des neuroblastes (cellules de type A) qui migrent sur une longue distance dans le bulbe olfactif par le biais du courant migratoire rostral (Alvarez-Buylla et Lim, 2004). Cette organisation particulière permet de maintenir un microenvironnement neurogène tout au long de la vie. De plus, la V-SVZ semble être un site potentiel cible des pesticides car certaines cellules de la V-SVZ sont en contact direct avec le liquide céphalo-rachidien (LCR). En effet, le LCR remplit les ventricules cérébraux et peut contenir des molécules exogènes potentiellement dangereuses. Ainsi, une perturbation peut conduire à des troubles critiques dans les fonctions neurogéniques de la V-SVZ et à une conduite prospective vers des troubles neurodéveloppementaux tels que l'hydrocéphalie (Jiménez et al., 2014). Des perturbations au sein de la V-SVZ, telles que la prolifération et la différenciation, ont déjà été montrées précédemment suite à l'exposition à des agents polluants (Franco et al., 2014 ; Paradells et al., 2015) et ont été suspectées de jouer un rôle dans divers cancers tumorigènes (Gilbertson et Rich, 2007 ; Zong et al., 2015).
Plusieurs recherches menées au laboratoire ces dernières années étudient les effets potentiels de pesticides sur le développement du système nerveux, suite à des expositions périnatales sur plusieurs types de modèles. Les pesticides ont toujours été utilisés à faibles doses puisque nous avons choisi des doses sous le seuil de la NOAEL (Non Observed Adverse Effect Level).
3.2. Les résultats avec notre modèle in vivo
Les résultats obtenus avec notre modèle in vivo d'exposition périnatale chez la souris ont montré que le glufosinate d'ammonium, un herbicide, induit une altération des comportements sensori-moteurs dans la période post-natale, mais également une altération comportementale à long terme chez les animaux devenus adultes, sans qu'ils soient à nouveau exposés (Laugeray et al., 2014 ; Herzine et al., 2016). Dans ce modèle in vivo, nous avons observé une perturbation de la prolifération et de la morphologie cellulaire au niveau de la zone ventriculaire sous-ventriculaire (V-SVZ), principale niche neurogénique située dans les parois des ventricules latéraux du cerveau (Herzine et al., 2016). Ainsi, nous avons émis l'hypothèse qu'une exposition développementale au glufosinate pourrait conduire à des troubles neurodéveloppementaux via une perturbation de la neurogenèse.
Par ailleurs, grâce à l'analyse transcriptomique de cerveaux d'animaux exposés en période périnatale, nous révélons une forte perturbation de l'expression d'un ensemble de gènes potentiellement impliqués dans le développement de l'environnement neurogène (Herzine et al., 2016). Au niveau cérébral, les analyses histologiques ont montré une perturbation de la migration des neuroblastes, et les analyses moléculaires une modification de l'expression de gènes impliqués dans l'homéostasie du cytosquelette. Or, de façon intéressante, parmi l'expression des gènes du cytosquelette affectés, la sous-unité 1 du complexe tubuline polyglutamylase (TPGS1) impliquée dans le mécanisme de polyglutamylation était dérégulée (Herzine et al., 2016). Cela indique qu'une exposition périnatale au glufosinate d'ammonium altère l'expression de la TPGS1 et est donc susceptible d'affecter le cytosquelette en perturbant la polyglutamylation. La polyglutamylation (PolyE) est une modification post-traductionnelle (PTM) correspondant à l'ajout ou au retrait de glutamate sur les régions de la queue C-terminale de la tubuline pour former des chaînes latérales polyglutamate (Edde et al., 1990 ; Bobinnec et al., 1999). La polyE est un mécanisme rapide et réversible se produisant sur la tubuline des neurones et joue un rôle important dans la morphologie, la prolifération et la différenciation des cellules. Elle possède également un rôle très important dans la structuration des cils cellulaires, comme par exemple chez les épendymocytes (Janke et al., 2008). Grâce aux battements de leurs cils, ces cellules assurent la circulation du liquide céphalo-rachidien, appelé également liquide cérébro-spinal. C'est pourquoi nous avons suspecté un effet délétère du glufosinate d'ammonium sur les cils des épendymocytes.
3.3. Les résultats avec notre modèle in vitro 2D
Pour étudier l'effet du glufosinate d'ammonium, nous avons utilisé un modèle de culture 2D de NSC. Grâce à l'utilisation de facteur de croissance spécifique, il est possible de maintenir ces cellules à l'état indifférencié ou bien d'induire leur différenciation, notamment en épendymocytes (Guirao et al., 2010 ; Spassky et al., 2005). Ce modèle in vitro nous a permis de prouver l'interaction de cet herbicide avec le cytosquelette impliqué dans la formation des cils, ces derniers étant caractéristiques de ces cellules de l'épithélium des ventricules cérébraux. Dans ce cas, nous n'obtenions pas une modification de leur différenciation, mais une altération de la formation des touffes multiciliées, allant jusqu'à leur disparition (Feat-Vetel et al., 2018). Par ailleurs, via l'utilisation d'un milieu de culture complémenté (supplément N2) qui conduit à la différenciation en cellules typiques des populations cellulaires de la SVZ (à savoir les neuroblastes, les astrocytes, les précurseurs aux oligodendrocytes) nous avons pu montrer une perturbation de la différenciation cellulaire et prouver ainsi que l'exposition à ce composé modifiait les proportions des différents types cellulaires (Feat-Vetel et al., 2018). Dans une autre étude, où nous avons analysé les effets d'une cyanotoxine de l'environnement, ce modèle de cellules souches nous a permis, entre autres, de montrer pour la première fois ses effets génotoxiques et sur le stress oxydant et ce, à faible dose (Laugeray et al., 2018).
3.4. Exemple de l’utilisation de neurosphères dans le cas de l’étude de l’impact des polluants de l’environnement
Au sein du modèle neurosphère, nous pouvons obtenir l’ensemble des populations cellulaires neuronales (i.e. les neurones) et gliales (i.e. les épendymocytes, astrocytes et oligodendrocytes). Dans le cadre d’une étude portant sur l’analyse des effets d’un mélange de polluants environnementaux (nommé MIX dans les figures), nous avons utilisé des cultures NSC in vitro pour constituer ce modèle de culture de neurosphères. Notre étude portait notamment sur l’induction par ce MIX de processus neurotoxiques et/ou neuro-inflammatoires. Par des études de cytométrie en flux, nous avons pu identifier que ce MIX était susceptible de perturber les populations de cellules immuno-compétentes du SNC, à savoir les astrocytes et la microglie ; en effet, un traitement au MIX diminue la population d’astrocytes et induit une augmentation de la population de cellules microgliales (figure 6).
Figure 6. Quantification de population cellulaire par cytométrie en flux.

Quantification de la population astrocytaire à gauche, et de la population microgliale (macrophage résidents du système nerveux) à droite (marquages des cellules ACSA2+ et CD11Bhigh/CD45Low/Medium respectivement).
Dans ce modèle de culture, nous sommes ainsi capables d'étudier chaque type cellulaire présent dans les structures cérébrales. De façon très intéressante, au sein des neurosphères la maturation cellulaire suit les étapes normalement présentes dans le système nerveux. Le meilleur exemple est illustré par les cellules microgliales. Au cours de leur maturation, ces cellules expriment un marqueur spécifique (« transmembrane protein 119 », TMEM119). Chez la souris il est produit dans ces cellules aux environs du 10ème jour après la naissance (Bennett et al., 2016). Dans des cultures microgliales en 2D, même en co-culture, ce marqueur n'est jamais exprimé car ces cellules semblent conserver un phénotype juvénile. Au contraire, après quelques temps de culture, les cellules microgliales présentes dans les neurosphères expriment TMEM119, traduisant ainsi leur capacité à se différencier dans ce système in vitro.
Ainsi, tout laisse donc penser que notre modèle permet bien d’aborder les problématiques neuro-inflammatoires liées à de potentielles expositions. En effet, les neurosphères contiennent les cellules microgliales impliquées dans cette neuro-inflammation, et ont une maturation caractéristique du système nerveux en développement. Ainsi, à partir de ces organoïdes traités avec un cocktail de polluants de l’environnement, il nous a été possible de mesurer l’évolution de la production des cytokines pro-inflammatoires, de déterminer le statut d’activation des cellules microgliales par des études de cytométrie en flux ainsi que d’étudier l’évolution des populations cellulaires dans ces neurosphères. Au sein de ces modèles, nous avons également mesuré l’expression des gènes impliqués dans la neuro-inflammation ; une exposition à un cocktail de polluants réduit l’expression de l’IL-6 et des facteurs de transcriptions NF-κB et STAT3 indiquant une modulation potentielle de la réponse inflammatoire par ces polluants présents en mélange (figure 7). De cette façon, il est devenu possible d’étudier in vitro les réactions neuro-inflammatoires induites par les expositions aux toxiques, mais aussi de suivre dans le temps, via la mesure des cytokines dans le milieu de culture, la « résolution » de l’inflammation, c’est à dire la résilience cellulaire.
Figure 7. Mesure par RT-qPCR de l’expression génique de marqueurs de l’inflammation suite à l’exposition à un mélange de polluant (MIX).

De façon préoccupante, un certain nombre d'infections bactériennes et virales au cours de la période gestationnelle sont à l’origine de phénomènes neuro-inflammatoires ; ceux-ci sont associés, entre autres, à un risque accru de neurodégénérescence. L’une des limites des organoïdes cérébraux est qu’il demeure difficile de réaliser une pré-exposition systémique plus précoce à un autre agent pro-inflammatoire, comme cela peut être fait in vivo (exposition pendant la gestation à un agent d’origine bactérienne, puis exposition aux polluants après la naissance).
Conclusion
Dans la recherche biomédicale humaine, les organoïdes trouvent de nombreuses applications comme modèles de recherche in vitro, par exemple pour l'étude de la toxicologie, des processus de développement, des maladies congénitales, des maladies infectieuses (Castellanos-Gonzalez et al., 2013), du cancer (Drost et Clevers, 2018) et de la médecine régénérative (Nakamura et Sato, 2018). De plus, ceux-ci sont de mieux en mieux définis et sont accessibles afin d'obtenir des informations phénotypiques sur les aspects cellulaires et moléculaires sous-jacents.
Les organoïdes peuvent être d'une grande utilité dans la recherche sur les animaux d’élevage et la recherche vétérinaire. En effet, leur utilisation peut permettre une meilleure compréhension de la physiologie animale, de la nutrition animale, de l'interaction hôte-microbe, et peut contribuer au phénotypage in vitro des animaux reproducteurs. Malgré cela, davantage de recherches sont nécessaires. En effet, il y a encore relativement peu d'études sur les organoïdes dans le domaine de la recherche vétérinaire et de la production animale. À ce jour, il n’existe pas de modèle in vitro en trois dimensions pour certaines espèces. Lorsque que ceux-ci sont présents, bien souvent, la plupart des organoïdes mis en place sont uniquement intestinaux.
Par rapport aux autres modèles in vitro, les organoïdes reproduisent mieux la structure et la fonction des tissus. Par rapport aux organes intacts, ce sont des modèles fortement simplifiés, ce qui représente un avantage pour les études visant à identifier des mécanismes spécifiques, mais confère également des limites claires au modèle. Ainsi, les expérimentations animales semblent toujours indispensables pour le dépistage préclinique dans le processus de découverte de médicaments. Ces besoins se retrouvent confrontés à des considérations éthiques et les différences entre les espèces demeurent. C’est pourquoi, l’utilisation de modèles d’organoïdes à partir de cellules d'origine humaine a été activement poursuivie et plébiscitée.
Aussi, ces modèles 3D ne sont pas en mesure d’être applicables dans l’ensemble des études, et ne témoignent pas des interactions des organes entre eux. Ainsi, il demeure difficile de prédire avec précision l’efficacité des médicaments et leur éventuelle toxicité. Une des pistes explorables est celle de la technique « body-on-chip ». Il s'agit d'un réseau d'organes miniatures in vitro qui s'unissent pour mimer des systèmes corporels. Ces modèles peuvent utiliser des cellules humaines, leur conférant une plus grande précision par rapport aux modèles animaux traditionnels tout en augmentant la possibilité d'une médecine personnalisée, où les cellules pourraient être dérivées de cellules souches de patients. Si l’emploi des organoïdes est une bonne alternative à l’utilisation des modèles in vivo, ces systèmes in vitro sur puces pourraient combler le fossé entre les études animales et les essais cliniques pour l'industrie pharmaceutique.
Références
- Abeysiriwardena N.M., Gascoigne S.J.L, Anandappa A., 2018. Algal bloom expansion increases cyanotoxin risk in food. Yale J. Biol. Med., 91, 129-142. PMID: 29955218; PMCID: PMC6020737. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6020737/
- Ahmadpour D., Mhaouty-Kodja S., Grange-Messent V., 2022. Les phtalates - Un facteur de risque pour la fonction cérébro-vasculaire chez la souris mâle. Med. Sci., Paris, France. 38, 141-144. French. doi:10.1051/medsci/2021256
- Alvarez-Buylla A., Lim D.A., 2004. For the long run: maintaining germinal niches in the adult brain. Neuron, 41, 683-686. doi:10.1016/S0896-6273(04)00111-4
- Andersen S.L., 2003. Trajectories of brain development: point of vulnerability or window of opportunity? Neurosci. Biobehav. Rev., 27, 3-18. doi:10.1016/S0149-7634(03)00005-8
- Ankley G.T., Bennett R.S., Erickson R.J., Hoff D.J., Hornung M.W., Johnson R.D., Mount D.R., Nichols J.W., Russom C.L., Schmieder P.K., Serrrano J.A., Tietge J.E., Villeneuve D.L., 2010. Adverse outcome pathways: A conceptual framework to support ecotoxicology research and risk assessment. Environ. Toxicol. Chem., 29,730-741. doi:10.1002/etc.34
- Barker N., Huch M., Kujala P., van de Wetering M., Snippert H.J., van Es J.H., Sato T., Stange D.E., Begthel H., van den Born M., Danenberg E., van den Brink S., Korving J., Abo A., Peters P.J., Wright N., Poulsom R., Clevers H., 2010. Lgr5(+ve) stem cells drive self-renewal in the stomach and build long-lived gastric units in vitro. Cell Stem Cell 6, 25-36. doi:10.1016/j.stem.2009.11.013
- Ben-David U., Siranosian B., Ha G., Tang H., Oren Y., Hinohara K., Strathdee C.A., Dempster J., Lyons N.J., Burns R., Nag A., Kugener G., Cimini B., Tsvetkov P., Maruvka Y.E., O’Rourke R., Garrity A., Tubelli A.A., Bandopadhayay P., Tsherniak A., Vazquez F., Wong B., Birger C., Ghandi M., Thorner A.R., Bittker J.A., Meyerson M., Getz G., Beroukhim R., Golub T.R., 2018. Genetic and transcriptional evolution alters cancer cell line drug response. Nature, 560, 325-330. doi:10.1038/s41586-018-0409-3
- Bennett M.L., Bennett F.C., Liddelow S.A, Ajami B., Zamanian J.L., Fernhoff N.B., Mulinyawe S.B., Bohlen C.J., Adil A., Tucker A., Weissman I.L., Chang E.F., Li G., Grant G.A., Hayden Gephart M.G., Barres B.A., 2016. New tools for studying microglia in the mouse and human CNS. Proc. Natl. Acad. Sci. U.S.A. 113, E1738-E1746. PMID: 26884166; PMCID: PMC4812770. doi:10.1073/pnas.1525528113
- Bilbo S.D., Schwarz J.M., 2009. Early-life programming of later-life brain and behavior: a critical role for the immune system. Front. Behav. Neurosci., 24, 3-14. PMID: 19738918; PMCID: PMC2737431. doi:10.3389/neuro.08.014.2009
- Bobinnec Y., Marcaillou C., Debec A., 1999. Microtubule polyglutamylation in Drosophila melanogaster brain and testis. Eur. J. Cell. Biol., 78, 671-674. doi:10.1016/S0171-9335(99)80053-3
- Bolton J.L, Bilbo S.D., 2014. Developmental programming of brain and behavior by perinatal diet: focus on inflammatory mechanisms. Dialogues Clin. Neurosci.,16, 307-320. PMID: 25364282; PMCID: PMC4214174. doi:10.31887/DCNS.2014.16.3/jbolton
- Broutier L., Andersson-Rolf A., Hindley C.J., Boj S.F., Clevers H., Koo B.K., Huch M., 2016. Culture and establishment of self-renewing human and mouse adult liver and pancreas 3D organoids and their genetic manipulation. Nat. Protoc., 11, 1724-1743. Epub 2016 Aug 25. PMID: 27560176. doi:10.1038/nprot.2016.097
- Buske P., Przybilla J., Loeffler M., Sachs N., Sato T., Clevers H., Galle J., 2012. On the biomechanics of stem cell niche formation in the gut--modelling growing organoids. FEBS J. , 279, 3475-3487. Epub 2012 Jun 18. PMID: 22632461. doi:10.1111/j.1742-4658.2012.08646.x
- Castellanos-Gonzalez A., Cabada M.M., Nichols J., Gomez G., White Jr A.C., 2013. Human primary intestinal epithelial cells as an improved in vitro model for Cryptosporidium parvum infection. Infect. Immun., 81,1996-2001. doi:10.1128/IAI.01131-12
- Chen Z., Jang S., Kaihatu J.M., Zhou Y.H., Wright F.A., Chiu W.A., Rusyn I., 2021. Potential human health hazard of post-hurricane harvey sediments in galveston bay and houston ship channel: a case study of using in vitro bioactivity data to inform risk management decisions. Int J. Environ. Res. Public Health., 18, 13378. doi:10.3390/ijerph182413378
- Clark E.L., Archibald A.L., Daetwyler H.D., Groenen MA.M., Harrison P.W., Houston R.D., Kühn C., Lien S., Macqueen D.J., Reecy J.M., Robledo D., Watson M., Tuggle C.K., Giuffra E., 2020. From FAANG to fork: application of highly annotated genomes to improve farmed animal production. Genome Biol., 21, 285. doi:10.1186/s13059-020-02197-8
- Costa E.C., Moreira A.F, de Melo-Diogo D., Gaspar V.M., Carvalho M.P., Correia I.J., 2016. 3D tumor spheroids: an overview on the tools and techniques used for their analysis. Biotechnol Adv. 34, 1427-1441. doi:10.1016/j.biotechadv.
- Coumoul X., Andujar P., Baeza-Squiban A., Barouki R., Bodin L., 2023. Toxicologie 2ème édition. Éditions Dunod. ISBN : 978-2-10-076173-9. https://www.dunod.com/sciences-techniques/toxicologie-1
- D'Almeida M., Sire O., Lardjane S., Duval H., 2020. Development of a new approach using mathematical modeling to predict cocktail effects of micropollutants of diverse origins. Environ. Res., 188, 109897. doi:10.1016/j.envres.2020.109897
- Danoy M., Jellali R., Tauran Y., Bruce J., Leduc M., Gilard F., Gakière B., Scheidecker B., Kido T., Miyajima A., Soncin F., Sakai Y., Leclerc E., 2021. Characterization of the proteome and metabolome of human liver sinusoidal endothelial-like cells derived from induced pluripotent stem cells. Differentiation, 120, 28-35. doi:10.1016/j.diff.2021.06.001
- Dietert R.R., 2012. Misregulated inflammation as an outcome of early-life exposure to endocrine-disrupting chemicals. Rev. Environ. Health, 27, 117-131. doi:10.1515/reveh-2012-0020
- Doetsch F., Garcı́a-Verdugo J.M., Alvarez-Buylla A., 1997. Cellular composition and three-dimensional organization of the subventricular germinal zone in the adult mammalian brain. J. Neurosci., 17, 5046-5061. doi:10.1523/JNEUROSCI.17-13-05046.1997
- Dridi I., Leroy D., Guignard C., Goerges S., Torsten B., Landoulsi A., Thomé J.P., Eppe G., Soulimani R., Bouayed J., 2014. Dietary early-life exposure to contaminated eels does not impair spatial cognitive performances in adult offspring mice as assessed in the Y-maze and the Morris water maze. Nutr Res., 34, 1075-1084. doi:10.1016/j.nutres.2014.06.011
- Dridi I., Soulimani R., Bouayed J., 2021. Chronic depression-like phenotype in male offspring mice following perinatal exposure to naturally contaminated eels with a mixture of organic and inorganic pollutants. Environ. Sci. Pollut. Res. Int., 28, 156-165. doi:10.1007/s11356-020-08799-w
- Drost J., Clevers H., 2018. Organoids in cancer research. Nat. Rev. Cancer., 18, 407-418. doi:10.1038/s41568-018-0007-6
- Fall C., 2009. Maternal nutrition: effects on health in the next generation. Indian J. Med. Res., 130, 593-599. https://pubmed.ncbi.nlm.nih.gov/20090113/
- Feat-Vetel J., Larrigaldie V., Meyer-Dilhet G., Herzine A., Mougin C., Laugeray A., Gefflaut T., Richard O., Quesniaux V., Montécot-Dubourg C., Mortaud S., 2018. Multiple effects of the herbicide glufosinate-ammonium and its main metabolite on neural stem cells from the subventricular zone of newborn mice Neuro Toxicology., 69, 152-163 doi:10.1016/j.neuro.2018.10.001
- Forbester J.L, Goulding D., Vallier L., Hannan N., Hale C., Pickard D., Mukhopadhyay S., Dougan G., 2015. Interaction of salmonella enterica serovar typhimurium with intestinal organoids derived from human induced pluripotent stem cells. Infect. Immun., 83, 2926-2934. doi:10.1128/IAI.00161-15
- Franco I., Valdez-Tapia M., Sanchez-Serrano S.L., Cruz S.L., Lamas M., 2014. Chronic toluene exposure induces cell proliferation in the mice SVZ but not migration through the RMS. Neurosci. Lett., 575, 101-106. doi:10.1016/j.neulet.2014.05.043
- Fritsche E., Gassmann K., Schreiber T., 2011. Neurospheres as a model for developmental neurotoxicity testing. Methods Mol. Biol., 758, 99-114. doi:10.1007/978-1-61779-170-3_7
- Gao D., Vela I., Sboner A., Iaquinta P.J., Karthaus W.R., Gopalan A., Dowling C., Wanjala J.N., Undvall E.A., Arora V.K., Wongvipat J., Kossai M., Ramazanoglu S., Barboza L.P., Di W., Cao Z., Zhang Q.F., Sirota I., Ran L., MacDonald T.Y., Beltran H., Mosquera J.M., Touijer K.A., Scardino P.T., Laudone V.P., Curtis K.R., Rathkopf D.E., Morris M.J., Danila D.C., Slovin S.F., Solomon S.B., Eastham J.A., Chi P., Carver B., Rubin M.A., Scher H.I., Clevers H., Sawyers C.L., Chen Y., 2014. Organoid cultures derived from patients with advanced prostate cancer. Cell., 159, 176-187. https://doi.org10.1016/j.cell.2014.08.016
- Gilbertson R.J., Rich J.N., 2007. Making a tumour’s bed: glioblastoma stem cells and the vascular niche. Nat. Rev. Cancer, 7, 733-736. doi:10.1038/nrc2246
- Gjorevski N., Ranga A., Lutolf M.P., 2014. Bioengineering approaches to guide stem cell-based organogenesis. Development, 141, 1794-1804. doi:10.1242/dev.101048
- Guirao B., Meunier A., Mortaud S., Aguilar A., Corsi J.M., Strehl L., Hirota Y., Desoeuvre A., Boutin C., Han Y.G., Mirzadeh Z., Cremer H., Montcouquiol M., Sawamoto K., Spassky N., 2010. Coupling between hydrodynamic forces and planar cell polarity orients mammalian motile cilia. Nat. Cell. Biol., 12, 341-350. doi:10.1038/ncb2040
- Habanjar O., Diab-Assaf M., Caldefie-Chezet F., Delort L., 2021. 3D Cell Culture Systems: Tumor application, advantages, and disadvantages. Int. J. Mol. Sci.,22, 12200. doi:10.3390/ijms222212200
- Hagberg H., MallardC., Ferriero, D.M., Vannucci S.J., Levison S.W., Vexler Z.S., Gressens P., 2015. The role of inflammation in perinatal brain injury. Nat. Rev. Neurol., 11, 192-208. doi:10.1038/nrneurol.2015.13
- Hale M.W., Spencer S.J., Conti B., Jasoni C.L., Kent S., Radler M.E., Reyes T.M., Sominsky L., 2014. Diet, behavior and immunity across the lifespan. Neurosci. Biobehav. Rev., 58, 46-62. doi:10.1016/j.neubiorev.2014.12.009
- Hamilton C.A., Young R., Jayaraman S., Sehgal A., Paxton E., Thomson S., Katzer F., Hope J., Innes E., Morrison L.J., Mabbott N.A., 2018. Development of in vitro enteroids derived from bovine small intestinal crypts. Vet. Res., 49, 54. doi:10.1186/s13567-018-0547-5
- Hasegawa Y., Takata N., Okuda S., Kawada M., Eiraku M., Sasai Y., 2016. Emergence of dorsal-ventral polarity in ESC-derived retinal tissue. Development. 143, 3895-3906. doi:10.1242/dev.134601
- Herzine A., Laugeray A., Feat J., Menuet A., Quesniaux V., Richard O., Pichon J., Montécot-Dubourg C., Perche O., Mortaud S., 2016. Perinatal exposure to glufosinate ammonium herbicide impairs neurogenesis and neuroblast migration through cytoskeleton destabilization. Front Cell Neurosci., 10, 191. doi:10.3389/fncel.2016.00191
- Hess M.W., Pfaller K., Ebner H.L, Beer B., Hekl D., Seppi T., 2010. 3D versus 2D cell culture implications for electron microscopy. Methods Cell Biol., 96, 649-670. doi:10.1016/S0091-679X(10)96027-5
- Ingber S.Z., Pohl H.R., 2016. Windows of sensitivity to toxic chemicals in the motor effects development. Regul. Toxicol. Pharmacol., 74, 93-10. doi:10.1016/j.yrtph.2015.11.018
- Janke C., Rogowski K., van Dijk J., 2008. Polyglutamylation: a fine-regulator of protein function? 'Protein Modifications: beyond the usual suspects' review series. EMBO Rep., 9, 636-641. doi:10.1038/embor.2008
- Jean-Quartier C., Jeanquartier F., Jurisica I. Holzinger A., 2018. In silico cancer research towards 3R. BMC Cancer, 18, 408. doi:10.1186/s12885-018-4302-0
- Jervis M., Huaman O., Cahuascanco B., Bahamonde J., Cortez J., Arias J.I., Torres C.G., Peralta O.A., 2019. Comparative analysis of in vitro proliferative, migratory and pro-angiogenic potentials of bovine fetal mesenchymal stem cells derived from bone marrow and adipose tissue. Vet. Res. Commun., 43, 165-178. doi:10.1007/s11259-019-09757-9
- Jiménez A.J., Dominguez-Pinos M.D., Guerra M.M., Fernandez-Llebrez P., Pèrez- Figares J.M., 2014. Structure and function of the ependymal barrier and diseases associated with ependyma disruption. Tissue Barriers, 2, doi:10.4161/tisb.28426
- Johnston J.J., Savarie P.J., Primus T.M., Eisemann J.D., Hurley J.C., Kohler D.J., 2002. Risk assessment of an acetaminophen baiting program for chemical control of brown tree snakes on Guam: evaluation of baits, snake residues, and potential primary and secondary hazards. Environ. Sci. Technol., 36, 3827-3833. doi:10.1021/es015873n
- Karahahil B., 2016. Overview of systems biology and omics technologies. Curr. Med. Chem., 23, 4221-4230. doi:10.2174/0929867323666160926150617
- Karkaba A., Soualeh N., Soulimani R., Bouayed J., 2017. Perinatal effects of exposure to PCBs on social preferences in young adult and middle-aged offspring mice. Horm. Behav., 96, 137-146. doi:10.1016/j.yhbeh.2017.09.002
- Kasai F., Hirayama N., Ozawa M., Iemura M., Kohara A., 2016. Changes of heterogeneous cell populations in the Ishikawa cell line during long-term culture: Proposal for an in vitro clonal evolution model of tumor cells. Genomics. 107, 259-66. doi:10.1016/j.ygeno.2016.04.003
- La Rocca C., Mantovani A., 2006. From environment to food: the case of PCB. Ann. Ist. Super Sanita. 42, 410-416. https://pubmed.ncbi.nlm.nih.gov/17361063/
- Lancaster M.A., Knoblich J.A., 2014. Organogenesis in a dish: modeling development and disease using organoid technologies. Science, 345, 1247125. doi:10.1126/science.1247125
- Laugeray A., Herzine A., Perche O., Hébert B., Aguillon-Naury M., Richard O., Menuet A., Mazaud-Guittot S., Lesné L., Briault S., Jegou B., Pichon J., Montécot-Dubourg C., Mortaud S., 2014. Pre- and postnatal exposure to low dose glufosinate ammonium induces autism-like phenotypes in mice. Front Behav. Neurosci., 8, 390. doi:10.3389/fnbeh.2014.00390
- Laugeray A., Herzine A., Perche O., Richard O., Montecot-Dubourg C., Menuet A., Mazaud-Guittot S., Lesné L., Jegou B., Mortaud S., 2017. In utero and lactational exposure to low-doses of the pyrethroid insecticide cypermethrin leads to neurodevelopmental defects in male mice-An ethological and transcriptomic study. PLoS One. 11, e0184475. doi:10.1371/journal.pone.0184475
- Laugeray A., Oummadi A., Jourdain C., Feat J., Meyer-Dilhet G., Menuet A., Plé K., Gay M., Routier S., Mortaud S., Guillemin G.J., 2018. Perinatal exposure to the cyanotoxin β-n-méthylamino-l-alanine (bmaa) results in long-lasting behavioral changes in offspring-potential involvement of dna damage and oxidative stress. Neurotox. Res., 33, 87-112. doi:10.1007/s12640-017-9802-1
- Lauritzen L., Hansen H.S., Jørgensen M.H., Michaelsen K.F., 2001. The essentiality of long chain n-3 fatty acids in relation to development and function of the brain and retina. Prog Lipid Res., 40, 1-94. doi:10.1016/s0163-7827(00)00017-5
- Lee B.R., Yang H., Lee S.I., Haq I., Ock S.A., Wi H., Lee H.C., Lee P., Yoo J.G., 2021. Robust three-dimensional (3d) expansion of bovine intestinal organoids: an in vitro model as a potential alternative to an in vivo system. Animals, 16, 2115. doi:10.3390/ani11072115
- Li L.X., Chen L., Meng X.Z., Chen B.H., Chen S.Q., Zhao Y., Zhao L.F., Liang Y., Zhang Y.H., 2013. Exposure levels of environmental endocrine disruptors in mother-newborn pairs in China and their placental transfer characteristics. PLoS One 8, e62526. doi:10.1371/journal.pone.0062526
- Lu Y.C., Fu D.J, An D., Chiu A., Schwartz R., Nikitin A.Y., Ma M., 2017. Scalable production and cryostorage of organoids using core-shell decoupled hydrogel capsules. Adv. Biosys., 1 1700165. doi:10.1002/adbi.201700165
- Menn B., Garcia-Verdugo J.M., Yaschine C., Gonzalez-Perez O., Rowitch D., Alvarez-Buylla A., 2006. Origin of oligodendrocytes in the subventricular zone of the adult brain. J. Neurosci., 26, 7907-7918. doi:10.1523/JNEUROSCI.1299-06.2006.
- Méresse S., Larrigaldie V., Oummadi A., de Concini V., Morisset-Lopez S., Reverchon F., Menuet A., Montécot-Dubourg C., Mortaud S., 2022. β-N-Methyl-Amino-L-Alanine cyanotoxin promotes modification of undifferentiated cells population and disrupts the inflammatory status in primary cultures of neural stem cells. Toxicology, 27, 482, 153358. doi:10.1016/j.tox.2022.153358
- Miyoshi H., Stappenbeck T.S., 2013. In vitro expansion and genetic modification of gastrointestinal stem cells in spheroid culture. Nat. Protoc. 8, 2471-2482. doi:10.1038/nprot.2013.153
- Nakamura T., Sato T., 2018. Advancing intestinal organoid technology toward regenerative medicine. Cell. Mol. Gastroenterol. Hepatol., 5, 51-60. doi:10.1016/j.jcmgh.2017.10.006
- Ortega F., Gascón S., Masserdotti G., Deshpande A., Simon C., Fischer J., Dimou L., Chichung Lie D., Schroeder T., Berninger B., 2013. Oligodendrogliogenic and neurogenic adult subependymal zone neural stem cells constitute distinct lineages and exhibit differential rresponsiveness to Wnt signalling. Nat. Cell Biol. 15, 602-613. doi:10.1038/ncb2736
- Paradells S., Rocamonde B., Llinares C., Herranz-Pérez V., Jimenez M., Garcia- Verdugo J.M., Zipancic I., Soria J.M., Garcia-Esparza M., 2015. Neurotoxic effects of ochratoxin a on the subventricular zone of adult mouse brain. J. Appl. Toxicol. 35, 737-751. doi:10.1002/jat.3061
- Pasch C.A., Favreau P.F., Yueh A.E., Babiarz C.P., Gillette A.A., Sharick J.T., Karim M.R., Nickel K.P., DeZeeuw A.K., Sprackling C.M., Emmerich P.B., DeStefanis R.A., Pitera R.T., Payne S.N., Korkos D.P., Clipson L., Walsh C.M., Miller D., Carchman E.H., Burkard M.E., Lemmon K.K., Matkowskyj K.A., Newton M.A., Ong I.M., Bassetti M.F., Kimple R.J., Skala M.C., Deming D.A., 2019. Patient-derived cancer organoid cultures to predict sensitivity to chemotherapy and radiation. Clin. Cancer Res., 25, 5376-5387. doi:10.1158/1078-0432.CCR-18-3590
- Pieters V.M., Co I.L., Wu N., Mc Guigan A.P., 2021. Applications of omics technologies for three-dimensional in vitro disease models. Tissue Eng. Part C Methods., 27, 183-199. doi:10.1089/ten.tec.2020.0300
- Puschmann E., Selden C., Butler S., Fuller B., 2017. Liquidus Tracking: Large scale preservation of encapsulated 3-D cell cultures using a vitrification machine. Cryobiology, 76, 65-73. doi:10.1016/j.cryobiol.2017.04.006
- Roegge C.S, Schantz S.L., 2006. Motor function following developmental exposure to PCBS and/or MEHG. Neurotoxicol. Teratol., 28, 260-277. doi:10.1016/j.ntt.2005.12.009
- Rossi G., Manfrin A., Lutolf M.P., 2018. Progress and potential in organoid research. Nat. Rev. Genet., 19, 671-687. doi:10.1038/s41576-018-0051-9
- Sato T., Vries R.G., Snippert H.J., van de Wetering M., Barker N., Stange D.E., van Es J.H., Abo A., Kujala P., Peters P.J., Clevers H., 2009. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature, 459, 262. doi:10.1038/nature07935
- Scalise M., Marino F., Salerno L., Cianflone E., Molinaro C., Salerno N., De Angelis A., Viglietto G., Urbanek K., Torella D., 2021. From spheroids to organoids: the next generation of model systems of human cardiac regeneration in a dish. Int. J. Mol. Sci., 22, 13180. doi:10.3390/ijms222413180
- Smith D., Price D.R.G., Burrells A., Faber M.N., Hildersley K.A., Chintoan-Uta C., Chapuis A.F., Stevens M., Stevenson K., Burgess S.T.G., Innes E.A., Nisbet A.J., McNeilly T.N., 2021. The development of ovine gastric and intestinal organoids for studying ruminant host-pathogen interactions. Front. Cell. Infect. Microbiol., 11, 733811. doi:10.3389/fcimb.2021.733811
- Spassky N., Merkle F.T., Flames N., Tramontin A.D., García-Verdugo J.M., Alvarez-Buylla A., 2005. Adult ependymal cells are postmitotic and are derived from radial glial cells during embryogenesis. J. Neurosci., 25, 10-18. doi:10.1523/JNEUROSCI.1108-04.2005
- Spencer S.J., 2013. Perinatal nutrition programs neuroimmune function long-term: mechanisms and implications. Front Neurosci 7, 144. doi:10.3389/fnins.2013.00144
- Takahashi K., Yamanaka S., 2006. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell, 126, 663-676. doi:10.1016/j.cell.2006.07.024
- Tauk B.S., Foster J.D., 2016. Treatment of ibuprofen toxicity with serial charcoal hemoperfusion and hemodialysis in a dog. J. Vet. Emerg. Crit. Care (San Antonio). 26, 787-792. doi:10.1111/vec.12544
- Vaudin P., Augé C., Just N., Mhaouty-Kodja S., Mortaud S., Pillon D., 2022. When pharmaceutical drugs become environmental pollutants: Potential neural effects and underlying mechanisms. Environ. Res., 205, 112495. doi:10.1016/j.envres.2021.112495
- Yamada K.M, Cukierman E., 2007. Modeling tissue morphogenesis and cancer in 3D. Cell, 130, 601-610. doi:10.1016/j.cell.2007.08.006
- Zhao X., Wan W., Li B., Zhang X., Zhang M., Wu Z., Yang H., 2021. Isolation and in vitro expansion of porcine spermatogonial stem cells. Reprod. Domest. Anim., 57, 210-220. doi:10.1111/rda.14043
- Zong H., Parada L.F., Baker S., 2015. Cell of origin for malignant gliomas and its implication in therapeutic development. Cold Spring Harb Perspect. Biol., 17, a020610. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4448618/
- MORTAUD S., MÉRESSE S., LARRIGALDIE V., 2023. Intérêts des cultures in vitro de cellules souches et d’organoïdes dans le cadre d’études toxicologiques. In : Cellules souches et Organoïdes : réalités et perspectives. Taragnat C., Pain B. (Eds). Dossier, INRAE Prod. Anim., 36, 7684.
Résumé
La toxicité de notre environnement et son impact sur la santé préoccupent de plus en plus la population. Certains polluants présents dans l’environnement peuvent affecter l’ensemble de l’environnement et des chaînes trophiques. Dans certains cas, ils peuvent affecter les animaux sauvages, les animaux domestiques, jusqu’à un transfert au sein de l’espèce humaine. Une intoxication correspond à une « introduction ou bio-accumulation d’une substance toxique dans l’organisme ». L’effet de ces substances toxiques est donc important à évaluer pour anticiper ses conséquences sur les organismes. Selon le modèle utilisé, ces évaluations peuvent contenir des biais importants. En effet le métabolisme est différent d’un organisme à l’autre, et donc la capacité à gérer un toxique de l’environnement, à le bio-accumuler ou à l’éliminer est spécifique de l’espèce. La toxicité pour l’animal les assimilant et la disponibilité de ces substances lors de la consommation humaine sont donc très variables. Cette problématique est retrouvée dans un autre contexte toxicologique, celui des drogues médicamenteuses. L’étude toxicologique devrait donc se faire de façon spécifique à l’espèce ciblée, y compris pour l’espèce humaine. En effet un écart important existe entre les résultats obtenus lors des phases pré-cliniques et ceux obtenus lors des essais cliniques. Par ailleurs l’utilisation des modèles animaux fait l’objet d’une réglementation au sein de l’union européenne qui s’attache particulièrement à la limitation de l’utilisation des animaux à des fins scientifiques quand cela est possible. Dans ces contextes se place toute l’importance de méthodes in vitro qui se sont développées au cours des dernières décennies grâce à l’avancée des connaissances fondamentales portant sur les cellules souches, ainsi que des avancées techniques qui y ont été associées. Ces méthodes ont permis la production de cultures en 3 dimensions mimant les structures réelles des organismes, d’où leur nom d’organoïdes. Ces outils deviennent des éléments clés des approches toxicologiques, qu’elles soient liées aux problèmes des expositions à des toxiques ou aux études précliniques humaines et vétérinaires.
Pièces jointes
Pas de document complémentaire pour cet article##plugins.generic.statArticle.title##
 Vues: 3841
Vues: 3841
Téléchargements
 PDF: 575
PDF: 575
 XML: 231
XML: 231

