Potentiel des organoïdes cérébraux comme modèles d’étude des neuropathologies chez les animaux domestiques
Chapeau
Le cerveau est un organe particulièrement complexe et son accès est quasi impossible sans perturber sa structure et son organisation intégrée. Développer des modèles in vitro mimant le tissu et son architecture est un défi auquel les organoïdes cérébraux peuvent désormais contribuer. Ces nouveaux modèles peuvent par exemple aider à mieux étudier les interactions hôte-pathogènes de virus neurotropes touchant certaines espèces agronomiques.
Introduction
Le cerveau est un organe complexe
Le cerveau est un des organes les plus complexes d’un organisme et son accès est délicat aussi bien au cours du développement que de la vie post-natale des individus. Chez les mammifères, toute approche de biopsie est quasi impossible sans modifier sa structure et son organisation intégrée, et donc potentiellement son activité. Cela le distingue d’autres tissus plus plastiques, plus ‘régénérants’ comme la peau, l’intestin, le foie, la moëlle, le tissu adipeux, etc, pour lesquels des biopsies plus ou moins invasives sont possibles sans qu’elles n’endommagent à long terme, la structure du tissu qui va se renouveler. Cela est vrai dans toutes les espèces dont l’homme, les animaux modèles et ceux d’intérêt agronomique. En conséquence, il est difficile d’évaluer les processus morphogénétiques, développementaux et surtout pathologiques qui peuvent affecter ce tissu par des approches analytiques.
Le développement de modèles in vitro qui visent à mimer le développement de cet organe et à proposer de nouvelles approches pour l’étude des processus pathologiques est très attendu et constitue un enjeu majeur du domaine des neurosciences humaines et agronomiques.
Un schéma de développement commun aux différentes espèces
Dans la longue histoire de l'évolution du monde vivant, la mise en place d'un système nerveux est une des principales caractéristiques des métazoaires. D'abord présent sous la forme d'un réseau diffus puis progressivement centralisé au niveau de cordons avec l'apparition de noyaux/ganglions au niveau de chaque segment de l'organisme, le plus important de ces ganglions à l'avant de l'animal va contribuer par son développement au processus de céphalisation et d'apparition d'un cerveau. Si les morphologies d'un annélide, d'un échinoderme, d'un insecte et d'un vertébré apparaissent vraiment très différentes, la mise en place de ce système nerveux obéit à des mécanismes spatio-temporels et moléculaires très similaires retrouvés très tôt dans l'arbre phylogénétique des espèces comme élégamment démontré par Denes et al. (2007), qui mentionne qu'« une grande partie de l'organisation spatiale du système nerveux central (SNC) des annélides et des vertébrés était déjà présent dans leur dernier ancêtre commun ».
Au cours du développement embryonnaire des vertébrés, le processus de gastrulation met en place les trois feuillets, l'ectoderme, le mésoderme et l'endoderme. Dans sa partie dorsale, l'ectoderme s'épaissit d'abord comme une simple feuille épithéliale pseudostratifiée, appelée neuroépithélium puis forme progressivement une gouttière en U avec la plaque neurale pour plancher et des parois et des replis qui vont constituer les futures crêtes neurales. Celles-ci donneront naissance au système nerveux périphérique. Les parois de la plaque neurale se replient, fusionnent et donne naissance en se refermant au tube neural. Cette fermeture s'étend et le tube neural en se différenciant va constituer les différentes parties du SNC. La partie rostrale se développe beaucoup plus vite que la partie caudale et va se segmenter en 3 vésicules primitives (prosencéphale, mésencéphale et rhombencéphale) qui se différencient en dédoublant les structures antérieures et postérieures pour donner les 5 subdivisions encéphaliques à l'origine de toutes les structures anatomiques du cerveau des vertébrés – le télencéphale, diencéphale, mésenséphale, métencéphale et myélencéphale (Puelles et al., 2003) comme illustré (figure 1).
Figure 1. Schéma illustrant les principales subdivisions embryonnaires du cerveau des vertébrés.
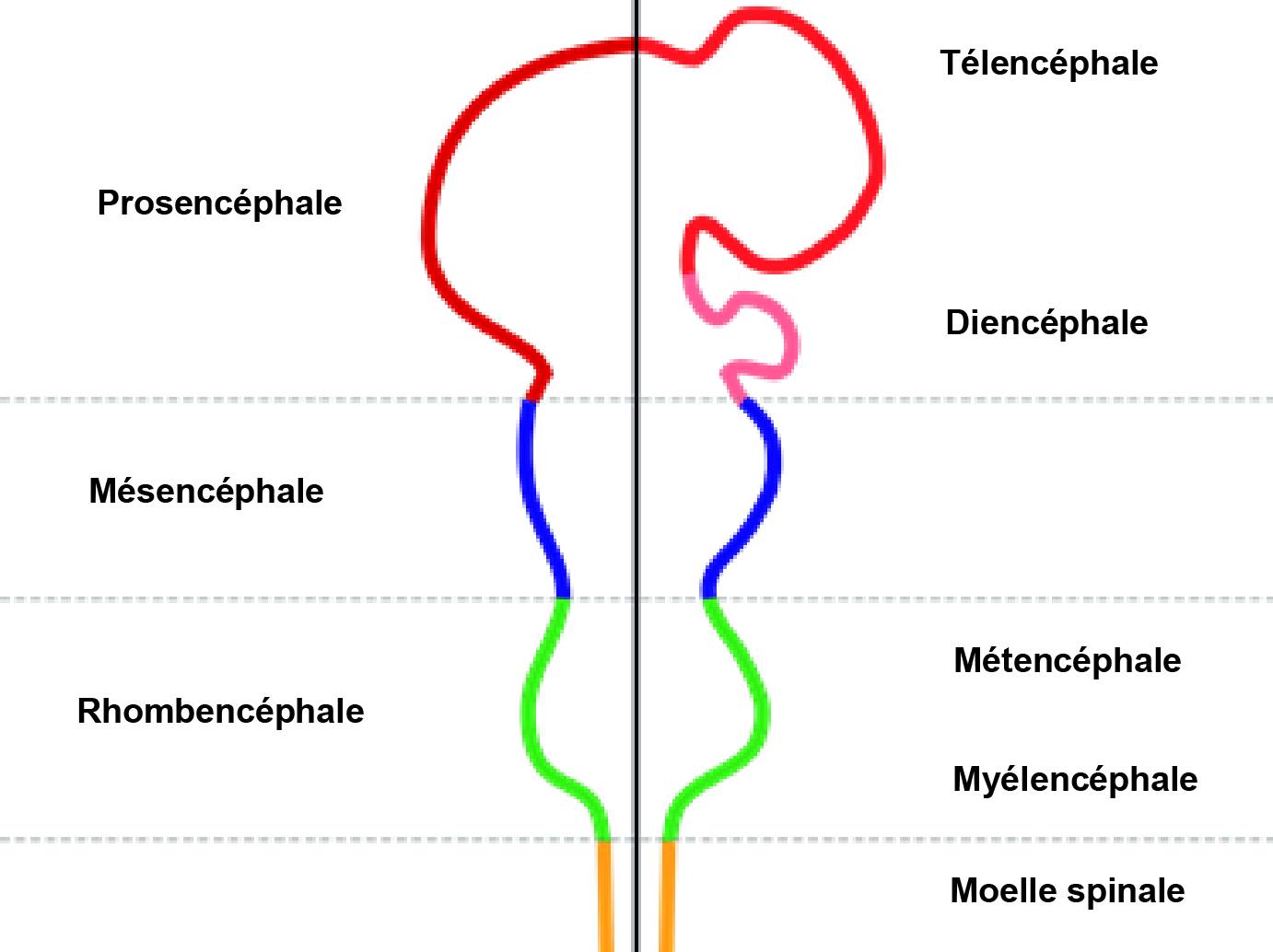
Le tube neural se différencie en 3 vésicules primitives (prosencéphale, mésencéphale et rhombencéphale) qui se différencient ensuite en 5 vésicules télencéphale, diencéphale, mésenséphale, métencéphale et myélencéphale. (Wikimedia Commons)
Comme pour beaucoup de tissus au cours du développement, la mise en place et la différenciation des différents types cellulaires sont contrôlés par des gradients de morphogènes. Dans le cas du tube neural puis de la formation des différentes vésicules, il existe un double gradient antiparallèle des facteurs de croissances SHH (Sonic Hedgehog) et BMP (Bone morphogenetic protein) qui définit l'axe dorso-ventral (Zagorski et al., 2017). De façon similaire, des interactions complexes entre les facteurs WNT (« Wingless »), FGF (« Fibroblaste Growth Factor ») et l'acide rétinoique (RA) contrôlent l'axe antéro-postérieur au travers de l'expression de facteurs de transcriptions spécifiques (Green et al., 2015).
Selon les espèces et les temps de développement embryonnaire, ce processus est plus ou moins rapide. Chez l'homme, le processus d'induction neurale commence au jour 12 de la gestation, avec l'établissement de la lignée primitive. Ensuite, la neurogenèse est initiée à partir de la semaine 8 de gestation et les premières connexions synaptiques sont établies à partir des semaines 11 à 12 (Silbereis et al., 2016). Les cellules gliales apparaissent plus tard : les astrocytes et les oligodendrocytes sont détectés à partir des semaines 13 et 19, respectivement, et le processus de myélinisation commence dés le 3ème trimestre de la grossesse (Gilmore et Walsh, 2013). Chez les espèces d'intérêt agronomique, notamment les ruminants, petits ruminants et équidés, le cerveau présente également une mise en place progressive et une structure complexe. On mettra en perspective les temps de gestation dans l'espèce humaine avec ceux des principales espèces de mammifères d'intérêt agronomique (tableau 1) pour souligner que les structures cérébrales embryonnaires se mettent en place dans des cinétiques longues au cours du développement, sans mentionner le développement post-natal, également très variable selon les espèces. Cette notion de « temps long » est au centre des approches de modélisation in vitro, notamment par l'approche des organoïdes cérébraux dans le modèle humain pour laquelle le processus de maturation prend plusieurs semaines voire plusieurs mois (Lancaster et al., 2013 ; Kanton et al., 2019 ; Velasco et al., 2019).
Tableau 1. Durée de gestation des mammifères.
Espèce |
Temps de gestation moyen |
|---|---|
Femme (Homo sapiens) |
273 (9 mois) |
Souris (Mus musculus) |
21 |
Truie (Sus scorfa) |
115 |
Chèvre (Capra hercus) |
150 |
Brebis (Ovis aries) |
150 |
Vache (Bos taurus) |
280 |
Jument (Equus caballus) |
336 |
Anesse (Equus asinus) |
365 |
Un processus de gyrification unique aux mammifères
Les comparaisons des structures cérébrales de différentes espèces de mammifères sont généralement effectuées entre les rongeurs, les primates non humains et les humains. Elles sont plus rares avec d'autres grands mammifères bien que plusieurs études d'imagerie par résonance magnétique (IRM) et un atlas cérébral aient été publiés pour le porc (Conrad et al., 2014), le bovin (Ballarin et al., 2016), l'ovin (Liyanage et al., 2016) et le cheval (Schmidt et al., 2019). Les paramètres du quotient d'encéphalisation (EQ) et du quotient cérébelleux (CQ), définis comme le rapport théorique entre la taille totale du cerveau observée (ou la taille du cervelet pour le CQ) et la masse corporelle donnée (Jerison, 1977) ont permis de comparer la taille des cerveaux de différentes espèces dont les mammifères incluant les animaux domestiques (Ballarin et al., 2016 ; Steinhausen et al., 2016 ; Smaers et al., 2021). Au cours du développement de l'encéphale, la présence d'un processus de gyrification commun à l'homme, aux primates non humains et aux gros animaux (voir encadré 1) permet de considérer les modèles porcins comme modèles d'intérêt pour l'homme, peut-être plus accessibles que les primates non humains. L'intérêt du modèle porcin a particulièrement été souligné par Conrad et al. (2012) ; Conrad et al. (2014) qui indiquent que « les porcs ont un cerveau gyrencéphalique qui peut être étudié à l'aide de scanners/protocoles IRM cliniques » (2014) et aussi que « la forte augmentation du volume cérébral dans la période post-natale est similaire à celle des nouveau-nés humains et suggère que les porcs peuvent être utilisés pour étudier le développement du cerveau » (2012). Différents gènes sont impliqués dans la formation de ces gyri parmi lesquels la ꞵ-caténine (Chenn et Walsh, 2002) ou le gène spécifique humain ARHGAP11B dont l'expression chez la souris (Florio et al., 2015), le furet (Kalebic et al., 2018) ou le ouistiti (Heide et al., 2020) modifie la prolifération de progéniteurs et conduit à l'expansion du cortex et à une gyrification accrue dans ses différents modèles. Une étude récente sur le gène NDE1 « NudE Neurodevelopment Protein 1 »,- dont la protéine est impliquée dans la régulation de la fonction de la dynéine et dont les mutations sont associées à la microlissencéphalie chez l'homme - a montré que l'épissage alternatif d'un exon terminal de ce gène pourrait être responsable de l'apparition de gyri chez les mammifères, y compris les porcins et bovins (Soto-Perez et al., 2020).
La gyrification est le processus qui aboutit lors du développement précoce et infantile de l’individu à la plissure de la surface du cerveau en crêtes et sillons (gyri et sulci) propres à certains mammifères, dont l’homme pour lequel le processus est maximal au niveau du cortex.
Notre connaissance du cerveau des animaux domestiques a fortement progressé ces dernières années, plusieurs études se focalisant sur certaines de leurs sous-structures (hypothalamus, substance noire, cervelet…), notamment chez les bovins (Peruffo et Cozzi, 2014 ; Ballarin et al., 2016), ovins (Liyanage et al., 2016 ; John et al., 2017), équins (Schmidt et al., 2019) et porcins (Minervini et al., 2016 ; Ryan et al., 2018). Ces études ont principalement porté sur la description des systèmes d'innervation, la composition en neurones et cellules gliales (Jelsing et al., 2006), la distribution de neurotransmetteurs spécifiques (Pirone et al., 2018) et la connectivité fonctionnelle (Simchick et al., 2019). Récemment, l'importance du modèle porcin pour explorer de nouvelles manières expérimentales et éthiques d'envisager la mort a été soulignée par le rapport original sur la « restauration des réponses inflammatoires vasculaires dilatatrices et gliales, de l'activité synaptique spontanée et du métabolisme cérébral actif en l'absence d'activité électro-corticographique globale » dans le cerveau de porc post-mortem de quatre heures (Vrselja et al., 2019).
Au niveau moléculaire, les analyses transcriptomiques et protéomiques ont également permis de comparer les profils d'expression génique et protéique entre l'homme et différentes espèces animales dont le porc et qui s'avèrent in fine très similaires entre les espèces (Sjöstedt et al., 2020).
Comment mimer le cerveau
Comme souligné, il est particulièrement délicat d'accéder au tissu cérébral et les modèles cellulaires sont une des voies privilégiées pour étudier le développement du cerveau et mimer son dysfonctionnement. Les cellules souches pluripotentes (CSPs) sont rapidement apparues comme le modèle de choix par leur propriétés uniques. D'abord utilisées dans des approches de cellules adhérentes en monocouche (2D), de nouvelles approches tridimensionnelles (3D) ont été développées, notamment avec la mise au point des organoïdes cérébraux (Eiraku et al., 2008 ; Lancaster et al., 2013).
Différents types de cellules souches peuvent générer des organoïdes, selon leur origine développementale ou tissulaire (Rossi et al., 2018). Dans une description très générale, les principales étapes pour générer un organoïde sont tout d'abord la prolifération initiale de cellules souches et précurseurs dans une structure 3D, puis leur différenciation sous l'effet d'inducteurs (milieux, facteurs de croissance, petites molécules chimiques, matrice…). Des changements dans les conditions de culture sont mis en place séquentiellement pour guider cette différenciation et l'ensemble du processus assure le développement et la maturation de l'organoïde qui présente alors une architecture et plusieurs types cellulaires représentatifs du tissu. Les cellules souches cancéreuses peuvent également produire dans certaines conditions de culture des structures tridimensionnelles (tumoroïdes), mais ne sont pas considérées dans le contexte présenté ici.
Dans la suite de cette revue, nous présentons successivement les cellules souches pluripotentes, la production et l’utilisation des organoïdes, notamment dans une perspective d’interaction hôte-pathogènes pour l’étude des encéphalites virales (avec l’exemple du cheval) avant de mettre en perspective les développements en cours pour complexifier encore davantage ces structures uniques que sont les organoïdes cérébraux.
1. Les cellules souches pluripotentes
Elles sont de deux types (les cellules souches pluripotentes embryonnaires et induites) présentées ci-après.
1.1. Les cellules souches pluripotentes embryonnaires (CSPEs)
Les CSPEs ont été isolées pour la première fois dans les années 1980 à partir d'embryons murins (Evans et Kaufman, 1981). Caractérisées par leur auto-renouvellement et leur potentiel de différenciation in vitro, les CSPEs de souris ont également la propriété unique de contribuer en plus du chimérisme somatique à la colonisation de la lignée germinale d'un embryon lorsqu'elles sont injectées dans un blastocyste préimplantatoire. Les CSPEs de primates non humains et humains ont été obtenues pour la première fois dans les années 1990 (Thomson et al., 1995, Thomson et al., 1998) à partir de culture d'embryons préimplantatoires. Selon les espèces, les conditions de culture restent le point critique dans l'établissement et la plasticité de ces cellules.
Dans les années 2000, des cellules souches épiblastiques (EpiSCs) ont été isolées à partir d'un embryon de souris post-implantation (Brons et al., 2007 ; Tesar et al., 2007). Contrairement aux CSPEs, les EpiSCs n'ont pas la propriété de contribuer au chimérisme in vivo bien qu'elles conservent les propriétés de différenciation in vitro dans les trois lignées embryonnaires (l'ectoderme, l'endoderme et le mésoderme). La propriété de colonisation de l'embryon et, en particulier, de colonisation germinale est actuellement considérée comme l'un des critères les plus exigeants, permettant de distinguer les CSPEs dans un état dit « naïf » versus un état « amorcé », dont l'archétype est représenté par les EpiSCs (Nichols et Smith, 2009). De nombreuses publications ont caractérisé ces deux types de cellules souches qui diffèrent à la fois par leurs conditions de culture et leur potentiel développemental ainsi que par leurs caractéristiques moléculaires et épigénétiques (Marks et al., 2012 ; Martello et al., 2012 ; Tosolini et al., 2018).
Plus récemment, un état formatif a été introduit comme « une troisième phase, appelée pluripotence formative, proposée pour exister dans le cadre d'un continuum de développement entre les phases naïve et amorcée » (Smith, 2017), état qui a pu être « capturé in vitro à la fois dans le modèle murin et humain (Kinoshita et al., 2021a).
L'existence de ces mêmes stades - naïf, amorcé et formatif - chez d'autres espèces que les rongeurs est encore largement débattue, notamment dans les modèles primates non humains et humains, pour lesquels de nombreux travaux ont tenté de définir des conditions de culture pour obtenir et maintenir des cellules naïves (Nakamura et al., 2016). En particulier, l'utilisation de différents cocktails de petites molécules inhibant les voies de signalisation a été décrite, permettant d'obtenir des cellules naïves (Guo et al., 2016 ; Bredenkamp et al., 2019).
Chez les espèces d'intérêt agronomique, des cellules de type « souches pluripotentes embryonnaires – CSPEs » avec des propriétés d'auto-renouvellement et de différenciation ont été isolées, amplifiées et établies en lignées chez les porcins (Park et al., 2013 ; Gao et al., 2019 ; Zhi et al., 2022), les bovins (Bogliotti et al., 2018), les ovins et caprins (De Kumar et al., 2011 ; Vilarino et al., 2020), les équins (Paris et Stout, 2010) et les lapins (Tancos et al., 2012). La plupart de ces cellules sont caractérisées par leur potentiel de prolifération et de différenciation in vitro et par la présence de certains marqueurs, comme les antigènes de surface, dont SSEA1, SSEA3 et SSEA4, des antigènes initialement identifiés chez la souris mais dont la réactivité croisée avec d'autres espèces s'est avérée importante pour l'identification de ces cellules. Mais leur potentiel développemental n'a pas été évalué (Koh et Piedrahita, 2014 ; Ezashi et al., 2016).
Plus récemment, en utilisant des stratégies similaires à celles développées pour les cellules humaines (à base de cocktails de molécules inhibitrices), des études ont été menées pour obtenir des CSPEs plus « naïves » chez les espèces bovine et porcine même si des expériences de chimères n'étaient pas mentionnées (Bogliotti et al., 2018 ; Gao et al., 2019). En parallèle, des analyses moléculaires réalisées au niveau de cellules isolées d'embryons préimplantatoires ont permis de mieux définir les marqueurs associés à ces stades précoces chez différentes espèces (bovins, porcs, lapins) et de les comparer avec la souris, le primate non humain et l'humain (Bernardo et al., 2018 ; Ramos-Ibeas et al., 2019). Les dernières conditions mises au point pour les espèces bovine, porcine et ovine, calquées sur l'état formatif humain (Kinoshita et al., 2021a), semblent permettre l'obtention de lignées de cellules capables de coloniser efficacement les embryons, comme démontré dans le modèle porcin (Kinoshita et al., 2021b). Ces cellules seraient ainsi d'excellents supports pour le développement de nouvelles approches in vivo et in vitro, notamment pour l'obtention des organoïdes cérébraux
1.2. Les cellules souches pluripotentes induites (CSPIs)
La mise au point de la reprogrammation somatique en 2006 a constitué une véritable révolution dans le domaine des CSP (Takahashi et Yamanaka, 2006). En criblant un ensemble de 24 gènes tous fortement exprimés dans les CSP, l'équipe de S. Yamanaka a ainsi identifié une combinaison minimale de quatre gènes, les gènes OCT4, SOX2, KLF4 et c-MYC qui était capable de « reprogrammer » un fibroblaste c'est-à-dire de donner à cette cellule des propriétés similaires à une CSP. Cette combinaison OSKM est définie comme la combinatoire canonique de la reprogrammation. Ce concept de reprogrammation somatique consiste donc à exprimer une combinatoire de gènes – dont des facteurs de transcription impliqués dans le contrôle de la pluripotence – dans une cellule somatique, conduisant ainsi à sa reprogrammation en cellule souche pluripotente induite (CSPI). Par la suite, d'autres combinaisons ont été identifiées comme OSNL avec OCT4, SOX2, NANOG et LIN28) (Yu et al., 2007) ainsi que le rôle d'autres gènes comme NR5A2, ESRRB, GLIS1, ZIC3, TBX3, H1F00, NKX3.2, et MIR302 (liste non exhaustive). Ces facteurs participent directement au processus de reprogrammation ou augmentent son efficacité (David et Polo, 2014). Les CSPIs partagent la plupart des propriétés des CSPEs mais sans le questionnement éthique de l'utilisation et de la destruction des embryons lors de leur mise en culture. De plus, par cette approche de reprogrammation, des CSPIs peuvent être obtenues à partir de n'importe quel individu ou animal, sain ou malade, porteur de mutation génétique ou non, et donc de tout génotype ouvrant entre autres aussi la voie à l'étude de nombreuses pathologies, voir à une médecine personnalisée pour l'Homme. Initialement démontré dans le modèle murin, le concept a été rapidement étendu aux primates non humains, à l'homme (Yu et al., 2007) et à de nombreuses autres espèces agronomiques comme les lapins (Honda et al., 2013 ; Osteil et al., 2013), les moutons et les bovins (Liu et al., 2012 ; Sandmaier et al., 2015 ; Talluri et al., 2015), les porcs (Ezashi et al., 2009 ; Rodríguez et al., 2012 ; Congras et al., 2016) et les chevaux (Nagy et al., 2011 ; Breton et al., 2013). Cependant, chez la plupart de ces espèces, il est difficile de valider le statut complet des cellules reprogrammées car leur potentiel de développement est rarement testé (De Los Angeles et al., 2015).
2. Les organoïdes cérébraux
2.1. Les travaux pionniers
Les propriétés d'auto-renouvellement et de différenciation des CSPEs ou des CSPIs sont les deux propriétés essentielles pour obtenir des organoïdes. Les travaux pionniers du laboratoire de Y. Sasai (Eiraku et al., 2008) dans le modèle neural puis de H. Clevers (Sato et al., 2009) dans le modèle intestinal ont été rapidement popularisés avec le développement de nombreuses approches pour la production d'organoïdes dans la plupart des tissus. La plupart de ces études ont été initialement réalisées sur des modèles murins et humains et, à ce jour, peu de données sont disponibles pour d'autres espèces, en particulier agronomiques et aucune pour les organoides cérébraux (Augustyniak et al., 2019 ; Pain, 2021 ; Pain et al., 2021).
Le développement des organoïdes cérébraux humains a été initié avec les travaux pionniers du laboratoire de J. Knoblich (Lancaster et al., 2013). Les CSPIs humaines sont induites dans la voie neurale de manière contrôlée et la structure obtenue s'auto-organise et se différencie en un organoïde lamellaire multicouche, similaire à la structure observée lors du développement du SNC. Ces premières études ont mis en évidence la nécessité d'un protocole en plusieurs étapes avec diverses conditions de culture. Initialement, les agrégats sont placés dans une matrice qui maintient l'organoïde en suspension et évite la polarisation des cellules. Puis ces gouttes sont placées dans un bioréacteur maintenu sous agitation qui permet le développement de structures 3D pendant plusieurs semaines. Un ensemble diversifié de marqueurs des précurseurs neuraux tels que SOX1, PAX6, TBR2, NESTIN et de marqueurs neuronaux exprimés plus tardivement tels que TUJ1, MAP2, CTIP2, SATB2, etc., est utilisé pour suivre le développement et la différenciation des organoïdes cérébraux (figure 2).
Le « développement du cerveau humain présente une organisation unique de la zone progénitrice », c'est-à-dire que la présence de la zone sous-ventriculaire externe (OSVZ) est typique du néocortex de l'homme et des primates non humains (Dehay et al., 2015). Or comme les marqueurs de ces zones étaient présents et organisés dans les organoïdes de façon similaire au tissu in vivo, il a été conclu que la structure 3D obtenue pouvait bien récapituler au moins certains aspects du développement cortical précoce humain (Lancaster et al., 2013).
Figure 2. Production d'organoïdes cérébraux dans le modèle humain (d'après Pain et al., 2021).
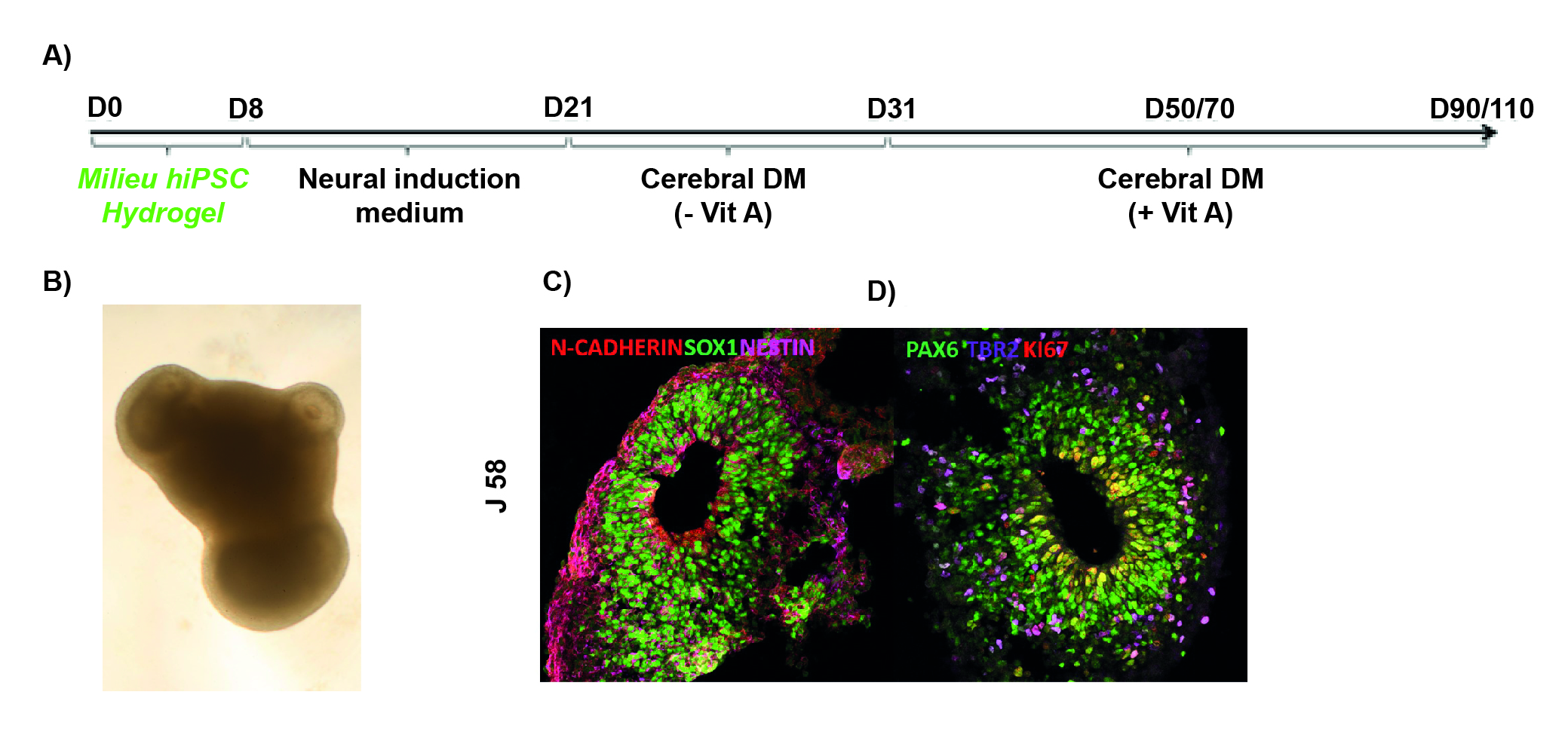
A) Le processus de production des organoïdes cérébraux débute par l’agrégation des hiPSCs et leur induction dans un milieu d’induction neurale. Différentes conditions de cultures permettent alors d’obtenir des organoïdes cérébraux qui se différencient et s’engagent dans des processus de maturation aboutissant à la formation de structures complexes avec des rosettes apparentes (B), rosettes qui expriment différents marqueurs analysés à 58 jours (J58) après induction comme SOX1, NESTIN et N-CADHERIN (C) ou KI67, marqueur de la prolifération des précurseurs qui sont PAX6 et TBR2 positifs (D).
2.2. Organoides et zones du cerveau
Au fur et à mesure du développement des protocoles de production des organoïdes cérébraux humains, il a également été possible d'obtenir des organoïdes cérébraux représentatifs de différentes zones du cerveau en changeant surtout les combinatoires de facteurs de croissance et de cytokines ajoutés au cours des différentes étapes d’induction.
Une liste non exhaustive de différents exemples de structures a été établie avec les références des protocoles utilisés (Qian et al., 2019). Celle-ci comprend des inductions non guidées, générant des organoïdes avec mélange de structures, et des inductions guidées par l'addition de molécules chimiques et facteurs de croissances spécifiques pour générer une structure en particulier. Ces molécules sont également souvent celles identifiées comme les morphogènes importants lors de la mise en place des structures neurales au cours du développement (SHH, BMP, FGF, WNT, RA…(Cederquist et al., 2019). Les inductions guidées peuvent conduire par exemple à des organoïdes corticaux, ceux correspondant aux différentes structures du télencéphale, du cervelet, du cerveau antérieur, ceux du plexus choroïde, de l'hippocampe, du mésencéphale ainsi que l'organoïde mimant l'hypophyse antérieure et le récent organoïde du plexus choroïde avec vésicule qui mime la barrière du SNC avec le liquide céphalo rachidien (Lancaster et al., 2017 ; Pellegrini et al., 2020). D'autres avancées ont été faites avec le développement des assembloïdes qui consistent soit à mélanger/fusionner les prosencéphales dorsaux et ventraux dans le but de mimer certains processus de projection (Bagley et al., 2017), soit à mélanger l'éminence ganglionnaire médiale humaine (MGE) avec un organoïde cortical, ce dernier étant utilisé pour modéliser la migration des interneurones humains (Xiang et al., 2017). Les relations entre différents tissus neuraux commencent également à être mimés pour être mieux étudier comme l'atteste l'obtention d'organoïdes cérébraux avec vésicules optiques (Gabriel et al., 2021) ou le développement des interactions neuro-musculaires dans des assembloïdes réalisés entre des organoïdes cérébraux (corticaux ou de cerveau postérieur/moêlle épinière) et des sphéroïdes du muscle squelettique humain pour générer des assembloïdes cortico-moteurs dans une structure 3D (Andersen et al., 2020).
Il est important de noter que les analyses transcriptomiques ont démontré que les divers et nombreux types cellulaires identifiés dans le cerveau ont également été identifiés dans les structures 3D humaines in vitro (Camp et al., 2019). L'acquisition de la diversité cellulaire s'avère progressive et, sur une période de 6 mois de culture, la plupart des types cellulaires se retrouvent comme dans le tissu de référence. Le séquençage au niveau cellule unique a également montré que les organoïdes cérébraux humains récapitulaient remarquablement bien le programme d'expression génique progressivement activé au cours du développement du néocortex fœtal humain (Camp et al., 2019 ; Velasco et al., 2019).
Une autre caractéristique importante des organoïdes cérébraux est la démonstration de leur fonctionnalité. Par exemple, le mouvement nucléaire intercinétique typique (un mouvement périodique du noyau cellulaire en phase avec la progression du cycle cellulaire qui est observé dans les progéniteurs prolifératifs engagés dans la différenciation au cours du développement cortical) et les activités électriques ont été observés dans les organoïdes cérébraux 3D (Trujillo et al., 2019).
3. De nombreux exemples de virus neurotropes
3.1. De nombreuses familles virales
En raison de la similitude dans leur développement et de l'architecture tissulaire obtenue, même encore imparfaite, les organoïdes cérébraux humains sont des modèles in vitro de plus en plus utilisés dans les études sur le neurodéveloppement, la modélisation des pathologies neurodégénératives, l'évaluation de la toxicité de molécules et pour l'étude de nombreuses encéphalites d'origine bactérienne ou virales (Arlotta, 2018). Les organoïdes cérébraux ont montré leur potentiel élevé lorsque le virus Zika est apparu en Amérique du Sud en 2016 et a été déclaré urgence de santé publique par l'Organisation mondiale de la santé en raison de son association possible avec de multiples cas de microcéphalie chez les nouveau-nés. Ils ont été utilisés pour démontrer le rôle causal du virus dans cette maladie dévastatrice ainsi que pour élucider les mécanismes qui conduisent à une altération de la neurogenèse (Qian et al., 2016 ; Krenn et al., 2021) et pour tester des molécules antivirales (Xu et al., 2016). Ce domaine de l'étude des interactions hôte-virus neurotrope et de leurs contrôles est sans doute le plus facilement transposable aux sciences vétérinaires (Antonucci et Gehrke, 2019).
Les virus neurotropes affectant les animaux domestiques appartiennent à de nombreuses familles et genres, dont les Lyssavirus, Flavivirus, Alphavirus, Bunyavirus, etc…. Le virus de la rage, un Rhabdovirus du genre Lyssavirus, est probablement le plus connu des virus neurotropes. Il est capable d'infecter tous les mammifères, mais les chiens, les carnivores sauvages et les chauves-souris sont considérés comme ses réservoirs naturels. Dans 99 % des cas, la transmission à l'homme se fait par le chien. Elle induit une encéphalite aiguë et progressive, avec une létalité proche de 100 % (Green, 1997). Le virus de la stomatite vésiculeuse, un autre Rhabdovirus mais du genre Vesiculovirus, affecte les porcs, les bovins et les chevaux dans l'hémisphère occidental. Il est rarement zoonotique mais une infection chez l'enfant a cependant été décrite (Rodríguez, 2002). Les Flavivirus de la famille des Flaviviridae forment un autre genre comprenant de nombreux virus neurotropes responsables d'encéphalites chez l'homme et le cheval (virus West Nile, virus de l'encéphalite japonaise, virus de l'encéphalite de Saint-Louis, virus de l'encéphalite de Murray Valley…) et chez l'ovin (virus Louping Ill) (Kumar et al., 2018). Les encéphalites à Louping Ill sont cependant rares chez l'homme (Desole et al., 2019). Les Alphavirus, (virus des encéphalites équines de l'Est, de l'Ouest et Vénézuélienne) et le mammalian 1 orthobornavirus de la famille des Bornaviridae peuvent également provoquer des encéphalites, potentiellement mortelles, chez l'homme et le cheval. (Lecollinet et al., 2019). Les hénipavirus, dont l'émergence s'est produite dans les années 1990, provoquent également des encéphalites chez l'homme et les animaux avec des taux de mortalité très élevés dans les deux cas. Les virus Nipah et Hendra ciblent respectivement les porcs et les chevaux. Les humains sont infectés soit directement par les chauves-souris (leur réservoir naturel) soit par contact avec des porcs et des chevaux infectés (leur hôte amplificateur) (Weatherman et al., 2018 ; Wang et Anderson, 2019). Parmi les virus non zoonotiques, le virus Schmallenberg, un Bunyavirus apparu en Allemagne en 2001 et transmis par des vecteurs Culicoides, affecte les ruminants (principalement bovins, mais aussi ovins, caprins et ruminants sauvages) et induit diverses lésions neurologiques (cécité, ataxie, paralysie, convulsions et sévères malformations du cerveau du veau au cours du développement) (Conraths et al., 2013) et le virus de l'encéphalomyélite hémagglutinante porcine, un coronavirus, induit une encéphalomyélite chez les porcelets de moins de 3 semaines (Dong et al., 2014). Enfin, l'herpès virus équin 1, distribué dans le monde entier est responsable de myéloencéphalopathies chez les chevaux (Oladunni et al., 2019). À noter qu'à l'exception des chevaux qui sont fortement touchés par de nombreux virus neurotropes, les principales pertes économiques induites par les virus chez les animaux domestiques ne sont pas dues à des troubles neurologiques.
3.2. Organoïdes cérébraux de cheval
Ainsi, le cheval apparait comme un modèle de choix pour le développement des organoïdes cérébraux. Nos travaux (non encore publiés) et ceux de Fortuna et al. (2018) ont déjà montré que des cellules neurales obtenues à partir de CSPI équines pouvaient être infectées par des Flavivirus et Alphavirus neurotropes, ouvrant la porte à des infections des organoïdes cérébraux équins. L'avantage d'un modèle 3D versus les cellules 2D réside notamment dans la complexité des interactions cellulaires qui sont présentes dans l'architecture tridimensionnelle de ces structures plus similaires au tissu que la culture 2D. En se basant sur une approche similaire à celle développée avec les CSPI humaines, nous avons obtenu, par reprogrammation somatique de cellules de l'oreille, des CSPI équines. Puis, selon une cinétique proche de celle suivie avec les cellules humaines, nous avons induit la formation d'organoides cérébraux (figure 3). Ces nouveaux modèles équins seront prochainement utilisés pour mimer les processus d'infection par des virus neurotropes.
Figure 3. Production d’organoïdes cérébraux dans le modèle équin
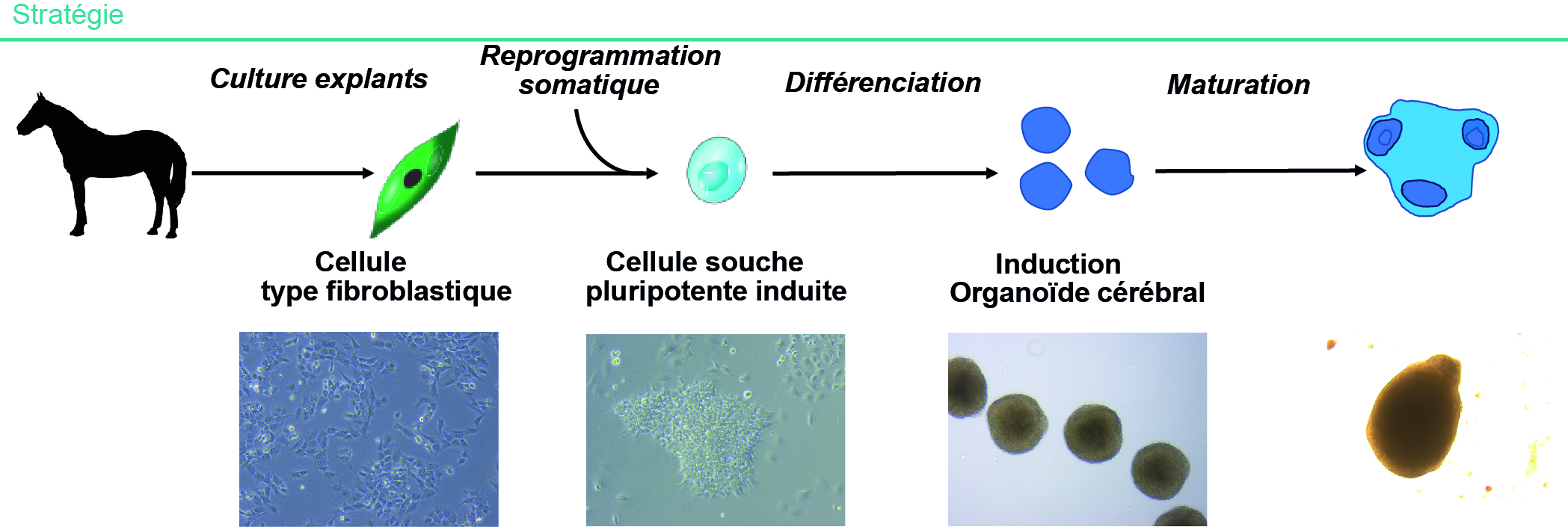
À partir de biopsies de tissus équins, notamment d’oreille, des cellules souches pluripotentes induites sont obtenues par reprogrammation somatique (avec le virus Sendaï apportant les facteurs de reprogrammation). Ces cellules sont induites en organoïdes cérébraux selon des protocoles similaires à ceux développés pour les organoïdes humains. Les marqueurs associés sont également très similaires à ceux détectés dans les organoïdes humains. Ces nouveaux modèles équins sont une base d’exploration originale des interactions hôte-pathogènes de virus neurotropes affectant à la fois l’homme et le cheval.
4. La perspective de complexification des modèles
La complexité et les processus du développement cérébral ont été largement étudiés notamment chez l'homme mais proportionnellement peu chez les animaux domestiques. Cependant, comme mentionné précédemment, quelques études comparatives ont démontré une forte proximité des structures cérébrales chez différentes espèces de mammifères, suggérant que des mécanismes cellulaires et moléculaires similaires sous-tendent le développement cérébral chez beaucoup d’espèces. On peut ainsi espérer que les protocoles développés pour obtenir des organoïdes du cerveau humain pourraient être transposés aux espèces domestiques. Nous essayons de le démontrer dans le modèle équin (figure 2), espèce pour laquelle le besoin est vraiment important au regard de la problématique des nombreuses encéphalites virales observées chez cette espèce. On peut également espérer que le développement de nouveaux protocoles de dérivation de CSPEs et CSPIs dans les espèces agronomiques va permettre d’obtenir des cellules avec des propriétés de différenciation améliorées pour générer des organoïdes cérébraux dans les différentes espèces d'intérêt. Cela permettrait de questionner les mécanismes neuropathogéniques, tels que ceux induits par des virus dans des modèles animaux domestiques qui sont pertinents et seraient très bénéfiques pour la recherche vétérinaire.
Enfin, les derniers développements dans le domaine des organoïdes cérébraux, comme la constitution d'assembloïdes (Bagley et al., 2017 ; Paşca, 2019), les premiers tests de vascularisation d'organoïdes et l'obtention de structures mimant la barrière hémato-encéphalique élargissent encore le champ des possibilités d'utilisation de ces structures innovantes (Pham et al., 2018 ; Ham et al., 2020 ; Pellegrini et al., 2020). L'absence de microglie demeure encore un obstacle pour mimer au mieux la physiologie complexe et complète du cerveau (Varrault et al., 2019), mais de premiers essais sont développés pour obtenir une microglie endogène (Ormel et al., 2018 ; Cakir et al., 2022) ou pour introduire dans le modèle des cellules microgliales (Fagerlund et al., 2021 ; Xu et al., 2021).
Dans tous les cas, le développement des organoïdes participera et conduira sans aucun doute à une réduction très importante de l'utilisation des animaux dans les protocoles expérimentaux, satisfaisant ainsi la règle des 3R – raffiner, réduire, remplacer. Ce sera certainement une force motrice majeure pour mener des recherches visant à améliorer le développement de ces approches pour les espèces domestiques.
Conclusion
Les récentes évolutions dans l’obtention de CSPEs et CSPIs les plus plastiques possibles dans les espèces de mammifères d’intérêt agronomique permettent d’envisager le développement de nouveaux protocoles pour obtenir des organoïdes cérébraux très similaires à ceux obtenus chez l’homme. Ceux-ci sont devenus un outil indispensable en neurosciences et on peut s’attendre dans les années qui viennent à de réelles avancées en recherche vétérinaire dans ce domaine, notamment pour les études des interactions hôtes-pathogènes neurotropes.
Remerciements
Les résultats présentés dans cette revue sur le modèle équin ont été obtenus dans le cadre du projet CRB-ANIM - ANR-11-INBS-0003 (BP).
Références
- Andersen J., Revah O., Miura Y., Thom N., Amin N.D., Kelley K.W., Singh M., Chen X., Thete M.V., Walczak E.M., Vogel H., Fan H.C., Paşca S.P., 2020. Generation of functional human 3d cortico-motor assembloids. Cell, 183, 1913-1929.e26. doi:10.1016/j.cell.2020.11.017
- Antonucci J., Gehrke L., 2019. Cerebral organoid models for neurotropic viruses. ACS Infect. Dis., 5, 1976-1979. doi:10.1021/acsinfecdis.9b00339
- Arlotta P., 2018. Organoids required! A new path to understanding human brain development and disease. Nature Methods, 15, 27-29. doi:10.1038/nmeth.4557
- Augustyniak J., Bertero A., Coccini T., Baderna D., Buzanska L., Caloni F., 2019. Organoids are promising tools for species-specific in vitro toxicological studies. J. Appl. Toxicol., 39,1610-1622. doi:10.1002/jat.3815
- Bagley J.A., Reumann D., Bian S., Lévi-Strauss J., Knoblich JA., 2017. Fused cerebral organoids model interactions between brain regions. Nature Methods, 14, 743-751. doi:10.1038/nmeth.4304
- Ballarin C., Povinelli M., Granato A., Panin M., Corain L., Peruffo A., Cozzi B., 2016. The brain of the domestic bos taurus: weight, encephalization and cerebellar quotients, and comparison with other domestic and wild cetartiodactyla. PloS One, 11, e0154580. doi:10.1371/journal.pone.0154580
- Bernardo A.S., Jouneau A., Marks H., Kensche P., Kobolak J., Freude K., Hall V., Feher A., Polgar Z., Sartori C., Bock I., Louet C., Faial T., Kerstens H.H.D., Bouissou C., Parsonage G., Mashayekhi K., Smith J.C., Lazzari G., Hyttel P., Stunnenberg H.G., Huynen M., Pedersen R.A., Dinnyes A., 2018. Mammalian embryo comparison identifies novel pluripotency genes associated with the naïve or primed state. Biol. Open. 7, bio033282. doi:10.1242/bio.033282
- Bogliotti Y.S., Wu J., Vilarino M., Okamura D., Soto D.A., Zhong C., Sakurai M., Sampaio R.V., Suzuki K., Izpisua Belmonte J.C., Ross P.J., 2018. Efficient derivation of stable primed pluripotent embryonic stem cells from bovine blastocysts. Proc. Natl. Acad. Sci., 115, 2090-2095. https://www.pnas.org/doi/full/10.1073/pnas.1716161115
- Bredenkamp N., Yang J., Clarke J., Stirparo G.G., von Meyenn F., Dietmann S., Baker D., Drummond R., Ren Y., Li D., Wu C., Rostovskaya M., Eminli-Meissner S., Smith A., Guo G., 2019. Wnt inhibition facilitates RNA-mediated reprogramming of human somatic cells to naive pluripotency, Stem Cell Rep., 13, 1083-1098. doi:10.1016/j.stemcr.2019.10.009
- Breton A., Sharma R., Diaz AC., Parham AG., Graham A., Neil C., Bruce Whitelaw C., Milne E., Xavier Donadeu F., 2013. Derivation and characterization of induced pluripotent stem cells from equine fibroblasts. Stem Cells Dev., 22, 611-621. doi:10.1089/scd.2012.0052
- Brons I.G., Smithers L.E., Trotter M.W., Rugg-Gunn P., Sun B., Chuva de Sousa Lopes S.M., Howlett S.K., Clarkson A., Ahrlund-Richter L., Pedersen R.A., Vallier L., 2007. Derivation of pluripotent epiblast stem cells from mammalian embryos. Nature, 448, 191-195. doi:10.1038/nature05950
- Cakir B., Tanala Y., Ridvan Kiral F., Xiang Y., Dagliyan O., Wang J., Lee M., Greaney A.M., Yang W.S., duBoulay C., Kural M.H., Patterson B., Zhong M., Kim J., Bai Y., Min W., Niklason L.E., Patra P., Park I.H., 2022. Expression of the transcription factor PU.1 induces the generation of microglia-like cells in human cortical organoids. Nature Commun. 13, 430. doi:10.1038/s41467-022-28043-y
- Camp J.G., Platt R., Treutlein B., 2019. Mapping human cell phenotypes to genotypes with single-cell genomics. Science, 365, 1401-1405. doi:10.1126/science.aax6648
- Cederquist G.Y., Asciolla J.J., Tchieu J., Walsh R.M., Cornacchia D., Resh M.D., Studer L., 2019. Specification of positional identity in forebrain organoids. Nature Biotechnol., 37, 436-444. doi:10.1038/s41587-019-0085-3
- Chenn et Walsh, 2002. Regulation of cerebral cortical size by control of cell cycle exit in neural precursors. Science, 297, 365-369. doi:10.1126/science.1074192
- Congras A., Barasc H., Canale-Tabet K., Plisson-Petit F., Delcros C., Feraud O., Oudrhiri N., Hadadi E., Griscelli F., Bennaceur-Griscelli A., Turhan A., Afanassieff M., Ferchaud S., Pinton A., Yerle-Bouissou M., Acloque H., 2016. Non integrative strategy decreases chromosome instability and improves endogenous pluripotency genes reactivation in porcine induced pluripotent-like stem cells. Sci. Rep., 6, 27059. doi:10.1038/srep27059
- Conrad M.S., Dilger R.N., Johnson R.W., 2012. Brain growth of the domestic pig (Sus scrofa) from 2 to 24 weeks of age: a longitudinal MRI study. Dev. Neurosci., 34, 291-298. doi:10.1159/000339311
- Conrad M.S., Sutton B.P., Dilger R.N., Johnson R.W., 2014. An in vivo three-dimensional magnetic resonance imaging-based averaged brain collection of the neonatal piglet (Sus scrofa), PLoS One, 9:e107650. doi:10.1371/journal.pone.0107650
- Conraths F.J., Kämer D., Teske K., Hoffmann B., Mettenleiter T.C., Beer M., 2013. Reemerging Schmallenbergs virus infections., Germany, 2012. Emerg. Infect. Dis., 19, 513-514. doi:10.3201/eid1903.121324
- David L., Polo J.M., 2014. Phases of reprogramming. Stem Cell Res., 12, 754-761. doi:10.1016/j.scr.2014.03.007
- De Los Angeles A., Ferrari F., Xi R., Fujiwara Y., Benvenisty N., Deng H., Hochedlinger K., Jaenisch R., Lee S., Leitch H.G., Lensch M.W., Lujan E., Pei D., Rossant J., Wernig M., Park P.J., Daley G.Q., 2015. Hallmarks of pluripotency. Nature, 525, 469-478. doi:10.1038/nature15515
- Dehay C., Kennedy H., Kosik K.S., 2015. The outer subventricular zone and primate-specific cortical complexification. Neuron, 85, 683-694. doi:10.1016/j.neuron.2014.12.060
- Denes A.S., Jékely G., Steinmetz P.R., Raible F., Snyman H., Prud'homme B., Ferrier D.E., Balavoine G., Arendt D., 2007. Molecular architecture of annelid nerve cord supports common origin of nervous system centralization in bilateria. Cell, 129, 277-288. doi:10.1016/j.cell.2007.02.040
- Desole G., Sinigaglia A., Riccetti S., Masi G., Pacenti M., Trevisan M., Barzon L., 2019. Modelling neurotropic Flavivirus infection in human induced pluripotent stem cell-derived systems. Int. J. Mol. Sci., 20, 5404. doi:10.3390/ijms20215404
- Dong B., Lu H., Zhao K., Liu W., Gao W., Lan Y., Zhao J., Tang B., Song D., He W., Gao F., 2014. Identification and genetic characterization of porcine hemagglutinating encephalomyelitis virus from domestic piglets in China. Arch. Virol., 159, 2329-2337. doi:10.1007/s00705-014-2070-y
- Eiraku M., Watanabe K., Matsuo-Takasaki M., Kawada M., Yonemura S., Matsumura M., Wataya T., Nishiyama A., Muguruma K., Sasai Y., 2008. Self-organized formation of polarized cortical tissues from ESCs and its active manipulation by extrinsic signals. Cell Stem Cell., 3, 519-532. doi:10.1016/j.stem.2008.09.002
- Evans M.J., Kaufman M.H., 1981. Establishment in culture of pluripotential cells from mouse embryos. Nature, 292,154-156. doi:10.1038/292154a0
- Ezashi T., Telugu B.P., Alexenko A.P., Sachdev S., Sinha S., Roberts R.M., 2009. Derivation of induced pluripotent stem cells from pig somatic cells. Proc. Natl. Acad. Sci., 106, 10993-10998. doi:10.1073/pnas.0905284106
- Ezashi T., Yuan Y., Roberts R.M., 2016. Pluripotent stem cells from domesticated mammals. Annu. Rev. Anim. Biosci., 4, 223-253. doi:10.1146/annurev-animal-021815-111202
- Fagerlund I., Dougalis A., Shakirzyanova A., Mireia Gómez-Budia M., Pelkonen A., Konttinen H., Ohtonen S., Fazaludeen M.F., Koskuvi M., Kuusisto J., Hernández D., Pebay A., Koistinaho J., Rauramaa T., Lehtonen S., Korhonen P., Malm T., 2021. Microglia-like Cells Promote Neuronal Functions in Cerebral Organoids. Cells, 11, 124. doi:10.3390/cells11010124
- Florio M., Albert M., Taverna E., Namba T., Brandl H., Lewitus E., Haffner C., Sykes A., Wong F.K., Peters J., Guhr E., Klemroth S., Prüfer K., Kelso J., Naumann R., Nüsslein I., Dahl A., Lachmann R., Pääbo S., Huttner W.B., 2015. Human-specific gene ARHGAP11B promotes basal progenitor amplification and neocortex expansion. Science, 347,1465-1470. doi:10.1126/science.aaa1975
- Fortuna P.R.J., Bielefeldt-Ohmann H., Ovchinnikov D.A., Wolvetang E.J., Whitworth D.J., 2018. Cortical neurons derived from equine induced pluripotent stem cells are susceptible to neurotropic Flavivirus infection and replication: an in vitro model for equine neuropathic diseases. Stem Cells Dev., 27, 704-715. doi:10.1089/scd.2017.0106
- Gabriel E., Albanna W., Pasquini G., Ramani A., Josipovic N., Mariappan A., Schinzel F., Karch C.M., Bao G., Gottardo M., Suren A.A., Hescheler J., Nagel-Wolfrum K., Persico V., Rizzoli S.O., Altmüller J., Riparbelli M.G., Callaini G., Goureau O., Papantonis A., Busskamp V., Schneider T., Gopalakrishnan J., 2021. Human brain organoids assemble functionally integrated bilateral optic vesicles. Cell Stem Cell., 28, 1740-1757.e8. doi:10.1016/j.stem.2021.07.010
- Gao X., Nowak-Imialek M., Chen X., Chen D., Herrmann D., Ruan D., Chen ACH., Eckersley-Maslin MA., Ahmad S., Lee YL., Kobayashi T., Ryan D., Zhong J., Zhu J., Wu J., Lan G., Petkov S., Yang J., Antunes L., Campos L.S., Fu B., Wang S., Yong Y., Wang X., Xue S.G., Ge L., Liu Z., Huang Y., Nie T., Li P., Wu D., Pei D., Zhang Y., Lu L., Yang F., Kimber S.J., Reik W., Zou X., Shang Z., Lai L., Surani A., Tam P.P.L., Ahmed A., Yeung W.S.B., Teichmann S.A., Niemann H., Liu P., 2019. Establishment of porcine and human expanded potential stem cells. Nat. Cell Biol., 21, 687-699. doi:10.1038/s41556-019-0333-2
- Gilmore E.C., Walsh C.A., 2013. Genetic causes of microcephaly and lessons for neuronal development. Wiley Interdiscip. Rev. Dev. Biol., 2, 461-478. doi:10.1002/wdev.89
- Green S.L., 1997. Rabies. Vet. Clin. North Am. Equine Pract., 13, 1-11. doi:10.1016/S0749-0739(17)30251-1
- Green D., Whitener A.E., Mohanty S., Lekven A.C., 2015. Vertebrate nervous system posteriorization: Grading the function of Wnt signaling. Dev. Dyn., 244, 507-512. doi:10.1002/dvdy.24230
- Guo G., von Meyenn F., Santos F., Chen Y., Reik W., Bertone P., Smith A., Nichols J., 2016. Naive pluripotent stem cells derived directly from isolated cells of the human inner cell mass. Stem Cell Rep., 6, 437-446. doi:10.1016/j.stemcr.2016.02.005
- Ham O., Jin Y.B., Kim J., Lee M.O., 2020. Blood vessel formation in cerebral organoids formed from human embryonicstem cells. Biochem. Biophys. Res. Commun., 521, 84-90. doi:10.1016/j.bbrc.2019.10.079
- Heide M., Haffner C., Murayama A., Kurotaki Y., Shinohara H., Okano H., Sasaki E., Huttner W.B., 2020. Human-specific ARHGAP11B increases size and folding of primate neocortex in the fetal marmoset. Science, 369, 546-550. doi:10.1126/science.abb2401
- Honda A., Hatori M., Hirose M., Honda C., Izu H., Inoue K., Hirasawa R., Matoba S., Togayachi S., Miyoshi H., Ogura A., 2013. Naive-like conversion overcomes the limited differentiation capacity of induced pluripotent stem cells. J. Biol. Chem., 288, 26157-26166. doi:10.1074/jbc.M113.502492
- Jelsing J., Nielsen R., Olsen A.K., Grand N., Hemmingsen R., Pakkenberg B., 2006. The postnatal development of neocortical neurons and glial cells in the Gottingen minipig and the domestic pig brain. J. Exp. Biol., 209, 1454-1462. doi:10.1242/jeb.02141
- Jerison H.J., 1977. The theory of encephalisation. Ann. N.Y. Acad. Sci., 299, 146-160. doi:10.1111/j.1749-6632.1977.tb41903.x
- John S.E., Lovell T.J.H., Opie N.L., Wilson S., Scordas T.C., Wong Y.T., Rind G.S., Ronayne S., Bauquier S.H., May C.N., Grayden D.B., O'Brien T.J., Oxley T.J., 2017. The ovine motor cortex: A review of functional mapping and cytoarchitecture. Neurosci. Biobehav. Rev., 80, 306-315. doi:10.1016/j.neubiorev.2017.06.002
- Kalebic N., Gilardi C., Albert M., Namba T., Long K.R., Kostic M., Langen B., Huttner W.B., 2018. Human-specific ARHGAP11B induces hallmarks of neocortical expansion in developing ferret neocortex. Elife, 7:e41241. doi:10.7554/eLife.41241
- Kanton S., Boyle M.J., He Z., Santel M., Weigert A., Sanchís-Calleja F., Guijarro P., Sidow L., Fleck J.S., Han D., Qian Z., Heide M., Huttner W.B., Khaitovich P., Pääbo S., Treutlein B., Camp J.G., 2019. Organoid single-cell genomic atlas uncovers human-specific features of brain development. Nature, 574, 418-422. doi:10.1038/s41586-019-1654-9
- Kinoshita M., Barber M., Mansfield W., Cui Y., Spindlow D., Stirparo G.G., Dietmann S., Nichols J., Smith A., 2021a. Capture of mouse and human stem cells with features of formative pluripotency. Cell Stem Cell., 28, 453-471.e8. doi:10.1016/j.stem.2020.11.005
- Kinoshita M., Kobayashi T., Planells B., Klisch D., Spindlow D., Masaki H., Bornelöv S., Stirparo G.G., Matsunari H., Uchikura A., Lamas-Toranzo I., Nichols J., Nakauchi H., Nagashima H., Alberio R., Smith A., 2021b. Pluripotent stem cells related to embryonic disc exhibit common self-renewal requirements in diverse livestock species. Development, 148, dev199901 doi:10.1242/dev.199901
- Koh S., Piedrahita J.A., 2014. From “ES-like” cells to induced pluripotent stem cells: a historical perspective in domestic animals. Theriogenology, 81, 103-111. doi:10.1016/j.theriogenology.2013.09.009
- Krenn V., Bosone C., Burkard TR., Spanier J., Kalinke U., Calistri A., Salata C., Rilo Christoff R., Pestana Garcez P., Mirazimi A., Knoblich JA., 2021. Cell Stem Cell,. 28, 1362-1379.e7. doi:10.1016/j.stem.2021.03.004
- Kumar B., Manuja A., Gulati B.R., Virmani N., Tripathi B.N., 2018. Zoonotic viral diseases of equines and their impact on human and animal health. Open Virol. J., 12, 80-98. doi:10.2174/1874357901812010080
- De Kumar A., Malakar D., Akshey Y.S., Jena M.K., Dutta R., 2011. Isolation and characterization of embryonic stem cell-like cells from in vitro produced goat (Capra hircus) embryos. Anim. Biotechnol., 22, 181-196. doi:10.1080/10495398.2011.622189
- Lancaster M.A., Renner M., Martin C.A., Wenzel D., Bicknell L.S., Hurles M.E., Homfray T., Penninger J.M., Jackson A.P., Knoblich J.A., 2013. Cerebral organoids model human brain development and microcephaly. Nature, 501, 373-379. doi:10.1038/nature12517
- Lancaster M.A., Corsini N.S., Wolfinger S., Gustafson E.H., Phillips A.W., Burkard T.R., Otani T., Livesey F.J., Knoblich J.A., 2017. Guided self-organization and cortical plate formation in human brain organoids. Nat. Biotechnol., 35, 659-666. doi:10.1038/nbt.3906
- Lecollinet S., Pronost S., Coulpier M., Beck C., Gonzalez G., Leblond A., Tritz P., 2019. Viral equine encephalitis., a growing threat to the horse population in Europe? Viruses, 12, 23. doi:10.3390/v12010023
- Liu J., Balehosur D., Murray B., Kelly J.M., Sumer H., Verma P.J., 2012. Generation and characterization of reprogrammed sheep induced pluripotent stem cells. Theriogenology, 77, 338-346.e1. doi:10.1016/j.theriogenology.2011.08.006
- Liyanage K.A., Steward C., Moffat B.A., Opie N.L., Rind G.S., John S.E., Ronayne S., May C.N., OBrien T.J., Milne M.E., Oxley T.J., 2016. Development and Implementation of a Corriedale Ovine Brain Atlas for Use in Atlas-Based Segmentation. PLoS One., 11, e0155974. doi:10.1371/journal.pone.0155974
- Marks H., Kalkan T., Menafra R., Denissov S., Jones K., Hofemeister H., Nichols J., Kranz A., Stewart A.F., Smith A., Stunnenberg H.G., 2012. The transcriptional and epigenomic foundations of ground state pluripotency. Cell. 149, 590-604. doi:10.1016/j.cell.2012.03.026
- Martello G., Sugimoto T., Diamanti E., Joshi A., Hannah R., Ohtsuka S., Göttgens B., Niwa H., Smith A., 2012. Esrrb is a pivotal target of the Gsk3/Tcf3 axis regulating embryonic stem cell self-renewal. Cell Stem Cell., 11, 491-504. doi:10.1016/j.stem.2012.06.008
- Minervini S., Accogli G., Pirone A., Graïc J.M., Cozzi B., Desantis S., 2016. Brain Mass and Encephalization Quotients in the Domestic Industrial Pig (Sus scrofa). PLoSOne, 11, e0157378. doi:10.1371/journal.pone.0157378
- Nagy K., Sung H.K., Zhang P., Laflamme S., Vincent P., Agha-Mohammadi S., Woltjen K., Monetti C., Michael I.P., Smith L.C., Nagy A., 2011. Induced pluripotent stem cell lines derived from equine fibroblasts. Stem Cell Rev Rep., 7, 693-702. doi:10.1007/s12015-011-9239-5
- Nakamura T., Okamoto I., Sasaki K., Yabuta Y., Iwatani C., Tsuchiya H., Seita Y., Nakamura S., Yamamoto T., Saitou M., 2016. A developmental coordinate of pluripotency among mice., monkeys and humans. Nature, 537, 57-62. doi:10.1038/nature19096
- Nichols J., Smith A., 2009. Naive and primed pluripotent states. Cell Stem Cell., 4, 487-492. doi:10.1016/j.stem.2009.05.015
- Oladunni F.S., Horohov D.W., Chambers T.M., 2019. EHV-1: A constant threat to the horse industry. Front Microbiol., 10, 2668. doi:10.3389/fmicb.2019.02668
- Ormel P.R., Vieira de Sa R., van Bodegraven E.J., Karst H., Harschnitz O., Sneeboer M.A.M., Johansen L.E., van Dijk R.E., Scheefhals N., van Berlekom A.B., Ribes Marinez E., Kling S., MacGillavry H.D., van den Berg L.H., Kahn R.S., Hol A.M., de Witte L.D., Pasterkamp R.J., 2018. Microglia innately develop within cerebral organoids. Nat. Commun., 9, 4167. doi:10.1038/s41467-018-06684-2
- Osteil P., Tapponnier Y., Markossian S., Godet M., Schmaltz-Panneau B., Jouneau L., Cabau C., Joly T., Blachère T., Gócza E., Bernat A., Yerle M., Acloque H., Hidot S., Bosze Z., Duranthon V., Savatier P., Afanassieff M., 2013. Induced pluripotent stem cells derived from rabbits exhibit some characteristics of naïve pluripotency. Biol. Open, 2, 613-628. doi:10.1242/bio.20134242
- Pain B., 2021. Organoids in domestic animals: with which stem cells? Vet Res., 52, 38. doi:10.1186/s13567-021-00911-3
- Pain B., Baquerre C., Coulpier M., 2021. Cerebral organoids and their potential for studies of brain diseases in domestic animals. Vet. Res., 52, 65. doi:10.1186/s13567-021-00931-z
- Paris D.B., Stout T.A., 2010. Equine embryos and embryonic stem cells: defining reliable markers of pluripotency. Theriogenology, 74, 516-524. doi:10.1016/j.theriogenology.2009.11.020
- Park J.K., Kim H.S., Uh K.J., Choi K.H., Kim H.M., Lee T., Yang B.C., Kim H.J., Ka H.H., Kim H., Lee C.K., 2013. Primed pluripotent cell lines derived from various embryonic origins and somatic cells in pig. PLoSOne, 8, e52481. doi:10.1371/journal.pone.0052481
- Paşca S.P., 2019. Assembling human brain organoids. Science, 363, 126-127. doi:10.1126/science.aau5729
- Pellegrini L., Bonfio C., Chadwick J., Begum F., Skehel M., Lancaster M.A., 2020. Human CNS barrier-forming organoids with cerebrospinal fluid production. Science, 369, eaaz5626. doi:10.1126/science.aaz5626
- Peruffo A., Cozzi B., 2014. Bovine Brain: An in vitro translational model in developmental neuroscience and neurodegenerative research. Front Pediatr., 2, 74. doi:10.3389/fped.2014.00074
- Pham M.T., Pollock K.M., Rose M.D., Cary W.A., Stewart H.R., Zhou P., Nolta J.A., Waldau B., 2018. Generation of human vascularized brain organoids. Neuro Report., 29, 588-593. doi:10.1097/WNR.0000000000001014
- Pirone A., Miragliotta V., Ciregia F., Giannessi E., Cozzi B., 2018. The catecholaminergic innervation of the claustrum of the pig J. Anat., 232, 158-166. doi:10.1111/joa.12706
- Puelles L., John L.R., Rubenstein J.L.R., 2003. Forebrain gene expression domains and the evolving prosomeric model. Trends Neurosci., 26, 469-476. doi:10.1016/S0166-2236(03)00234-0
- Qian X., Nguyen H.N., Song M.M., Hadiono C., Ogden S.C., Hammack C., Yao B., Hamersky G.R., Jacob F., Zhong C., Yoon K.J., Jeang W., Lin L., Li Y., Thakor J., Berg D.A., Zhang C., Kang E., Chickering M., Nauen D., Ho C.Y., Wen Z., Christian K.M., Shi P.Y., Maher B.J., Wu H., Jin P., Tang H., Song H., Ming G.L., 2016. Brain-region-specific organoids using mini-bioreactors for modeling ZIKV exposure. Cell, 165, 1238-1254. doi:10.1016/j.cell.2016.04.032
- Qian X., Song H., Ming G.L., 2019. Brain organoids: advances., applications and challenges Development, 146, dev166074. doi:10.1242/dev.166074
- Ramos-Ibeas P., Sang F., Zhu Q., Tang W.W.C., Withey S., Klisch D., Wood L., Loose M., Surani M.A., Alberio R., 2019. Pluripotency and X chromosome dynamics revealed in pig pre-gastrulating embryos by single cell analysis. Nat Commun., 10, 500. doi:10.1038/s41467-019-08387-8
- Rodríguez L.L., 2002. Emergence and re-emergence of vesicular stomatitis in the United States. Virus Res., 85, 211-219. doi:10.1016/S0168-1702(02)00026-6
- Rodríguez A., Allegrucci C., Alberio R., 2012. Modulation of pluripotency in the porcine embryo and iPS cells. PlosOne, 7, e49079. doi:10.1371/journal.pone.0049079
- Rossi G., Manfrin A., Lutolf M.P., 2018. Progress and potential in organoid research. Nat. Rev. Genet., 19, 671-687. doi:10.1038/s41576-018-0051-9
- Ryan M.C., Kochunov P., Sherman P.M., Rowland L.M., Wijtenburg S.A., Acheson A., Hong L.E., Sladky J., McGuire S., 2018. Miniature pig magnetic resonance spectroscopy model of normal adolescent brain development. J. Neurosci. Methods, 308, 173-182. doi:10.1016/j.jneumeth.2018.08.008
- Sandmaier S.E., Nandal A., Powell A., Garrett W., Blomberg L., Donovan D.M., Talbot N., Telugu B.P., 2015. Generation of induced pluripotent stem cells from domestic goats. Mol. Reprod. Dev., 82, 709-721. doi:10.1002/mrd.22512
- Sato T., Vries R.G., Snippert H.J., van de Wetering M., Barker N., Stange D.E., van Es J.H., Abo A., Kujala P., Peters P.J., Clevers H., 2009. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459, 262-265. doi:10.1038/nature07935
- Schmidt M.J., Knemeyer C., Heinsen H., 2019. Neuroanatomy of the equine brain as revealed by high-field (3Tesla) magnetic-resonance-imaging. PLoSOne, 14, e0213814. doi:10.1371/journal.pone.0213814
- Silbereis JC., Pochareddy S., Zhu Y., Li M., Sestan N., 2016. The cellular and molecular landscapes of the developing human central nervous system. Neuron, 89, 248-268. doi:10.1016/j.neuron.2015.12.008
- Simchick G., Shen A., Campbell B., Park HJ., West FD., Zhao Q., 2019. Pig Brains Have Homologous Resting-State Networks with Human Brains. Brain Connect., 9, 566-579. doi:10.1089/brain.2019.0673
- Sjöstedt E., Zhong W., Fagerberg L., Karlsson M., Mitsios N., Adori C., Oksvold P., Edfors F., Limiszewska A., Hikmet F., Huang J., Du Y., Lin L., Dong Z., Yang L., Liu X., Jiang H., Xu X., Wang J., Yang H., Bolund L., Mardinoglu A., Zhang C., von Feilitzen K., Lindskog C., Pontén F., Luo Y., Hökfelt T., Uhlén M., Mulder J., 2020. An atlas of the protein-coding genes in the human, pig, and mouse brain. Science, 367, 6482. doi:10.1126/science.aay5947
- Smaers J.B., Rothman R.S., Hudson D.R., Balanoff A.M., Beatty B., Dechmann D.K.N., de Vries D., Dunn J.C., Fleagle J.G., Gilbert C.C., Goswami A., Iwaniuk A.N., Jungers W.L., Kerney M., D T Ksepka D.T., Manger P.R., Mongle C.S., Rohlf J.F., Smith N.A., Soligo C., Weisbecker V., Safi K., 2021. The evolution of mammalian brain size. Sci. Adv., 7, eabe2101. doi:10.1126/sciadv.abe2101
- Smith A., 2017, Formative pluripotency: the executive phase in a developmental continuum. Development, 144, 365-373. doi:10.1242/dev.142679
- Soto-Perez J., Baumgartner M., Kanadia R.N., 2020. Role of NDE1 in the Development and Evolution of the Gyrified Cortex. Front Neurosci., 14, 617513. doi:10.3389/fnins.2020.617513
- Steinhausen C., Zehl L., Haas-Rioth M., Morcinek K., Walkowiak W., Huggenberger S., 2016. Multivariate meta-analysis of brain-mass correlations in eutherian mammals. Front Neuroanat., 10, 91. doi:10.3389/fnana.2016.00091
- Takahashi K., Yamanaka S., 2006. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell, 126, 663-676. doi:10.1016/j.cell.2006.07.024
- Talluri T.R., Kumar D., Glage S., Garrels W., Ivics Z., Debowski K., Behr R., Niemann H., Kues W.A., 2015. Derivation and characterization of bovine induced pluripotent stem cells by transposon-mediated reprogramming. Cell Reprogram., 17, 131-140. doi:10.1089/cell.2014.0080
- Tancos Z., Nemes C., Polgar Z., Gocza E., Daniel N., Stout TA., Maraghechi P., Pirity M.K., Osteil P., Tapponnier Y., Markossian S., Godet M., Afanassieff M., Bosze Z., Duranthon V., Savatier P., Dinnyes A., 2012. Generation of rabbit pluripotent stem cell lines. Theriogenology, 78, 1774-1786. doi:10.1016/j.theriogenology.2012.06.017
- Tesar P.J., Chenoweth J.G., Brook F.A., Davies T.J., Evans E.P., Mack D.L., Gardner R.L., McKay R.D., 2007. New cell lines from mouse epiblast share defining features with human embryonic stem cells. Nature, 448, 196-199. doi:10.1038/nature05972
- Thomson J.A., Kalishman J., Golos T.G., Durning M., Harris C.P., Becker R.A., Hearn J.P., 1995. Isolation of a primate embryonic stem cell line. Proc. Natl. Acad. Sci., 92, 7844-7848. doi:10.1073/pnas.92.17.7844
- Thomson J.A., Itskovitz-Eldor J., Shapiro S.S., Waknitz M.A., Swiergiel J.J., Marshall V.S., Jones J.M., 1998. Embryonic stem cell lines derived from human blastocysts. Science, 282, 1145-1147. doi:10.1126/science.282.5391.1145
- Tosolini M., Brochard V., Adenot P., Chebrout M., Grillo G., Navia V., Beaujean N., Francastel C., Bonnet-Garnier A., Jouneau A., 2018. Contrasting epigenetic states of heterochromatin in the different types of mouse pluripotent stem cells. Sci Rep., 8, 5776. doi:10.1038/s41598-018-23822-4
- Trujillo C.A., Gao R., Negraes P.D., Gu J., Buchanan J., Preissl S., Wang A., Wu W., Haddad G.G., Chaim I.A., Domissy A., Vandenberghe M., Devor A., Yeo G.W., Voytek B., Muotri A.R., 2019. Complex oscillatory waves emerging from cortical organoids model early human brain network development. Cell Stem Cell, 25, 558-569.e7. doi:10.1016/j.stem.2019.08.002
- Varrault A., Journot L., Bouschet T., 2019. Cerebral cortex generated from pluripotent stem cells to model corticogenesis and rebuild cortical circuits: in vitro veritas? Stem Cells Dev., 28, 361-369. doi:10.1089/scd.2018.0233
- Velasco S., Kedaigle A.J., Simmons S.K., Nash A., Rocha M., Quadrato G., Paulsen B., Nguyen L., Adiconis X., Regev A., Levin J.Z., Arlotta P., 2019. Individual brain organoids reproducibly form cell diversity of the human cerebral cortex. Nature, 570, 523-527. doi:10.1038/s41586-019-1289-x
- Vilarino M., Alba Soto D., Soledad Bogliotti Y., Yu L., Zhang Y., Wang C., Paulson E., Zhong C., Jin M., Carlos Izpisua Belmonte J., Wu J., Juan Ross P., 2020. Derivation of sheep embryonic stem cells under optimized conditions. Reproduction, 160, 761-772. doi:10.1530/REP-19-0606
- Vrselja Z., Daniele S.G., Silbereis J., Talpo F., Morozov Y.M., Sousa A.M.M., Tanaka B.S., Skarica M., Pletikos M., Kaur N., Zhuang Z.W., Liu Z., Alkawadri R., Sinusas A.J., Latham S.R., Waxman S.G., Sestan N., 2019. Restoration of brain circulation and cellular functions hours post-mortem. Nature, 568, 336-343. doi:10.1038/s41586-019-1099-1
- Wang L.F., Anderson D.E., 2019. Viruses in bats and potential spillover to animals and humans. Curr. Opin. Virol., 34, 79-89. doi:10.1016/j.coviro.2018.12.007
- Weatherman S., Feldmann H., de Wit E., 2018.Transmission of henipaviruses. Curr. Opin. Virol., 28, 7-11. doi:10.1016/j.coviro.2017.09.004
- Xiang Y., Tanaka Y., Patterson B., Kang YJ., Govindaiah G., Roselaar N., Cakir B., Kim K.Y., Lombroso A.P., Hwang S.M., Zhong M., Stanley E.G., Elefanty A.G., Naegele J.R., Lee S.H., Weissman S.M., Park I.H., 2017. Fusion of regionally specified hPSC-derived organoids models human brain development and interneuron migration. Cell Stem Cell, 21, 383-398.e7. doi:10.1016/j.stem.2017.07.007
- Xu M., Lee E.M., Wen Z., Cheng Y., Huang W.K., Qian X., Tcw J., Kouznetsova J., Ogden SC., Hammack C., Jacob F., Nguyen H.N., Itkin M., Hanna C., Shinn P., Allen C., Michael SG., Simeonov A., Huang W., Christian K.M., Goate A., Brennand K.J., Huang R., Xia M., Ming G.L., Zheng W., Song H., Tang H., 2016. Identification of small-molecule inhibitors of Zika virus infection and induced neural cell death via a drug repurposing screen. Nat. Med., 22, 1101-1107. doi:10.1038/nm.4184
- Xu R., Boreland A.J., Li X., Erickson C., Jin M., Atkins C., Pang Z.P., Daniels B.P., Jiang P., 2021. Developing human pluripotent stem cell-based cerebral organoids with a controllable microglia ratio for modeling brain development and pathology. Stem Cell Reports, 16, 1923-1937. doi:10.1016/j.stemcr.2021.06.011
- Yu J., Vodyanik M.A., Smuga-Otto K., Antosiewicz-Bourget J., Frane J.L., Tian S., Nie J., Jonsdottir G.A., Ruotti V., Stewart R., Slukvin II., Thomson J.A., 2007. Induced pluripotent stem cell lines derived from human somatic cells. Science, 318, 1917-1920. doi:10.1126/science.1151526
- Zagorski M., Tabata Y., Brandenberg N., Lutolf M.P., Tkačik G., Bollenbach T., Briscoe J., Kicheva A., 2017. Decoding of position in the developing neural tube from antiparallel morphogen gradients. Science, 356, 1379-1383. doi:10.1126/science.aam5887
- Zhi M., Zhang J., Tang Q., Yu D., Gao S., Gao D., Liu P., Guo J., Hai T., Gao J., Cao S., Zhao Z., Li C., Weng X., He M., Chen T., Wang Y., Long K., Jiao D., Li G., Zhang J., Liu Y., Lin Y., Pang D., Zhu Q., Chen N., Huang J., Chen X., Yao Y., Yang J., Xie Z., Huang X., Liu M., Zhang R., Li Q., Miao Y., Tian J., Huang X., Ouyang H., Liu B., Xie W., Zhou Q., Wei H., Liu Z., Zheng C., Li M., Han J., 2022. Generation and characterization of stable pig pregastrulation epiblast stem cell lines. Cell Res., 32, 383-400. doi:10.1038/s41422-021-00592-9
Résumé
Le cerveau est un organe complexe et tout modèle pour l'étudier dans ses aspects normaux et pathologiques devient un outil de choix en neurobiologie. La maîtrise et la diffusion de protocoles permettant le développement d'organoïdes cérébraux ont ouvert la voie à de nouvelles études dans le domaine du développement du cerveau, de la modélisation des maladies neurodégénératives ou neurodéveloppementales, de la compréhension des tumeurs ainsi que des maladies infectieuses qui affectent le cerveau. Alors que les études se sont focalisées principalement sur l'utilisation d'organoïdes cérébraux humains, il existe un intérêt croissant pour des modèles similaires chez d'autres espèces. Cette revue présente ce qui est actuellement développé dans ce domaine avec un accent particulier sur le potentiel des organoïdes cérébraux pour l'étude des maladies neuro-infectieuses des animaux domestiques, notamment du cheval. Pour cette espèce, les atteintes neurologiques liées aux encéphalites virales sont parmi les plus dommageables pour la filière. La mise au point de modèles d’organoïdes animaux et équins en particulier, les plus prédictifs possibles permettra à la fois de diminuer les coûts de recherche particulièrement élevés pour les études sur les maladies du cerveau et surtout de contribuer efficacement aux 3R, enjeu agronomique et sociétal.
Pièces jointes
Pas de document complémentaire pour cet articleStatistiques de l'article
 Vues: 2305
Vues: 2305
Téléchargements
 PDF: 745
PDF: 745
 XML: 194
XML: 194
Articles les plus lus par le même auteur ou la même autrice
- Catherine TARAGNAT, Xavier CAYLA, Bertrand PAIN , Organoïdes hypophysaires : des outils pour caractériser le développement, la plasticité et les pathologies hypophysaires ? , INRAE Productions Animales: Vol. 36 No 2 (2023): Cellules souches et Organoïdes : réalités et perspectives
- Françoise MÉDALE, Alain BOISSY, Irène GABRIEL, Bertrand PAIN, Catherine TARAGNAT, Avant-propos du dossier « Cellules souches et Organoïdes : réalités et perspectives » , INRAE Productions Animales: Vol. 36 No 2 (2023): Cellules souches et Organoïdes : réalités et perspectives

