Méthodes alternatives in vitro pour l’étude des interactions hôte-pathogène du poumon
Chapeau
Les maladies infectieuses respiratoires ont un fort impact en santé animale et humaine. L’étude des agents pathogènes animaux est nécessaire pour mieux comprendre les pathologies respiratoires non résolues et également mieux anticiper de nouvelles émergences. Cette revue fait le point sur les méthodes alternatives in vitro pour l’études des interactions hôte-pathogène du poumon, en présentant les travaux d’équipes INRAE travaillant chez le bovin.
Introduction
Chez l’homme, les infections des voies respiratoires basses se placent au quatrième rang des principales causes de mortalité (source de l’Organisation Mondiale de la Santé, OMS). Chez l’animal elles sont la première cause de mortalité (source de l’Organisation Mondiale de la Santé Animale, OIE). Ces infections représentent un enjeu majeur de bien-être et de santé, et sont particulièrement préoccupantes quant à leur impact sociétal et économique. La pandémie COVID-19, une crise majeure de santé publique humaine causée par un virus potentiellement d’origine animale, souligne l’importance et la pertinence du concept « One Health », une seule santé, pour comprendre et affronter les risques sanitaires mondiaux à l’interface santé animale – santé humaine. Souvent utilisée pour coordonner des efforts multisectoriels de prévention et de réponse aux maladies zoonotiques (c’est-à-dire transmissibles de l’animal à l’humain ou de l’humain à l’animal), la démarche « One Health » est primordiale pour contrôler des maladies telles que la rage, la grippe aviaire ou la tuberculose (https://www.oie.int/fr/ce-que-nous-faisons/sante-et-bien-etre-animale/). Selon les chiffres de l’OIE, 60 % des agents pathogènes connus responsables des maladies humaines proviennent des animaux domestiques et de la faune sauvage, et 75 % des agents pathogènes humains émergents sont d’origine animale.
L’étude des interactions entre les agents pathogènes animaux, dont ceux des espèces de rente, avec leur espèce cible est nécessaire pour mieux comprendre et combattre les pathologies respiratoires non résolues sur le terrain et également mieux anticiper de nouvelles émergences dans le futur.
Le complexe respiratoire bovin : plusieurs pathogènes, une seule maladie
Les maladies respiratoires bovines sont la principale cause de morbidité et mortalité en élevage chez les veaux (laitiers ou allaitants) avec des pics de mortalité pouvant atteindre 20 % certains hivers, en fonction des agents pathogènes impliqués et des conditions d'élevage (Perrin, 2012 ; Pardon et al., 2020). Chez les adultes, la mortalité due aux problèmes respiratoires est de 3 % (Perrin, 2012). Les pertes pour la filière sont estimées à 576 millions € par an en Europe (Nicholas et Ayling, 2003). Plus de la moitié des coûts est liée à la diminution de la masse corporelle des animaux, la mortalité et les coûts associés au travail supplémentaire pour l'éleveur et les soignants (séparation des animaux infectés, traitements vétérinaires). Les pertes par animal sont estimées à 65 € pour un veau laitier, et 123 € pour un veau de race à viande (Andrews, 2000). Les agents pathogènes incriminés sont multiples, ils sont d'origine bactérienne (Pasteurella multocida, Mannheimia haemolytica, Histophilus somni, Mycoplasma bovis… ou virale (Virus Respiratoire Syncytial bovin (VRS), Rhinotrachéite Infectieuse Bovine (IBR), Parainfluenza 3 virus (PI3V), Bovine Viral Diarrhea Virus (BVDV), coronavirus…) ; plus rarement d'origine parasitaire (strongles pulmonaires) ou fongique (Aspergillus). La fréquence des pathogènes incriminés varie selon les études et les élevages (Caron, 2018 ; Pardon et al., 2020).
Pour les maladies respiratoires bovines, on parle de Complexe Respiratoire Bovin (CRB) car les associations de pathogènes sont fréquentes, par exemple une infection virale prédispose souvent à une surinfection bactérienne (Pardon et al., 2020). Ces associations se traduisent par des traitements antibiotiques qui favorisent l'apparition de résistance chez les bactéries.
Au niveau clinique, la fièvre, la toux, le jetage nasal, l'abattement et l'hyperventilation sont les signes d'alerte pour les éleveurs (Mosier, 2014 ; Ferraro et al., 2021). Les signes cliniques et les données épidémiologiques peuvent permettre d'établir le diagnostic, mais des examens complémentaires sont souvent nécessaires (lavage broncho-alvéolaire, prélèvements rhinopharyngés, prises de sang, autopsies). La prévention des pathologies respiratoires passe notamment par la vaccination (Riffault et al., 2020 ; Makoschey et Berge, 2021), l'optimisation des conditions d'hébergement (nombre d'animaux par aires, ventilation, exposition à la poussière…) et la réduction du stress (transport, allotement).
La tuberculose bovine : maladie zoonotique et règlementaire
Un autre pathogène respiratoire qui cause d'important problème en élevage est Mycobacterium bovis (Mb), l'agent de la Tuberculose Bovine (bTB). De par son caractère zoonotique, la bTB est soumise à une règlementation très stricte au sein de l'Union Européenne. Elle est associée à l'abattage systématique des animaux dépistés positifs par un test de sensibilisation à la tuberculine. Ce diagnostic étant très précoce, les animaux ne présentent quasiment jamais de signes cliniques. Les pertes économiques liées au contrôle de la bTB sont estimées à 3 milliards de dollars dans le monde (Schiller et al., 2011). Pour la France, les programmes de contrôle de la bTB représentent 20 millions d'euros par an (communication du laboratoire national de référence sur la bTB) incluant les montants compensatoires pour les éleveurs. Outre ces pertes économiques, la bTB est associée à une problématique croissante de l'acceptabilité de l'abattage systématique des animaux, aussi bien par les éleveurs que la société. L'éradication de la bTB est un objectif affiché par l'OIE (https://www.oie.int/app/uploads/2021/03/roadmap-zoonotic-tb.pdf), mais elle se heurte au manque de connaissances sur la pathophysiologie chez l’animal, notamment les étapes précoces de l’infection dans le poumon qui conditionnent le contrôle et l’élimination de Mb versus sa survie et dissémination.
Physiologie du poumon et immunité
La grande sensibilité des bovins aux infections respiratoires est en partie due à la morphologie de leur système respiratoire : la trachée et les bronches sont étroites et les poumons sont petits et mal vascularisés par rapport à la masse corporelle (Veit et Farrell, 1978). Le volume respiratoire est ainsi réduit par rapport à d'autres mammifères de poids équivalent comme le cheval (Gallivan et al., 1989). Pour pallier ce manque d'efficacité, les bovins sont obligés d'inspirer beaucoup plus d'air dans leurs poumons pour oxygéner le sang, ce qui augmente les risques d'infections.
Les poumons des bovins sont composés de 8 lobes, 3 gauches et 5 droits (figure 1). Cette morphologie pulmonaire est à la fois asymétrique et très compartimentée, avec peu de connexions entre les lobes. L’épithélium pulmonaire a une fonction d’échange gazeux et également de défense. C’est une barrière physique qui bloque l’entrée de molécules étrangères ou de microorganismes.
D'un point de vue histologique, l'appareil respiratoire est tapissé d'un épithélium qui est dit « pseudo-tratifié en colonne », c'est-à-dire que toutes les cellules n'atteignent pas la surface. La structure de l'épithélium varie en fonction de sa localisation le long de l'arbre respiratoire (figure 1). Son épaisseur est d'environ 60 µm dans les bronches, 10 µm dans les bronchioles et inférieur à 1µm dans les alvéoles (Patton et Byron, 2007). Il repose sur une membrane basale et un tissu conjonctif, la lamina propria sous laquelle se situe la sous-muqueuse, riche en glande séromuqueuses. Au niveau de la trachée ou des bronches, mais pas des bronchioles, la sous-muqueuse est attachée au cartilage. L'épithélium est très actif, en particulier grâce à ses fonctions de sécrétion (mucus, surfactant et molécules immunitaires), d'épuration (clairance muco-ciliaire, macrophages alvéolaires) et de transport (ions, autres substances). Cependant, cette vision de l'épithélium en tant que simple barrière physique entre l'hôte et son environnement est réductrice. En effet, de nombreux travaux de recherche démontrent son implication dans l'immunité (Fehrenbach, 2001 ; Hippenstiel et al., 2006 ; Tam et al., 2011 ; Vareille et al., 2011). Les cellules épithéliales sont dynamiques et plurifonctionnelles, elles peuvent détecter la présence de microorganismes via des récepteurs spécifiques et déclencher le recrutement et l'activation de cellules immunitaires par la sécrétion de diverses cytokines ou chimiokines.
Figure 1. Morphologie des poumons bovins et composition cellulaire.

Les poumons des bovins sont composés de 8 lobes, 3 gauches et 5 droits. Au niveau des bronches et des bronchioles (caractérisées par un diamètre inférieur à 1mm), l’épithélium est composé de cellules ciliées, de cellules caliciformes sécrétrices de mucus, de cellules basales, de cellules Club, de cellules neuroendocrines et de cellules en brosse. Au niveau des alvéoles, deux populations sont présentes : les pneumocytes de type I qui forment la paroi de l’alvéole et assurent les échanges gazeux ; et les pneumocytes de type II qui sécrètent le surfactant.
L'épithélium est identique dans les bronches et bronchioles (Rock et Hogan, 2011), il est composé majoritairement de cellules ciliées, de cellules caliciformes (goblet cells), de cellules Club, de cellules basales et de cellules en brosse (Tuft ou brush cells). Les cellules ciliées, qui s'étendent de la membrane basale à la surface de l'épithélium, comportent environ 200 cils par cellule et de fines microvillosités, visibles en microscopie électronique à balayage. Certaines infections diminuent le battement des cils et la ciliogénèse, rendant plus difficile l'épuration des voies aériennes (Mata et al., 2012). Les cellules caliciformes ou « Goblet cells » contiennent des granules et sécrètent le mucus, qui forme un film continu à la surface des cils (Hermans et Bernard, 1999). Les cellules Club (anciennement nommées cellules de Clara), non-ciliées, contiennent de petits granules de sécrétion et sont localisées dans les bronchioles terminales. Ces cellules sécrètent des molécules immunomodulatrices (Wang et al., 2003) et servent de progéniteurs pour renouveler les cellules caliciformes (Rock et Hogan, 2011). Les cellules Club sécrètent Scgb1a1, une uteroglobine, la protéine la plus abondante trouvée dans les fluides respiratoires (Rawlins et al., 2009) et sont également l'unique source de CC10 pour « Clara Cell secretory protein 10 » (ou CCSP), une protéine importante pour l'immunité anti-virale (Wang et al., 2003). Les cellules basales sont petites et adhèrent à la membrane basale sans atteindre la surface de l'épithélium. Ces cellules sont impliquées dans la régénération des cellules épithéliales (Inayama et al., 1988). Les cellules en brosse (Tuft cells) contiennent moins de cils que les cellules ciliées (120 cils par cellule). Leur fonction n'est pas encore connue, et différentes hypothèses ont été formulées, notamment celle d'un rôle dans l'immunosurveillance, car ces rares cellules sont stratégiquement localisées au niveau des bifurcations bronchiques (Reid et al., 2005). Elles sont décrites chez les rongeurs et les bovins (Tizzano et al., 2006 ; Tizzano et al., 2011). Leur nombre est augmenté après une infection sévère par le virus de la grippe chez la souris (Rane et al., 2019).
Le compartiment alvéolaire, site spécifique des échanges gazeux, est très différent des bronches et bronchioles. Au niveau cellulaire, les sacs alvéolaires sont composés de deux populations : les pneumocytes de type I qui forment la paroi de l'alvéole et assurent les échanges gazeux et les pneumocytes de type II qui sécrètent le surfactant, fluide visqueux d'une part essentiel au maintien de l'élasticité de l'alvéole lors des mouvements mécaniques d'inspiration-expiration et d'autre part protégeant le poumon contre les agressions et les agents infectieux (molécules de défenses, opsonisation) (Fehrenbach, 2001). À l'intérieur des alvéoles, des macrophages alvéolaires assurent un rôle de sentinelle et patrouillent les alvéoles (en proportion 1 macrophage pour 2-3 alvéoles) (Neupane et al., 2020 ; Remot et al., 2021). En cas d'agression, d'autres cellules immunitaires sont recrutées dans le poumon, grâce aux signaux envoyés par les cellules épithéliales et les macrophages alvéolaires (Fehrenbach, 2001).
Comment mimer le poumon in vitro ?
Mieux comprendre le fonctionnement normal ou pathologique du poumon et sa réponse aux agressions nécessite de disposer de modèles manipulables en laboratoire, et permettant de multiplier et reproduire les conditions testées. Comme expliqué ci-dessus, les voies aériennes conductrices et respiratoires sont tapissées d'un épithélium hautement spécialisé qui assure l'interface avec le micro-environnement interne et l'environnement externe. La surface apicale de l'épithélium est exposée à l'air et aux substances inhalées, tandis que la surface basale est en contact avec la muqueuse sous-jacente (matrice extra-cellulaire, cellules interstitielles et système vasculaire). L'interface air-liquide (ALI) uniquement présente dans les voies respiratoires explique pourquoi l'épithélium joue le rôle de première ligne de défense contre les particules, les toxines et les pathogènes inhalés (Nicod, 1999 ; Gohy et al., 2020). L'architecture complexe du poumon et notamment l'interface ALI qui le caractérise, est difficile à reproduire in vitro et constitue un vrai challenge méthodologique. En effet, mimer un poumon in vitro implique : i) de reproduire la complexité des voies respiratoires, de ses différentes régions (bronches-bronchioles versus alvéoles) et de ses différents types cellulaires ; ii) de reproduire des fonctions spécifiques de protection du poumon par la sécrétion de mucus spécifique (piégeage des matières externes) et par une activité de battement ciliaire active (élimination des matières piégées dans le mucus), et iii) d'imiter l'espace alvéolaire où les échanges gazeux essentiels se produisent à travers une fine couche de cellules épithéliales vers le système vasculaire. Aujourd'hui encore, les modèles in vitro largement utilisés dans les laboratoires sont des versions très simplifiées de la microarchitecture, la matrice extracellulaire et/ou le microenvironnement, et ils ne représentent que partiellement la diversité des populations cellulaires. Les cellules épithéliales pulmonaires différenciées adultes restent difficiles à isoler en raison de leur faible taux de renouvellement. Elles perdent rapidement leur phénotype en culture, elles peuvent présenter une grande variabilité dans la composition cellulaire d'un isolement ou d'un animal à l'autre, et ne peuvent souvent être développées que par dédifférenciation. Par ailleurs, les quelques lignées cellulaires immortalisées d'épithélium pulmonaire disponibles commercialement (A549, 16-HBE, Calu-3…) montrent un niveau de différenciation relativement limité. Cependant, des progrès remarquables ont été réalisés ces dernières années (culture polarisées 2D, culture dans des matrices extracellulaires 3D, organoïdes) aboutissant à des modèles in vitro plus proches de la physiologie du poumon. La grande majorité des protocoles publiés sont développés à partir de tissus murins et humains, avec description des méthodes d'isolement et de culture des cellules épithéliales pulmonaires en épithélium polarisé (2D), à l'interface ALI, dans des matrices 3D ou organoïdes. Peu de données sont disponibles sur d'autres espèces animales notamment celles d'intérêt agronomique. Cependant plusieurs articles sur les cellules pulmonaires porcines (Xie et al., 2018), bovines (Cozens et al., 2018a ; Cozens et al., 2018b ; Lee et al., 2018 ; Lee et Chambers, 2019), équines (Abs et al., 2019) et ovines (Archer et al., 2007 ; Archer et al., 2013) méritent d'être cités.
Les approches in vitro telles que les coupes de précisions de poumons (PCLS) ont l’avantage de conserver un degré de complexité cellulaire, et de préserver des interactions entre cellules.
Ces différentes approches fournissent des outils précieux pour mieux comprendre les interactions hôtes/pathogènes, évaluer la pathogénicité des agents biologiques, et mieux prédire l’efficacité de traitement préventif ou curatif. Par ailleurs, ces approches sont des méthodes alternatives à l’expérimentation animale qui permettent de répondre au principe éthique des 3R : Remplacement des animaux par des alternatives si possible, Réduction du nombre d’animaux en expérimentation et Raffinement des protocoles expérimentaux. Dans cette revue, nous détaillerons des nouveaux modèles in vitro, organoïdes et culture ALI, et les approches d’explants pulmonaires (PCLS).
1. Organoïdes et culture Air-Liquide-Interface (ALI)
Les organoïdes sont des autoassemblages in vitro de différents types cellulaires, en trois dimensions (3D) qui miment l'organe natif, en termes de type cellulaires, de structure, d’architecture et de fonctions. Cette organisation en 3D permet des interactions cellule-cellule et cellule-matrice biologiquement pertinentes. Les organoïdes sont générés à partir de cellules souches ou de progéniteurs selon un processus qui simule les étapes moléculaires et cellulaires du développement de l'organe, en l’occurrence ici le poumon (figure 2).
Figure 2. Représentation schématique des différents stades de développement du poumon.

En jaune/orange, les stades de développement et les gènes caractéristiques de chaque stade, exprimés. En gris, Les voies de signalisation impliquées dans l’induction des différents stades : Activation (flêche montante) ou inhibition (flêche descendante) des voies. En violet, les sources de cellules utilisées par les équipes de recherche pour l’obtention des modèles in vitro.
Ces organoïdes peuvent être mis en culture sur des membranes sur lesquelles les cellules s’organisent en 2D en couches pluristratifiées polarisées, dont la face apicale est en contact avec l’air et la face basale en contact avec le milieu nutritif (figure 3F).
Lorsqu'elles sont établies en 3D grâce aux matrices extracellulaires, ces cultures peuvent reproduire l'architecture in vivo, l'organisation spatiale et la diversité génétique des populations cellulaires présentes dans l'organe d'origine avec une fidélité remarquable. En tant que structures 3D autoorganisées et auto-renouvelables, les organoïdes présentent un avantage certain par rapport à la culture en monocouche car ils sont un modèle plus proche de la structure physiologique.
1.1. Quelles cellules de départ ?
a. Cellules souches et progéniteurs du poumon
Le poumon adulte a la particularité d'être un tissu hautement quiescent avec un taux de renouvellement cellulaire faible (< 1 % par jour) des épithéliums des voies respiratoires et des alvéoles (Kotton et Morrisey, 2014). Cependant, et en réponse à une lésion tissulaire, il montre une extraordinaire capacité de régénération avec multiplication et/ou différentiation de cellules progénitrices et restauration des fonctions. Bien que précédemment basée sur des études morphologiques et ultrastructurales, la connaissance de la diversité des cellules pulmonaires et de leur lignage complexe (cellules souches pluripotentes, progéniteurs multipotents) a dernièrement fait un grand pas grâce aux approches de traçage de lignées cellulaires, des analyses par cytométrie en flux, des méthodes de séquençage de l'ARN de cellules uniques, de protéomique, de transcriptomique et aux progrès de l'imagerie. De nombreuses revues décrivent les différentes populations de cellules souches pulmonaires, principalement caractérisées chez l'homme et la souris (Rawlins et Hogan, 2006 ; Morrisey et Hogan, 2010 ; Rackley et Stripp, 2012 ; Kotton et Morrisey, 2014 ; Schilders et al., 2016). Les descriptions de cellules souches pulmonaires chez d'autres mammifères tels que les animaux d'élevage sont encore très rares, à l'exception de notre travail sur l'identification de progéniteurs bronchoalvéolaires ovins à double potentiel de différenciation (Archer et al., 2013).
b. Organoïdes dérivés de cellules souches embryonnaires ou de cellules souches pluripotentes induites (iPS)
L'une des premières descriptions de la culture d'organoïdes pulmonaires a été publiée par Zimmermann (1987). En isolant et en cultivant des cellules provenant de fœtus de souris, l'auteur a pu générer une structure organoïde, avec la formation d'une lumière au centre des agrégats organisés, la différenciation des cellules vers le type pneumocytes de type II (présence de corps lamellaires) et la production d'une matrice par les cellules mésenchymateuses entourant les organoïdes. Bien que ces premières expériences aient ouvert la voie à la production in vitro d'organoïdes pulmonaires à partir de différentes espèces, le processus de culture reste complexe et nécessite de reproduire les étapes spécifiques de la différenciation du tissu pulmonaire, avec activation ou inactivation de voies de signalisation clés régulant le développement embryonnaire du poumon (figure 2) (Tadokoro et al., 2016 ; Chung et al., 2018). Des approches étape par étape ont été établies avec succès pour la différenciation des Cellules Souches Embryonnaires (CSE) en cellules fonctionnelles des voies respiratoires et alvéolaires (Wang et al., 2007 ; Longmire et al., 2012). Dans la première étape de l'induction en différenciation des cellules souches, l'Activin-A, qui appartient à la voie de signalisation du facteur de croissance transformant β (TGFβ), joue le rôle clé déclencheur dans l'activation de la spécification de l'épiblaste vers la couche germinale de l'endoderme. L'inhibition de cette même voie permet ensuite de conduire les cellules dans la lignée de l'intestin primitif antérieur. Ensuite, l'activation des voies de signalisation Wnt et FGF permet la différenciation des cellules en progéniteurs pulmonaires, puis en progéniteurs des bronches ou des alvéoles (figure 2). En plus de l'activation fine et séquentielle de voies de signalisation très spécifiques, l'obtention des cultures en 3D ou organoïdes nécessite de cultiver les cellules enchâssées dans une matrice gélatineuse issue d'extrait de membrane basale ; cette matrice participe physiquement à l'architecture de la structure et favorise, de par ses propres facteurs biochimiques, la maturation cellulaire. Plus de 40 jours de ces protocoles très précis et séquentiels sont nécessaires pour aboutir à des organoïdes différenciés.
Une autre source de cellules souches possible est les cellules souches pluripotentes induites, appelées « iPSC ». Elles sont issues de cellules somatiques (fibroblastes de peau par exemple) et ont été reprogrammées génétiquement (expression des facteurs OCT4+, SOX2+, SSEA4+, TRA1-60+) dans un état semblable à celui d'un embryon. Ces iPSC ont plusieurs avantages : il est possible de i) les produire en grande quantité et les conserver, ii) les différencier en de nombreux types cellulaires ; iii) générer des cultures à partir d'individus ou d'animaux d'espèces différentes. Afin de transformer les iPSC en épithélium pulmonaire, il est nécessaire, comme pour les CSE, de suivre un protocole de différenciation par étapes afin de générer des cellules de l'endoderme définitif (facteurs CXCR4+, SOX17+, FOXA2+), puis des cellules de l'endoderme de l'intestin antérieur (NKX2.1+, PAX9+, SOX2+) et, par la suite, d'obtenir des populations de cellules basales, caliciformes, ciliées, clubs, pneumocytes de type I et de type II. Huang et al. ont rapporté une méthode optimisée pour générer des cellules progénitrices FOXA2+NKX2.1+ à partir de cellules endodermiques humaines définitives avec un taux d'efficacité de 86 % (Huang et al., 2014). Ces progéniteurs ont donné naissance à des cellules basales, des cellules club, des cellules caliciformes, des cellules ciliées, des pneumocytes de type I et de type II. Les pneumocytes de type II dérivés d'iPSC humaines présentent une capacité d'auto-renouvellement et pourraient présenter une réactivité immunitaire (Ghaedi et al., 2013 ; Jacob et al., 2017 ; Yamamoto et al., 2017).
c. Organoïdes dérivés de cellules souches adultes
Pour surmonter la complexité et la lourdeur des protocoles de différenciation des cellules souches pluripotentes (CSE ou iPSC), de nouvelles approches ont été développées à partir de tissus adultes, en tirant parti du potentiel d'autorenouvellement et de différenciation des cellules souches résidantes. Parmi toutes les cellules épithéliales qui tapissent les voies respiratoires, les cellules basales (région trachéobronchique), les cellules Club et les cellules souches broncholoalvéolaires-BASC (région bronchiolaire), et les pneumocytes de type II (régions alvéolaires) sont capables de générer des organoïdes chez la souris et l'homme (Choi et al., 2016). Les variations de protocoles incluent la composition des milieux (hormones de croissance spécifiques, activateurs ou inhibiteurs de voies spécifiques), des étapes d'isolement différentiel de cellules souches/progéniteurs spécifiques, la coculture avec ou sans cellules stromales, et l'éventuelle première étape de culture en conditions 2D avec une interface air-liquide (ALI) avant la culture en matrice. Les facteurs les plus importants dans la génération d'organoïdes pulmonaires à partir de cellules souches adultes impliquent les voies d'activation WNT et FGF, et de répression ROCK, MAPK, TGF et BMP. Récemment, Salahudeena et ses collègues ont mis au point une culture reproductible de progéniteurs pulmonaires humains distaux sous forme d'organoïdes dérivés de cellules basales (KRT5+) ou de pneumocytes de type II. Les organoïdes issus de pneumocytes de type II présentaient un potentiel de transdifférenciation en pneumocytes de type I, tandis que les organoïdes issus de cellules basales développaient progressivement des lumières tapissées de cellules ciliées et de cellules Club différenciées (Salahudeen et al., 2020). Outre le tissu pulmonaire prélevé par voie chirurgicale, des organoïdes ont pu être générés à partir de la culture de cellules épithéliales pulmonaires prélevées dans le liquide de Lavage Broncho-Alvéolaire (LBA) (Sachs et al., 2019).
1.2. Des organoïdes et des cultures pulmonaires en ALI pour étudier les interactions hôte-pathogènes
Dans l'ensemble, ces protocoles donnent naissance à des organoïdes composés de populations épithéliales pulmonaires proximales et/ou distales qui peuvent être développés à long terme, amplifiés, congelés, exposés à différents stimuli et analysés (Dye et al., 2016 ; Barkauskas et al., 2017 ; Chen et al., 2017 ; Miller et al., 2019 ; Deprez et al., 2020 ; Li et al., 2020). Comme mentionné ci-dessus, tous les protocoles ont quasiment tous été développés et testés sur cellules humaines et murines. À l'heure actuelle, aucun exemple d'organoïde pulmonaire d'animaux domestiques utilisant des cellules souches pluripotentes n'a été publié. Sur la base des protocoles d'organoïdes pulmonaires humains, nous avons réussi à obtenir des organoïdes pulmonaires bovins et des cultures air-liquide-interface ALI, à partir de poumons embryonnaires (résultats non publiés), prélevés à différents stades de maturation (figure 3 A, F). Ces deux types de cultures ont montré un niveau élevé de différentiation et de fonctionnalisation avec présence des différents types cellulaires des voies aériennes (bronches, bronchioles) et des alvéoles (figure 3 B-E, G-J), de cellules ciliées, cellules basales, pneumocytes de type I et pneumocytes de type II. Que ce soit en conditions de culture 3D organoïdes ou en conditions ALI, l'activité des cils des cellules ciliées est observable en microscopie optique et l'architecture typique des cils est observable en microscopie confocale et microscopie électronique (figure 3 D, E, H, J). La fonction de sécrétion des cellules est mise en évidence par l'observation de mucus à la surface des cultures ALI et à l'intérieur des organoïdes, ainsi que des corps lamellaires (vésicules spécialisées dans la sécrétion du surfactant) dans les pneumocytes de type II (figure 3 C, I).
Figure 3. Modèles pulmonaires bovins issus de poumons embryonnaires en organoïde et en interface Air-Liquide (ALI).

A : Illustration et représentation schématique de la culture en organoïde en goutte de Matrigel®. B : Organoïdes amplifiés en goutte de Matrigel®. C : Pneumocyte de type II de l’alvéole avec corps lamellaires (CL, flèches blanches) caractéristiques de ce type cellulaire en microscopie électronique à transmission. D, E, H : Cellules ciliées (Cils, flèche noire) de la bronche et la bronchiole en (D) microscopie photonique et en (E, G) microscopie électronique à transmission. F : Illustration et représentation schématique de la culture en ALI. G : Cellules embryonnaires cultivées en ALI pendant 16 jours. I, J : Doubles marquages immunofluorescents des cellules en culture en interface air-liquide. Mise en évidence de la présence de pneumocytes de type I (pI) et II (pII) de l’alvéole et des cellules basales et ciliées de la bronche et bronchiole, microscopie confocale.
Ces organoïdes et ces cultures ALI permettent d’étudier l’infection par différents pathogènes bovins problématiques (RSV, Mycobacterium bovis, Mycoplasma bovis…). Pour cela, les organoïdes ou les cultures ALI sont exposés aux differents pathogènes soit par microinjection (organoïdes) soit par mise en contact à la face apicale des ALI. Le modèle ALI permet un contrôle aisé de la dose infectieuse, du suivi de la réponse cellulaire à l’infection (immunomarquages, dosages de cytokines dans le surnageant… figure 4). Le ciblage spécifique de certains types cellulaires (tropisme) et les dérégulations cellulaires induites par les différents pathogènes sont à l’étude dans nos laboratoires, ainsi que le criblage de molécules thérapeutiques afin de proposer des nouveaux traitements anti-infectieux.
Figure 4. Infection du modèle de culture ALI par des pathogènes bovins.
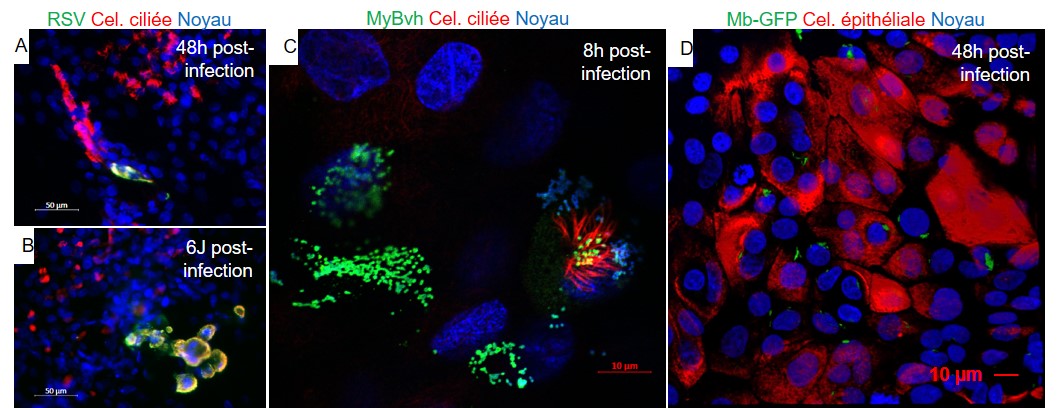
A, B : Doubles marquages immunofluorescents des cellules infectées par une souche de RSV bovin à 48h (A) et 6 jours (B) post-infection. Mise en évidence de l’évolution de l’infection de cellules ciliées par le virus RSV (rouge + vert). C : Double marquage immunofluorescent des cellules infectées par une souche de mycoplasme bovin à 8h post-infection, microscopie confocale. D : Marquage immunofluorescent des cellules infectées par une souche de mycobactérie fluorescente GFP (vert) bovine à 48h post-infection, microscopie confocale.
2. Le modèle des explants de poumon ou PCLS (« Précision-Cut Lung Slices ») pour étudier le tissu pulmonaire natif
L'utilisation des PCLS présente l'avantage de réduire le nombre d'animaux nécessaire à une étude tout en augmentant le nombre de paramètres pouvant être analysés en parallèle (Sewald et Braun, 2013). Elles peuvent être maintenues en culture pendant plusieurs jours (Goris et al., 2009). Si l'on compare les PCLS à des cellules isolées en culture (lignées ou cultures primaires), l'intégrité du tissu est conservée, si bien que les interactions et les différences de répartition des particules infectieuses dans les différents compartiments tissulaires peuvent être analysées. Chez le poulet et le bovin, les macrophages alvéolaires conservent leur capacité dynamique in situ et restent mobiles à l'intérieur de la PCLS en réponse à une infection bactérienne (Bryson et al., 2020 ; Remot et al., 2021).
Les PCLS sont obtenues stérilement grâce au « Alabama R&D Tissue Slicer » (anciennement appelé Krumdieck Tissue Slicer), qui est un microtome dans lequel circule un milieu stérile permettant la survie du tissu (Smith et al., 1985). Les explants de poumons sont réalisés à partir de prélèvements post-mortem, par exemple dans les abattoirs commerciaux pour le bovin. Au laboratoire, le lobe accessoire droit bovin est rempli à l'aide d'une canule avec du milieu de culture (RPMI) et de l'agarose à bas point de fusion chauffé puis maintenu à 38°C. Pour des plus petits animaux, comme la souris par exemple, l'intégralité de la lumière des poumons est remplie d'un mélange RPMI/agarose via une canule insérée dans la trachée. Le lobe de poumon gonflé avec le mélange RPMI/Agarose est ensuite placé sur un champ stérile sur lit de glace. Cette étape permet de préserver la structure pulmonaire avant de réaliser des biopsies à l'aide d'un punch de 8 mm de diamètre. Les punchs sont insérés dans l'appareil Alabama R&D Tissue Slicer, placé sous un PSM en condition stérile. Les PCLS sortent avec un débit moyen de 1 coupe toutes les 3,5 secondes, leur épaisseur peut varier entre 100 et 1 000 µm. Les coupes sont placées dans des plaques de culture cellulaire et incubées à 37°C 5 % CO2, le milieu sera changé toutes les 30 min pendant 2 h pour enlever toute trace d'agarose. Ainsi, il est possible de préparer de très fines coupes, d'épaisseur bien calibrée et de les mettre en contact in vitro avec des ligands ou des pathogènes afin d'étudier la réactivité des PCLS à l'exposition (Goris et al., 2009). Il est possible d'évaluer la viabilité des explants pulmonaires par différentes méthodes comme l'observation de l'activité ciliaire des cellules ciliées des bronchioles, le marquage des mitochondries (MitoTracker Deep Red, figure 5A et B) ou la quantification de la libération de la lactacte déshydrogénase (LDH, figure 5C et D).
Figure 5. Étude de la survie de PCLS dans le temps ou selon différentes stimulations.
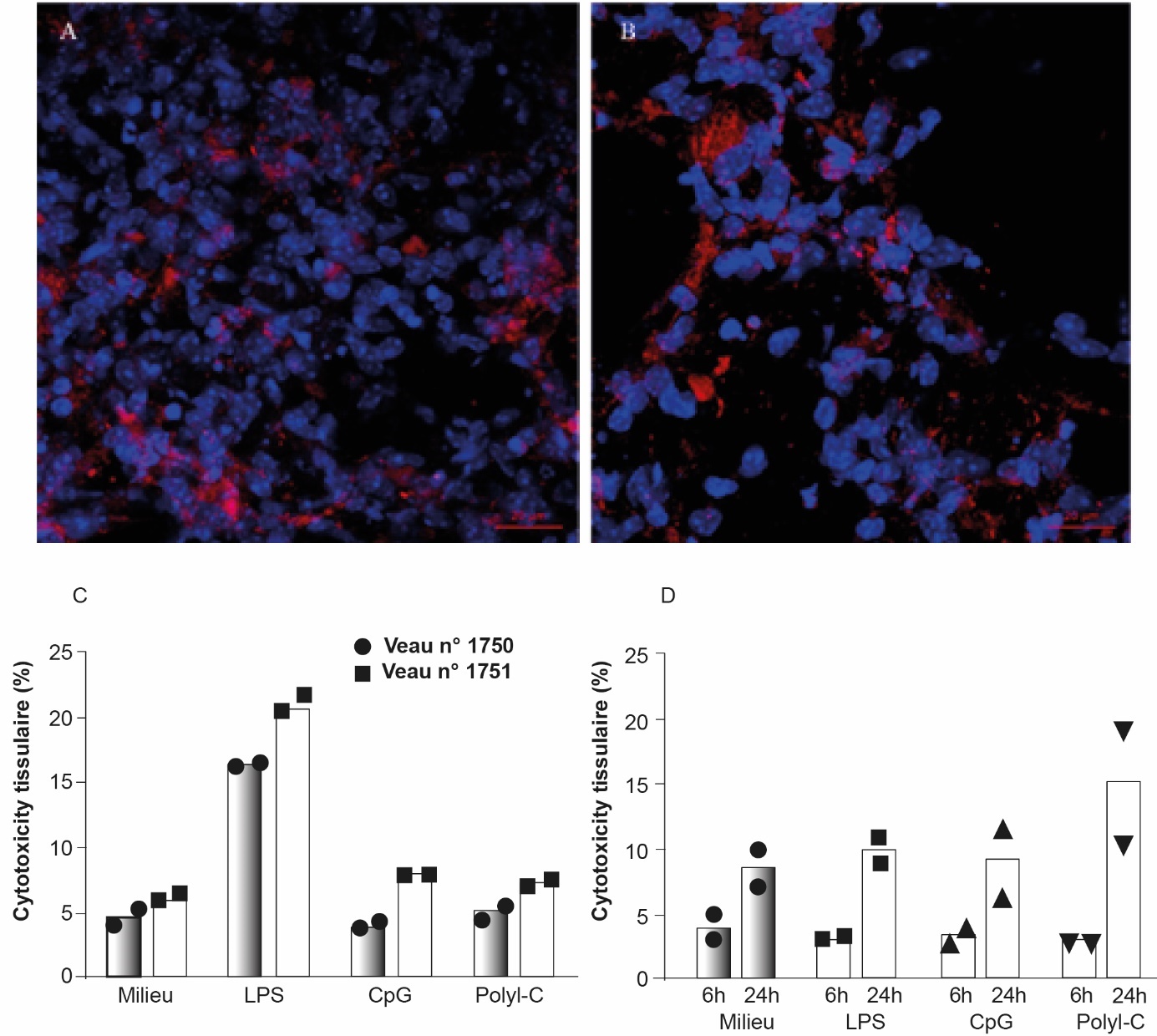
Le marquage des mitochondries vivantes des cellules (coloration rouge) a été réalisé par incubation avec le MitoTracker® Deep Red 24 h (A) ou 48 h (B) après obtention des PCLS de souris adultes. Les noyaux ont été marqués au DAPI (bleu). Les images ont été obtenues au microscope confocal (grossissement x40). C PCLS de veaux ont été incubées 24 h en présence de différents ligands de TLR (LPS, CpG et polyI-C) ou avec le milieu de culture seul. D : PCLS de souris adultes ont été incubées 6 h et 24 h en présence de différents ligands de TLR (LPS, CpG et polyI-C) ou avec le milieu de culture seul. Les symboles correspondent au nombre d’animaux testés (n=2 souris). La cytotoxicité tissulaire est exprimée en pourcentage d’activité de lactate déshydrogénase (LDH) dans le surnageant de culture par rapport à la totalité de l’activité LDH (tissu et surnageant). La moyenne est représentée en histogramme.
La réponse du tissu à une infection peut également être mesurée par le dosage des médiateurs (cytokines, chimiokines, molécules antimicrobiennes…) dans le surnageant de culture (protéines) ou dans le tissu (transcrits ARN). De nombreux travaux ont montré des résultats comparables entre des études menées in vivo et in vitro en utilisant le modèle PCLS. Par exemple, sur PCLS murines, humaines et porcines, utilisées respectivement pour étudier la bronchoconstriction induite en réponse à des allergènes (Henjakovic et al., 2008), la réponse immunologique à différents ligands de TLR (Switalla et al., 2010 ; Marquant et al., 2021) et la virulence de différents sous-types de virus influenza A porcins (Meng et al., 2013), les résultats obtenus sur PCLS concordaient avec ceux obtenus in vivo sur l'Homme ou l'animal. La présence de Mycobacterium bovis GFP a pu être visualisée dans les macrophages alvéolaires suite à l'exposition de PCLS bovins à la bactérie (figure 6A). Par des techniques d'immunofluorescence ou de microscopie électronique, des équipes allemandes ont localisé et suivi la réplication du VRS au sein de cellules épithéliales pulmonaires grâce aux PCLS murines ou bovines (Ebsen et al., 2002 ; Goris et al., 2009, figure 6B). La réplication virale dans les PCLS peut aussi être visualisée par émission de bioluminescence. Des PCLS issues d'une souris adulte ont été infectées par des doses croissantes de VRS codant la luciférase (VRS-Luc, 550, 5 500 et 55 000 pfu). La production de la luciférase reflète la réplication du VRS-Luc (Rameix-Welti et al., 2014). Chaque lecture de bioluminescence est précédée par l'ajout du substrat (luciférine) de l'enzyme (luciférase) sur les PCLS murines (figure 6C). La bioluminescence émise lors de la réplication du VRS est proportionnelle à la dilution de la charge virale lors de l'inoculation du virus initialement déposée sur les PCLS (figure 6C).
Figure 6. Visualisation par immunohistochimie ou bioluminescence de la présence de pathogènes dans les PCLS.
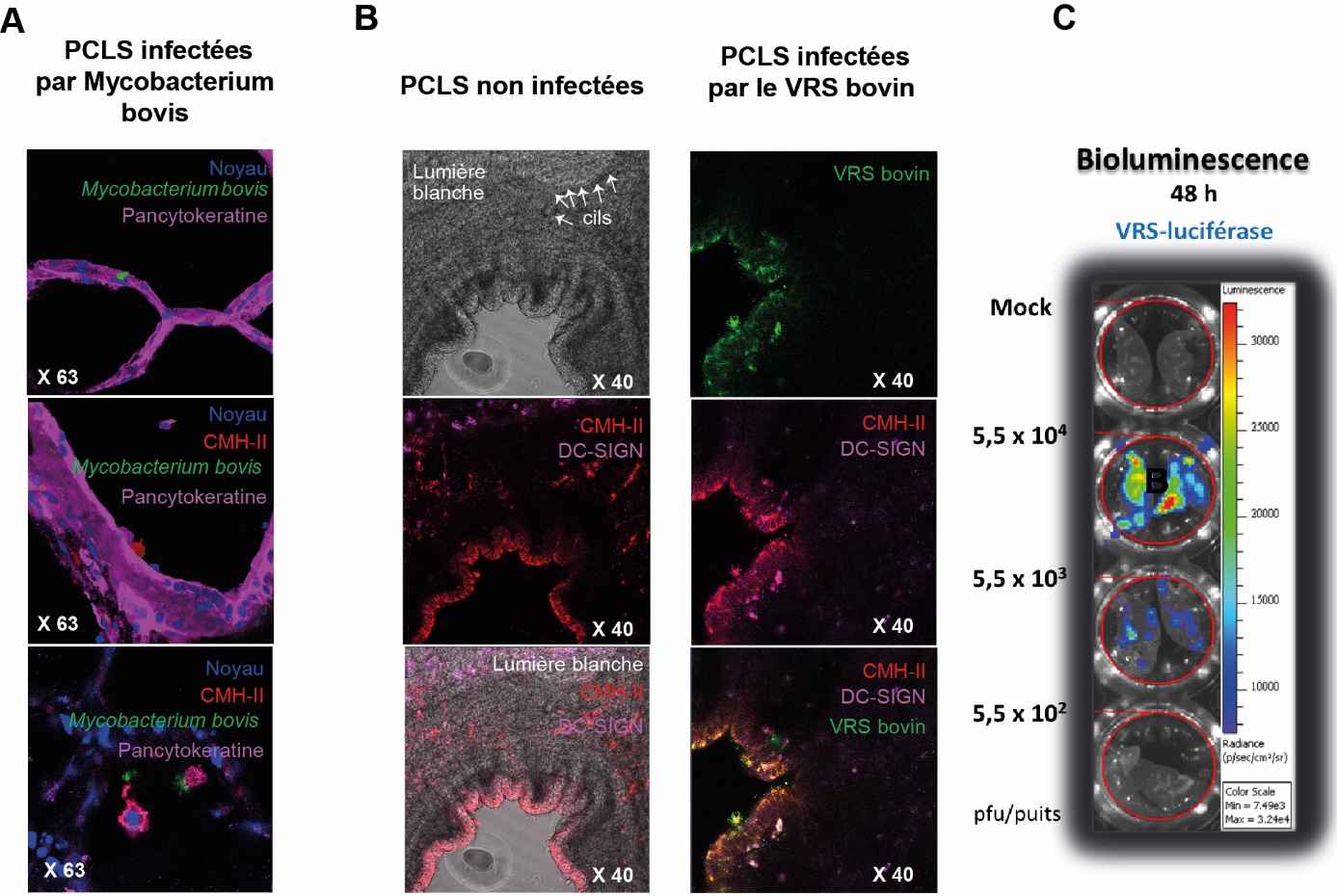
A : Détection de Mycobacterium bovis-GFP ou (B) du VRS bovin dans des PLCS bovines exposées aux pathogènes 48h post infection. Les noyaux ont été marqué au DAPI (marquage bleu). La bactérie Mycobacterium bovis est visualisée directement par le GFP qu’elle exprime suite à la modification génétique de la bactérie. La détection du VRS bovin-GFP a été amplifiée par immunomarquage de la protéine F du virus grâce à un anticorps anti-F couplé au fluorochrome Alexa 488 (marquage vert). L’anticorps anti-pancytokeratine couplé à l’APC permet de visualiser les cellules épithéliales (marquage rose). Les cellules immunitaires type macrophages sont détectées par un anticorps anti-CMH-II marqué à l’Alexa 555 (marquage rouge) et les cellules dendritiques par un anticorps anti-DC-SIGN couplé à l’Alexa647 (marquage rose). C : Quantification de la bioluminescence induite par le VRS-luciférase dans des PCLS de souris adultes 48 h post-infection. Les PCLS ont été infectées avec 55 000 pfu, 5 500 pfu ou 550 pfu de VRS-luciférase ou incubées avec la préparation témoin (mock) pendant 48 h. Le substrat de la luciférase a été ajouté sur les PCLS à 48 h. L’émission de photons est quantifiée grâce au système Ivis®. Une image digitale pseudo-colorée est générée en fonction de l’émission de photons par seconde par surface de tissu (radiance).
Toutefois, en raison de la viabilité tissulaire limitée dans le temps et de l'absence de connections avec les réseaux lymphatiques et sanguins, il est impossible d'obtenir des informations sur une infection persistante ou sur des phénomènes de recrutements cellulaires (Ebsen et al., 2002).
3. L’avenir de ces modèles
D'un point de vue éthique et sociétal, le développement de méthodes alternatives à l'expérimentation animale est aujourd'hui une nécessité. Les nouvelles méthodes alternatives doivent satisfaire à un ou plusieurs principes des règles des 3R : remplacement (substitution des modèles animaux chaque fois que cela est possible), réduction (réduction du nombre d'animaux dans l'expérimentation), et raffinement (optimisation de la méthodologie appliquée aux animaux).
Les PCLS permettent de travailler avec un explant de poumon dont l'architecture est préservée, et on y retrouve toutes les cellules résidentes au moment du prélèvement du tissu. À l'intérieur d'un incubateur au laboratoire, les cellules sont en présence du même taux d'oxygène que celui de l'air (21 % O2). Or dans les organes, ce taux est bien inférieur (et propre à chacun), on parle de physioxie. Cette notion est très peu prise en compte dans les études en biologie. Paddenberg et al. (2014) ont démontré une fluctuation des phénomènes de vasoconstriction d'artères en fonction du taux d'oxygène sur des PCLS murines. À l'avenir, des études d'infection de PCLS en conditions physioxiques permettraient de mimer plus fidèlement l'environnement pulmonaire et d'obtenir des analyses plus pertinentes des voies biologiques mises en jeu. Pour pallier le manque de recrutement cellulaire post-infection, l'ajout de cellules comme les neutrophiles ou les lymphocytes peut également être envisagé dans les puits de culture.
Les organoïdes peuvent pallier le manque actuel de modèles pulmonaires in vitro, pertinents et efficaces, en tirant parti de la plasticité des cellules souches. En effet, bon nombre des limitations citées ci-dessus peuvent être surmontées en générant des organoïdes à partir de progéniteurs, de cellules souches pluripotentes, de cellules souches embryonnaires ou d'iPS qui sont facilement amplifiables. Des progrès sont constamment réalisés dans l'établissement de cultures d'organoïdes physiologiques et pertinents, dans lesquelles de multiples types de cellules (stromales, endothéliales, immunitaires, nerveuses) sont combinés. Nous comprendrons ainsi comment les différents types cellulaires et compartiments, communiquent entre eux in vivo et comment ils sont affectés par les altérations telles que l'inflammation, les infections ou le vieillissement (Shojaie et al., 2015 ; Leeman et al., 2019). Toutefois, pour avancer dans cette voie, le perfectionnement des modèles d'organoïdes pulmonaires nécessitera l'identification d'un plus grand nombre de marqueurs de surface et/ou de rapporteurs pour isoler et purifier les sous-populations de cellules souches et progénitrices et de cellules de soutien stromales.
Il est également probable que les composants de la matrice extracellulaire (MEC) et les forces physiques jouent des rôles clés dans la régulation du comportement et de la différenciation des cellules souches, et ces paramètres commencent également à être explorés à l'aide de systèmes organoïdes. La MEC du poumon natif est complexe et façonne le microenvironnement cellulaire en fournissant des indices structurels, en régulant l'accès aux facteurs de croissance solubles et en contrôlant l'adhésion et la migration des cellules. Afin de créer un environnement physiologique pour les cellules pulmonaires, les chercheurs se sont tournés vers des approches de bioingénierie pour créer une variété d'échafaudages structurels (Matrigel, collagène, matériau synthétique tel que le PLGA...) et de micro-environnements pour imiter de manière reproductible le poumon (Shojaie et al., 2015).
Afin de modéliser les forces mécaniques du poumon (inspiration, expiration), les bioingénieurs développent des microsystèmes innovants appelés « poumons sur puce » (lung on a chip), dans lesquels l'emplacement et la force mécanique exercée sur chaque cellule sont minutieusement définis pour modéliser à la fois les petites voies aériennes et l'étirement qui se produit dans le compartiment alvéolaire. Dans le poumon alvéolaire sur puce, les éléments structurels, fonctionnels et mécaniques de l'interface entre les alvéoles et le réseau capillaire ont été modélisés par un dispositif microfluidique contenant deux canaux séparés par une fine membrane flexible recouverte de protéines de la MEC. Des cellules endothéliales vasculaires sont cultivées dans une chambre, et des cellules épithéliales alvéolaires pouvant également être exposées à l'air sont cultivées dans l'autre. La régulation contrôlée de l'étirement de la membrane et des flux de fluides dans la chambre vasculaire permet d'étudier le passage de matériaux, de nutriments ou d'agents pathogènes de la région alvéolaire au compartiment vasculaire. Ces systèmes modèles sont les seuls à intégrer un étirement mécanique contrôlé et un contrôle du flux de liquide pour simuler la fonction physiologique au niveau de l'organe (Nichols et al., 2014 ; Ishahak et al., 2020 ; Pasman et al., 2020). Park et al ont développé un système de coculture cellules épithéliales-cellules mésenchymateuses-cellules endothéliales sur puce en utilisant différents compartiments pour cultiver séparément les voies aériennes et la partie vasculaire. Ces compartiments ou chambres de culture étant communicants entre eux, ils ont pu étudier la communication entre les différents types de cellules (Park et al., 2018). Par rapport à une culture ALI, le contact avec le compartiment vasculaire (contenant également des fibroblastes) entraîne une différenciation épithéliale plus robuste des voies respiratoires (mise en évidence par le nombre de cellules caliciformes et de cellules ciliées présentes) ainsi qu'une intégrité accrue de la barrière épithéliale (résistance transépithéliale plus élevée). Ces résultats soulignent l'avantage des modèles in vitro modulaires, où les réponses intégrées peuvent être comparées à celles des cocultures monocellulaires pour identifier les éléments de communication inter-cellule et analyser leur impact. Une fois encore, tous ces développements sont actuellement réalisés dans des modèles humains, mais ils devraient également profiter à d'autres espèces de mammifères.
Conclusion
Les organoïdes, les cultures 2D ALI et les PCLS sont des modèles in vitro qui miment la structure tridimensionnelle du poumon, qui reflètent sa composition multicellulaire et reproduisent dans une certaine mesure ces fonctionnalités (production de mucus, activité ciliaires). Les avantages et limites de ces systèmes sont reportés dans le tableau 1.
Tableau 1. Avantages et limites des modèles in vitro.
Avantages |
Limites |
|
|---|---|---|
PCLS |
- Architecture tissulaire préservée ; |
- Manque le recrutement des cellules |
Organoïdes – 3D |
- Complexité cellulaire préservée |
- Complexité de la composition du milieu |
Tapis cellulaire 2D |
- Complexité cellulaire préservée |
- Complexité de la composition du milieu |
Ils peuvent être développés à partir de différentes sources de cellules souches (embryonnaires, iPS, adultes) et de tissus (poumon embryonnaire ou adulte) et constituent une méthode réaliste pour étudier la physiologie et le développement des tissus et des organes, tout en limitant l'expérimentation animale. En plus d'apporter des outils précieux et puissants pour l'étude des maladies infectieuses comme décrit dans cette revue, et le test de molécules thérapeutiques, ces nouveaux modèles in vitro peuvent couvrir de nouveaux champs d'applications. D'un point de vue génétique, il est possible de générer des organoïdes d'espèces, de races et d'animaux différents, ce qui permet de générer des biobanques de références et de travailler sur nos espèces d'intérêt agronomiques, tout en tenant compte de la diversité génétique de différentes races de bovins, ainsi que la diversité génétique inter-individuelle au sein d'un troupeau. La diversité génétique des organoïdes générés peut permettre de mieux appréhender les différences inter-races ou inter-individuelles de la réponse aux pathogènes ou une certaine résilience d'une race par rapport à une autre. Bien que plus appliqués à la santé humaine pour le moment, les organoïdes pulmonaires sont des ressources importantes pour la modélisation des maladies autres qu'infectieuses, notamment génétiques ou cancéreuses ainsi que pour le dépistage de médicaments et de thérapies appropriés (Clevers, 2016 ; Ramamoorthy et al., 2019 ; Strikoudis et al., 2019 ; Wang et al., 2020). Des approches de thérapie génétique sont testées sur les organoïdes pulmonaires humains pour corriger des mutations de certains récepteurs défectueux des cellules pulmonaires (Récepteur CFTR impliqué dans la mucoviscidose) (Ruan et al., 2019). Une autre application possible touche à la médecine régénérative avec l'utilisation des organoïdes comme source durable de cellules fonctionnelles d'une part et comme outil de criblage de molécule stimulant la multiplication d'un type cellulaire spécifique afin de promouvoir son renouvellement dans des pathologies. À ce jour, ces nouveaux modèles in vitro efficaces sont principalement développés chez l'homme, mais des efforts doivent être faits pour s'assurer qu'ils peuvent bénéficier aux animaux domestiques et apporter de nouveaux outils en adéquation avec les espèces d'intérêt. En conclusion, l'éventail de différents organoïdes qui peuvent être utilisés pour modéliser divers aspects du développement, de l'homéostasie, de la régénération et des maladies pulmonaires représente une nouvelle voie passionnante pour répondre aux questions restantes sur la biologie pulmonaire de diverses espèces d'intérêt.
Remerciements
Les illustrations présentées dans cet article sont issues de travaux financés par le projet ANR EpiLungCell (grant ANR-17-CE20-0018), le projet Européen Veterinary Biocontained research facility Network (VETBIONET), le projet ANIMALT FEDER/Region Centre Val de Loire (FEDER convention EX007516, Région Centre 2019-00134936, programme AE-2019-1850) et le projet FINOVI projet Myco3D.
Les auteurs tiennent à remercier Pierre Germon, Sabine Riffault et Nathalie Winter pour leurs conseils et relecture. Les auteurs remercient la plateforme MIMA2 pour l’accès à l’appareil IVIS200 qui a été financé par la région Ile-de-France (SESAME). Les auteurs remercient Florence Tardy, Patrice Gaurivaud et Sandra Lacote de l’UMR MYCO (ANSES-VetAgro Sup) pour la réalisation des infections avec mycoplasmes ; et le professeur Georg Herrler qui a formé Aude Remot à l’obtention et l’infection de PCLS par le VRS.
Références
- Abs V., Bonicelli J., Kacza J., Zizzadoro C., Abraham G., 2019. Equine bronchial fibroblasts enhance proliferation and differentiation of primary equine bronchial epithelial cells co-cultured under air-liquid interface. PLoS ONE, 14, e0225025. doi:10.1371/journal.pone.0225025
- Andrews A.H., 2000. Calf pneumonia costs. Cattle Practice, 8, 109-114.
- Archer F., Jacquier E., Lyon M., Chastang J., Cottin V., Mornex J.F., Leroux C., 2007. Alveolar type II cells isolated from pulmonary adenocarcinoma: a model for JSRV expression in vitro. Am. J. Respir. Cell Mol. Biol., 36, 534-540. doi:10.1165/rcmb.2006-0285OC
- Archer F., Abi-Rizk A., Desloire S., Dolmazon C., Gineys B., Guiguen F., Cottin V., Mornex J.F., Leroux C., 2013. Lung progenitors from lambs can differentiate into specialized alveolar or bronchiolar epithelial cells. BMC Vet. Res., 9. doi:10.1186/1746-6148-9-224
- Barkauskas C.E., Chung M.I., Fioret B., Gao X., Katsura H., Hogan B.L, 2017. Lung organoids: current uses and future promise. Development, 144, 986-997. doi:10.1242/dev.140103
- Bryson K.J., Garrido D., Esposito M., McLachlan G., Digard P., Schouler C., Guabiraba R., Trapp S., Vervelde L., 2020. Precision cut lung slices: a novel versatile tool to examine host-pathogen interaction in the chicken lung. Vet. Res., 51, 2. doi:10.1186/s13567-019-0733-0
- Caron C.H.J., 2018. Élaboration d'une démarche structurée et argumentée d'audit "logement" en cas de problèmes respiratoires chez les veaux. Thèse vétérinaire, Faculté de médecine de Créteil.
- Chen Y.W., Huang S.X., de Carvalho Alrt., Ho S.H., Islam M.N., Volpi S., Notarangelo L. D., Ciancanelli M., Casanova J.L., Bhattacharya J., Liang A.F., Palermo L.M., Porotto M., Moscona A., Snoeck H.W., 2017. A three-dimensional model of human lung development and disease from pluripotent stem cells. Nat. Cell Biol., 19, 542-549. doi:10.1038/ncb3510
- Choi J., Iich E., Lee J.H., 2016. Organogenesis of adult lung in a dish: Differentiation, disease and therapy. Dev Biol, 420, 278-286. doi:10.1016/j.ydbio.2016.10.002
- Chung M.I., Bujnis M., Barkauskas C.E., Kobayashi Y., Hogan B.L.M., 2018. Niche-mediated BMP/SMAD signaling regulates lung alveolar stem cell proliferation and differentiation. Development, 145. doi:10.1242/dev.163014
- Clevers H., 2016. Modeling development and disease with organoids. Cell, 165, 1586-1597. doi:10.1016/j.cell.2016.05.082
- Cozens D., Grahame E., Sutherland E., Taylor G., Berry C.C., Davies R.L., 2018a. Development and optimization of a differentiated airway epithelial cell model of the bovine respiratory tract. Sci. Rep., 8, 853. doi:10.1038/s41598-017-19079-y
- Cozens D., Sutherland E., Marchesi F., Taylor G., Berry C.C., Davies R. L., 2018b. Temporal differentiation of bovine airway epithelial cells grown at an air-liquid interface. Sci. Rep., 8, 14893. doi:10.1038/s41598-018-33180-w
- Deprez M., LE Zaragosi, Truchi M., Becavin C., Ruiz García S., Arguel M.J., Plaisant M., Magnone V., Lebrigand K., Abelanet S., Brau F., Paquet A., Pe'er D., Marquette C.H., Leroy S., Barbry P., 2020. A Single-Cell Atlas of the Human Healthy Airways., Am. J. Respir. Crit. Care Med., 202, 1636-1645. doi:10.1164/rccm.201911-2199OC
- Dye B.R., Miller A.J., Spence J.R., 2016. How to Grow a Lung: Applying Principles of Developmental Biology to Generate Lung Lineages from Human Pluripotent Stem Cells. Curr. Pathobiol. Rep., 4, 47-57. doi:10.1007/s40139-016-0102-x
- Ebsen M., Mogilevski G., Anhenn O., Maiworm V., Theegarten D., Schwarze J., Morgenroth K., 2002. Infection of murine precision cut lung slices (PCLS) with respiratory syncytial virus (RSV) and chlamydophila pneumoniae using the Krumdieck technique. Pathol. Res. Pract., 198, 747-753. doi:10.1078/0344-0338-00331
- Fehrenbach H., 2001. Alveolar epithelial type II cell: defender of the alveolus revisited. Respir. Res., 2, 33-46. doi:10.1186/rr36
- Ferraro S., Fecteau G., Dubuc J., Francoz D., Rousseau M., Roy J.P., Buczinski S., 2021. Scoping review on clinical definition of bovine respiratory disease complex and related clinical signs in dairy cows, J. Dairy Sci., 104, 7095-7108. doi:10.3168/jds.2020-19471
- Gallivan G.J., McDonell W.N., Forrest J.B., 1989. Comparative pulmonary mechanics in the horse and the cow. Res. Vet. Sci., 46, 322-330. doi:10.1016/S0034-5288(18)31174-3
- Ghaedi M., Calle E.A., Mendez J.J., Gard A. L., Balestrini J., Booth A., Bove P.F., Gui L., White E.S., Niklason L.E, 2013. Human iPS cell-derived alveolar epithelium repopulates lung extracellular matrix. J Clin Invest, 123: 4950-4962. doi:10.1172/JCI68793
- Gohy S., Hupin C., Ladjemi M.Z., Hox V., Pilette C., 2020. Key Role of the Epithelium in Chronic Upper Airways Diseases. Clin. Exp. Allergy, 50, 135-146. doi:10.1111/cea.13539
- Goris K.S., Uhlenbruck C., Schwegmann-Wessels, Köhl W., Niedorf F., Stern M., Hewicker-Trautwein M., Bals R., Taylor G., Braun A., Bicker G., Kietzmann M., Herrler G., 2009. Differential sensitivity of differentiated epithelial cells to respiratory viruses reveals different viral strategies of host infection. J. Virol., 83, 1962-1968. doi:10.1128/JVI.01271-08
- Henjakovic M., Martin C., Hoymann H.G., Sewald K., Ressmeyer A.R., Dassow C., Pohlmann G., Krug N., Uhlig S., Braun A., 2008. Ex vivo lung function measurements in precision-cut lung slices (PCLS) from chemical allergen-sensitized mice represent a suitable alternative to in vivo studies. Toxicol. Sci., 106, 444-453. doi:10.1093/toxsci/kfn178
- Hermans C., Bernard A., 1999. Lung epithelium-specific proteins: characteristics and potential applications as markers. Am. J. Respir. Crit. Care Med., 159, 646-678. doi:10.1164/ajrccm.159.2.9806064
- Hippenstiel S., Opitz B., Schmeck B., Suttorp N., 2006. Lung epithelium as a sentinel and effector system in pneumonia--molecular mechanisms of pathogen recognition and signal transduction. Respir. Res., 7, 97. doi:10.1186/1465-9921-7-97
- Huang S.X., Islam M.N., O'Neill J., Hu Z., Yang Y.G., Chen Y.W., Mumau M., Green M.D., Vunjak-Novakovic G., Bhattacharya J., Snoeck H.W., 2014. Efficient generation of lung and airway epithelial cells from human pluripotent stem cells. Nat. Biotechnol., 32, 84-91. doi:10.1038/nbt.2754
- Inayama Y., Hook G.E., Brody A.R., Cameron G.S., Jetten A.M., Gilmore L.B., Gray T., Nettesheim P., 1988. The differentiation potential of tracheal basal cells. Lab. Invest., 58, 706-717.
- Ishahak M., Hill J., Amin Q., Wubker L., Hernandez A., Mitrofanova A., Sloan A., Fornoni A., Agarwal A., 2020. Modular microphysiological system for modeling of biologic barrier function. Front. Bioeng. Biotechnol., 8, 581163. doi:10.3389/fbioe.2020.581163
- Jacob A., Morley M.,, Hawkins F.,. McCauley K.B., Jean J.C., Heins H., Na C.L., Weaver T.E., Vedaie M., Hurley K., Hinds A., Russo S. J., Kook S., Zacharias W., Ochs M., Traber K., Quinton L.J., Crane A., Davis B. R., White F.V., Wambach J., Whitsett J.A., Cole F.S., Morrisey E.E., Guttentag S.H., Beers M.F., Kotton D.N., 2017. Differentiation of human pluripotent stem cells into functional lung alveolar epithelial cells. Cell Stem Cell, 21, 472-488 e10. doi:10.1016/j.stem.2017.08.014
- Kotton D.N., Morrisey E.E., 2014. Lung regeneration: mechanisms, applications and emerging stem cell populations. Nat. Med., 20, 822-832. doi:10.1038/nm.3642
- Lee D., Chambers M., 2019. A co-culture model of the bovine alveolus. F1000Res, 8, 357. doi:10.12688/f1000research.18696.2
- Lee D.F., Salguero F.J., Grainger D., Francis R.J., MacLellan-Gibson K., Chambers M.A., 2018. Isolation and characterisation of alveolar type II pneumocytes from adult bovine lung. Sci. Rep., 8, 11927. doi:10.1038/s41598-018-30234-x
- Leeman K.T., Pessina P., Lee J.H., Kim C.F., 2019. Mesenchymal Stem Cells Increase Alveolar Differentiation in Lung Progenitor Organoid Cultures. Sci. Rep., 9, 6479. doi:10.1038/s41598-019-42819-1
- Li Y., Wu Q., Sun X., Shen J., Chen H., 2020. Organoids as a Powerful Model for Respiratory Diseases. Stem. Cells Int., 2020, 5847876. doi:10.1155/2020/5847876
- Longmire T.A., Ikonomou L., Hawkins F., Christodoulou C., Cao Y., Jean J.C., Kwok L.W., Mou H., Rajagopal J., Shen S.S., Dowton A.A., Serra M., Weiss D.J., Green M.D., Snoeck H.W., Ramirez M.I., Kotton D.N., 2012. Efficient derivation of purified lung and thyroid progenitors from embryonic stem cells. Cell Stem Cell, 10, 398-411. doi:10.1016/j.stem.2012.01.019
- Makoschey B., Berge A.C., 2021. Review on bovine respiratory syncytial virus and bovine parainfluenza - usual suspects in bovine respiratory disease - a narrative review, BMC Vet. Res., 17, 261. doi:10.1186/s12917-021-02935-5
- Marquant Q., Laubreton D., Drajac C., Mathieu E, Bouguyon E., Noordine M.L., Remot A., Riffault S., Thomas M., Descamps D., 2021. The microbiota plays a critical role in the reactivity of lung immune components to innate ligands. FASEB J., 35, e21348. doi:10.1096/fj.202002338R
- Mata M., Sarrion I., Armengot M., Carda C., Martinez I., Melero J. A., Cortijo J., 2012. Respiratory syncytial virus inhibits ciliagenesis in differentiated normal human bronchial epithelial cells: effectiveness of N-acetylcysteine. PLoS One, 7, e48037. doi:10.1371/journal.pone.0048037
- Meng F., Punyadarsaniya D., Uhlenbruck S., Hennig-Pauka I., Schwegmann-Wessels C., Ren X., Dürrwald R., Herrler G., 2013. Replication characteristics of swine influenza viruses in precision-cut lung slices reflect the virulence properties of the viruses. Vet. Res., 44, 110. doi:10.1186/1297-9716-44-110
- Miller A.J., Dye B.R., Ferrer-Torres D., Hill D.R., Overeem A.W., Shea L.D., Spence J.R., 2019. Generation of lung organoids from human pluripotent stem cells in vitro. Nat. Protoc., 14, 518-540. doi:10.1038/s41596-018-0104-8
- Morrisey E.E., Hogan B.L., 2010. Preparing for the first breath: genetic and cellular mechanisms in lung development. Dev. Cell., 18, 8-23. doi:10.1016/j.devcel.2009.12.010
- Mosier D., 2014. Review of BRD pathogenesis: the old and the new. Anim. Health Res. Rev., 15, 166-168. doi:10.1017/S1466252314000176
- Neupane A.S., Willson M., Chojnacki A.K., Silva Castanheira E., Vargas F., Morehouse C., Carestia A., Keller A.E., Peiseler M., DiGiandomenico A., Kelly M.M., Amrein M., Jenne C., Thanabalasuriar A., Kubes P., 2020. Patrolling alveolar macrophages conceal bacteria from the immune system to maintain homeostasis. Cell, 183, 110-125 e11. doi:10.1016/j.cell.2020.08.020
- Nicholas R.A.J., Ayling R.D., 2003. Mycoplasma bovis: disease, diagnosis, and control. Res. Sci., 74, 105-112. doi:10.1016/S0034-5288(02)00155-8
- Nichols J.E., Niles J., Vega S.P., Argueta L.B., Eastaway A., Cortiella J., 2014. Modeling the lung: Design and development of tissue engineered macro- and micro-physiologic lung models for research use. Exp. Biol. Med. (Maywood), 239, 1135-1169. doi:10.1177/1535370214536679
- Nicod L.P., 1999. Pulmonary defence mechanisms. Respiration, 66, 2-11. doi:10.1159/000029329
- Paddenberg R., Mermer P., Goldenberg A., Kummer W., 2014. Videomorphometric analysis of hypoxic pulmonary vasoconstriction of intra-pulmonary arteries using murine precision cut lung slices. J. Visualized Exp., JoVE, 83, e50970. doi:10.3791/50970-v
- Pardon B., Callens J., Maris J., Allais L., Van Praet W., Deprez P., Ribbens S., 2020. Pathogen-specific risk factors in acute outbreaks of respiratory disease in calves. J. Dairy Sci., 103, 2556-2266. doi:10.3168/jds.2019-17486
- Park J.Y., Ryu H., Lee B., Ha D.H., Ahn M., Kim S., Kim J.Y., Jeon N.L., Cho D.W., 2018. Development of a functional airway-on-a-chip by 3D cell printing. Biofabrication, 11. doi:10.1088/1758-5090/aae545
- Pasman T., Baptista D., van Riet S., Truckenmuller R.K., Hiemstra P.S., Rottier R.J., Stamatialis D., Poot A. A., 2020. Development of Porous and Flexible PTMC Membranes for In Vitro Organ Models Fabricated by Evaporation-Induced Phase Separation. Membranes (Basel), 10. doi:10.3390/membranes10110330
- Patton J.S., Byron P.R., 2007. Inhaling medicines: delivering drugs to the body through the lungs. Nat. Rev. Drug Discov., 6, 67-74. doi:10.1038/nrd2153
- Perrin J.B., 2012. Modélisation de la mortalité bovine dans un objectif de surveillance épidémiologique. Thèse de Médecine humaine et pathologie. Université Claude Bernard - Lyon I, France, ffNNT : 2012LYO10275ff. fftel-00830542.
- Rackley C.R., Stripp B.R., 2012. Building and maintaining the epithelium of the lung. J. Clin. Invest., 122, 2724-2730. doi:10.1172/JCI60519
- Ramamoorthy P., Thomas S.M., Kaushik G., Subramaniam D., Chastain K.M., Dhar A., Tawfik O., Kasi A., Sun W., Ramalingam S., Gunewardena S., Umar S., Mammen J.M., Padhye S.B., Weir S.J., Jensen R.A., Sittampalam G.S., Anant S., 2019. Metastatic Tumor-in-a-Dish, a Novel Multicellular Organoid to Study Lung Colonization and Predict Therapeutic Respons., Cancer Res, 79, 1681-1695. doi:10.1158/0008-5472.CAN-18-2602
- Rameix-Welti M.A., Le Goffic R., Herve P.L., Sourimant J., Remot A., Riffault S., Yu Q., Galloux M., Gault E., Eleouet J.F., 2014. Visualizing the replication of respiratory syncytial virus in cells and in living mice, Nat. Commun, 5, 5104. doi:10.1038/ncomms6104
- Rane C.K., Jackson S.R., Pastore C.F., Zhao G., Weiner A.I., Patel N.N., Herbert D.R., Cohen N.A., Vaughan A.E., 2019. Development of solitary chemosensory cells in the distal lung after severe influenza injury. Am. J. Physiol. Lung Cell Mol. Physiol., 316, L1141-L1149. doi:10.1152/ajplung.00032.2019
- Rawlins E.L., Hogan B.L., 2006. Epithelial stem cells of the lung: privileged few or opportunities for many? Development, 133, 2455-2465. doi:10.1242/dev.02407
- Rawlins E.L., Okubo T., Xue Y., Brass D.M., Auten R.L., Hasegawa H., Wang F., Hogan B.L., 2009. The role of Scgb1a1+ Clara cells in the long-term maintenance and repair of lung airway, but not alveolar, epithelium. Cell Stem Cell, 4, 525-534. doi:10.1016/j.stem.2009.04.002
- Reid L., Meyrick B., Antony V.B., Chang L.Y., Crapo J.D., Reynolds H.Y., 2005. The mysterious pulmonary brush cell: a cell in search of a function. Am. J. Respir. Crit. Care Med., 172, 136-139. doi:10.1164/rccm.200502-203WS
- Remot A., Carreras F., Coupe A., Doz-Deblauwe E., Boschiroli M.L., Browne J.A., Marquant Q., Descamps D., Archer F., Aseffa A., Germon P., Gordon S..V., Winter N., 2021. Mycobacterial infection of precision-cut lung slices reveals type 1 interferon pathway is locally induced by mycobacterium bovis but not m. tuberculosis in a cattle breed. Front Vet. Sci., 8, 696525. doi:10.3389/fvets.2021.696525
- Riffault S., Hagglund S., Guzman E., Naslund K., Jouneau L., Dubuquoy C., Pietralunga V., Laubreton D., Boulesteix O., Gauthier D., Remot A., Boukaridi A., Falk A., Shevchenko G., Lind S.B., Vargmar K., Zhang B., Kwong P.D., Rodriguez M.J., Duran M.G., Schwartz-Cornil I., Eleouet J.F., Taylor G., Valarcher J.F., 2020. A single shot pre-fusion-stabilized bovine rsv f vaccine is safe and effective in newborn calves with maternally derived antibodies, Vaccines (Basel), 8. doi:10.3390/vaccines8020231
- Rock J.R., Hogan B.L.M., 2011. Epithelial progenitor cells in lung development, maintenance, repair, and disease. Annu. Rev. Cell Dev. Biol., 27, 493-512. doi:10.1146/annurev-cellbio-100109-104040
- Ruan J., Hirai H., Yang D., Ma L., Hou X., Jiang H., Wei H., Rajagopalan C., Mou H., Wang G., Zhang J., Li K., Chen Y.E., Sun F., Xu J., 2019. Efficient gene editing at major cftr mutation loci. Mol. Ther. Nucleic Acids, 16, 73-81. doi:10.1016/j.omtn.2019.02.006
- Sachs N., Papaspyropoulos A., Zomer-van Ommen D.D., Heo I., Bottinger L., Klay D., Weeber F., Huelsz-Prince G., Iakobachvili N., Amatngalim G.D., de Ligt J., van Hoeck A., Proost N., Viveen M.C., Lyubimova A., Teeven L., Derakhshan S., Korving J., Begthel H., Dekkers J.F., Kumawat K., Ramos E., van Oosterhout M.F., Offerhaus G.J., Wiener D.J., Olimpio E.P., Dijkstra K.K., Smit E.F., van der Linden M., Jaksani S., van de Ven M., Jonkers J., Rios A.C., Voest E.E., van Moorsel C.H., van der Ent C.K., Cuppen E., van Oudenaarden A., Coenjaerts F.E., Meyaard L., Bont L.J., Peters P.J., Tans S.J., van Zon J.S., Boj S.F., Vries R.G., Beekman J. M., Clevers H., 2019. Long-term expanding human airway organoids for disease modeling. EMBO J., 38. doi:10.15252/embj.2018100300
- Salahudeen A.A., Choi S.S., Rustagi A., Zhu J., van Unen V., Sm de la O., Flynn R.A., Margalef-Catala M., Santos A.J.M., Ju J., Batish A., Usui T., Zheng G.X.Y., Edwards C.E., Wagar L.E., Luca V., Anchang B., Nagendran M., Nguyen K., Hart D.J., Terry J.M., Belgrader P., Ziraldo S.B., Mikkelsen T.S., Harbury P.B., Glenn J.S., Garcia K.C., Davis M. M., Baric R.S., Sabatti C., Amieva M.R., Blish C.A., Desai T.J., Kuo C.J., 2020. Progenitor identification and SARS-CoV-2 infection in human distal lung organoids. Nature, 588, 670-675. doi:10.1038/s41586-020-3014-1
- Schilders K.A., Eenjes E., van Riet S., Poot A.A., Stamatialis D., Truckenmuller R., Hiemstra P.S., Rottier R.J., 2016. Regeneration of the lung: Lung stem cells and the development of lung mimicking devices. Respir. Res., 17, 44. doi:10.1186/s12931-016-0358-z
- Schiller I., Waters W.R., Vordermeier H.M., Jemmi T., Welsh M., Keck N., Whelan A., Gormley E., Boschiroli M.L., Moyen J.L., Vela C., Cagiola M., Buddle B.M., Palmer M., Thacker T., Oesch B., 2011. Bovine tuberculosis in Europe from the perspective of an officially tuberculosis free country: trade, surveillance and diagnostics., Vet. Microbiol., 151, 153-159. doi:10.1016/j.vetmic.2011.02.039
- Sewald K., Braun A., 2013. Assessment of immunotoxicity using precision-cut tissue slices., Xenobiotica, 43, 84-97. doi:10.3109/00498254.2012.731543
- Shojaie S., Ermini L., Ackerley C., Wang J., Chin S., Yeganeh B., Bilodeau M., Sambi M., Rogers I., Rossant J., Bear C.E., Post M., 2015. Acellular lung scaffolds direct differentiation of endoderm to functional airway epithelial cells: requirement of matrix-bound HS proteoglycans. Stem Cell Reports, 4, 419-30. doi:10.1016/j.stemcr.2015.01.004
- Smith P.F., Gandolfi A.J., Krumdieck C.L., Putnam C.W., Zukoski III C.F., Davis W.M., Brendel K., 1985. Dynamic organ culture of precision liver slices for in vitro toxicology. Life Sci., 36, 1367-1375. doi:10.1016/0024-3205(85)90042-6
- Strikoudis A., Cieslak A., Loffredo L., Chen Y.W., Patel N., Saqi A., Lederer D.J., Snoeck H.W., 2019. Modeling of fibrotic lung disease using 3d organoids derived from human pluripotent stem cells. Cell Rep, 27, 3709-37223.e5. doi:10.1016/j.celrep.2019.05.077
- Switalla S., Lauenstein L., Prenzler F., Knothe S., Förster C., Fieguth H.G., Pfennig O., Schaumann F., Martin C., Guzman C.A., Ebensen T., Müller M., Hohlfeld J.M., Krug N., Braun A., Sewald K., 2010. Natural innate cytokine response to immunomodulators and adjuvants in human precision-cut lung slices. Toxicol. Appl. Pharmacol., 246, 107-115. doi:10.1016/j.taap.2010.04.010
- Tadokoro T., Gao X., Hong C.C., Hotten D., Hogan B.L., 2016. BMP signaling and cellular dynamics during regeneration of airway epithelium from basal progenitors. Development, 143, 764-773. doi:10.1242/dev.126656
- Tam A., Wadsworth S., Dorscheid D., Man S.F.P., Sin D.D., 2011. The airway epithelium: more than just a structural barrier. Therapeutic Adv. Respiratory Disease, 5, 255-273. doi:10.1177/1753465810396539
- Tizzano M., Merigo F., Sbarbati A., 2006. Evidence of solitary chemosensory cells in a large mammal: the diffuse chemosensory system in Bos taurus airways. J. Anat., 209, 333-337. doi:10.1111/j.1469-7580.2006.00617.x
- Tizzano M., Cristofoletti M., Sbarbati A., Finger T.E., 2011. Expression of taste receptors in Solitary Chemosensory Cells of rodent airways. BMC Pulmonary Med., 11:3. doi:10.1186/1471-2466-11-3
- Vareille M., Kieninger E., Edwards M.R., Regamey N., 2011. The airway epithelium: soldier in the fight against respiratory viruses. Clin. Microbiol. Rev., 24, 210-229. doi:10.1128/CMR.00014-10
- Veit H.P, Farrell R.L., 1978. The anatomy and physiology of the bovine respiratory system relating to pulmonary disease. Cornell Vet., 68, 555-581. doi:10.1111/j.1469-7580.2006.00617.x
- Wang S.Z., Rosenberger C.L., Bao Y.X., Stark J.M., Harrod K.S., 2003. Clara cell secretory protein modulates lung inflammatory and immune responses to respiratory syncytial virus infection. J. Immunol., 171, 1051-1060. doi:10.4049/jimmunol.171.2.1051
- Wang D., Haviland D.L., Burns A.R., Zsigmond E., Wetsel R.A., 2007. A pure population of lung alveolar epithelial type II cells derived from human embryonic stem cells. Proc. Natl. Acad. Sci. U.S.A., 104, 4449-4454. doi:10.1073/pnas.0700052104
- Wang J., Li X., Chen H., 2020. Organoid models in lung regeneration and cancer. Cancer Lett., 475, 129-135. doi:10.1016/j.canlet.2020.01.030
- Xie X., Gan Y., Pang M., Shao G., Zhang L., Liu B., Xu Q., Wang H., Feng Y., Yu Y., Chen R., Wu M., Zhang Z., Hua L., Xiong Q., Liu M., Feng Z., 2018. Establishment and characterization of a telomerase-immortalized porcine bronchial epithelial cell line. J. Cell Physiol., 233, 9763-9776. doi:10.1002/jcp.26942
- Yamamoto Y., Gotoh S., Korogi Y., Seki M., Konishi S., Ikeo S., Sone N., Nagasaki T., Matsumoto H., Muro S., Ito I., Hirai T., Kohno T., Suzuki Y., Mishima M., 2017. Long-term expansion of alveolar stem cells derived from human iPS cells in organoids. Nature Meth., 14, 1097-1106. doi:10.1038/nmeth.4448
- Zimmermann B., 1987. Lung organoid culture. Differentiation, 36, 86-109. doi:10.1111/j.1432-0436.1987.tb00183.x
Résumé
Les maladies respiratoires, qu’elles touchent les animaux et/ou les hommes, ont un impact sanitaire et économique considérable sur notre société. Pouvoir mieux les contrôler, les traiter et les prédire, nécessite de pouvoir les étudier. Pour cela des modèles d’études pertinents, reproductibles, efficaces aisés d’utilisation, et alternatifs à l’expérimentation animale doivent être proposés. D’énormes progrès méthodologiques ont été réalisés ces dernières années avec l’émergence de modèles in vitro qui miment le poumon en reproduisant la diversité des types cellulaires, l’architecture du tissu et certaines de ses fonctionnalités (activité ciliaire, sécrétion). Cette revue présente les avancées dans la génération de ces modèles chez le bovin : les organoïdes, les cultures Air-liquide-interface (ALI) et les coupes fines de poumon (PCLS). Ils sont utilisés pour mieux décrire et comprendre les processus physiopathologiques induits par des infections (virus, bactérie, parasite) respiratoires et permettent de tester des approches prophylactiques ou curatives.
Pièces jointes
Pas de document complémentaire pour cet article##plugins.generic.statArticle.title##
 Vues: 2673
Vues: 2673
Téléchargements
 PDF: 470
PDF: 470
 XML: 203
XML: 203

