Des produits issus d’animaux terrestres recevant une alimentation enrichie en DHA algal peuvent contribuer à la couverture des besoins en cet acide gras essentiel
Chapeau
Un déficit chronique en acide docosahexanoïque (DHA) existe dans la plupart des sociétés occidentales et jusqu’alors, la principale façon de l’atténuer était d’augmenter la consommation de poisson. Le présent travail présente une solution alternative consistant à enrichir certains produits d’élevages terrestres par incorporation de microalgues riches en DHA dans l’alimentation des animaux.
Introduction
Jusqu’à une période récente (Innis, 1991), seul l’acide linoléique (LA - C18:2 ω6) et l’acide alpha-linolénique (ALA - C18:3 ω3) étaient considérés comme essentiels pour l’homme et l’animal qui ne les synthétisent pas ; ils doivent donc être apportés par l’alimentation pour servir de base à la synthèse des acides gras polyinsaturés longues chaînes (AGPI-LC). Le DHA est le principal AGPI-LC ω3, constituant de certaines cellules, comme de la rétine et du cerveau (Bradbury, 2011). Il entre également dans la composition des parois cellulaires de la plupart des autres cellules. Il dérive de l’acide alpha-linolénique (ALA - C18:3 ω3) par élongation et désaturation.
Même en présence d'apports importants d'ALA, la synthèse chez l'homme est trop faible pour couvrir la totalité des besoins (Givens & Gibbs, 2008). Un apport alimentaire de DHA est donc nécessaire pour assurer un bon état de santé de la population mais le niveau souhaitable est rarement atteint. Par exemple, en France, la consommation moyenne de DHA/habitant est de 137 mg/jour (ANSES, 2011) quand les recommandations de l'ANSES (2016) sont de 250 mg/jour. Chez l'homme, une consommation de DHA égale ou supérieure à ces recommandations décroit les risques de dégénérescence maculaire liée à l'âge (DMLA) (Merle et al., 2014) et de maladie d'Alzheimer (Wu et al., 2015). Associé à l'EPA (acide eicosapentaenoïque), le DHA diminue les risques cardiovasculaires (Delarue, 2018, 2021), d'insulino-résistance (Delarue, 2020, 2021 ; Delarue, 2022), donc de diabète ainsi que d'obésité (Delarue et al., 2004) et de syndrome métabolique (Delarue et al., 2006). Selon plusieurs auteurs, une consommation suffisante accroit également les capacités cognitives chez l'enfant et l'adulte (Nelson & Van Elswyk, 2015 ; Zhang et al., 2016).
L’objectif de cet article est de présenter une stratégie originale permettant l’augmentation de la consommation en DHA de la population en enrichissant l’alimentation des animaux terrestres en cet AG.
1. Les sources de DHA
La nécessité d'augmenter l'apport de DHA dans l'alimentation de la population se heurte à des difficultés d'approvisionnement. En effet, cet AG est totalement absent des angiospermes, donc des plantes cultivées (Castro-González, 2002). Plusieurs revues (Barnathan, 2007 ; Delarue & Guriec, 2014 ; Tocher et al., 2019) ont évoqué l'existence de sources alternatives possibles : microorganismes synthétisant cet AG comme certaines bactéries marines, des microalgues (microalgues vraies et thaustochytridés comme Schizochytrium sp.), les levures mais aussi la cameline (Camelina sativa) génétiquement modifiée. Leur disponibilité est cependant encore limitée et le développement de certaines n'est pas assuré (Tocher et al., 2019). Ainsi, aujourd'hui, la principale solution pour augmenter l'ingestion de DHA de l'homme consiste à consommer du poisson qui représente 85 % du DHA ingéré ; l'œuf représente un autre apport significatif mais très inférieur au poisson (8 %).
La consommation humaine de DHA peut également être augmentée en utilisant la capacité d'accumulation de cet AG par certains animaux terrestres. Une première solution consiste à intégrer dans l'alimentation des animaux des matières premières riches en ALA (précurseur du DHA) (lin extrudé et graines de colza) (Weill et al., 2002 ; Legrand et al., 2010). Cette pratique augmente le contenu en ALA dans les produits animaux mais l'accroissement du niveau de DHA reste faible sauf dans le cas de l'œuf.
Simopoulos et Salem (1992) ont démontré la possibilité d'augmenter jusqu'à six fois le taux de DHA des œufs par incorporation d'huile de poisson dans l'alimentation des poules ; dans les mêmes conditions, on peut atteindre des pourcentages d'AGPI-LC ω3 dépassant 5 % des AG dans la viande de lapin (Bernardini et al., 1999) et de poulet (López-Ferrer et al., 2001). Toutefois l'incorporation des huiles de poisson dans les aliments des animaux est entravée par la raréfaction de la ressource halieutique mondiale et simultanément par les taux croissants en métaux lourds (Bernhard & Andreae, 1984 ; Munthe et al., 2007) et polluants organiques persistants (POP). En outre, elles sont susceptibles de détériorer la qualité hédonique des produits animaux (Wood & Enser, 1997 ; Feng et al., 2020).
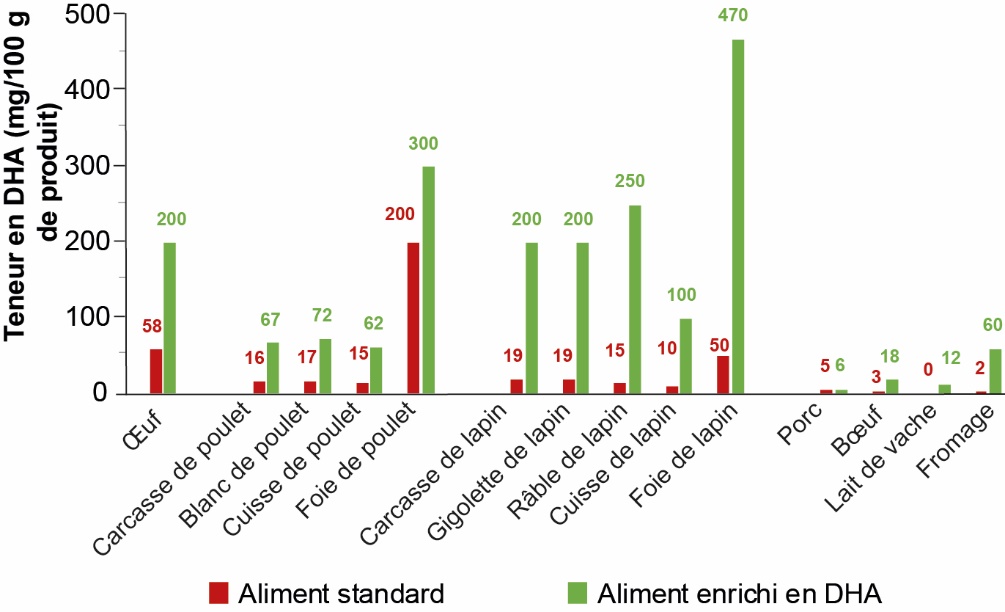
L'utilisation en nutrition humaine (Doughman et al., 2007) et animale de Schizochytrium sp., organisme producteur de DHA et dont la culture est maintenant maîtrisée, permet d'éviter les inconvénients des huiles de poisson. On peut ainsi enrichir en DHA l'œuf (Colin et al., 2021a), la viande de lapin (Colin et al., 2021b), de poulet (Ribeiro et al., 2014) et de porc (De Tonnac et al., 2016). Le lait peut également être enrichi en DHA par incorporation de Schizochytrium dans l'alimentation des vaches mais on observe une très forte diminution de son taux butyreux nécessitant beaucoup de prudence dans la généralisation de cette pratique (Raguénés, 2012 ; Moate et al., 2012). La figure 1 rapporte ainsi les teneurs en DHA des principaux produits issus d'animaux terrestres correspondant soit à une alimentation standard (en rouge) soit à une alimentation enrichie en Schizochytrium (en vert) selon les données de nos essais pour le lapin (Colin et al., 2017 ; Van Lissum et al., 2019) et l'œuf (Colin et al., 2018) et d'après Colin et al. (2021b) pour le poulet, le lait, le porc, le bœuf et le fromage. Elle souligne l'intérêt du lapin, de la pondeuse et du poulet pour accumuler le DHA dans leurs produits. Dans les travaux présentés ici, quatre des six sources commerciales de Schizochytrium actuellement disponibles (Tocher et al., 2019) contenant selon l'origine 18 à 28 % de DHA ont été utilisées. À notre connaissance, cette stratégie d'augmentation de la consommation de DHA de la population par enrichissement de l'alimentation des animaux terrestres avec une source durable n'a fait l'objet d'aucune revue bibliographique. Outre le Schizochytrium, les aliments contenaient une source d'ALA, du lin extrudé, incorporé à des taux compris entre 4 et 6 %.
Figure 1. Contenu en DHA de produits d'animaux terrestres ayant reçu un « Aliment standard » ou un « Aliment enrichi en DHA » (Colin et al., 2021b).
La supplémentation en DHA dans l’alimentation est obtenue via l’addition de microalgues (dans notre cas le DHA du Schizochytrium sp. est apporté dans l’aliment à environ 0,2 %).
2. Enrichissement en DHA de produits animaux par apport de Schizochytrium sp. dans l’alimentation
2.1. L’œuf
a. Présentation générale
Vingt et un essais réalisés entre 2012 et 2022, correspondant à 140 traitements expérimentaux et à plus de 2 000 poules, ont été consacrés à l'enrichissement en DHA de l'œuf par incorporation de Schizochytrium dans l'alimentation des poules. Ils ont déjà fait l'objet de publications partielles (Colin et al., 2013 ; Guriec et al., 2014, 2015 ; Guriec et al., 2016 ; Delarue et al., 2017 ; Colin et al., 2018 ; Dewez et al., 2021 ; Colin et al., 2021a ; Pruvost et al., 2022). Ils regroupaient des situations diverses pour la composition de l'aliment, l'origine du DHA algal et le niveau de vitamine E dans l'aliment. Ces résultats (figure 2) sont synthétisés en intégrant plusieurs autres publications portant également sur l'enrichissement des œufs en DHA par incorporation de Schizochytrium dans l'aliment (Šefer et al., 2011 ; Ao et al., 2015 ; Feng et al., 2020 ; Moran et al., 2020). Nous étudierons ici les résultats globaux et le principal facteur influençant le dépôt de DHA dans l'œuf, la teneur en ALA de l'aliment. Nous avons ainsi distingué les situations où le DHA provenant des microalgues est la seule source d'AG ω3 additionnels ce qui signifie un niveau d'ALA bas dans l'aliment de l'ordre de 0,05 % (37 traitements expérimentaux) et celles où sont incorporés dans la ration à la fois du DHA provenant des microalgues et des matières premières riches en ALA, comme la graine de lin extrudée ou la graine de colza entière, donc un niveau d'ALA élevé dans l'aliment compris entre 0,4 et 1,2 % (103 traitements). Dans les deux cas, les résultats montrent une relation statistique hautement significative (P 0,001) entre la teneur de l’aliment en DHA (exprimée en pourcentage) et le contenu en DHA de l’œuf (exprimé en mg/100 g d’œuf). Les valeurs obtenues pour le R2 (0,59 et 0,75) montrent cependant une corrélation moyenne, reflétant la diversité des situations dans les différents essais.
Figure 2. Relation entre le pourcentage de DHA dans l’aliment et la teneur en DHA de l’œuf.

Aliments dont les taux en ALA sont bas (carrés rouge) ou élevés (losanges verts).
Positionnement des données provenant de traitements d’œufs de poules de basse-cour définis au paragraphe 2.1.c (Triangles violets).
« Poly » : courbe de tendance polynomiale de la relation entre le taux de DHA de l’aliment et le taux de DHA de l’œuf avec des taux d’ALA élevés dans l’aliment.
« Linéaire » : courbe de tendance linéaire de la relation entre le taux de DHA de l’aliment et le taux de DHA de l’œuf avec des taux d’ALA bas dans l’aliment.
Chaque point représente un traitement.
b. Influence du taux d’ALA dans l’aliment sur le dépôt de DHA dans l’œuf
Même en l'absence de DHA dans l'aliment, la teneur en DHA de l'œuf est non négligeable. Mais elle est beaucoup plus forte lorsque l'aliment a un taux d'ALA élevé (124,3 mg/100g en moyenne) que lorsqu'il est faible (59,4 mg/100g en moyenne). Ces résultats confirment la capacité de la poule pondeuse à synthétiser des quantités importantes de DHA à la condition de disposer d'ALA en quantité suffisante (Simopoulos & Salem,1992 ; Weill et al., 2002 ; Kerhoas et al., 2010).
Pour les régimes à faible taux d'ALA, le contenu des œufs en DHA augmente linéairement avec le taux de DHA dans l'aliment au moins jusque 0,25 %. Cette capacité de l'œuf d'augmenter sa teneur en DHA est confirmée par Ao et al. (2015) et Moran et al. (2020) avec des pourcentages de DHA dans l'aliment beaucoup plus élevés que ceux étudiés ici (supérieurs à 0,4 %) et en l'absence d'ALA. Par contre, pour des taux élevés d'ALA, ce contenu stagne voire diminue à partir de 0,15 % de DHA dans la ration (figure 2). La non augmentation du contenu en DHA de l'œuf voire sa légère diminution lorsque l'on cumule taux élevés de DHA et d'ALA peut s'expliquer par des phénomènes d'oxydation des AGPI-LC ω3 en accord avec Fraeye et al. (2012) et Irawan et al. (2022).
Ainsi, ces résultats confirment que le DHA contenu dans ces œufs a deux origines : une synthèse endogène à partir de l'ALA présent dans la ration et un dépôt direct du DHA apporté par l'aliment. En outre, une alimentation enrichie à la fois en DHA et en ALA permet de bénéficier des effets positifs de ce dernier (Kerhoas et al., 2010) et de diminuer le niveau d'AG saturés dans l'œuf (Colin et al., 2013). Il est donc judicieux d'associer des matières premières riches en ALA et du DHA issu de Schizochytrium, en limitant cependant le niveau d'incorporation. Cette double stratégie d'enrichissement en AGPI-LC ω3 pourrait cependant connaitre ses limites si l'on recherche des taux de DHA dans l'œuf beaucoup plus élevés.
c. Comparaison des œufs enrichis avec du DHA algal à d'autres types d'œufs
Les apports en DHA d'œufs correspondant à différentes stratégies d'enrichissement en oméga-3 (exprimés en mg/100 g) sont rapportés à la figure 3 ; les valeurs utilisées correspondent à ce travail, à l'exception de l'enrichissement en huile de poisson provenant de la publication de Feng et al. (2020) (sans apport d'ALA). Nous avons également rajouté des œufs de basse-cour, produits dans des conditions totalement traditionnelles : poules picorant dans les prés et le jardin. Pour cette partie de l'étude, nous avons utilisé les résultats obtenus par Simopoulos et Salem (1992) ainsi que les analyses réalisées par nous-mêmes chez quatre producteurs de ce type d'œuf (figure 2).
Figure 3. Contenus en DHA de différents types d’œufs.
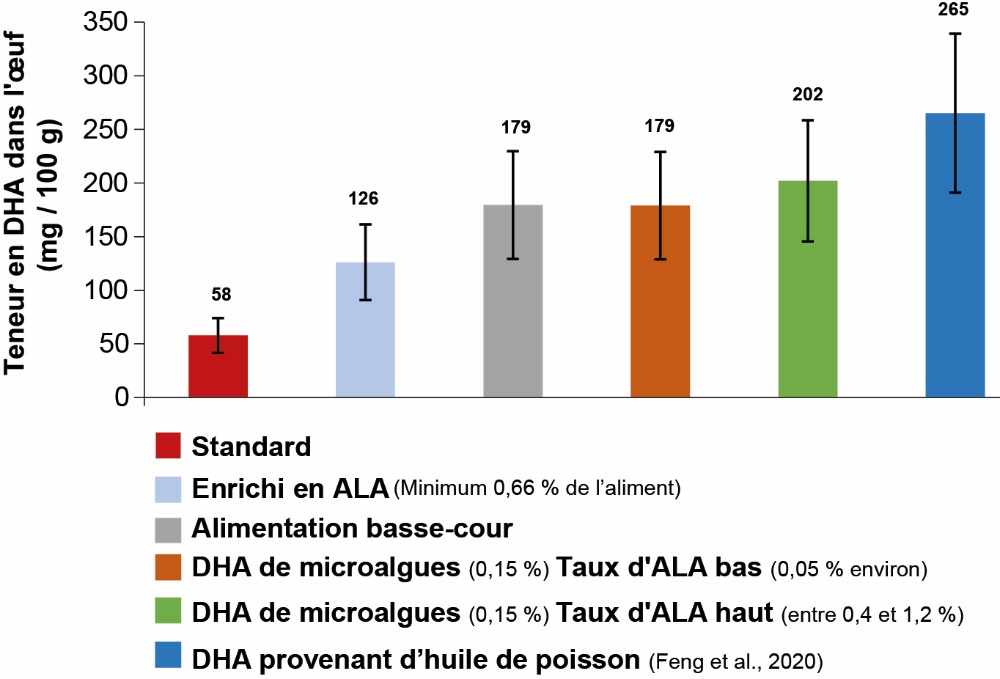
Même en dehors d'un enrichissement en oméga-3, la teneur en DHA d'un œuf standard est beaucoup plus élevée que celle de tous les autres produits provenant d'animaux terrestres (figure 1) (Simopoulos & Salem, 1992 ; Weill et al., 2001). Un œuf obtenu avec un aliment enrichi en un seul AG ω3 a une valeur doublée si cet enrichissement est à base d'ALA et triplée s'il est à base de DHA. Avec un taux d'incorporation dans l'aliment allant jusque 0,15 % de DHA, on atteint une teneur encore plus élevée en apportant simultanément ALA et DHA. Ces valeurs obtenues avec le DHA provenant de microalgues sont inférieures à celles résultant de l'utilisation d'huiles de poisson mais les œufs produits avec cette méthode ne présentent aucun arrière-goût de poisson en accord avec les résultats de Feng et al. (2020) ; les tests hédoniques réalisés à notre niveau les ont même jugés de qualité hédonique légèrement supérieure aux œufs standards.
Dans quatre cas sur les cinq étudiés, le contenu en DHA des œufs de basse-cour était compris entre 150 et 250 mg/100 g d’œuf (figure 3), soit les niveaux que permettent des taux de supplémentation des aliments en DHA de 0,10 % à 0,20 %. Cette caractéristique de l’œuf de basse-cour provient probablement du régime alimentaire de la poule qui consomme beaucoup d’invertébrés, reconstituant une chaîne alimentaire du DHA comparable à celle existant dans la mer (Van Vliet & Katan, 1990).
L'œuf étant préparé selon de nombreuses recettes, Douny et al. (2015) ont étudié sept préparations différentes et démontré qu'à une exception près (incorporation dans une crème), le taux de DHA de l'œuf est peu affecté par la cuisson confirmant l'intérêt de ces œufs enrichis en DHA pour participer à la couverture du besoin en cet AG.
d. Conclusions sur l’œuf
L’enrichissement de l’aliment par du DHA provenant de Schizochytrium permet d’obtenir des teneurs en DHA dans l’œuf comprises entre 180 et 200 mg de DHA/100g d’œuf soit 105 à 120 mg/œuf, qui sont conservées dans pratiquement tous les modes de préparation culinaire. Un seul de ces œufs représente 43 à 48 % du besoin journalier d’un adulte en DHA contre 12 à 15 % pour un œuf standard. Il contribue ainsi de façon très significative à la diminution du déficit alimentaire en DHA de la population.
2.2. Le lapin
a. Présentation générale
Neuf essais dont les caractéristiques ont déjà été publiées (Colin et al., 2017) regroupant plus de 5 000 lapins et réalisés entre 2010 et 2016 ont été consacrés à l'enrichissement en DHA de la viande de lapin par incorporation de Schizochytrium dans leur alimentation. À notre connaissance, une seule publication a été consacrée à ce sujet (Mordenti et al., 2010).
Dans tous ces essais, outre le DHA provenant de Schizochytrium, la graine de lin extrudée (Tradilin®) et la graine de colza entière étaient systématiquement incorporées dans l’aliment aboutissant à des taux d’ALA compris entre 0,5 et 1,0 %.
b. Viande de lapin enrichie en DHA algal
La cinétique d’évolution du taux en DHA de la viande de lapin en fonction de l’apport alimentaire a été obtenue sur la gigolette (épaule) car ce morceau est facile à définir anatomiquement et les résultats préliminaires nous ont montré une variabilité entre individus faible. Des analyses supplémentaires nous ont permis également de déterminer les valeurs correspondant aux carcasses entières et aux autres morceaux (tableau 2).
Les pourcentages de DHA dans les AG totaux de la viande de gigolette augmentent fortement avec l’apport de DHA dans l’aliment (figure 4), avec une corrélation hautement significative (R2 = 0,79 – P 0,001).
Figure 4. Relation entre le taux de DHA dans la viande de gigolette et le taux de DHA de l’aliment.
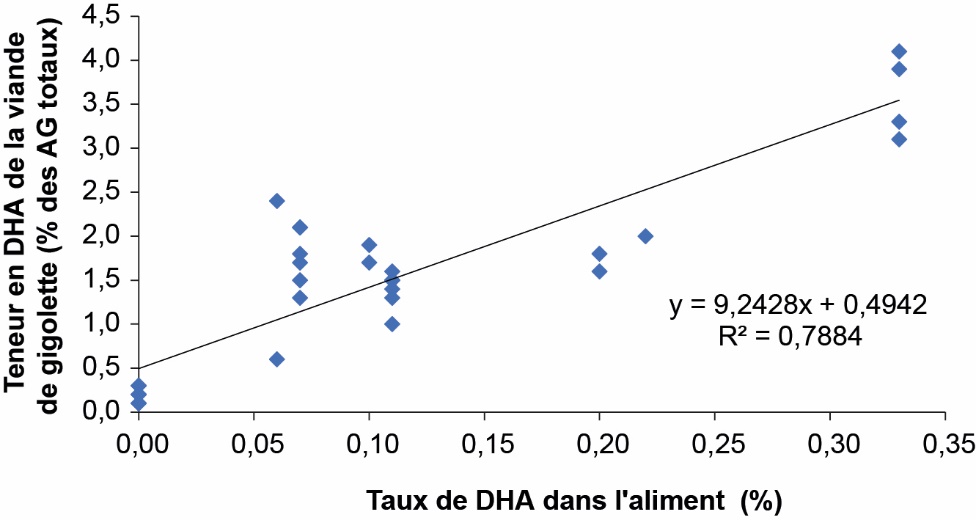
Chaque point correspond à un traitement expérimental.
Contrairement à l'œuf, le taux de lipides de la viande de lapin est très variable d'un essai à l'autre avec un coefficient de variation estimé à 70 % en accord avec Combes et Dalle Zotte (2005) (67 %). La teneur en DHA de la viande de gigolette (en mg/100 g de viande) a donc été calculée pour différents taux de lipides correspondant à la bibliographie (Combes & Dalle Zotte, 2005) et à nos propres résultats (tableau 1). Cette teneur a été déterminée à partir de l'équation rapportée à la figure 4, et en considérant que les AG totaux représentent en moyenne 91 % de la graisse de lapin (Akoh et al., 1994). Le reste de la fraction lipidique est essentiellement représentée par le glycérol (triglycérides) et le glycérol phosphate (phospholipides). Dès 0,05 %, l'incorporation de DHA algal semble déjà permettre un dépôt significatif de cet AG dans la viande de gigolette.
Tableau 1. Estimation (calculée d’après l’équation présentée à la figure 4) de la teneur en DHA de la viande de gigolette de lapin en fonction de la teneur de l’aliment en cet acide gras et du taux de lipides de la gigolette.
DHA |
Taux de lipides |
Énergie |
Teneur estimée en DHA de la viande |
||
|---|---|---|---|---|---|
AG totaux (%) |
(mg/100 g) |
(mg/100 kcal) |
|||
0,05 |
9,0 |
205 |
0,97 |
79 |
39 |
11,0 |
223 |
97 |
44 |
||
13,0 |
241 |
115 |
48 |
||
0,10 |
9,0 |
205 |
1,5 |
123 |
60 |
11,0 |
223 |
150 |
67 |
||
13,0 |
241 |
177 |
74 |
||
0,15 |
9,0 |
205 |
1,99 |
163 |
80 |
11,0 |
223 |
200 |
89 |
||
13,0 |
241 |
235 |
98 |
||
0,20 |
9,0 |
205 |
2,44 |
200 |
97 |
11,0 |
223 |
244 |
109 |
||
13,0 |
241 |
288 |
120 |
||
0,25 |
9,0 |
205 |
2,84 |
233 |
114 |
11,0 |
223 |
285 |
128 |
||
13,0 |
241 |
337 |
140 |
||
0,30 |
9,0 |
205 |
3,21 |
263 |
128 |
11,0 |
223 |
322 |
144 |
||
13,0 |
241 |
380 |
158 |
||
Dans les paragraphes suivants, pour un taux alimentaire de 0,15 % de DHA, nous avons retenu une valeur de 200 mg de DHA/100 g de viande de gigolette, soit 2 % des AG totaux (tableau 2). On multiplie donc par 10 la teneur de la gigolette en cet AG (figure 1).
Tableau 2. Teneur en DHA des différents morceaux et charcuteries de lapin recevant un aliment témoin ou contenant 0,15 % de DHA algal (Colin et al., 2017 ; Palacios et al., 2023).
Morceaux |
Témoin |
Enrichissement |
Augmentation |
||
|---|---|---|---|---|---|
mg/100 g |
% des AG |
mg/100 g |
% des AG |
||
Carcasse |
19,4 (120,0) |
0,26 |
200 (70,2) |
3,0 |
10,3 |
Gigolette |
19,4 (57,2) |
0,18 |
200 (22,4) |
2,0 |
10,3 |
Râble entier |
25,0 (66,0) |
0,22 |
250 (17,5) |
2,4 |
10,0 |
Râble |
5,0 (ND) |
0,33 |
50 (ND) |
3,7 |
10,0 |
Cuisse |
10,0 (ND) |
0,27 |
100 (23,5) |
3,0 |
10,0 |
Foie |
50,0 (ND) |
1,22 |
470 (15) |
12,7 |
9,4 |
Pâté |
20,0 (ND) |
0,32 |
243 (ND) |
4,3 |
12,2 |
Rillette |
20,0 (ND) |
0,06 |
360 (ND) |
1,3 |
18,0 |
Saucisson |
20,0 (ND) |
0,07 |
427 (ND) |
1,6 |
21,4 |
Les coefficients de variation sont entre parenthèses au sein du tableau.
ND : Non disponible
Le râble (tableau 2) des lapins recevant un aliment enrichi en DHA d'origine algal présente des teneurs en DHA égales ou légèrement supérieures à la gigolette (Colin et al., 2017). Nous retenons une valeur de 250 mg/100 g de râble soit 2,4 % environ des AG totaux donc environ 10 fois celle des lapins standards (figure 1).
La cuisse des lapins recevant un aliment enrichi en DHA d’origine algale présente des teneurs en DHA nettement plus faibles que celles de la gigolette et du râble (100 mg/100g de cuisse) mais un pourcentage relatif par rapport aux AG totaux plus élevé (3,0 %), s’expliquant par l’importance des lipides de structure dans ce morceau et par des lipides de dépôt en quantités plus limitées que dans les morceaux précédents. Globalement, comme pour les autres morceaux, le niveau de DHA de la cuisse de lapins recevant un aliment contenant 0,15 % de DHA algal est environ 10 fois plus élevé que celui des lapins standards (tableau 2).
Le foie des lapins recevant une alimentation enrichie en DHA est le morceau le plus riche en cet AG essentiel avec 450 mg/100 g de foie soit 12,7 % des AG totaux, valeur comparable à celles observées par Bernardini et al. (1999) lors d'un enrichissement de l'aliment en DHA provenant d'huile de poisson. Cette valeur est à rapprocher de celles observées chez le poulet dans nos propres essais (300 mg/100 g de foie). Globalement, le niveau de DHA du foie de lapins recevant un aliment contenant 0,15 % de DHA algal est environ 12,7 fois plus élevé que celui des lapins standard, en faisant une source privilégiée d'apport en cet AG à l'instar de certains poissons comme la truite (Loiseau et al., 2022).
Dans la plage de variation d'inclusion alimentaire de DHA étudiée (0,05 à 0,3 %), aucun goût et/ou odeur déplaisante n'ont été détectés lors des différents tests de dégustation réalisés (Colin et al., 2017). De même, aucune dégradation de croissance n'a été observée et la viabilité des lapins a été améliorée de 1,7 % (P 0,001) (Colin et al., 2017). L'enrichissement en DHA de la viande de lapin par incorporation de Schizochytrium dans l'aliment ne provoque donc pas de difficultés, aux niveaux performances zootechniques et caractéristiques hédoniques du produit.
Les valeurs rapportées aux tableaux 1 et 2 concernent des enrichissements avec des taux de DHA dans l'aliment compris entre 0,15 et 0,20 %, correspondant à des niveaux restant réalistes dans le contexte actuel des prix de marché de Schizochytrium. Mais la figure 4 montre également que des enrichissements supérieurs sont possibles et permettent d'atteindre des valeurs de 300 à 400 mg/100 g de viande sans détérioration des caractéristiques hédoniques (Colin et al., 2017). Il est donc possible que des améliorations au niveau de l'offre de Schizochytrium renforce encore l'intérêt du lapin comme source de DHA.
c. Préparations à base de viande de lapin enrichie en DHA algal
Des préparations exclusivement à base de viande et de graisse de lapins recevant un aliment contenant 0,2 % de DHA provenant de Schizochytrium ont également été étudiées : deux types de pâtés (Prigent et al., 2013), des saucissons (Le Minous, 2020) et des rillettes (tableau 3).
Tableau 3. Caractéristiques nutritionnelles et teneurs en oméga-3 des pâtés, rillettes et saucissons exclusivement à base de viande de lapin (Palacios et al., 2023).
Pâté nature* |
Pâté aux algues |
Rillette |
Rillette |
Saucisson |
|
|---|---|---|---|---|---|
Caractéristiques nutritionnelles |
|||||
Matière grasse (%) |
6,3 |
6,0 |
31,8 |
29,4 |
30,2 |
Énergie |
138 |
140 |
360 |
343 |
427 |
Teneurs en acides gras |
|||||
DHA (% AG) |
4,5 |
4,3 |
0,8 |
0,70 |
0,60 |
DHA (mg/100 g) |
243 |
227 |
199 |
164 |
147 |
DHA + EPA |
254 |
239 |
199 |
164 |
147 |
DHA + EPA |
184 |
171 |
34 |
48 |
34 |
*Recette de base
Les deux pâtés présentent une teneur élevée en DHA, à la fois en valeur absolue (227 à 243 mg/100 g de produit), et en taux relatif (4 à 4,5 % des AG totaux) (tableau 3). Ces analyses confirment l’intérêt nutritionnel du produit et sa contribution potentielle à la couverture des besoins en DHA de la population. La teneur relative des graisses en DHA est comparable à celle de la carcasse montrant un faible effet de ces transformations sur l’apport en cet acide gras.
Les rillettes et les saucissons sont des préparations plus grasses que les pâtés : 30 % environ versus 6,0 à 6,3 % pour ces derniers. Le DHA a des teneurs relatives (pourcentage des AG totaux) 13 à 18 fois plus faibles que dans les pâtés (0,6 à 0,8 % vs 4,3 à 4,5 %) probablement en raison de l'utilisation importante de graisse viscérale fixant moins les AGPI-LC ω3 que les graisses de structure (Bernardini et al., 1999 ; Colin & Teillet, 2009). Cependant, en raison de leur taux élevé de graisse, ils représentent un apport absolu de DHA non négligeable (140 à 170 mg/100 g de produit). Ils participent donc à la couverture des besoins en DHA des populations dans le cadre de menus orientés sur la couverture des besoins en cet AG. Ils devraient présenter moins de risques au niveau nutritionnel que les charcuteries classiques en raison de leur faible teneur en acides gras saturés puisqu'ils sont exclusivement à base de viande et de graisse de lapin. Il conviendra cependant de vérifier ce point avant de préconiser leur consommation de façon régulière.
Le DHA est sensible à l’oxydation et sa teneur baisse durant la conservation des denrées alimentaires (Colin & Teillet, 2009). On pourrait donc craindre que le taux de DHA ne diminue au cours de la conservation, dégradant leur valeur nutritionnelle. Un essai de vieillissement a été réalisé en dosant des verrines de pâtés après 6 mois et 3 ans de conservation (tableau 4). Le taux de DHA diminue d’environ 25 % en 3 ans. Même si cette évolution représente une perte regrettable de cet AG à haute valeur nutritive, l’apport à l’issue de cette période reste suffisant pour contribuer de façon importante à la couverture du besoin en DHA.
Tableau 4. Évolution de la teneur en AG ω3 des pâtés de lapin au cours du temps (Palacios et al., 2023).
Pâté nature* |
Pâté aux algues |
|||||||
|---|---|---|---|---|---|---|---|---|
Durée de |
0 |
6 |
36 |
Évolution en 36 mois (%) |
0 |
6 |
36 |
Évolution en |
DHA (mg/100 kcal) |
176 |
159 |
127 |
– 27,8 |
162 |
164 |
123 |
– 24,1 |
EPA (mg/100 kcal) |
8,0 |
8,8 |
7,9 |
– 28,2 |
12,3 |
12,9 |
9 |
– 24,8 |
DHA + EPA |
184 |
168 |
135 |
– 27,9 |
171 |
177 |
132 |
– 24,3 |
DHA + EPA |
254 |
232 |
186 |
– 27,9 |
239 |
248 |
185 |
– 24,3 |
*Recette de base
d. Conclusions sur la viande de lapin
En conclusion, le lapin possède une exceptionnelle capacité d’accumulation du DHA dans ses différentes parties comestibles, en en faisant un constituant de choix de menus DHA orientés sur la couverture des besoins de la population en cet AG. Ainsi, 100 grammes de gigolette et de râble représentent 70 à 100 % des apports nutritionnels conseillés, et même la cuisse qui est plus maigre en apporte 40 %. Enfin, le foie concentre particulièrement le DHA lors d’une supplémentation de l’aliment en cet AG ; sa teneur de 460 mg de DHA/100 g l’apparente à certains poissons comme la truite, contribuant ainsi à combler le déficit potentiel engendré par les autres composants de l’alimentation. En outre, la viande de lapin enrichie en DHA peut être transformée (pâtés, rillettes, saucisson) en maintenant les taux élevés de cet AG après trois ans de conservation pour les pâtés. Ainsi, le lapin enrichi en DHA algal permet d’introduire des produits carnés à côté des œufs et du poisson dans un menu destiné à combler le déficit de la population en cet AG. Son intérêt pourrait d’ailleurs se renforcer si l’offre économique de marché pour la fourniture de Schizochytrium s’améliore.
2.3. Le poulet
a. Présentation générale
L'étude de l'enrichissement de la cuisse et du filet de poulet ainsi que du foie a fait l'objet de deux essais réalisés en 2020 et impliquant un total de 200 poulets abattus à 12 semaines. Les deux régimes expérimentaux apportaient 1,04 % d'ALA provenant de lin extrudé et de graines de colza ; le taux de DHA provenant de Schizochytrium dans le régime expérimental était de 0,12 %. Cette étude a été réalisée en synthétisant ces résultats expérimentaux et ceux de la bibliographie (Rymer et al., 2010 ; Colm et al., 2018a, 2018b).
b. Viande de poulet enrichie en DHA algal
Globalement, lors d’un enrichissement en DHA algal les teneurs de la viande de poulet sont plus faibles que celles observées pour le lapin (figure 1). Pour un taux de 0,15 % de DHA dans l’aliment, la teneur en DHA est de 74 mg/100 g pour la cuisse de poulet (soit environ 1 % des AG totaux) contre 100 mg/100 g pour la cuisse de lapin (2,4 % des AG) et de 77 mg/100 g pour le filet de poulet (soit environ 4% des AG totaux) contre 250 mg/100g pour le râble de lapin (2,4 % des AG) (figure 5). Les pourcentages de DHA en mg/100 g de viande de poulet (cuisse et filet) augmentent fortement avec l’apport de DHA dans l’aliment jusque 0,70 % pour atteindre une valeur de 200 mg/100 g (figure 5) et diminuent ensuite avec une corrélation hautement significative (R2 = 0,88 – P 0,001). Ces niveaux élevés de DHA dans la viande de poulet sont actuellement difficilement atteignables dans les conditions économiques actuelles de fourniture du DHA algal mais pourraient l’être si celles-ci s’améliorent.
Les taux de DHA dans le foie sont de 200 (témoin) et 300 (enrichi) mg/100g.
Figure 5. Relations entre le taux de DHA dans la cuisse et le filet de poulet et le taux de DHA de l'aliment (Rymer et al., 2010 ; Colm et al., 2018a, 2018b).
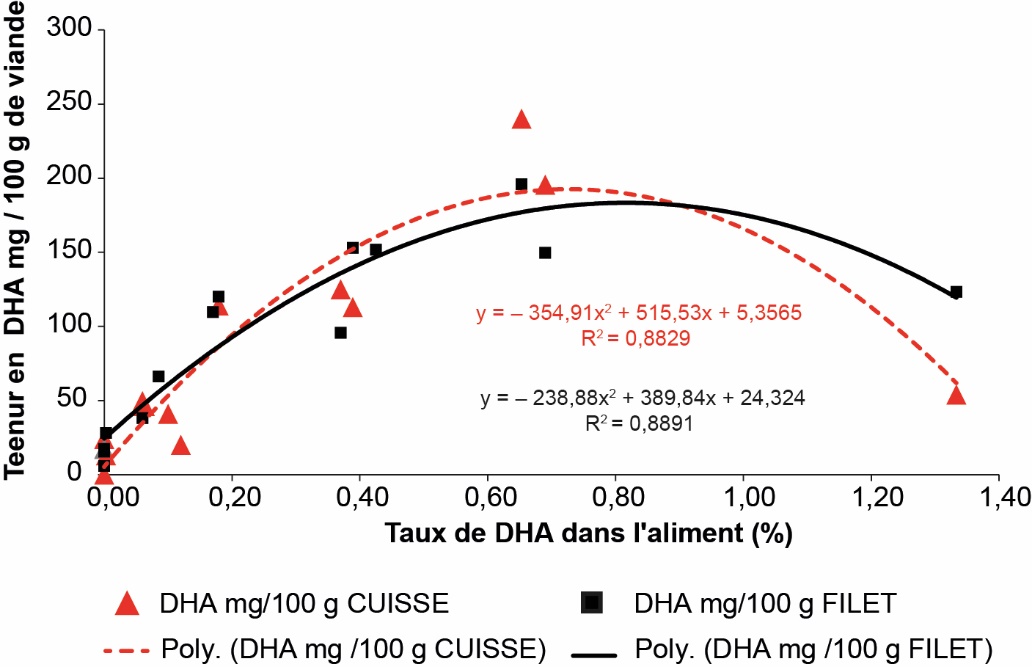
Chaque point représente un traitement expérimental.
Poly. : courbe de tendance polynomiale de la relation entre le taux de DHA de l’aliment et le taux de DHA de la viande de cuisse (rouge) ou de filet (noir).
Comme pour l’œuf et le lapin, les tests hédoniques réalisés n’ont montré aucune détérioration des caractéristiques du produit.
c. Conclusions sur la viande de poulet
Le poulet recevant une alimentation enrichie en DHA algal accumule cet AG dans sa viande mais de façon très inférieure à la viande de lapin ou à l’œuf. Cependant, en raison de la fréquence de sa consommation dans tous les pays du monde, cette viande est à retenir comme un composant important de menus destinés à combler le déficit en DHA de la population, d’autant que des améliorations au niveau de l’offre économique de Schizochytrium permettraient d’incorporer davantage de DHA dans l’aliment et donc d’obtenir des teneurs de DHA plus élevées dans la viande.
2.4. Allégations relatives aux produits issus d’animaux recevant une alimentation enrichie en DHA algal
Les allégations font partie intégrante d’une stratégie de développement de produits enrichis en DHA issus d’animaux terrestres en vue de contribuer à couvrir les besoins en cet AG car elles définissent les bases de l’information que l’on peut communiquer au consommateur. Concernant les AGPI-LC ω3, deux types d’allégations sont possibles, les allégations nutritionnelles (Règlement CE N°1924/2006, 2014) et les allégations fonctionnelles (Règlement UE N°432/2012, 2021) :
i) « source d’oméga-3 » si le produit apporte au moins 300 mg d’ALA/100 g et 100 kcal et /ou 40 mg de DHA/100 g et 100 kcal. (Règlement CE N°1924/2006, 2014) ;
ii) « riche en oméga-3 » si le produit apporte au moins 600 mg d’ALA/100 g et 100 kcal et/ou 80 mg de DHA/100 g et 100 kcal. (Règlement CE N°1924/2006, 2014) ;
iii) « l’EPA et le DHA contribuent à une fonction cardiaque normale ». (Règlement UE N°432/2012, 2021) ;
iv) « le DHA contribue au fonctionnement normal du cerveau ». (Règlement UE N°432/2012, 2021) ;
v) « le DHA contribue au maintien d’une vision normale ». (Règlement UE N°432/2012, 2021).
Un certain nombre de produits présentés dans cette étude ont des apports en DHA + EPA (niveau faible d’EPA mais détectable), nettement supérieurs à 80 mg/100 kcal (à partir de 0,15 % de DHA dans l’aliment), permettant d’alléguer « Riche en oméga-3 » (Règlement CE N°1924/2006, 2014) avec les taux suivants :
i) 142 et 128 mg/100 kcal pour les œufs avec un aliment contenant ou non de l’ALA ;
ii) supérieur à 80 mg/100 kcal dans la gigolette et le râble de lapin ;
iii) supérieur à 130 mg/100 kcal pour les pâtés de lapin même après 3 ans de conservation ;
iv) supérieur à 200 mg/100 kcal pour les foies de lapin et de poulet.
D’autres produits présentés dans cette étude ont des apports en DHA + EPA (niveau faible d’EPA mais détectable) compris entre 40 et 80 mg/100 kcal, permettant d’alléguer « Source d’oméga-3 » (Règlement CE N°1924/2006, 2014) avec les taux suivants :
i) 70 mg/100 kcal pour la cuisse de lapin et plus de 45 mg/100 kcal pour l’épaule de lapin à partir de 0,05 % de DHA dans l’aliment ;
ii) 46 et 62 mg/100 kcal respectivement pour la cuisse et le filet de poulet à partir de 0,15 % de DHA dans l’aliment.
Ces produits « Riches en oméga-3 » ou « Source d’oméga-3 » en raison de leur apport de DHA + EPA ou de DHA seul peuvent revendiquer les allégations de santé (Règlement UE N°432/2012, 2021) évoquées précédemment.
Les rillettes et les saucissons peuvent alléguer « Source d’oméga-3 » en raison de leur taux d’ALA : 550 mg/100 kcal pour les rillettes et 450 mg/100 kcal pour les saucissons (Règlement CE N°1924/2006, 2014) mais pas en raison de leur taux de DHA+EPA qui est trop faible.
3. Élaboration de menus destinés à compenser le déficit en DHA de la population
3.1. Formes d’apport du DHA : triglycérides et phospholipides
Peu d'études concernant les teneurs en DHA des produits animaux distinguent les quantités apportées par les triglycérides et les phospholipides (Takama et al., 1994 ; Combes & Dalle Zotte, 2005 ; Pieroni & Coste, 2010 ; Xue et al., 2015) alors que ce point est important puisque le DHA des phospholipides semble mieux métabolisé que celui des triglycérides ; ainsi, la rétroconversion du DHA dans le foie vers les cellules du cerveau est deux fois plus élevée pour le DHA PC (PC : phosphatidylcholine) que pour le TAG-DHA (TAG : triacylglycérol). (Balakrishnan et al., 2021). Une synthèse des données de la littérature a donc été réalisée pour les produits intégrés dans ce menu (œuf, viande de lapin et viande de poulet enrichis en DHA) qui ont été comparés à un poisson gras de référence, la sardine (tableau 5).
Tableau 5. Composition en phospholipides et en triglycérides des différents produits du menu à base de produits d'animaux terrestres nourris avec une alimentation enrichie en DHA algal et comparaison avec un poisson gras (la sardine) (Bandarra et al., 1997 ; Combes & Dalle Zotte, 2005 ; Betti et al., 2009 ; Pieroni & Coste, 2010 ; Xue et al., 2015).
Œuf enrichi |
Lapin enrichi |
Poulet de chair |
Sardine |
|
|---|---|---|---|---|
Lipides (% de produit) |
10,0 |
8,3 |
6,6 |
9 |
Dont DHA (% des acides gras) |
1,70 |
2,1 |
0,88 |
10,59 |
DHA (mg/100 g de produit) |
195 |
200 |
67 |
930 |
Phospholipides |
2750 |
1145 |
650 |
468 |
Phospholipides (% lipides) |
27,5 |
13,8 |
9,8 |
7,4 |
DHA des phospholipides |
5,96 |
11,02 |
3,51 |
36,10 |
DHA des phospholipides |
164 |
126 |
22,8 |
169 |
Triglycérides |
6500 |
7155 |
3481 |
6704 |
Triglycérides (% lipides) |
65,0 |
86,2 |
52,7 |
92,5 |
DHA des phospholipides |
0,48 |
1,03 |
1,27 |
9,32 |
DHA des triglycérides |
31,2 |
73,8 |
44,2 |
1020,1 |
DHA apporté par |
84,0 |
63,1 |
34,1 |
14,2 |
DHA apporté par triglycérides |
16,0 |
36,9 |
65,9 |
85,8 |
Le produit dans lequel les phospholipides représentent le pourcentage le plus élevé de DHA est l’œuf, suivi du lapin, puis du poisson (sardine) et enfin du poulet de chair. Le DHA provenant des œufs et de la viande de lapin est vraisemblablement mieux utilisé par l’organisme, notamment au niveau cérébral, que celui de la viande de poulet et de la chair de poisson où le DHA provenant des triglycérides se trouve en quantités plus importantes, même si en valeur absolue la sardine reste le plus gros apporteur de DHA sous forme de phospholipides.
Des menus ont été déterminés afin de permettre une couverture des besoins hebdomadaires en DHA (1 750 mg/semaine) en cherchant à limiter la consommation de poisson à un repas par semaine. Ils intègrent le petit déjeuner qui est un repas privilégié pour la consommation d’œufs.
Les portions retenues pour établir ces menus sont les suivantes : 62 g pour un œuf, 150 g pour les viandes (lapin ou poulet), 125 g pour le foie, 50 g pour la charcuterie et 125 g pour le poisson.
À titre d’exemples non exhaustifs, on peut ainsi atteindre une consommation hebdomadaire de 1 750 mg de DHA en consommant les produits enrichis dans différentes proportions :
i) la première proposition est constituée de l’ensemble des produits enrichis mais sans poisson : 7 œufs, 2 portions de viande de lapin, 1 portion de préparations de viande de lapin et 3 portions de viande de poulet ;
ii) la seconde proposition n’inclut pas d’œufs : 2 portions de viande lapin, 1 portion de préparations de viande de lapin, 3 portions de viande de poulet et 0,5 portion de poisson gras ;
iii) la troisième proposition ne contient pas de viande de lapin : 7 œufs, 3 portions de viande de poulet et 0,5 portion de poisson gras ;
iv) la quatrième proposition contient du foie de lapin et n’inclut pas de poisson : 5 œufs, 3 portions de viande de lapin, 1 portion de foie de lapin, 1 portion de préparations de viande de lapin et 3 portions de viande de poulet ;
v) la cinquième proposition concerne les ovo-végétariens et pesco-végétariens. Elle ne comprend donc ni viande de lapin, ni viande de poulet : 5 œufs et 1 portion de poisson gras.
Les produits provenant d’animaux terrestres recevant une alimentation enrichie en DHA algal représentent entre 30 et 50 % des repas de la semaine au sein des propositions de ces menus. Ils laissent donc une flexibilité au consommateur au niveau des aliments qu’il souhaite ingérer d’autant qu’ils représentent eux-mêmes un choix entre des produits variés : œufs, deux viandes et foies (poulet de chair et lapin), ainsi que des préparations de viande de lapin.
Ils peuvent également être adaptés aux personnes ovo-végétariennes et pesco-végétariennes en associant consommation d’œufs et de poisson. Un enrichissement en DHA des produits laitiers renforcerait encore fortement cette possibilité mais se heurte actuellement à des obstacles au niveau zootechnique.
Ainsi, les menus à base d'œufs, de viande de lapin et de poulet de chair enrichis en DHA algal constituent une alternative permettant d'atteindre les recommandations nutritionnelles en matière de consommation hebdomadaire de DHA sans augmenter, voire en diminuant la consommation de poisson, représentant un avantage important au niveau de la ressource halieutique. L'impact environnemental de l'adoption de cette stratégie d'enrichissement en DHA des produits animaux terrestres par incorporation de microalgues dans l'alimentation des animaux devrait rester limité dans la mesure où il ne s'agit pas d'augmenter la consommation de ces produits mais de les substituer à des produits standards (Colin et al., 2021b).
Conclusion
Jusqu’à ces dernières années, l’augmentation de la consommation humaine de DHA en vue d’atténuer la progression de certaines maladies métaboliques n’était envisageable qu’en augmentant la consommation de poisson, donc en accroissant directement ou indirectement les prélèvements halieutiques.
Le développement de la culture de microalgues productrices de DHA comme Schizochytrium et l’identification d’espèces domestiques fixant des taux élevés de DHA dans leurs produits (poule pondeuse, lapin, poulet et probablement dans le futur, vache laitière) permet de disposer de produits issus d’animaux terrestres présentant des teneurs élevés en DHA. Ceux-ci peuvent être associés pour constituer des menus assurant la couverture des besoins en DHA sans augmenter la consommation de poisson, voire en la diminuant. En outre, ces menus tendent à augmenter la proportion de DHA provenant des phospholipides, donc à améliorer l’efficacité du DHA ingéré. Une telle stratégie d’apport en DHA concilie santé de la population, respect des habitudes alimentaires et gestion de la ressource halieutique.
Contributions des auteurs
Michel Colin, Jacques Delarue, Clarisse Palacios, François Lebas et Anne Yvonne Prigent ont contribué à l’ensemble de ces travaux ; Laura Caillaud à la partie concernant les lapins ; Frank Lebreton à celle concernant la production d’œufs ; Marion Van Lissum et Christophe Claveau à celle concernant les menus.
Remerciements
Les auteurs remercient la région Bretagne et le département du Finistère pour leurs aides financières concernant la réalisation d’une partie de ce projet.
Références
- Akoh, C. C., Nwosu, C. V., Lukefahr, S. D., Rao, D. R., Bush, L., & Wande, R. (1994). Fatty acid composition of total lipids and glycerophospholipids of New Zealand white rabbit lean muscle tissue. The Professional Animal Scientist, 10(1), 40-45. doi:10.15232/S1080-7446(15)31925-2
- ANSES (2011). Actualisation des Apports Nutritionnels Conseillés pour les acides gras. Rapport d’expertise collective. Saisine n° 2006-SA-0359. https://www.anses.fr/fr/system/files/NUT2006sa0359Ra.pdf
- ANSES (2016). Actualisation des repères du PNNS (Programme National de Nutrition Santé) : révision des repères de consommations alimentaires. Rapport d’expertise collective, Saisine n°2012-SA-0103. https://www.anses.fr/fr/system/files/NUT2012SA0103Ra-1.pdf
- Ao, T., Macalintal, L., Paul, M., Pescatore, A. J., Cantor, A. H., Ford, M. J., Timmons, B. W., & Dawson, K. A. (2015). Effects of supplementing microalgae in laying hen diets on productive performance, fatty-acid profile, and oxidative stability of eggs. Journal of Applied Poultry Research, 24(3), 394‑400. doi:10.3382/japr/pfv042
- Balakrishnan, J., Kannan, S., & Govindasamy, A. (2021). Structured form of DHA prevents neurodegenerative disorders: a better insight into the pathophysiology and the mechanism of DHA transport to the brain. Nutrition Research, 85, 119134. doi:10.1016/j.nutres.2020.12.003
- Bandarra, N. M., Batista, I., Nunes, M. L., Empis, J., & Christie, W. W. (1997). Seasonal changes in lipid composition of sardine (Sardina pilchardus). Journal of Food Science, 62(1), 40‑42. doi:10.1111/j.1365-2621.1997.tb04364.x
- Barnathan, G. (2007). Sources connues et potentielles de DHA pour les besoins de l’homme. Oilseeds and fats, crops and lipids, 14(1), 35‑43. doi:10.1051/ocl.2007.0096
- Bernardini, M., Bosco, A. D., & Castellini, C. (1999). Effect of dietary N-3/N-6 ratio on fatty acid composition of liver, meat and perirenal fat in rabbits. Animal Science, 68(4), 647‑654. doi:10.1017/s1357729800050682
- Bernhard, M., & Andreae, M.-O. (1984). Transport of trace metals in marine food chains. In: J. O. Nriagu (Ed.), Changing Metal Cycles and Human Health (pp.143-167). Springer. doi:10.1007/978-3-642-69314-4_8
- Betti, M., Perez, T.-I., Zuidhof, M. J., & Renema, R. A. (2009). Omega-3-enriched broiler meat: 3. Fatty acid distribution between triacylglycerol and phospholipid classes. Poultry Science, 88(8), 1740‑1754. doi:10.3382/ps.2008-00449
- Bradbury, J. (2011). Docosahexaenoic acid (DHA): an ancient nutrient for the modern human brain. Nutrients, 3(5), 529‑554. doi:10.3390/nu3050529
- Castro-González, M.-I. (2002). Ácidos grasos oméga-3: beneficios y fuentes. Interciencia, 27(3), 128‑136. https://www.redalyc.org/pdf/339/33906605.pdf
- Colin, M., & Teillet, B. (2009). Effet de l’augmentation du taux d’oméga 9 dans l’aliment sur les performances de croissance et la qualité de la viande de lapin. Intérêt d’une utilisation simultanée d’antioxydants. Valorial Omegalap. Rapport interne
- Colin, M., Delarue, J., Raguénes, N., Prigent, A., Guttierrez, G., & Saliba, C. (2013). P003 Effets d’un apport alimentaire d’un extrait d’algue riche en maltanediénol sur le taux de lipides et le profil d’acide gras des œufs de poules recevant une ration enrichie en DHA végétal. Nutrition Clinique et Métabolisme, 27(Suppl.1), S58–S59. doi:10.1016/s0985-0562(13)70336-4
- Colin, M., Delarue, J., Caillaud, L., & Prigent, A.Y. (2017). Effets de l’incorporation de microalgues (Schizochytrium) dans l’alimentation des lapins sur leurs performances et la teneur en DHA de leur viande. 17e Journées de la Recherche Cunicole, Le Mans, 79-82. http://www.cuniculture.info/Docs/Magazine/Magazine2017/Fichiers-pdf-JRC/eBook-JRC-2017.pdf
- Colin, M., Delarue, J., Prigent, A.Y., Guriec, N., Alain, C., Raguénes, N., Ibrahim Dalieh, R., & Van Lissum, M. (2018). Étude des possibilités d’enrichissement de l’œuf en différents nutriments essentiels (oméga-3, vitamines, oligo-éléments) par apport de ces nutriments dans l’alimentation de la poule. 4e Rencontres Nutrition, Alimentation, Métabolisme et Santé, Rennes.
- Colin, M., Delarue, J., Van Lissum, M., Garres, F., Blanchouin, F., Rossignol, G., Palacios, C., Prigent, A.Y., & Garres P. (2021a). Étude d’un poly-enrichissement de l’œuf en oméga-3, vitamine E et sélénium. Journées Francophones de Nutrition, Lille, Communication P006.
- Colin, M., Lebas, F., Delarue, J., Caillaud, L, Van Lissum, M., & Prigent, A.Y. (2021b). Meat from rabbits fed Vegetable DHA can be an important part of a DHA-oriented human diet. 12th Word Rabbit Congress, Nantes, Communication Q08. http://world-rabbit-science.com/WRSA-Proceedings/Congress-2021-Nantes/Papers/Quality%20of%20Products/Q-08.pdf
- Colm, A. M., Currie, D., Keegan, J. D., & Knox, A. (2018a). Tolerance of broilers to dietary supplementation with high levels of the DHA-Rich microalga, Aurantiochytrium limacinum: effects on health and productivity. Animals, 8(10), 180. doi:10.3390/ani8100180
- Colm, A. M., Keegan, J. D., Vienola, K., & Apajalahti, J. (2018b). Broiler tissue enrichment with docosahexaenoic acid (DHA) through dietary supplementation with Aurantiochytrium limacinum algae. Food and Nutrition Sciences, 9(10), 1160‑1173. doi:10.4236/fns.2018.910084
- Combes, S., & Dalle Zotte, A. (2005). La viande de lapin : valeur nutritionnelle et particularités technologiques. 11e Journées de la Recherche Cunicole, Paris, 167-180. http://www.cuniculture.info/Docs/Magazine/Magazine2009/Fig-2009-htm/Verone-2008/Figures/37-CombesS.pdf
- De Tonnac, A., Meteau, K., Guillevic, M., Chesneau, G., Mairesse, & G., Mourot, J. (2016). Influence de la nature des acides gras n-3 sur les critères de performances de croissance du porc et sur les qualités nutritionnelle et sensorielle de la viande. 48e Journées de la Recherche Porcine, Paris, 279-284. https://www.journees-recherche-porcine.com/texte/2016/genetique/g5.pdf
- Delarue, J. (2018). Acides gras polyinsaturés à longue chaîne n-3 et risque cardiovasculaire : un mauvais procès d’inefficacité. Cahiers de Nutrition et de Diététique, 53(2), 86‑99. doi:10.1016/j.cnd.2018.01.003
- Delarue, J. (2020). Are marine n-3 fatty acids protective towards insulin resistance? From cell to human. Proceedings of the Nutrition Society, 79(4), 417‑427. doi:10.1017/s0029665120000087
- Delarue, J. (2021). Dietary fatty acids and CHD: From specific recommendations to dietary patterns. Nutrition Research Reviews, 34(2), 240‑258. doi:10.1017/s0954422420000293
- Delarue, J. (2022). Prévention de l’insulino-résistance par les acides gras polyinsaturés à longue chaîne n-3 : actualisation en 2022*. Bulletin de l’Académie Nationale de Médecine, 206(8), 1028‑1036. doi:10.1016/j.banm.2022.04.028
- Delarue, J., & Guriec, N. (2014). Opportunities to enhance alternative sources of long-chainN-3 fatty acids within the diet. Proceedings of the Nutrition Society, 73(3), 376‑384. doi:10.1017/s0029665114000123
- Delarue, J., Foll, C.-L., Corporeau, C., & Lucas, D. (2004). n-3 long chain polyunsaturated fatty acids: a nutritional tool to prevent insulin resistance associated to type 2 diabetes and obesity? Reproduction Nutrition Development, 44(3), 289‑299. doi:10.1051/rnd:2004033
- Delarue, J., Corporeau, C., & Alain, G. (2006). Intérêt des oméga-3 marins dans la prévention et le traitement du syndrome métabolique. Médecine thérapeutique, 12(5), 319‑326. https://www.jle.com/10.1684/met.2006.0037
- Delarue, J., Sussmann, D., Guriec, N., Colin, M., Prigent, A.Y., Dujol, J., & Godun, K. (2017). Effet de doses croissantes de DHA végétal (Schizochytrium cultivé à partir de coproduits de cannes à sucre) comme source unique d’ω3 dans l’aliment sur la composition des lipides de l’œuf et ses caractéristiques hédoniques. Journées Francophones de Nutrition, Nantes, PO 23. https://2018.lesjfn.fr/medias/content/files/JFN_2017_-_Livre_des_abstracts.pdf
- Dewez, M., Le Roux, J.F., Delarue, J., Prigent, A.Y., Colin, M. (2021). Influence d’une supplémentation des aliments pondeuses en chlorure de choline et en un équivalent naturel sur la valeur nutritionnelle de l’œuf. Journées Francophones de Nutrition, Lille, P007.
- Doughman, S. D., Krupanidhi, S., & Sanjeevi, C. B. (2007). Omega-3 fatty acids for nutrition and medicine: Considering microalgae oil as a vegetarian source of EPA and DHA. Current Diabetes Reviews, 3(3), 198‑203. doi:10.2174/157339907781368968
- Douny, C., Khoury, R. E., Delmelle, J., Brose, F., Degand, G., Moula, N., Farnir, F., Clinquart, A., Maghuin‐Rogister, G., & Scippo, M. (2015). Effect of storage and cooking on the fatty acid profile of omega‐3 enriched eggs and pork meat marketed in Belgium. Food Science and Nutrition, 3(2), 140‑152. doi:10.1002/fsn3.197
- Feng, J., Long, S., Zhang, H., Wu, S., Qi, G., & Wang, J. (2020). Comparative effects of dietary microalgae oil and fish oil on fatty acid composition and sensory quality of table eggs. Poultry Science, 99(3), 1734 1743. doi:10.1016/j.psj.2019.11.005
- Fraeye, I., Bruneel, C., Lemahieu, C., Buyse, J., Muylaert, K., & Foubert, I. (2012). Dietary enrichment of eggs with omega-3 fatty acids: a review. Food Research International, 48(2), 961‑969. doi:10.1016/j.foodres.2012.03.014
- Givens, D., & Gibbs, R. A. (2008). Current intakes of EPA and DHA in European populations and the potential of animal-derived foods to increase them. Proceedings of the Nutrition Society, 67(3), 273‑280. doi:10.1017/s0029665108007167
- Guriec, N., Colin, M., Delarue, J., Prigent, A., Guttierez, G., & Saliba, C. (2014). P013 : Effets d’un extrait d’algue riche en maltanediénol dans l’alimentation de la poule sur le niveau d’enrichissement en vitamine E et en sélénium de l’œuf. Nutrition Clinique et Métabolisme, 28, S74. doi:10.1016/s0985-0562(14)70656-9
- Guriec, N., Ibrahim Dalieh R., Delarue, J., Peron, M., Colin, M., Claveau, C., & Van Lissum, M. (2016). Enrichissement en DHA des œufs par incorporation dans l’aliment de DHA de 2 origines différentes. Journées Francophones de Nutrition, Montpellier, PO 048. https://2016.lesjfn.fr/medias/content/files/JFN2016_-_Livre_des_resumes.pdf
- Guriec, N., Zaraa, S., Colin, M., Delarue, J., Prigent, A.Y. (2015). Effets d’un apport alimentaire d’un extrait d’algue riche en Maltanediénol sur l’enrichissement en vitamine D de l’œuf par un apport alimentaire. Journées Francophones de Nutrition, Marseille, PO18.
- Innis, S. M. (1991). Essential fatty acids in growth and development. Progress in Lipid Research, 30(1), 39‑103. doi:10.1016/0163-7827(91)90006-q
- Irawan, A., Ningsih, N., Hafizuddin, H., Rusli, R. K., Suprayogi, W. P. S., Akhirini, N., Hadi, R. F., Setyono, W., & Jayanegara, A. (2022). Supplementary n-3 fatty acids sources on performance and formation of omega-3 in egg of laying hens: A meta-analysis. Poultry Science, 101(1), 101566. doi:10.1016/j.psj.2021.101566
- Kerhoas, N., Guillevic, M., Bordais, E., Chesneau, G., & Weill, P. (2010). Le mode de production influence la composition lipidique de l’œuf. Nutrition Clinique et Métabolisme, 24(1), S98-S98.
- Le Minous, A.E., (2020). Étude de mise au point de produits de snacking et de restauration rapide à base de viande de lapin avec de nouveaux profils nutritionnels. Compte rendu de mission Adria développement, Quimper.
- Legrand, P., Schmitt, B., Mourot, J., Cathaline, D., Chesneau, G., Mireaux, M., Kerhoas, N., & Weill, P. (2010). The consumption of food products from linseed fed animals maintains omega-3 fatty acids in obese human. Lipids, 45, 11-19. doi:10.1007/s11745-009-3376-5
- Loiseau, C., Palacios, C., Delarue, J., Sauvaget, D., Lebreton, F., & Colin, M. (2022). Développement d’une méthode permettant l’identification et la sélection des produits pouvant revendiquer l’allégation « riche en oméga-3 » au sein d’une enseigne de distribution. Journées Francophones de Nutrition, Toulouse, PO01_025.
- López-Ferrer, S., Baucells, M. D., Barroeta, A. C., & Grashorn, M. A. (2001). n-3 enrichment of chicken meat. 1. Use of very long-chain fatty acids in chicken diets and their influence on meat quality: fish oil. Poultry Science, 80(6), 741‑752. doi:10.1093/ps/80.6.741
- Merle, B. M. J., Benlian, P., Puche, N., Bassols, A. M. S., Delcourt, C., & Souied, E. H. (2014). Circulating omega-3 fatty acids and neovascular age-related macular degeneration. Investigative Ophthalmology & Visual Science, 55(3), 2010-2018. doi:10.1167/iovs.14-13916
- Moate, P. J., Williams, S., Hannah, M., Eckard, R., Auldist, M., Ribaux, B., Jacobs, J. L., & Wales, W. J. (2012). Effects of feeding algal meal high in docosahexaenoic acid on feed intake, milk production, and methane emissions in dairy cows. Journal of Dairy Science, 96(5), 3177‑3188. doi:10.3168/jds.2012-6168
- Moran, C. A., Morlacchini, M., Keegan, J. D., Rutz, F., & Fusconi, G. (2020). Docosahexaenoic acid enrichment of layer hen tissues and eggs through dietary supplementation with heterotrophically grown Aurantiochytrium limacinum. Journal of Applied Poultry Research, 29(1), 152‑161. doi:10.1016/j.japr.2019.10.002
- Mordenti, A., Sardi, L., Bonaldo, A., Pizzamiglio, V., Brogna, N., Cipollini, I., Tassinari, M., & Zaghini, G. (2010). Influence of marine algae (Schizochytrium spp.) dietary supplementation on doe performance and progeny meat quality. Livestock Science, 128(1‑3), 179‑184. doi:10.1016/j.livsci.2009.12.003
- Munthe, J., Bodaly, R. A., Branfireun, B. A., Driscoll, C. T., Gilmour, C. C., Harris, R. O., Horvat, M., Lucotte, M., & Malm, O. (2007). Recovery of mercury-contaminated fisheries. AMBIO: A Journal of the Human Environment, 36(1), 33‑44. doi:10.1579/0044-7447(2007)36[33:ROMF]2.0.CO;2
- Nelson, E., & Van Elswyk, M. E. (2015). Limitations of the review and meta-analysis of the role of n–3 long-chain PUFA supplementation and cognitive function. The American Journal of Clinical Nutrition, 101(6), 1305‑1306. doi:10.3945/ajcn.115.107078
- Palacios, C., Delarue, J., Colin, M., Le Minous, A.E., Guezenec, A., Van Lissum, M., Caillaud, L., & Prigent, A.Y. (2023). Mise au point d'une gamme de produits de charcuteries à base uniquement de viande de lapins enrichie en DHA d’origine végétale ; intérêt nutritionnel. 19e Journées de la Recherche Cunicole, Le Mans, sous presse.
- Pieroni, G., & Coste, T. (2010). Composition en acides gras des œufs. Intérêt nutritionnel et valeur santé. Cahiers de Nutrition et de Diététique, 45(5), 261‑266. doi:10.1016/j.cnd.2010.04.004
- Prigent, A.Y., Delarue, J., Caillaud, L., & Colin, M. (2013). Élaboration de pâtés de lapins naturellement enrichis en DHA. Journées Francophones de Nutrition, Bordeaux. Cahier de Nutrition et de Diététique, 48(Suppl. 1), S59. doi:10.1016/S0007-9960(13)70363-8
- Pruvost, M., Colin, M., Chevalier, D., & Faouën, A. (2022). Enrichissement des œufs : effet sur les performances des poules, la qualité et la composition nutritionnelle des œufs. 18e Journées de la Recherche Avicole et des Palmipèdes à Foie Gras, Tours, 956.
- Raguénés, N. (2012). Étude de l’enrichissement en oméga-3 des produits issus d’animaux terrestres et commercialisation d’additifs naturels en Asie. [Mémoire de master, Université de Brest]. Document interne
- Règlement CE N°1924/2006 (2014). Règlement du Parlement Européen et du Conseil du 20 décembre 2006 : concernant les allégations nutritionnelles et de santé portant sur les denrées alimentaires..
- Règlement UE N°432/2012 (2021). Règlement de la Commission du 16 mai 2012 : établissant une liste des allégations de santé autorisées portant sur les denrées alimentaires, autres que celles faisant référence à la réduction du risque de maladie ainsi qu’au développement et à la santé infantiles. https://eur-lex.europa.eu/legal-content/FR/TXT/PDF/?uri=CELEX:02012R0432-20210517&qid=1698129608894
- Ribeiro, T., Lordelo, M., Costa, P., Alves, S. P., Benevides, W., Bessa, R. J. B., Lemos, J. P. C., Pinto, R., Ferreira, L., Fontes, C. M. G. A., & Prates, J. A. M. (2014). Effect of reduced dietary protein and supplementation with a docosahexaenoic acid product on broiler performance and meat quality. British Poultry Science, 55(6), 752‑765. doi:10.1080/00071668.2014.971222
- Rymer, C., Gibbs, R. A., & Givens, D. I. (2010). Comparison of algal and fish sources on the oxidative stability of poultry meat and its enrichment with omega-3 polyunsaturated fatty acids. Poultry Science, 89(1), 150‑159. doi:10.3382/ps.2009-00232
- Šefer, D., Andonov, A., Šobajić, S., Marković, R., Radulović, S., Jakić-Dimić, D., & Petrujkić, B. (2011). Effects of feeding laying hens diets supplemented with oméga-3 fatty acids on the egg fatty acid profile. Biotechnology in Animal Husbandry, 27(3), 679‑686. doi:10.2298/bah1103679s
- Simopoulos, A. P., & Salem, N. (1992). Egg yolk as a source of long-chain polyunsaturated fatty acids in infant feeding. The American Journal of Clinical Nutrition, 55(2), 411‑414. doi:10.1093/ajcn/55.2.411
- Takama, K., Suzuki, T., Yoshida, K., Arai, H., & Anma, H. (1994). Lipid content and fatty acid composition of phospholipids in White-Flesh fish species. Fisheries Science, 60(2), 177‑184. doi:10.2331/fishsci.60.177
- Tocher, D. R., Betancor, M. B., Sprague, M., Olsen, R. E., & Napier, J. A. (2019). Omega-3 long-chain polyunsaturated fatty acids, EPA and DHA: Bridging the gap between supply and demand. Nutrients, 11(1), 89. doi:10.3390/nu11010089
- Van Lissum, M., Delarue, J., Lebas, F., Prigent, A.Y., Caillaud, L., & Colin, M. (2019). La viande de lapins ayant reçu des aliments enrichis en DHA peut être une solution intéressante pour contribuer à couvrir les besoins de l’homme en cet acide gras essentiel – une revue. 18e Journées de la Recherche Cunicole, Nantes, 50-55. http://www.cuniculture.info/Docs/Magazine/Magazine2019/Coomunications-JRC-pdf/050-Van-Lissum-DHA-Revue.pdf
- Van Vliet, T., & Katan, M. B. (1990). Lower ratio of N-3 to N-6 fatty acids in cultured than in wild fish. The American Journal of Clinical Nutrition, 51(1), 1‑2. doi:10.1093/ajcn/51.1.1
- Weill, P., Schmitt, B., Chesneau, G., Daniel, N., Safraou, F., & Legrand, P. (2002). Effects of introducing linseed in livestock diet on blood fatty acid composition of consumers of animal products. Annals of Nutrition and Metabolism, 46(5), 182‑191. doi:10.1159/000065405
- Wood, J., & Enser, M. (1997). Factors influencing fatty acids in meat and the role of antioxidants in improving meat quality. British Journal of Nutrition, 78(1), S49‑S60. doi:10.1079/bjn19970134
- Wu, S., Ding, Y., Wu, F., Li, R., Hou, J., & Mao, P. (2015). Omega-3 fatty acids intake and risks of Dementia and Alzheimer’s Disease: A meta-analysis. Neuroscience & Biobehavioral Reviews, 48, 1‑9. doi:10.1016/j.neubiorev.2014.11.008
- Xue, S., He, Z., Lu, J., Tao, X., Li, Z., Xie, Y., Xiao, X., Peng, R., & Li, H. (2015). Effect of growth on fatty acid composition of total intramuscular lipid and phospholipids in IRA rabbits. Korean Journal for Food Science of Animal Resources, 35(1), 10‑18. doi:10.5851/kosfa.2015.35.1.10
- Zhang, X., Hou, W., Li, M., & Tang, Z. (2016). Omega-3 fatty acids and risk of cognitive decline in the elderly: A meta-analysis of randomized controlled trials. Aging Clinical and Experimental Research, 28(1), 165‑166. doi:10.1007/s40520-015-0381-9
Résumé
Ce travail présente une méthode permettant d’augmenter la consommation en DHA de la population sans accroitre le prélèvement halieutique, grâce à la production de produits provenant d’animaux terrestres nourris avec des aliments contenant du DHA provenant de microalgues de culture et d’ALA provenant du lin extrudé. Après une identification des espèces fixant le DHA en quantité importante (pondeuse, lapins, poulet de chair), des essais réalisés sur ces animaux (21 sur pondeuses, 9 sur lapins, 6 sur poulets de chair) ont permis de déterminer les conditions d’enrichissement en DHA ainsi que les teneurs en cet acide gras que l’on peut atteindre dans ces produits. Ainsi, avec cette alimentation, le contenu en DHA des œufs est de 200 mg / 100 grammes soit 3,5 fois plus qu’un œuf standard; pour le lapin (par exemple, la gigolette), cette valeur est également de 200 mg / 100 grammes soit 10 fois plus qu’une viande de lapin standard; et pour le poulet de chair (par exemple, le blanc) 83 mg / 100 grammes soit 4 fois plus qu’une viande de poulet de chair standard. La plupart de ces produits peuvent alléguer « Riche en oméga 3 » ou « Source d’oméga 3 ». Ces différents aliments peuvent être associés dans des menus permettant d’atteindre les recommandations d’ingestion de DHA sans augmenter la consommation de poisson, améliorant ainsi la santé de la population et celle de la planète dans le respect des habitudes alimentaires.
Pièces jointes
Pas de document complémentaire pour cet articleStatistiques de l'article
 Vues: 5748
Vues: 5748
Téléchargements
 PDF: 520
PDF: 520
 XML: 64
XML: 64

