Vers une maîtrise de la reproduction sans hormones chez les petits ruminants
Chapeau
L’insémination artificielle après synchronisation hormonale des ovulations est l’outil de diffusion génétique sur lequel s’appuient aujourd’hui les schémas de sélection et permet aussi la maîtrise de la saisonnalité des productions dans les filières ovines et caprines. Toutefois les traitements hormonaux sont remis en cause voire interdits dans certaines filières de production comme l’agriculture biologique. Des pratiques alternatives avec moins ou pas d’hormones se développent. Ces avancées vers la maîtrise de la reproduction sans hormones seront profitables en élevages conventionnels et biologiques, et contribueront à la gestion durable de l’agriculture
Introduction
La maîtrise de la reproduction est une pratique nécessaire en élevage. Il s’agit de mettre en œuvre des stratégies techniques ou de conduite des troupeaux permettant d’optimiser la reproduction par monte naturelle ou Insémination Artificielle (IA).
Chez les petits ruminants, la saisonnalité de la reproduction conduit à des variations annuelles de la disponibilité et du prix des produits (lait et viande) sur le marché. La maîtrise de la saisonnalité de la reproduction permet de maintenir l’offre en lait ou viande tout au long de l’année. Il s’agit d’un enjeu majeur pour ces filières afin de répondre à la demande des consommateurs et des marchés. Le désaisonnement est fréquent d’après des enquêtes réalisées auprès d’éleveurs dans les principaux bassins de production français. En production caprine, un tiers environ des éleveurs en Agriculture Biologique (AB) pratique la lutte à contre-saison, contre 70 % en Agriculture Conventionnelle (AC) (dont 20 % ayant deux périodes de lutte, saison et contre-saison). Dans les élevages ovins laitiers et allaitants, environ 70 et 85 % des éleveurs (ayant en général une ou deux périodes de lutte) choisissent une lutte à contre-saison en AB et AC, respectivement (Lurette et al., 2016).
La synchronisation des chaleurs pour le groupage des mises bas est aussi un objectif recherché en élevages ovins et caprins, laitiers ou allaitants, afin de faciliter la gestion des lots d’animaux et du travail (alimentation, traite, prophylaxie). Elle a aussi un rôle central pour la pratique de l’IA (ou de la monte en main) dans le contrôle des accouplements et l’organisation des schémas de sélection génétique. De plus, l’IA apporte des avantages sanitaires en limitant la circulation de reproducteurs (mâles ou femelles) entre élevages.
La maîtrise de la reproduction sur les agnelles et chevrettes a pour objectifs de réduire leurs périodes improductives, d’améliorer la fertilité à la première mise à la reproduction et de faciliter leur mise à la reproduction à la même période que les adultes.
Pour atteindre ces objectifs, diverses pratiques de maîtrise de la reproduction (traitements hormonaux d’induction et de synchronisation des chaleurs, effet mâle, traitements lumineux, mélatonine, lactations longues), sont mises en œuvre (seules ou en combinaison) par les éleveurs selon les modes de production et les spécificités de chaque filière (pour revue : Pellicer-Rubio et al., 2009 ; Lurette et al., 2016).
Depuis les années 1970, les traitements hormonaux d’induction et synchronisation des chaleurs ont montré leur efficacité pour : i) désaisonner la reproduction ; ii) synchroniser la reproduction pendant et hors saison sexuelle dans le cadre de l’IA, de la monte en main ou en lutte naturelle (pour revue : Fatet et al., 2008), et iii) avancer, déclencher et synchroniser la puberté des jeunes femelles (Groupe Reproduction Caprine, 2012a ; Piedhault et al., 2014 ; CIIRPO, 2015). Le traitement utilisé en France combine une hormone stéroïdienne de synthèse (FGA : acétate de fluorogéstone) à activité progestative, une hormone glycoprotéique d’origine animale (eCG : gonadotrophine chorionique équine) et, dans le cas de la chèvre, aussi une prostaglandine de synthèse (cloprosténol) à activité lutéolytique. Ce traitement est utilisé majoritairement pour l’IA (Fatet et al., 2008). En France, environ 8 % des chèvres (≈ 70 000 IA, Idele et CNE, 2017), 42 % des brebis laitières (≈ 668 000 IA) et 4 % des brebis allaitantes (≈ 150 000 IA) sont inséminées (Loywyck et Lagriffoul, 2017).
Le traitement hormonal d’induction et synchronisation des chaleurs a été le seul moyen efficace pour désaisonner la reproduction (notamment chez des races très saisonnées), jusqu’au développement des traitements lumineux dans les années 1990. Néanmoins, les traitements lumineux doivent être associés à une autre hormone, la mélatonine, notamment pour désaisonner la reproduction en période estivale (Chemineau et al., 1996). En France, les traitements lumineux et/ou la mélatonine sont utilisés principalement chez les caprins. Aujourd’hui, plus de 50 % des 1 800 élevages caprins adhérents au schéma de sélection Capgènes utilisent les traitements photopériodiques pour la reproduction des chèvres laitières, ce qui représente environ 200 000 chèvres (le nombre total d’élevages caprins en France étant d’environ 4 800 et le cheptel caprin français de 840 000 têtes) (Gaunand et al., 2014).
Les hormones ou analogues (traitements d’induction et synchronisation des chaleurs et des ovulations, mélatonine) ne sont pas autorisés par le cahier des charges en AB (règlements 2007/834/CE et 2008/889/CE), ce qui constitue un frein pour le désaisonnement et l’adhésion à des schémas de sélection. Les hormones sont exclusivement utilisées en AC dans un cadre réglementaire strict (directives 96/22/CE, 2003/74/CE et 2008/97/CE ; décret n°2009-504, article D234-6 du code rural). Cette réglementation veille à protéger la santé publique de la présence de résidus hormonaux dans les produits animaux et l’environnement. Des délais d’attente avant toute commercialisation de lait ou viande sont appliqués après le traitement (Fréret et al., 2018), ce qui peut conduire à des pertes économiques importantes, notamment en production laitière. En outre, l’hormone eCG, de par son origine animale, représente un risque sanitaire comme vecteur potentiel de maladies. De plus, le mode de production de l’eCG (hormone purifié à partir du sang de juments gestantes) soulève des questions éthiques importantes en lien avec le bien-être animal, ce qui pousse fortement vers la recherche de traitements alternatifs.
Chez les petits ruminants, l’effet mâle apparaît comme une solution alternative à l’utilisation d’hormones pour la maîtrise de la reproduction, et notamment pour la mise en œuvre de l’IA. La première partie de cet article rappelle les spécificités de la réponse ovulatoire et comportementale des femelles à « l’effet mâle » qui justifient l’intérêt de cette pratique en élevage. L’association de l’effet mâle à des traitements photopériodiques de désaisonnement est un élément clé pour la réussite de cette technique. C’est pourquoi, la deuxième partie de cet article récapitule les traitements photopériodiques disponibles aujourd’hui en élevage, et décrit les stratégies photopériodiques qui ont été étudiées pour éliminer l’emploi de mélatonine. Ces deux parties résument les bases sur lesquelles s’appuient les protocoles d’IA après effet mâle développés à ce jour. Ces protocoles sont présentés dans la troisième partie de l’article.
1. Qu’est que l’effet mâle ?
Un mâle sexuellement actif, via des signaux sensoriels (notamment olfactifs), est capable d’induire et de synchroniser les chaleurs et les ovulations chez des femelles anovulatoires (au repos sexuel ou non cycliques). Il s’agit d’un processus naturel qui est observé aussi bien chez les caprins que les ovins (Walkden-Brown et al., 1999). Cet « effet mâle » est une pratique d’élevage d’intérêt pour avancer et synchroniser la puberté des jeunes femelles (Abecia et al., 2016 ; Chasles et al., 2017), mettre en place la reproduction hors saison sexuelle et grouper les mises bas (Chemineau, 1989 ; Tournadre et al., 2002 ; Pellicer-Rubio et al., 2007). Cette pratique est mise en œuvre pour une lutte naturelle à contre-saison par environ 30 % des éleveurs caprins en AB et 60 % en AC, dans les principaux bassins de production en France. En élevage ovin biologique, l’effet bélier est plus utilisé en filière laitière (68 %) qu’allaitante (28 %), alors qu’en AC la fréquence d’utilisation est similaire (35 %) pour ces deux filières (Lurette et al., 2016).
1.1. Réponse comportementale et endocrine des chèvres à l’effet mâle
a. Étape 1 : augmentation de la sécrétion pulsatile de LH (réponse à court terme)
Pendant l’anœstrus saisonnier, en absence de contact avec des mâles, les niveaux plasmatiques de l’hormone gonadotrope FSH (Hormone Folliculo-Stimulante) et de l’estradiol sont au niveau basal, ou bien fluctuent de façon périodique suivant les vagues de croissance terminale des follicules ovariens. La sécrétion pulsatile de l’hormone gonadotrope LH (Hormone Lutéinisante) est minimale (1-2 pulses toutes les 6 h) et le niveau plasmatique de progestérone reste au niveau basal (Claus et al., 1990 ; Bartlewski et al., 1998 ; Adib et al., 2014 ; Fabre-Nys et al., 2015a) (figure 1A).
Les signaux stimulateurs du mâle vont activer des régions spécifiques du système nerveux central (aire préoptique, noyau arqué hypothalamique) impliquées dans l’activité des neurones à GnRH dans l’hypothalamus (pour revue : Fabre-Nys et al., 2015a). Ces évènements vont conduire à la réactivation de l’axe hypothalamo-hypophysaire de la femelle. Ceci se traduit par la stimulation de la sécrétion pulsatile de LH dans les quelques heures qui suivent l’exposition aux mâles ou à leur odeur (Martin et al., 1980 ; Cohen-Tannoudji et Signoret, 1987 ; Chemineau, 1989 ; Claus et al., 1990). Le niveau sanguin de FSH reste inchangé, ou bien on peut observer une diminution (Poindron et al., 1980 ; Atkinson et Williamson, 1985) (figure 1B). L’augmentation de la concentration plasmatique d’estradiol est initiée parallèlement à celle de LH (Claus et al., 1990 ; Adib et al., 2014 ; Fabre-Nys et al., 2015b).
L’activation des neurones à kisspeptine (neuropeptide stimulateur de la libération de LH et FSH via la stimulation de la sécrétion de GnRH) dans le noyau arqué a pu être mise en évidence lors d’un effet mâle chez la brebis (De Bond et al., 2013) mais non chez les caprins (Bedos et al., 2016).
Figure 1. Exemples de profils hormonaux plasmatiques individuels chez des chèvres alpines en anœstrus saisonnier avant (A) et après (A, B) leur exposition à des boucs sexuellement actifs (ayant reçu préalablement un traitement photopériodique de désaisonnement : Groupe Reproduction Caprine, 2012b) ou à leur odeur (Pellicer-Rubio et al., résultats non publiés).
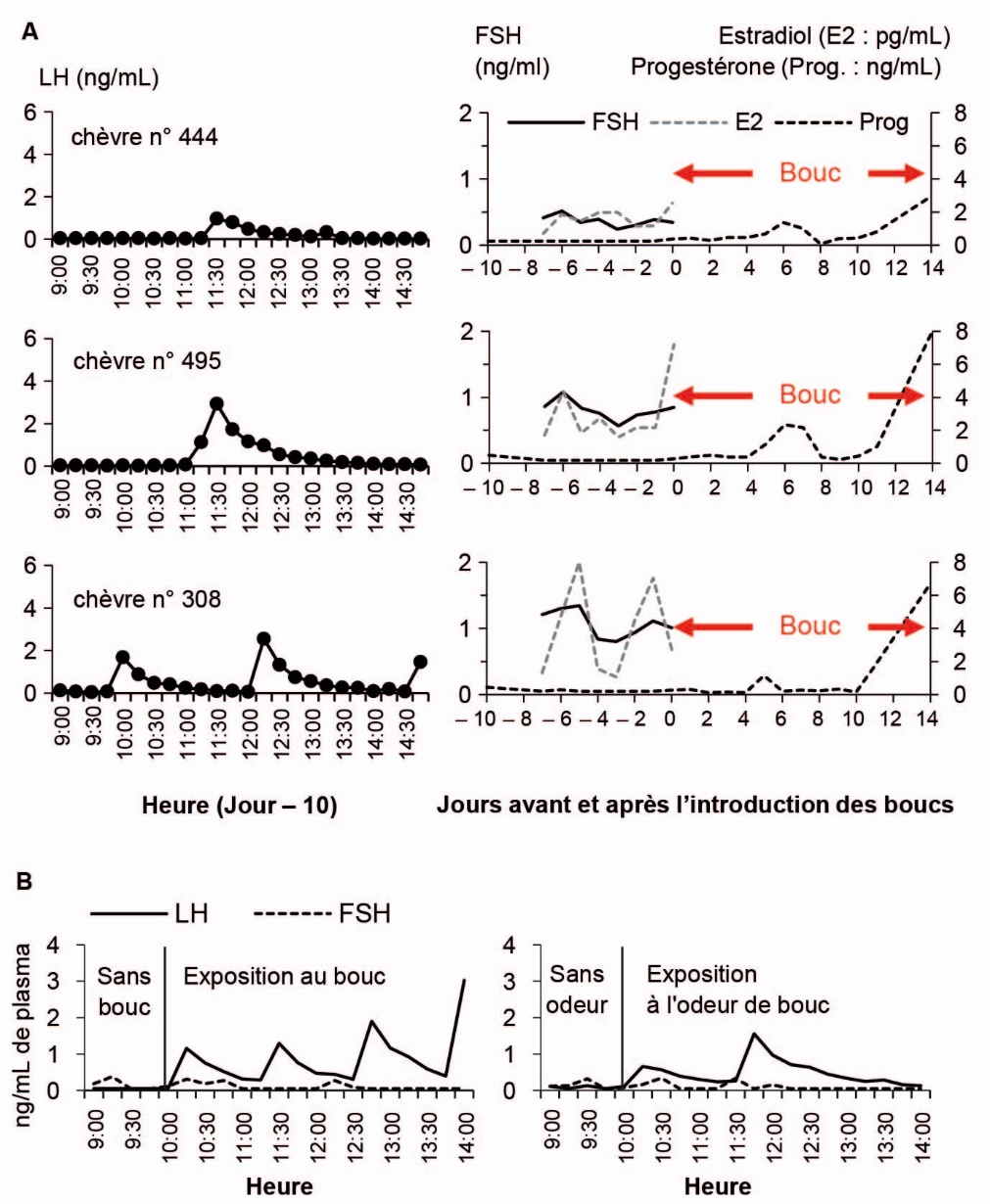
b. Étape 2 : déclenchement du pic préovulatoire de LH (réponse à moyen terme)
L’augmentation de la sécrétion pulsatile de LH va agir sur les follicules ovariens pour stimuler leur croissance et maturation terminale, et produire de l’estradiol. La production d’estradiol va augmenter jusqu’à déclencher, par rétrocontrôle positif au niveau de l’axe hypothalamo-hypophysaire, un pic préovulatoire simultané de LH et de FSH. Une augmentation abrupte et transitoire des niveaux plasmatiques de ces deux hormones est observée entre 8 h et 56 h après l’exposition aux mâles (Poindron et al., 1980 ; Claus et al., 1990 ; Ungerfeld et al., 2002 ; Ungerfeld et al., 2005 ; Adib et al., 2014 ; Fabre-Nys et al., 2015b).
Chez la brebis, soit les niveaux plasmatiques d’estradiol augmentent progressivement depuis l’introduction des béliers et restent élevés jusqu’à la décharge ovulante de LH, soit l’individu développe des épisodes (un ou plusieurs) d’augmentation puis de diminution des niveaux d’estradiol avant le déclenchement du pic préovulatoire. Le niveau maximal d’estradiol dans le plasma sanguin est atteint dans les 12 h avant le pic de LH, moment qui coïncide avec l’acquisition de la taille maximale du follicule destiné à ovuler (Adib et al., 2014 ; Fabre-Nys et al., 2015b). La capacité des follicules ovariens à produire de l’estradiol dans les 12 h qui suivent l’effet bélier est associée à une augmentation de l’expression des messagers du gène codant pour la protéine STAR (protéine de transport qui régule le transfert du cholestérol dans la mitochondrie : étape limitante de la stéroïdogenèse) dans les cellules de granulosa, alors que l’expression des messagers des enzymes CYP11A1 (catalyse la conversion de cholestérol en pregnenolone : première réaction du processus de la stéroïdogenèse) et 3β-hydroxystéroïde déshydrogénase (3β-HSD : catalyse la biosynthèse de progestérone à partir de pregnenolone) restent inchangées (Fabre-Nys et al., 2015b). En outre, chez certaines brebis, le bélier peut déclencher un pic préovulatoire de LH précoce (dans les 4 h après l’exposition au bélier) sans qu’il y ait une augmentation importante d’estradiol préalable, ce qui suggère l’implication d’un mécanisme, non classique, s’affranchissant du rétrocontrôle positif de l’estradiol (Fabre-Nys et al., 2016). Ces phénomènes n’ont pas été étudiés chez les caprins.
c. Étape 3 : induction de l’œstrus et de l’ovulation (réponse à long terme)
Le pic préovulatoire de LH va induire l’ovulation des follicules ovariens sélectionnés. Lors du premier cycle, ils peuvent émerger (acquisition d’un diamètre entre 3 et 4 mm) quelques jours avant l’exposition des femelles aux mâles, le jour même, ou au cours de la période de stimulation. Le diamètre de ces follicules au moment de l’introduction des mâles peut alors varier de < 3 mm à ≥ 6 mm (taille ovulatoire chez les chèvres, ≥ 5 mm chez la brebis) et ceux qui étaient plus gros vont acquérir leur taille maximale et ovuler plus tôt que les petits. Toutefois, le diamètre maximal atteint pour chacun de ces follicules et leur diamètre ovulatoire sont similaires quel que soit leur taille au moment de l’exposition aux mâles (tableau 1) (Delgadillo et al., 2011 ; Pellicer-Rubio et al., 2013 ; Adib et al., 2014).
Tableau 1. Dynamique folliculaire du premier cycle ovulatoire induit par effet mâle chez des brebis et des chèvres en anœstrus saisonnier.
Paramètres |
Émergence |
Émergence |
P |
|---|---|---|---|
*Chèvre (Alpine) |
|||
Nb chèvres non cycliques |
7 |
7 |
|
Dont nb ovulant |
7 |
5 |
|
Nb fol. ovul. |
10 |
6 |
|
∅ à J0 (mm) |
6,4 [5,9 ; 6,6] |
3 [3 ; 3,8] |
< 0,001 |
∅ maximal |
6,6 [6,4 ; 7,8] |
6,7 [6,5 ; 7,0] |
NS |
∅ ovulatoire |
6,5 [6,2 ; 7,3] |
6,7 [6,1 ; 7,0] |
NS |
J. émergence |
ND |
0 [0 ; 0,8] |
-- |
J. obs° ∅ maximal |
1,0 [1,0 ; 1,8] |
2,5 [2,0 ; 3,0] |
≤ 0,05 |
J. ovulation |
3,0 [2,3 ; 3,8] |
4,0 [4,0 ; 4,0] |
≤ 0,05 |
Durée de vie (j) |
ND |
ND |
-- |
**Brebis (Ile de France) |
|||
Nb brebis non cycliques |
12 |
7 |
|
Dont nb ovulant |
12 |
7 |
|
Nb fol. ovul. |
18 |
7 |
|
∅ à J0 (mm) |
5,1 [4,4 ; 5,8] |
3,4 [3 ; 3,5] |
< 0,0001 |
∅ maximal |
5,4 [5,3 ; 5,9] |
5,3 [5,2 ; 5,7] |
NS |
∅ ovulatoire |
5,0 [4,6 ; 5,4] |
5,2 [4,6 ; 5,3] |
NS |
J. émergence |
– 2,5 [– 4 ; – 1,3] |
0 |
< 0,0001 |
J. obs° du ∅ max |
1 [0 ; 1] |
2 [2 ; 3] |
< 0,01 |
J. ovulation |
2 [2 ; 3] |
3 [3 ; 4] |
< 0,01 |
Durée de vie (jours) |
4,5 [4 ; 6] |
3 [3 ; 4] |
< 0,01 |
Caractéristiques des follicules ovulatoires (fol. ovul.) selon le moment d’émergence (jour où le diamètre (Ø) du follicule est de 3-4 mm) par rapport au jour (J) d’introduction des mâles (J0). Observations par échographie transrectale. Les boucs et les chèvres ont reçu préalablement un traitement photopériodique de désaisonnement (Groupe Reproduction Caprine, 2012b).
* Pellicer-Rubio et al., résultats non publiés. ** D’après Adib et al., 2014. Données exprimées en médiane [Q1 ; Q3]. P : probabilité après comparaison des 2 groupes avec le test exact de Fisher-Pitman (logiciel R3.2.2). ND : non déterminé. NS : non significatif avec p > 0,05.
La première ovulation a lieu 2-3 jours après l’exposition au mâle. Après l’ovulation, les follicules se transformeront en corps jaunes sécrétant de la progestérone et une augmentation des niveaux plasmatiques de progestérone pourra être observée à partir du quatrième jour. Chez certaines femelles, ce premier corps jaune va régresser de façon prématurée (cycle court), puis une deuxième ovulation aura lieu environ 5 à 6 jours après la première, avec la mise en place d’un corps jaune d’une durée de vie similaire de celle observé en saison sexuelle (cycle normal) (figure 1A). D’autres femelles vont développer des cycles normaux dès la première ovulation. Dans les deux cas, des cycles normaux successifs pourront avoir lieu en absence de gestation, si la stimulation par le mâle est maintenue. Ces profils ovulatoires sont observés dans les deux espèces, caprine (Chemineau et al., 1984 ; Chemineau, 1989 ; Pellicer-Rubio et al., 2016) et ovine (Thimonier et al., 2000 ; Pellicer-Rubio et al., 2013 ; Adib et al., 2014).
Chez la chèvre, un premier pic de chaleurs est observé associé à la première ovulation chez 20 à 60 % des chèvres (selon les races). Lorsque le premier cycle est court, un deuxième pic de chaleurs a lieu 5 à 6 jours après, lors de l’ovulation suivante (Chemineau, 1989 ; Pellicer-Rubio et al., 2007 et 2016).
Chez la brebis, la première ovulation induite par le bélier est toujours silencieuse (pas accompagnée de comportement d’œstrus), qu’elle soit associée à un cycle court ou normal. Lorsque le premier cycle est normal, les chaleurs apparaissent vers 19 jours après l’introduction des béliers, au moment de la deuxième ovulation. Lorsque le premier cycle est court, une deuxième ovulation silencieuse a lieu associée à un cycle normal 5 à 6 jours après, et les chaleurs apparaissent lors d’une troisième ovulation environ 25 jours après l’exposition aux béliers (Thimonier et al., 2000).
1.2. Un prétraitement des femelles avec de la progestérone prévient l’apparition des cycles courts induits par « effet mâle »
Les cycles courts induits par effet mâle chez certaines femelles sont à l’origine d’une distribution des chaleurs fertiles (et des mises bas) en deux pics dans le troupeau (Chemineau, 1989 ; Thimonier et al., 2000 ; Pellicer-Rubio et al., 2007). La fréquence de femelles qui développent un 1er cycle court ou normal peut varier en fonction de : la race et le moment de l’anœstrus (Chanvallon et al., 2011), la proportion des femelles cycliques dans le troupeau (Chemineau, 1983), la date d’entrée en anœstrus (Pellicer-Rubio et al., 2013), l’état nutritionnel des femelles (Thimonier et al., 2000 ; Tournadre et al., 2009), une supplémentation alimentaire avant l’exposition aux mâles (De Santiago-Miramontes et al., 2008), la performance sexuelle des mâles (Perkins et Fitzgerald, 1994).
À ce jour, le seul moyen de prévenir les cycles courts consiste à prétraiter les femelles avec de la progestérone (ou analogues). Une injection unique de 20 mg de progestérone le jour de l’introduction des mâles, ou bien un prétraitement de plus longue durée (en utilisant des dispositifs vaginaux par exemple) avant l’introduction des mâles, permet d’obtenir majoritairement des cycles normaux à la 1ère ovulation induite par le mâle, aussi bien chez les ovins (Cognie et al., 1982, Adib et al., 2014) que les caprins (Chemineau, 1985 ; González-Bulnes et al., 2006 ; Pellicer-Rubio et al., 2007).
Un traitement progestatif d’une durée supérieure à 6 jours permet l’expression de l’œstrus dès la première ovulation chez la brebis et la chèvre, alors qu’une seule injection de progestérone (ou un traitement inférieur à 6 jours) est insuffisante pour obtenir ce résultat chez la brebis contrairement à la chèvre.
Chez la brebis, la suppression des cycles courts par un prétraitement progestatif serait le résultat d’une action à différents niveaux de l’axe de la reproduction. Au niveau ovarien, la progestérone participerait à la complétion de la croissance et de la maturation des follicules préovulatoires induits par l’effet bélier (Adib et al., 2014). Au niveau utérin, elle agirait au travers de mécanismes amenant à l’inhibition de la lutéolyse (Chemineau et al., 2006). Ces informations ne sont pas disponibles chez les caprins.
1.3. Le traitement photopériodique des mâles et/ou des femelles améliore la réponse œstrale et ovulatoire à l’effet mâle
La qualité de la réponse à l’effet mâle se traduit par : i) la proportion des femelles qui vont ovuler et exprimer le comportement des chaleurs après leur l’exposition aux mâles, ii) la vitesse du déclenchement et le degré de synchronisation des ovulations et des chaleurs, iii) la qualité des corps jaunes post-ovulatoires, et iv) la capacité à développer plusieurs cycles ovulatoires fertiles successifs (pour revue : Walkden-Brown et al. 1999). La réussite à l’effet mâle va dépendre de la qualité de la stimulation assurée par le mâle (en lien avec leur niveau d’activité sexuelle) et de l’état physiologique de la femelle (en lien avec l’état d’inhibition de l’axe hypothalamo-hypophyso-ovarien).
La réponse à l’effet mâle peut être améliorée en stimulant l’activité sexuelle des mâles par une alimentation adaptée et/ou leur exposition préalable à des femelles en chaleur (Walkden-Brown et al., 1993), mais notamment grâce aux protocoles photopériodiques de désaisonnement (Flores et al., 2000 ; Abecia et al., 2016, Chasles et al., 2016).
La réceptivité des femelles aux signaux stimulateurs du mâle est également importante (Walkden-Brown et al., 1999). Par exemple, la qualité de la réponse à l’effet mâle peut varier en fonction de l’intervalle entre le tarissement et la mise à la reproduction ou du statut nutritionnel des femelles (Fitz-Rodríguez et al., 2009 ; Tournadre et al., 2009). De même, le traitement de femelles avec un protocole lumineux de désaisonnement (avec ou sans mélatonine) peut faciliter l’expression de l’œstrus et l’ovulation, avancer l’ovulation, favoriser l’installation d’une cyclicité et/ou améliorer la fertilité (Chemineau et al., 1986 ; tableau 2). Sur cette base, en France les fiches techniques préconisent de traiter les boucs et les chèvres avec des protocoles photopériodiques de désaisonnement, pour une mise à la reproduction par effet mâle (Groupe Reproduction Caprine, 2012b ; 2014a).
Tableau 2. Réponse à l’effet bouc chez des chèvres ayant reçu préalablement (groupe traité) ou non (groupe témoin) un traitement photopériodique de désaisonnement.
Race (Pays) |
Groupe |
a Jours longs |
b Mélatonine |
Date |
n |
Chèvres en chaleurs |
Chèvres ovulant |
Chèvres avec cycle normal |
C Chèvres mettant bas |
|
|---|---|---|---|---|---|---|---|---|---|---|
début |
fin |
|||||||||
Sarda |
témoin |
-- |
-- |
-- |
15/5/10 |
20 |
36 % |
75 % |
32 % |
60 % |
traité |
15/12/09 |
14/3/10 |
-- |
18 |
71 % * |
100 % |
75 % * |
80 % * |
||
Serrana |
témoin |
-- |
-- |
-- |
18/5/11 |
18 |
83 % |
100 % |
63 % |
34 % |
traité |
4/1/11 |
14/3/11 |
-- |
19 |
95 % |
100 % |
91 % |
58 % |
||
Carpathian |
témoin |
-- |
-- |
-- |
16/5/11 |
20 |
31 % |
40 % |
4 % |
30 % |
traité |
15/12/10 |
14/3/11 |
-- |
20 |
66 % * |
85 % * |
21 % * |
53 % * |
||
Blanche |
témoin |
-- |
-- |
-- |
26/6/11 |
20 |
27 % |
45 % |
3 % |
24 % |
traité |
15/2/11 |
24/4/11 |
25/4/11 |
20 |
61 % * |
85 % * |
15 % |
46 % |
||
Saanen |
témoin |
15/4/10 |
27/6/10 |
-- |
28/8/10 |
20 |
85 % |
85 % |
73 % |
68 % |
traité |
15/4/10 |
27/6/10 |
28/6/10 |
19 |
96 % |
100 % |
94 % |
85 % |
||
Alpine |
témoin |
-- |
-- |
-- |
2/8/17 |
10 |
60 % |
90 % |
20 % |
70 % |
traité |
-- |
-- |
31/5/17 |
10 |
80 % |
100 % |
70 % t |
70 % |
||
TOTAL |
témoin |
108 |
54 % |
73 % |
34 % |
48 % |
||||
traité |
106 |
78 % * |
95 % * |
63 % * |
65 % * |
|||||
Résultats issus du projet européen FLOCK-REPROD (FP7, Grant Agreement n°243520, https://cordis.europa.eu/project/rcn/94541 ; Grizelj et al., résultats non publiés).
J0 : jour de l’introduction des boucs. n : chèvres non cycliques.
a : Pendant la période de jours longs (16 h de lumière/8 h d'obscurité), le groupe témoin reçoit la photopériode naturelle. À la fin de la période de jours longs, toutes les chèvres reçoivent la photopériode naturelle. Les boucs ont reçu le même traitement que les chèvres du groupe traité.
b : MELOVINE , 1 implant par chèvre, 3 implants par bouc. c : 35 jours de lutte. Variables binaires analysées par régression logistique (proc GLIMMIX, SAS®, avec race en variable aléatoire). Les valeurs sont exprimées en pourcentage (%). * : différences significatives entre groupes avec p≤0,05. t : 0.05
2. Quels sont les traitements photopériodiques (avec ou sans mélatonine) disponibles ?
2.1. Pour un effet mâle en anœstrus saisonnier (avec ou sans mélatonine)
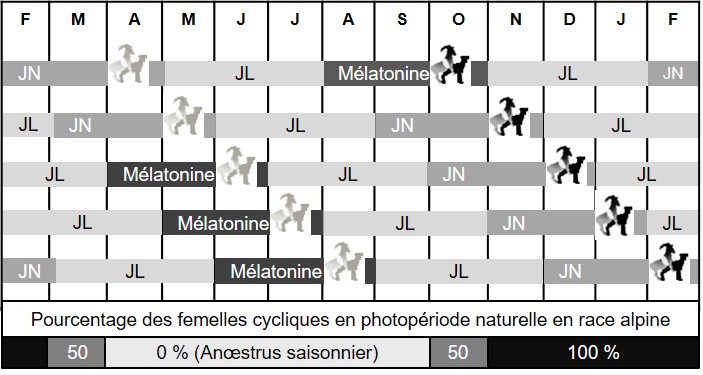
Le traitement photopériodique consiste à soumettre les animaux à une alternance de « Jours Longs » (JL : inhibiteurs de la reproduction, équivalent à 16 h de lumière par jour) puis de « Jours Courts » (JC : stimulateurs de la reproduction, 8-12 h de lumière par jour) à des moments de l’année très précis (Chemineau et al., 1996 ; Pellicer-Rubio et al., 2009). Les dates de mise en place de ces traitements dépendent de la période de reproduction souhaitée par l’éleveur. La durée du traitement est également importante pour assurer son efficacité.
En élevages caprins (figure 2), pour des mises à la reproduction au printemps (avril-mai), le traitement de JL est administré pendant l’hiver en éclairant les animaux avec de la lumière artificielle. Ensuite, vers le mois de mars, les animaux reçoivent la photopériode naturelle qui est encore de courte durée pour pouvoir stimuler l’activité sexuelle ; le bouc est introduit 60 jours après l’arrêt des JL.
Pour des mises à la reproduction en été, un traitement lumineux de JL est mis en place à la fin de l’hiver, ou bien les animaux peuvent bénéficier des JL naturels du printemps. L’effet stimulateur des JC est alors mimé par l’administration de mélatonine (sous forme d’implant sous-cutané : MELOVINE ) ; le bouc est introduit 60 jours après l’administration de mélatonine. Le recours à la mélatonine pour mimer des JC peut aussi être nécessaire à cause des contraintes d’élevage (surveillance des mise bas, heures de traite, repousse de l’aliment…) qui ne permettent pas d’assurer un minimum de 12 h par jour d’obscurité.
Ces traitements ont montré leur efficacité chez les races Alpines et Saanen (Pellicer-Rubio et al., 2007 ; Pellicer-Rubio et al., 2008 ; Fréret et al., 2013 ; Pellicer-Rubio et al., 2016). Ils sont aussi efficaces mais peu utilisés en élevages ovins (Chemineau et al., 1996 ; Pellicer-Rubio et al., 2009 ; Abecia et al., 2015 ; Abecia et al., 2016 ; Lurette et al., 2016).
Figure 2. Traitements lumineux utilisés en élevage caprin en France pour une reproduction hors saison sexuelle (d’après Groupe Reproduction Caprine, 2012b ; Fatet et Tuauden, 2013).

JL : Jours Longs (16 h de lumière, 8 h d’obscurité) ; JN : Jours Naturels
2.2. Pour un effet mâle en saison sexuelle (avec ou sans mélatonine)
Pour obtenir une bonne synchronisation des ovulations par effet mâle, il faut que les femelles soient réceptives, mais au repos sexuel (non cycliques). En saison sexuelle, puisque les femelles sont cycliques, l’effet mâle n’est pas suffisant pour synchroniser les ovulations (Pellicer-Rubio et al., 2009).
Pour pratiquer l’effet mâle en saison sexuelle, un nouveau traitement lumineux a été étudié chez les caprins de races alpine et saanen (figure 3). Il est basé sur la succession en continu de 3 mois de JL artificiels (16 h de lumière et 8 h d’obscurité) et 3 mois de JC (soit naturels, soit mimés avec de la mélatonine selon le moment de l’année). Le but de cette stratégie est de retarder de façon contrôlé le démarrage de la saison de reproduction.
Lorsque le premier cycle de JL artificiels démarre début décembre, on observe une courte période d’activité ovulatoire à contre saison au printemps, puis le démarrage de l’activité ovulatoire cyclique de la saison sexuelle suivante (qui a lieu début novembre chez la chèvre alpine sous photopériode naturelle ; Caillat et al., 2011) est retardée d’une vingtaine de jours (Ahmadpour et al., 2018a, figure 3A). Ce décalage rend possible un effet mâle début novembre. Chez les boucs, on observe deux périodes d’activité sexuelle maximale pendant les cycles de jours naturels (Boissard et al., 2018, figure 3B). Un essai réalisé en élevage montre l’efficacité de ce nouveau traitement lors d’un effet bouc en novembre : toutes les chèvres ont ovulé et 92 % des ovulations fertiles ont eu lieu au huitième et neuvième jours d’exposition aux boucs (Boissard et al., 2018).
Figure 3. Évolution de l’activité sexuelle des chèvres (A) et des boucs (B) lors d’une alternance de 3 mois de jours longs et 3 mois de jours naturels.
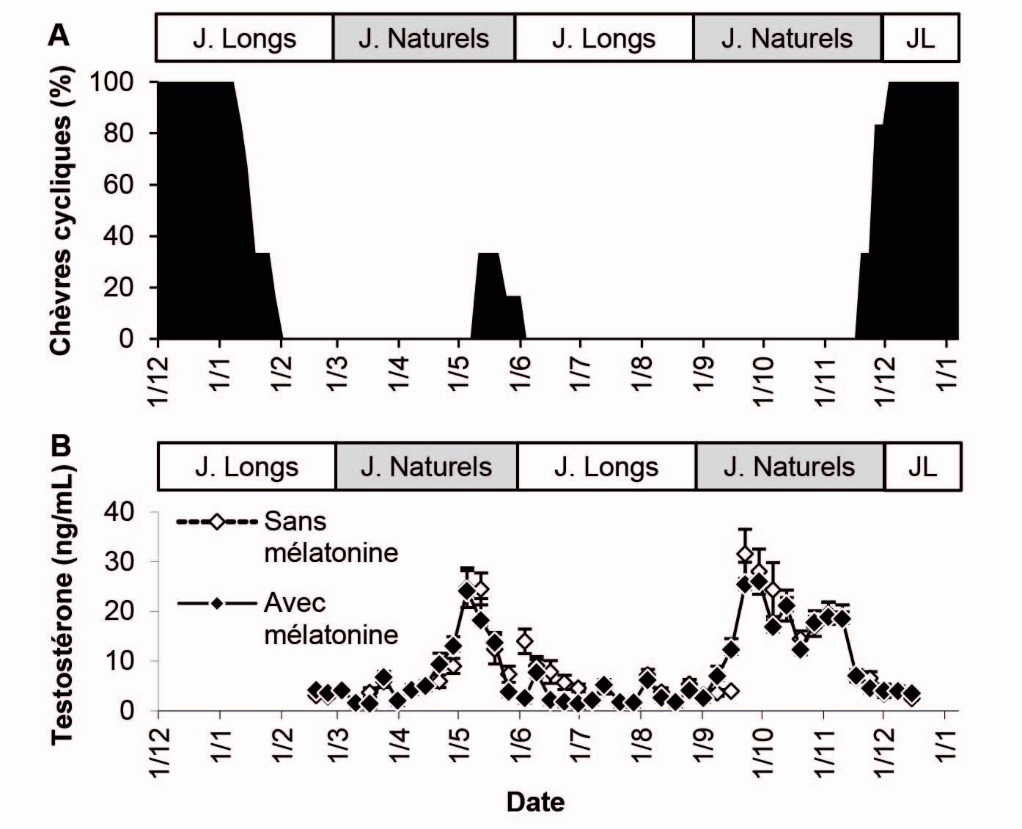
(A) Pourcentage de chèvres alpines cycliques, déterminé grâce à l’analyse des concentrations plasmatiques de progestérone 2 fois par semaine (n = 6 ; Ahmadpour et al., 2018a)
(B) Niveaux plasmatiques de testostérone (moy ± sem) de boucs alpins et saanen, mesurés 1 fois par semaine (n = 8 ; Boissard et al., 2018). Le traitement de mélatonine des boucs a eu lieu à la date d’arrêt de chaque cycle de jours longs (MELOVINE : 3 implants sous-cutanés par bouc).
Résultats issus du projet européen FLOCK-REPROD (FP7, Grant Agreement n°243520, https://cordis.europa.eu/project/rcn/94541_en.html)
Cette stratégie photopériodique peut être adaptée pour la pratique d’un effet bouc tout au long de la saison sexuelle (d’octobre à février) (figure 4 ; Fatet et Tuauden, 2013). Pour une reproduction en novembre, elle peut être mise en place en utilisant les jours naturels comme des JC (sans mélatonine), ce qui rend le traitement utilisable en AB. Toutefois, pour une reproduction programmée durant les autres mois de la saison sexuelle naturelle, le traitement doit être mis en place en utilisant la mélatonine pour simuler les JC. En outre, ce protocole permet deux périodes de mise à la reproduction par effet bouc à 6 mois d’intervalle (ex : mai et novembre). Dans des élevages avec une seule période de reproduction en saison (de novembre à février), seul le traitement des chèvres sera nécessaire car les boucs sont naturellement actifs sexuellement au moment de l’effet bouc. En revanche, si l’éleveur pratique deux périodes de reproduction, ce traitement lumineux devra aussi être appliqué sur les boucs de façon à les rendre sexuellement actifs aux deux périodes de reproduction correspondantes.
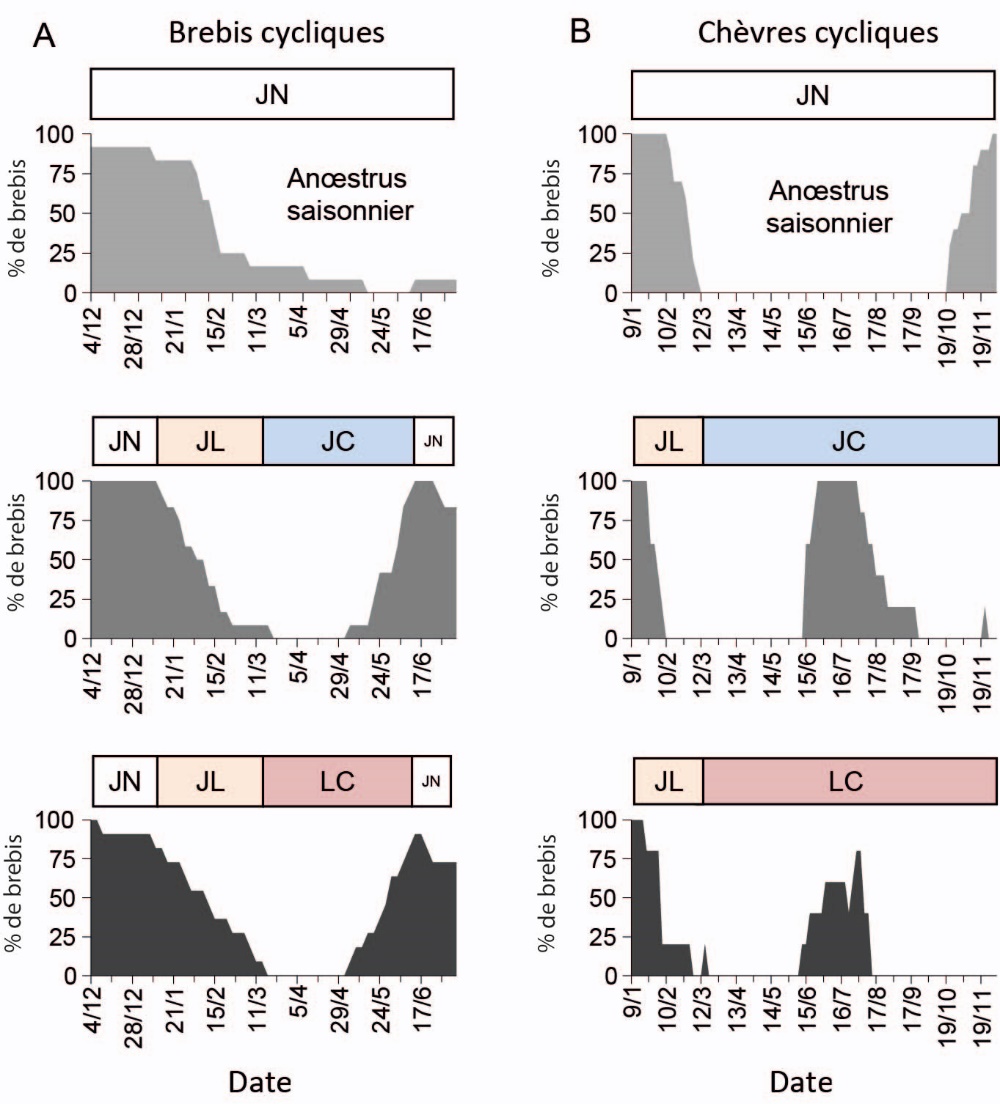
L’évolution de l’activité ovulatoire cyclique au cours d’une alternance de trois mois de JL et trois mois de JC a aussi été caractérisée chez la brebis Ile-de-France (Thimonier, 1989). Les brebis montrent deux périodes d’activité et deux périodes d’inactivité ovulatoire par an, avec toutefois des périodes d’inactivité plus courtes comparées aux caprins. À ce jour, l’utilisation de cette stratégie n’a pas encore été envisagée en élevage ovin.
Figure 4. Traitements lumineux proposés en élevage caprin pour une reproduction par effet mâle en saison sexuelle (d’après Fatet et Tuauden, 2013 - FLOCK-REPROD ). Ils sont basés sur une alternance en continue de cycles de 3 mois de jours longs (JL) artificiels (16 h de lumière et 8 h d’obscurité) et 3 mois de jours courts (naturels (JN) ou mimés avec de la mélatonine, selon le moment de l’année). Ce protocole permet deux périodes de mise à la reproduction par effet bouc à 6 mois d’intervalle.
2.3. Recherche de traitements lumineux alternatifs à la mélatonine pour une reproduction en toute saison sans hormones
a. Une alternance de « jours longs » et de « lumière continue » stimule l’activité sexuelle des mâles et des femelles hors saison sexuelle (mais sa mise en œuvre en élevage n’est pas autorisée par la réglementation européenne)
La mélatonine est sécrétée pendant la nuit par la glande pinéale (sa sécrétion est inhibée par la lumière). Il s’agit du signal hormonal utilisé par l’animal pour mesurer la durée du jour. Chez la brebis, l’absence de mélatonine circulante en continu (24 h/24 h) suite à une pinéalectomie (ablation de la glande pinéale) pendant l’été (en JL) se traduit, paradoxalement, par une stimulation de l’activité sexuelle similaire à celle observée après traitement avec de la mélatonine (Wayne et al., 1990). L’absence de mélatonine circulante peut être reproduite sur animaux non pinéalectomisés en les éclairant en continu 24 h/24 h.
Un traitement lumineux basé sur une alternance de JL et de lumière continue se traduit par une stimulation de l’activité sexuelle à contre-saison chez les ovins et les caprins mâles (Delgadillo et al., 2016, Chesneau et al., 2017) et femelles (figure 5). Toutefois, cette pratique pourrait s’accompagner de perturbations des rythmes biologiques de différentes fonctions (i.e. la fonction immunitaire, Campo et al., 2007). Les normes minimales de protection des animaux en élevage n’autorisent pas l’éclairement en continu des animaux (Directive communautaire 95/58/CE).
Figure 5. Pourcentage de brebis (A, n = 12 par groupe) et de chèvres (B, n = 6 par groupe) cycliques (déterminé grâce à l’analyse des concentrations plasmatiques de progestérone 2 fois par semaine) en jours naturels (JN), lors d’une alternance de JL (16 h de lumière/24 h) et de JC (8 h de lumière/24 h) ou de lumière continue 24 h/24 h (Pellicer-Rubio et al., résultats non publiés).
b. Une alternance de « jours très longs » et de « jours longs printaniers » ne se traduit pas par une stimulation de l’activité sexuelle
Des études ont été conduites chez la chèvre Alpine afin d’évaluer si les JL printaniers (14 h ou 16 h de lumière/jour) peuvent agir comme des JC (stimulateurs de la reproduction) lorsqu’ils sont appliqués après des jours « très longs » de 18 h ou 20 h de lumière/jour. Il s’agirait d’une stratégie d’intérêt pour remplacer la mélatonine lors d’une mise à la reproduction en été, ou lors d’une alternance en continu de 3 mois de JL et 3 mois de JC. Toutefois, les résultats ont mis en évidence que la chèvre ne différencie pas correctement les photopériodes comprises entre 20 h et 14 h de lumière/jour. Les photopériodes supérieures à 14 h sont alors interprétées comme des JL inhibiteurs de la reproduction quel que soit la photopériode reçue par les animaux au préalable. Les traitements lumineux basés sur des jours « très longs » suivis par des JL printaniers ne constituent donc pas une alternative à la mélatonine chez les caprins (Ahmadpour et al., 2018b). Le recours aux jours très longs n’a pas été étudié chez les ovins dans le cadre du désaisonnement.
c. La réussite de l’effet mâle en été sans utilisation de mélatonine est possible grâce à l’induction préalable d’un état réfractaire à l’effet inhibiteur des jours longs
Lorsque le traitement de jours longs (inhibiteurs de la reproduction) est appliqué pendant une longue durée (au-delà de 150 jours environ chez les ovins, 210 jours chez la chèvre), l’activité sexuelle des animaux se voit réactivé, on parle alors de l’acquisition d’un état réfractaire aux jours longs (Malpaux et al., 1988 ; Ahmadpour et al., 2018b).
Cette stratégie a été étudiée chez la chèvre Alpine pour une mise à la reproduction en été. Il s’agit de soumettre les animaux (boucs et chèvres) à une alternance de 6 mois de jours longs (16 h de lumière/jour, à démarrer en hiver) et 6 mois de photopériode naturelle. Lors d’un effet bouc fin juillet, une bonne réponse œstrale et ovulatoire des chèvres a été obtenue, similaire de celle observé en appliquant le traitement classique utilisé en élevage (avec mélatonine). La stimulation des chèvres non traités (sous photopériode naturelle) s’est avéré significativement inférieure (tableau 3, Pellicer-Rubio et al., résultats non publiés). Des études complémentaires sont nécessaires pour ajuster le moment d’exposition des chèvres aux boucs selon la date de démarrage du traitement des jours longs.
Tableau 3. Réponse à l’effet bouc chez des chèvres devenues réfractaires aux jours longs.
Réponse à l’effet bouc |
JN (n = 9) |
JN puis mélatonine (n = 10) |
180 JL puis JN (n = 7) |
P |
|---|---|---|---|---|
Chèvres en chaleurs |
22 % a |
100 % b |
100 % b |
P < 0,05 |
Chèvres ovulant |
44 % a |
100 % b |
100 % ab |
P < 0,05 |
Chèvres avec cycle normal |
25 % a |
100 % b |
100 % b |
P < 0,05 |
Jour début 1ère phase lutéale |
5,5 ± 2,7 |
4,5 ± 1,0 |
4,0 ± 1,0 |
P < 0,05 |
Groupe JN : les chèvres et les boucs reçoivent les jours naturels.
Groupe JN puis mélatonine : traitement de référence utilisé en élevage (Groupe Reproduction Caprine, 2012b). Les chèvres et les boucs reçoivent les jours naturels, puis la mélatonine est administrée le 31 mai (MELOVINE par voie sous-cutanée : 1 implant par chèvre, 3 par bouc), 60 jours avant l’effet mâle.
Groupe 180 JL puis JN : les chèvres et les boucs reçoivent des jours longs (JL : 16 h de lumière/24 h) pendant 6 mois (du 2 janvier au 3 juillet), puis les jours naturels.
J0 : jour de l’introduction des boucs (30 juillet).
n : nombre de chèvres non cycliques avant exposition aux boucs. Valeurs exprimées en pourcentage (%) ou en Médiane ± IQ. P : probabilité après test exact de Fisher (variables binaires) ou ANOVA avec test par permutations (variables quantitatives). a versus b : différences significatives entre traitements avec p < 0,05 (ajustement de Bonferroni).
3. Comment pratiquer l’IA après effet mâle, et avec quels résultats ?
L’IA en élevage ne nécessite pas obligatoirement une synchronisation de l’œstrus et de l’ovulation car, grâce à la détection des chaleurs, il est possible d’identifier les femelles à inséminer et de déterminer le moment de l’insémination. Lorsque les femelles sont naturellement cycliques (saison sexuelle) et en absence de synchronisation des chaleurs, les inséminations doivent être réalisées sur plusieurs jours (sur une durée équivalente à la durée d’un cycle sexuel), au fur et à mesure que les femelles viennent en chaleurs. La pratique de l’IA sur chaleurs naturelles est habituelle chez les bovins (espèce à reproduction non saisonnée), notamment en troupeaux laitiers. Toutefois, il s’agit d’une solution qui ne s’est pas développée en élevages des petits ruminants, essentiellement en raison de contraintes associées à la saisonnalité de la reproduction, de difficultés liées à la conservation et au transport de la semence (notamment en filière ovine), et de particularités de conduite des troupeaux dans ces filières.
Chez les petits ruminants, ce sont les traitements hormonaux d’induction et synchronisation des chaleurs qui ont permis le développement de l’IA, avec l’avantage de pouvoir inséminer un lot de femelles à un moment prédéterminé, sans détection préalable de chaleurs, et ce quel que soit le moment de l’année, sur femelle cyclique et non cyclique (figure 6).
Figure 6. Représentation schématique des protocoles d’induction et synchronisation de l’œstrus et de l’ovulation utilisés en France chez les petits ruminants (eCG : gonadotrophine chorionique équine ; FGA : acétate de fluorogéstone) (d’après Fatet et al., 2008).

Les premiers essais d’IA après effet mâle ont été réalisés chez les ovins (Corke, 1982) et les caprins (Restall, 1988 ; Moore et Hall, 1991) sur la base d’une détection des chaleurs préalable à l’IA. Les ovulations fertiles induites et synchronisées par effet mâle s’étalent sur une ou deux semaines. De ce fait, un seul moment d’IA ne suffit pas pour féconder l’ensemble des femelles stimulées. La détection des chaleurs constitue donc un passage obligé, afin de déterminer à quel moment et quelles femelles inséminer.
Chez les caprins, le premier protocole d’IA sans hormones qui a été proposé en France consiste à réaliser une détection des chaleurs (grâce à l’utilisation de males munis de harnais marqueurs) deux fois par jour à partir du jour 5 après l’introduction des boucs et jusqu’au jour 9. Les chèvres sont inséminées au fur et à mesure qu’elles viennent en chaleurs, environ 12 h après avoir été détectées (figure 7 et tableau 4 : protocole A) (Groupe Reproduction Caprine, 2014b ; Pellicer-Rubio et al., 2016). Ce protocole peut mettre en œuvre jusqu’à neuf moments d’IA à 12 h d’intervalle sur cinq jours consécutifs, pour inséminer la totalité des chèvres stimulées.
De nouveaux protocoles d’IA après effet mâle (présentés dans les sections suivantes) ont été étudiés chez les caprins, dans l’objectif de réduire le nombre d’inséminations nécessaires pour féconder un maximum des femelles stimulées. La complexité de la réponse à l’effet mâle et la variabilité observée en élevage ont conduit, tout d’abord, à l’étude de protocoles limitant, sans exclure complètement, le recours aux hormones. Ils proposent des stratégies basées sur l’association de l’effet bouc avec des progestagènes et/ou des prostaglandines pour s’affranchir de la problématique des cycles courts, afin de pratiquer une seule IA à un moment prédéterminé (figure 7 et tableau 4 : protocoles B, C et D). Ces protocoles utilisent certes des hormones, mais ils ont l’avantage d’exclure l’eCG, une hormone d’origine animale. Quant aux protocoles basés sur l’effet bouc seul (sans hormone), trois stratégies ont été développés. Deux protocoles proposent deux moments d’IA prédéterminés, avec ou sans détection des chaleurs préalable (figure 7 et tableau 4 : protocoles E et F). Le dernier protocole fait appel à la détection des chaleurs dans l’objectif de réaliser une IA unique à un moment non prédéterminé (figure 7 et tableau 4 : protocole G, tableau 4).
Le succès de la pratique de l’IA après effet bouc repose sur une bonne stimulation de l’activité œstrale et ovulatoire des chèvres qui se trouvent au repos sexuel. C’est grâce aux traitements lumineux qu’il sera possible de stimuler l’activité sexuelle des boucs et de maîtriser l’état de cyclicité des chèvres ainsi que leur réceptivité pour réussir l’effet bouc. Tous les protocoles qui sont décrits ci-dessous requièrent donc l’association des traitements lumineux évoqués dans la section 2 de cet article. Le choix du traitement lumineux dépendra du moment de l’année souhaité par l’éleveur pour la reproduction du troupeau. Tous ces protocoles exigent une grande rigueur dans leur application et le respect de l’ensemble des recommandations concernant la préparation des mâles et le choix des femelles pour l’IA (Groupe Reproduction Caprine, 2013, 2014a).
Figure 7. Protocoles d’IA après effet mâle étudiés chez les caprins.

3.1. L’IA après « effet bouc » en associant des progestatifs et des prostaglandines
Ce protocole (sous la marque IMA-PRO , López-Sebastian et al., 2007 ; figure 7B), consiste à injecter une dose intramusculaire (i.m.) unique de 25 mg de progestérone le jour de l’introduction des boucs (J0), suivi par l’injection i.m. d’une dose unique de 75 μg de cloprosténol (un analogue de synthèse de la PGF2α) le neuvième jour d’exposition aux boucs. Une seule IA est faite 50 h après l’injection de cloprosténol sur l’ensemble du lot de chèvres sans détection des chaleurs préalable. Il s’agit d’un protocole validé en élevage chez la chèvre Murciano-Granadina. Les résultats de fertilité obtenus par IA intra-cervicale avec de la semence réfrigérée sont très satisfaisants (65 % de mises bas) et supérieurs de ceux obtenus après le traitement hormonal classique (47 %), (tableau 4, protocole B).
Cette stratégie a été étudiée chez les ovins dans le cadre d’une lutte naturelle hors saison sexuelle. L’association de l’effet bélier à des prostaglandines et à des progestatifs améliore la fertilité comparée à celle obtenue après effet bélier seul. Les meilleurs résultats de fertilité ont été obtenus chez les brebis recevant une injection de 25 mg de progestérone le jour de l’introduction des béliers (comparées à des brebis non traitées), suivie par une injection de 100 μg de cloprosténol le jour 16 (comparées à des brebis traitées le jour 12 ou 14). Le taux de gestation obtenu était d’environ 70 % au premier service lors d’une lutte naturelle pendant 3 jours après l’injection de cloprosténol (López-Sebastian et Inskeep, 1988). Ces résultats prouvent que cette stratégie pourrait être associée à l’IA avec succès chez les ovins.
3.2. L’IA après « effet bouc » chez des chèvres prétraitées avec des progestatifs
Ce protocole (figure 7C) consiste à prétraiter les chèvres avec des progestatifs pendant 11 jours à l’aide de dispositifs vaginaux qui libèrent en continu soit des progestagènes (éponges vaginales imprégnées d’acétate de fluorogéstone, FGA), soit de la progestérone (dispositifs vaginaux, CIDR ). L’introduction des boucs (J0) a lieu le jour du retrait du dispositif vaginal, puis l’IA est réalisée 52 h après sur l’ensemble du lot de chèvres sans détection des chaleurs préalable (Pellicer-Rubio et al., 2008). Ce protocole a été validé en élevages Alpin et Saanen. Les résultats de fertilité par IA intra-cervicale avec de la semence congelée étaient très satisfaisants (71 % de mises bas) et similaires à ceux obtenus après traitement hormonal classique (72 %) (tableau 4, protocole C).
Cette stratégie est intéressante pour l’IA chez les ovins, car la première ovulation fertile aurait lieu sur l’ensemble du lot dans les trois jours après l’introduction des béliers (Cognie et al., 1982), ce qui permettrait de réduire à un seul le nombre de moments d’insémination.
3.3. L’IA après « effet bouc » en associant des prostaglandines
Ce protocole, sous la marque communautaire FLOCK-REPROD (Fatet et Tuauden, 2013 ; López-Sebastian et al., 2014 ; Bruni et al., 2016 ; figure 7D), comporte une injection i.m. unique de 75 μg de cloprosténol 17 jours après l’introduction des boucs (J0). Une seule IA a lieu 70 h après l’injection de cloprosténol sur l’ensemble du lot de chèvres, sans détection des chaleurs préalable. Il a été testé dans 33 élevages caprins de 7 pays européens (Italie, Croatie, France, Grèce Portugal, Roumanie et Espagne), chez les races alpine, saanen, Murciano-Granadina, Malagueña, Serrana, Capra prisca, Damascus et Carpathian. La fertilité obtenue par IA intra-cervicale avec de la semence réfrigérée ou congelée reste acceptable (taux de gestation de 45 %). Toutefois cette fertilité est 10 à 30 % (selon les élevages) inférieure à celle obtenue après IA des chèvres ayant reçu le traitement hormonal classique (63 % en moyenne) (tableau 4, protocole D).
En races alpine et saanen, une proportion importante des chèvres développe une phase lutéale courte (cycle court) après l’injection de prostaglandines, lorsqu’elle a lieu 17 jours après l’exposition aux boucs. Ceci pourrait expliquer la faible fertilité observée après IA dans ces races (Boissard et al., résultats non publiés). En revanche, chez les ovins il est possible d’obtenir une bonne fertilité en lutte naturelle dans les 3 jours après l’injection de prostaglandines, lorsque celle-ci a lieu 14 ou 16 jours après l’exposition aux béliers (López-Sebastian et Inskeep, 1988). Ces résultats incitent à penser que cette stratégie serait intéressante pour l’IA ovine à contre-saison.
À ce jour, chez les ovins, l’association de l’effet mâle et des prostaglandines dans le cadre de l’IA a seulement été étudiée chez des brebis cycliques en régions tropicales (Contreras-Solís et al., 2009). Le protocole consiste à traiter les brebis avec deux injections de prostaglandines à 7 jours d’intervalle, les béliers étant introduits avec les femelles le jour de la deuxième injection. Le taux de gestation a été de l’ordre de 60 % après IA intra vaginale 48 h après l’introduction des béliers.
3.4. L’IA après « effet bouc » seul (sans hormones)
Chez les caprins, une bonne maîtrise du traitement photopériodique combiné à l’effet mâle permet de grouper les chaleurs fertiles à partir du sixième jour d’exposition aux boucs et jusqu’au neuvième jour (Pellicer-Rubio et al., 2016). Les inséminations doivent avoir lieu sur ces chaleurs fertiles (figure 8).
Figure 8. Réponse œstrale et ovulatoire à l’effet bouc des chèvres qui développent une 1ère phase lutéale courte (cycle court, non fertile) suivi d’une phase lutéale normale (cycle normal, fertile) : il s’agit de la réponse la plus fréquente chez les caprins (d’après Pellicer-Rubio et al., 2016).

a. L’IA à des moments prédéterminés
Deux moments d’IA ont été fixés le jour 7 et le jour 8 après l’introduction des boucs. Deux protocoles d’IA ont été étudiés.
Le premier protocole (figure 7E) nécessite une détection des chaleurs à partir de J5 et jusqu’à J8. La détection des chaleurs a lieu deux fois par jour, le matin et le soir, grâce à l’utilisation de boucs munis d’un tablier marqueur. Seules les chèvres en chaleur sont inséminées et une seule fois. À J7 sont inséminées les chèvres venant en chaleur entre J5 et J7. À J8 sont inséminées les chèvres venant en chaleur dès J7 et jusqu’à J8.
Le deuxième protocole (figure 7F) consiste à inséminer deux fois toutes les chèvres mises à la reproduction (en chaleurs ou non). Une première IA aura lieu à J7 et une deuxième à J8, sans détection des chaleurs préalable.
Ces deux protocoles ont été validés en élevages de races alpine et saanen (Pellicer-Rubio et al., 2016), avec des résultats de fertilité par IA intra-cervicale avec de la semence congelée très satisfaisants (61 et 58 % de mises bas avec les protocoles E et F, respectivement) et similaires à ceux obtenus après traitement hormonal classique (65 %) (tableau 4 : protocoles E et F).
b. L’IA à un moment non prédéterminé
Ce protocole (sous la marque communautaire FLOCK-REPROD , figure 7G) consiste à réaliser une seule insémination et au même moment chez un groupe de chèvres détectées en chaleur (marquées par le bouc) à partir de J5. La détection des chaleurs a lieu 2 fois par jour, le matin et le soir, et jusqu’à J8 au soir au plus tard. Le jour de l’IA (non prédéterminé à l’avance) se situe entre J5 et J10, et est déterminé à partir du moment où le seuil de 40-50 % de chèvres en chaleur est atteint (détection dite « positive » : Jour « X »). L’IA est ensuite programmée 24 h après la détection « positive » et toutes les chèvres marquées jusqu’au moment de l’IA sont inséminées.
Ce protocole a été évalué dans 21 élevages caprins de 5 pays européens (France, Italie, Espagne, Grèce et Roumanie) chez les races Alpine, Saanen, Murciano-Granadina, Capra prisca, Damascus et Carpathian (Bruni et al., 2016). La fertilité obtenue par IA intra-cervicale avec de la semence réfrigérée ou congelée est satisfaisante (taux de gestation de 58 %), et similaire à celle obtenue chez des chèvres ayant reçu le traitement hormonal classique (60 %) (tableau 4 : protocole G). Lors d’une stimulation par effet bouc efficace, plus de 50 % des chèvres pourront être inséminées au même moment.
Chez la brebis, les venues en chaleurs s’étalent sur 2 à 3 semaines et surviennent en deux vagues autour des 19ème et 25ème jours après l’introduction des béliers. L’IA sans hormones nécessite obligatoirement une détection préalable des chaleurs pour savoir à quel moment et quelles femelles inséminer. Des outils d’aide à la détection des chaleurs seraient un atout pour l’IA sans hormone, notamment en filière ovine. Le détecteur de chevauchements Alpha® (Wallace Group) qui est porté par un « bélier détecteur » permet d’automatiser la détection des brebis venant en chaleurs (Alhamada et al., 2016). Des études menées sur des brebis de races Lacaune (laitière) et Mérinos (allaitante) ont notamment permis de réaliser des IA sur chaleurs naturelles à contre-saison après effet mâle. Les résultats de fertilité (taux d’agnelage) obtenus ont été compris entre 50 et 75 % selon la race et le lot d’IA, avec de la semence réfrigérée. Les meilleurs résultats de fertilité sont observés lorsque les brebis sont inséminées entre 0 et 35 h après la détection des chaleurs (Maton et al., 2014 ; Debus et al., 2016 ; Fréret et al., 2018). Ces travaux sont poursuivis actuellement, notamment pour ajuster le moment d’IA par rapport au moment de la détection des chaleurs, et tester la possibilité d'inséminer les brebis avec de la semence congelée.
Des travaux sur la détection automatisée des chaleurs sont également menés chez les caprins. Les colliers-activimètres Heatime® (SCR Engineers Ltd.), portés par les chèvres, permettent de détecter un pic d’activité au moment des chaleurs induites par traitement hormonal (Fréret et al., 2015). Ils sont actuellement testés en race alpine dans le cadre de protocoles d’IA après effet mâle en contre-saison.
Tableau 4. Protocoles d’IA après effet mâle étudiés chez les caprins (n : nombre de chèvres. ND : non disponible, TH : Traitement Hormonal).
EFFET BOUC |
TH |
RACES |
SOURCE |
|||||
|---|---|---|---|---|---|---|---|---|
Protocole |
Détection |
Nombre |
Nombre de |
Type de |
% gestation |
% gestation |
||
A |
OUI |
1 |
5 |
fraîche, non diluée |
82 % |
ND |
Chèvre |
Restall, 1988 |
OUI |
1 |
* Max. 9 |
congelée |
56 % |
60 % |
Cachemire |
Moore et Hall, 1991 |
|
OUI |
1 |
* 2 à 6 |
congelée |
49 % |
ND |
Alpine |
Pellicer-Rubio |
|
B |
NON |
1 |
1 |
réfrigérée |
65 % |
47 % |
Murciano- |
López-Sebastian |
C |
NON |
1 |
1 |
congelée |
71 % |
72 % |
Alpine |
Pellicer-Rubio |
D |
NON |
1 |
1 |
réfrigérée ou |
45 % |
63 % |
Alpine |
López-Sebastian |
E |
OUI |
1 |
2 |
congelée |
61 % |
65 % |
Alpine |
Pellicer-Rubio |
NON |
2 |
2 |
congelée |
58 % |
||||
G |
OUI |
1 |
1 |
réfrigérée ou |
58 % |
60 % |
Alpine |
López-Sebastian |
*Variable selon l’élevage
PELLICER-RUBIO M.-T., BOISSARD K., GRIZEL J., VINCE S., FRÉRET S., FATET A., LÓPEZ-SEBASTIAN A., 2019. Vers une maîtrise de la reproduction sans hormones chez les petits ruminants. INRA Prod. Anim., 32
Conclusion
La saisonnalité de la reproduction est une contrainte majeure dans les filières ovines et caprines. L’effet mâle est une pratique d’élevage d’un grand intérêt pour limiter l’utilisation d’hormones lors d’une reproduction hors saison sexuelle, et notamment pour la mise en œuvre de l’IA chez les petits ruminants. La réussite de l’effet mâle repose sur une bonne maîtrise de la saisonnalité de l’activité sexuelle des mâles et des femelles. C’est grâce aux traitements photopériodiques que nous pourrons stimuler l’activité sexuelle des mâles et maîtriser l’état de cyclicité ainsi que la réceptivité des femelles, pour que la réponse à l’effet mâle soit efficace.
Les dernières avancées sur les traitements lumineux permettent aujourd’hui la mise en œuvre de l’effet mâle sur femelle non cyclique en toute saison, pour une reproduction en lutte naturelle, en monte en main ou par IA. Certains de ces traitements lumineux nécessitent l’utilisation de mélatonine à certaines périodes de l’année (notamment pour une reproduction en période estivale). Un nouveau traitement lumineux basé sur l’induction d’un état réfractaire aux jours longs apparaît comme une alternative à l’utilisation de mélatonine pour une reproduction en été.
Des protocoles d’IA après effet mâle ont été développés chez les caprins. Parmi eux, certains proposent des stratégies basées sur l’association de l’effet bouc avec des progestatifs et/ou des prostaglandines, et permettent de pratiquer une seule IA à un moment prédéterminé. Ces protocoles mériteraient d’être adaptés à l’espèce ovine.
Des protocoles d’IA après effet bouc seul (sans hormones) sont également disponibles. Ils comportent un ou deux moments d’IA, avec ou sans détection des chaleurs préalable. Chez les ovins, la détection des chaleurs est obligatoire pour la pratique de l’IA après un effet bélier seul. Dans les deux espèces, le développement de la détection automatisée des chaleurs facilitera le déploiement des protocoles d’IA sans utilisation d’hormones (Fréret et al., 2018).
Néanmoins, la variabilité de la réponse à l’effet mâle en élevage reste un frein à la généralisation de cette pratique. L’identification des molécules olfactives émises par le mâle et qui sont responsables de la stimulation de l’activité sexuelle des femelles (Lurette et al., 2016), la caractérisation de biomarqueurs de la réceptivité de la femelle aux signaux stimulateurs du mâle, le développement de stratégies nutritionnelles pouvant améliorer la croissance et maturation des follicules ovariens (Fréret et al., 2013) et/ou le recours à des plantes contenant des principes actifs pouvant moduler la fonction de reproduction, par exemple, offrent de perspectives de recherche d’intérêt pour améliorer, standardiser et faciliter la mise en œuvre de l’effet mâle. Ces avancées vers la maîtrise de la reproduction sans hormones seront profitables en élevages conventionnels et biologiques, et contribueront à la gestion durable de l’agriculture.
Remerciements
Les recherches chez les caprins menant au développement des traitements lumineux sans mélatonine et des protocoles d’IA sous la marque communautaire FLOCK-REPROD ont été cofinancées par l’Union Européenne (FP7 - Grant agreement n° 243520) et par la région Centre-Val de Loire (APR IR 2016, projet MALEFIC). Un grand merci aux consortiums de ces deux projets.
Notes
- Cet article a fait l’objet d’une présentation aux 24èmes Journées Rencontres Recherches Ruminants (Pellicer-Rubio et al., 2018).
Références
- Abecia J.A., Chemineau P., Flores J.A., Keller M., Duarte G., Forcada F., Delgadillo J.A., 2015. Continuous exposure to sexually active rams extends estrous activity in ewes in spring. Theriogenology, 84, 1549-1555.
- Abecia J.A., Chemineau P., Gómez A., Keller M., Forcada F., Delgadillo J.A., 2016. Presence of photoperiod-melatonin-induced sexually activated rams in spring advances puberty in autumn-born ewe lambs. Anim. Reprod. Sci., 170, 114-120.
- Adib A., Fréret S., Touze J.L., Lomet D., Lardic L., Chesneau D., Estienne A., Papillier P., Monniaux D., Pellicer-Rubio M.T., 2014. Progesterone improves the maturation of male-induced preovulatory follicles in anoestrous ewes. Reprod., 148, 403-416.
- Ahmadpour D., Lainé A.L., Fréret S., Pellicer-Rubio M.T., 2018a. Nouveau traitement photopériodique pour synchroniser les ovulations par efffet mâle en, saison sexuelle sans utilisation d’hormones. Renc. Rech. Rum., 24, Session Réduction des intrants chimiques en élevage. http://www.journees3r.fr/.
- Ahmadpour D., Lainé A.L., Fréret S., Pellicer-Rubio M.T., 2018b. Les traitements lumineux basés sur des jours « très longs » sont-ils une alternative à l’utilisation de mélatonine chez la chèvre ? Renc. Rech. Rum., 24, Session Réduction des intrants chimiques en élevage. http://www.journees3r.fr/.
- Alhamada M., Debus N., Lurette A., Bocquier F., 2016. Validation of automated electronic oestrus detection in sheep as an alternative to visual observation. Small Rum. Res., 134, 97-104.
- Atkinson S., Williamson P., 1985. Ram-induced growth of ovarian follicles and gonadotrophin inhibition in anoestrous ewes. J. Reprod. Fertil., 73, 185-189.
- Bartlewski P.M., Beard A.P., Cook S.J., Rawlings N.C., 1998. Ovarian follicular dynamics during anoestrus in ewes. J. Reprod. Fertil., 113, 275-285.
- Bedos M., Portillo W., Dubois J.P., Duarte G., Flores J.A., Chemineaua P., Keller M., Paredes R.G., Delgadillo J.A., 2016. A hight level of male sexual activity is necessary for the activation of the medial preoptic area and the arcuate nucleus during the ‘male effect’ in anoestrus goats. Physiol. Behav., 165, 173-178.
- Boissard K., Forgerit Y., Bruneteau E., Borderes F., Weyers E., Pougnard J.L., Fatet A., Pellicer-Rubio M.T., 2018. Synchroniser les ovulations en saison sexuelle grâce à un nouveau traitement photopériodique combiné à l’effet mâle chez les caprins. Renc. Rech. Rum., 24, Session Réduction des intrants chimiques en élevage. http://www.journees3r.fr/.
- Bruni G., Grizelj J., Vince S., Boué P., Tuauden M., Johnson L., Boissard K., Fréret S., Fatet A., Melpomeni A., Marantidis A., Zanatta G., Floris B., Branca A., Epifani G.P., Villa M., Pereira F., Pintor F., Cavaco-Gonçalves S., Barbas J.,P., Baptista M., Mascarenhas R., Zamfirescu S., Sogorescu E., Hortase A., Anghelescu C., Durbalau D., López-Sebastián A., Coloma M.A., Santiago J., Toledano A., Carrizosa J.A., Urrutia B., Castillo J., Pellicer M.T., 2016. Large-scale technical and economical validation of the FLOCK-REPROD AI protocols. In: Sustainable Goat Breeding and Goat Farming in the Central and Eastern European Countries. Kukovics S. (Ed). Eur. Reg. Conf. Goats, Devrezen, Hungary, 271-275.
- Caillat H., Bouvier F., Pellicer M.T., Leboeuf B., Baril, G., Malpaux B., Bodin L., 2011. Étude de la saisonnalité de chèvres de race Alpine et Créole maintenues hors reproduction. Renc. Rech. Rum., 18, 418.
- Campo J.L., Gil M.G., Da Silva S.G., Muñoz I., 2007. Effect of lighting stress on fluctuating asymmetry, heterophil- to lymphocyte ratio, and tonic immobility duration in eleven breeds of Chikens. Poult. Sci., 86, 37-45.
- Chanvallon A., Sagot L., Pottier E., Debus N., François D., Fassier T., Scaramuzzi R.J., Fabre-Nys C., 2011. New insights into the influence of breed and time of the year on the response of ewes to the ‘ram effect’. Animal, 5, 1594-1604.
- Chasles M., Chesneau D., Moussu C., Delgadillo J.A., Chemineau P., Keller M., 2016. Sexual active bucks are efficient to stimulate female ovulatory activity during the anestrous season also under temperate latitudes. Anim. Reprod. Sci., 168, 86-91.
- Chasles M., Chesneau D., Moussu C., Delgadillo J.A., Chemineau P., Keller M., 2017. Advancement of puberty in autumn-born goat kids by exposure to sexually active bucks. Reprod. Domest. Anim., 52 S3, 58.
- Chemineau P., 1983. Effect on oestrus and ovulation of exposing Creaole goats to the male at three times of the year. J. Reprod. Fertil., 67, 65-72.
- Chemineau P., 1985. Effects of a progestagen on buck-induced short ovarian cycles in the Creole meat goat. Anim. Reprod. Sci., 9, 87-94.
- Chemineau P., 1989. L’effet bouc: mode d’action et efficacité pour stimuler la reproduction des chèvres en anoestrus. INRA Prod. Anim., 2, 97-104.
- Chemineau P., Poulin N., Cognié Y., 1984. Sécrétion de progestérone au cours du cycle induit par in’introduction du mâle chez la chèvre créole en anoestrus: effet de la saison. Reprod. Nutr. Dev., 24, 557-561.
- Chemineau P., Normant E., Ravault J.P., Thimonier J., 1986. Induction and persistence of pituitary and ovarian activity in the out-of-season lactating goats after a treatment combining a skeleton photoperiod, melatonin nad the male effect. J. Reprod. Fertil., 78, 497-504.
- Chemineau P., Malpaux B., Pelletier J., Leboeuf B., Delgadillo J.A., Deletang F., Pobel T., Brice G., 1996. Emploi des implants de mélatonine et des traitements photopériodiques pour maîtriser la reproduction saisonnière chez les ovins et les caprins. In : Numéro spécial, Photopériode et reproduction. INRA Prod. Anim., 9, 45-60.
- Chemineau P., Pellicer-Rubio M.T., Lassoued N., Khaldi G., Monniaux D., 2006. Male-induced short oestrus and ovarian cycles in sheep and goats: a working hypothesis. Reprod. Nutr. Dev. 46, 417-429.
- Chesneau D., Guillaume D., Chemineau P., Malpaux B., 2017. Continuous light after 2 month of long days stimulates ram testis volume and increases fertility in spring. Animal, 11, 1189-1195.
- CIIRPO, 2015. Des agnelles de renouvellement fertiles dès la première mise en lutte naturelle. Fiches techniques , CIIRPO - Institut de l’élevage – Inn’ovin, 2p.
- Claus R., Over R., Dehnhard M., 1990. Effect of male odour on LH secretion and the induction of ovulation in seasonally anoestrous goats. Anim. Reprod. Sci., 22, 27-38.
- Cohen-Tannoudji J., Signoret J.P., 1987. Effect of short exposure to the ram on later reactivity of anoestrous ewes to the male effect. Anim. Reprod. Sci., 13, 263-268.
- Contreras-Solís I., VasquezB., Diaz T., Letelier C., López-Sebastian A., Gonzalez-Bulnes A., 2009. Efficiency of estrus synchronization in tropical sheep by combining short-interval cloprostenol-based protocols and male effect. Theriogenology, 71, 1018-1025.
- Cognie Y., Gray S.J., Lindsay D.R., Oldham C.M., Pearce D.T., Signoret J.P., 1982. A new approach to controlled breeding in sheep using the ‘ram effect’. Proc. Aust. Soc. Anim. Prod., 14, 519-522.
- Corke D.G., 1982. Use of teasing in an A.I. programme. Proc. Aust. Soc. Anim. Prod., 13, 81-82.
- De Bond J.A., Li Q.,Millar R.P., Clardke I.J., Smth J.T., 2013. Kisspeptin signaling is required for the luteinizing hormone response in anoestrus ewes following the inrtpductin of males. Plos one, 8, e57972.
- De Santiago-Miramontes M.A., Rivas-Muñoz R., Muñoz-Gutierrez M., Malpaux B., Scaramuzzi R.J., Delgadillo J.A., 2008. The ovulation rate in anoestrous female goats managed under grazing conditions and exposed to the male effect is increased by nutrional supplementation. Anim. Reprod. Sci., 105, 409-416.
- Debus N., Maton C., Lurette A., Guyonneau J-D., Viudes G., Tesniere A., Alhamada M., Menassol J.B., Bocquier F., 2016. Artificial insemination of ewes grouped by a ram effect is feasible with the use of automated oestrus detector. In: Proc. Workshop “The male effect yesterday, today and tomorrow”, Nouzilly, France, 8.
- Delgadillo J.A., Ungerfeld R., Flores J.A., Hernandez H., Fitz-Rodriguez G., 2011. The ovulatory response of anoestrous goats exposed to the male effect in the subtropics is unrelated to their follicular diameter at male exposure. Reprod. Domest. Anim., 46, 687-691.
- Delgadillo J.A., Vélez L.I., Flores J.A., 2016. Continuous light after a long-day treatment is equivalent to melatonin implants to stimulate testosterone secretion in Alpine male goats. Animal, 10, 649-654.
- Fabre-Nys C., Kendridck K.M., Scaramyzzi R.J., 2015a. The “ram efect”: new insights into neural modulation of the gonadotropic axisby male odors and socio-sexual interactions. Front. Neurosci., 9, 111, 1-16.
- Fabre-Nys C., Chanvallon A., Debus N., François D., Bouvier F., Dupont J., Lardic L., Lomet D., Ramé C., Scaramuzzi R.J., 2015b. Plasma and ovarian oestradiol and the variability in the LH surge induced in ewes by the ram effect. Reprod., 149, 511-521.
- Fabre-Nys C., Chanvallon A., Dupont J., Lardic L., Lomet D., Martinet S., Scaramuzzi R.J., 2016. The “ram effect”: A “non-classical” mechanism for inducing LH surges in sheep. Plos one, 11, 1-22.
- Fatet A., Leboeuf B., Fréret S., Druart X., Bodin L., Caillat H., David I., Palhière I., Boué P., Lagriffoul G., 2008. L’insémination dans les filières ovines et caprines. Renc. Rech. Rum., 15, 355-358.
- Fatet A., Tuauden M., 2013. Reproduction des chèvres en toute saison: FLOCK-REPROD, une solution durable. Guide pratique FLOCK-REPROD, version française, 22p.
- Fitz-Rodríguez G., De Santiago-Miramontes M.A., Scaramuzzi R.J., Malpaux B., Delgadillo J.A., 2009. Nutritional supplementation improves ovulation and pregnancy rates in female goats managed under natural grazing conditions and exposed to the male effect. Anim. Reprod. Sci., 116, 85-94.
- Flores J.A., Véliz F.G., Pérez-Villanueva J.A., Martínez De La Escalera G., Chemineau P., Poindron P., Malpaux B., Delgadillo J.A., 2000. Malereproductive condition is the limiting factor of efficiency in the maleeffect during seasonal anestrus in female goats. Biol. Reprod., 62, 1409-1414.
- Fréret S., Fassier T., Bouvier F., Caillat H., Pellicer-Rubio M.T., 2013. Effet d’une supplémentation énergétique sur la réponse de chèvres alpines à l’effet mâle. Renc. Rech. Rum., 20, 363-366.
- Fréret S., Talbot J., Fatet A., Boissard K., Ranger B., Bruneteau E., Boisseau C., Laine A.L., Borderes F., Desmarchais A., Caillat H., Dewez J., Johnson L., Pellicer-Rubio M.T., 2015. Evaluation d’un collier accéléromètre pour la détection automatisée des chaleurs induites par traitement hormonal chez des chèvres Alpines désaisonnées et en bâtiment. Renc. Rech. Rum., 22, 207-210.
- Fréret S., Fatet A., Debus N., Pellicer-Rubio M.T., 2018. L’effet mâle, une méthode alternative pour la synchronisation en vue de l’insémination des petit ruminants. Bull. GTV, 90, 25-32.
- Gaunand A., Chemineau P., Dufourny L., Fatet A., Pellicer Rubio M., Vignon X., 2014. Control of animal reproduction in small ruminants: seasonality - photoperiod. In: Analyse Socio‐économique des Impacts de la Recherche Publique Agronomique (ASIRPA). Département PHASE, INRA, Paris, France, 15p.
- González-Bulnes A., Carrizosa J.A., Urrutia B., López-Sebastian A., 2006. Oestrous behaviour and development of preovulatory follicles in goats induced to ovulate using the male effect with and without progesterone priming. Reprod. Fertil. Dev., 18, 745-50.
- Groupe Reproduction Caprine, 2012a. Physiologie de la reproduction caprine. Institut de l’élevage, Collection l’Essentiel, Réf n° 0012 38 029, 8p.
- Groupe Reproduction Caprine, 2012b. Les traitements photopériodiques et la reproduction caprine. Institut de l’élevage, Collection l’Essentiel, Réf n° 0012 38 080, 6p.
- Groupe Reproduction Caprine, 2013. Le choix des chèvres et l’organisation du chantier d’IA. Institut de l’élevage, Collection l’Essentiel, Réf n°0013 31 019, 4p.
- Groupe Reproduction Caprine, 2014a. L’effet mâle. Institut de l’élevage, Collection l’Essentiel, Réf n°0014 302 042, 6p.
- Groupe Reproduction Caprine, 2014b. L’insémination sans hormones. Institut de l’élevage, Collection l’Essentiel, Réf n°0014302043, 3p.
- Idele, CNE, 2017. Chiffres clés du GEB. Caprins 2017 Productions lait et viande. Institut de l’Élevage et Confédération Nationale de l’Élevage (CR n°0017 501 038), 10p.
- López-Sebastian A., Inskeep E.K., 1988. Effects of progesterone pretreatment and duration of ram exposure on synchronization of estrus, conception and preghancy by prostaglandin during seasonal anestrus. Anim. Reprod. Sci., 17, 185-195.
- López-Sebastian A., González-Bulnes A., Carrizosa J.A., Urrutia B., Díaz-Delfa C., Santiago-Moreno J., Gómez-Brunet A., 2007. New estrus synchonization and artificial insemination protocol for goats based on male exposure, progesterone and cloprostenol during the non-breeding season. Theriogenology, 68, 1081-1087.
- López-Sebastian A., Coloma M.A., Toledano A., Santiago-Moreno J., 2014. Hormone-free protocols for the control of reproduction and artificial insemination in goats. Reprod. Domest. Anim., 49, 22-29.
- Loywyck V., Lagriffoul G., 2017. Compte-rendu annuel sur l’insémination artificielle ovine – campagne 2016. Institut de l’Élevage Collection Résultats (CR n°0017 200 015), 32p.
- Lurette A., Fréret S., Chanvallon A., Experton C., Frappat B., Gatien J., Dartois S., Martineau C., Le Danvic C., Ribaud D., Fatet A., Pellicer-Rubio M.T., 2016. La gestion de la reproduction en élevages ovins et caprins, conventionnels et biologiques : états des lieux, intérêt et acceptabilité de nouveaux outils dans six bassins de production en France. INRA Prod. Anim., 29, 163-184.
- Malpaux B., Moenter S.M., Wayne N.L., Woodfill C.J.I., Karsch F.J., 1988. Reproductive refractoriness of the ewe to inhibitory photoperiod is not caused by alteration of the circadian secrerion of melatonin. Neuroendocrinol., 48, 264-270.
- Martin G.B., Oldham C.M., Lindsay D.R., 1980. Increased plasma LH levels in seasonally anovular Merino ewes following the introduction of rams. Anim. Reprod. Sci., 3, 125-132.
- Maton C., Debus N., Lurette A., Guyonneau J.D., Viudes G., Tesniere A., Bocquier F., 2014. Insémination animale sans hormone après détection automatisée des chevauchements chez la brebis. Renc. Rech. Rum., 21, 281-284.
- Moore R.W., Hall D.R.H., 1991. Artificial insemination using the buck effect to partially synchronise cashemire does. Proc. N.Z. Soc. Anim. Prod., 51, 143-146.
- Pellicer-Rubio M.T., Leboeuf B., Bernelas D., Forgerit Y., Pougnard J.L., Bonne J.L., Senty E., Chemineau P., 2007. Highly synchronous and fertile reproductive activity induced by the male effect during deep anoestrus in lactating goats subjected to treatment with artificially long days followed by a natural photoperiod. Anim. Reprod. Sci., 98, 241-258.
- Pellicer-Rubio M.T., Leboeuf B., Bernelas D., Forgerit Y., Pougnard J.L., Bonne J.L., Senty E., Breton S., Brun F., Chemineau P., 2008. High fertility using artificial insemination during deep anoestrus after induction and synchronisation of ovulatory activity by the “male effect” in lactating goats subjected to treatment with artificial longs days and progestagens. Anim. Reprod. Sci., 109, 172-188.
- Pellicer-Rubio M.T., Ferchaud S., Fréret S., Tournadre H., Fatet A., Boulot S., Pavie J., Leboeuf B., Bocquier F., 2009. Les méthodes de maîtrise de la reproduction disponibles chez les mammifères d’élevage et leur intérêt en agriculture biologique. In : Numéro spécial, Élevage bio. Guyomard H., Coudurier B., Herpin P. (Eds). INRA Prod. Anim., 22, 255-270.
- Pellicer-Rubio M.T., Touzé J.L., Baril G., Malpaux B., 2013. The luteal outcome of anoestrus ewes induced to ovulate by the male effect is not related to the population of ovarian antral follicles before male exposure. Anim. Reprod. Sci., 137, 23-30.
- Pellicer-Rubio M.T., Boissard K., Forgerit Y., Pougnard J.L., Bonné J.L., Leboeuf B., 2016. Evaluation of hormone-free protocols based on the “male effect” for artificial insemination in lactating goats during seasonal anestrus. Theriogenology, 85, 960-969.
- Pellicer-Rubio M.T., Boissard K., Grizel J.J., Vince S., Fréret S., Fatet, Lopez-Sebastian A., 2018. Vers une maîtrise de la reproduction sans hormones chez les petits ruminants. Renc. Rech. Rum., 24, 12p.
- Perkins A., Fitzgerald J.A., 1994. The behavioural component of the ram effect: the influence of ram sexuel behaviour on the induction of estrus in anovulatory ewes. J. Anim. Sci., 72, 51-55.
- Piedhault F., Lazard K., Proust M., Foisnon B., Lictevout V., Lhériau J.Y., Bossis N., 2014. Réussir l’élevage des chevrèttes, de la naissance à la mises bas. Institut de l’élevage, Collection Théma, 20p.
- Poindron P., Cognie Y., Gayerie F., Orgeur P., Oldham M., Ravault J.P., 1980. Changes in gonadotrophins and prolactin levels in isolates (seasonally or lactationally) anovular ewes associates with ovulation caused by the introduction of rams. Physiol. Behav., 25, 227-236.
- Restall, 1988. The artificial insemination of Australian goats stimulated by the “buck effect”. Proc. Aust. Soc. Anim. Prod., 17, 302-305.
- Thimonier J., 1989. Contrôle photopériodique de l’activité ovulatoire chez la brebis. Existence de rhytmes endogènes. Thèse de doctorat, Université François-Rabelais de Tours, 112p.
- Thimonier J., Cognié Y., lassoued N., Khaldi G., 2000. L’effet mâle chez les ovins: une technique actuelle de maïtrise de la reproduction. INRA Prod. Anim., 13, 223-231.
- Tournadre H., Pellicer M.T., Bocquier F., 2009. Maîtriser la reproduction en élevage ovin biologique: influence de facteurs d’élevage sur l’efficacité de l’effet bélier. Innov. Agron., 4, 85-90.
- Ungerfeld R., Pinczak A., Forsberg M., Rubianes E., 2002. Ovarian responses of anestrous ewes to the “ram effect”. J. Anim. Sci., 82, 599-602.
- Ungerfeld R., Carbajal B., Rubianes E., Forsberg M., 2005. Endocrine and ovarian changes in response to the ram effect in medroxyprogesterone acetate-primed Corriedale ewes during the breeding and nonbreeding season. Acta vet. scand., 46, 33-44.
- Walkden-Brown S.W., Restall B.J., Henniawati, 1993. The male effect in the Australian cashemiere goat. 3. Enhacement with buck nutrition and use of oestrus females. Anim. Reprod. Sci., 32, 69-84.
- Walkden-Brown S.W., Martin G.B., Restall B.J., 1999. Role of male-female interaction in regulating reproduction in sheep and goats. J. Reprod. Fertil., Suppl. 52, 243-257.
- Wayne N.L., Malpaux B., Karch F.J., 1990. Photoperiodic requirements for timing onset and duration of the breeding season of the ewe: synchronisation of an endogenous rhythm of reproduction. J. Comp. Physiol. Anim., 166, 835-842.
Résumé
Dans les élevages ovins et caprins, la maîtrise de la reproduction est importante pour une reproduction hors saison sexuelle, pour grouper les mises bas et pour la pratique de l’Insémination Artificielle (IA). Le traitement hormonal d’induction et de synchronisation de l’œstrus et de l’ovulation est aujourd’hui le moyen le plus efficace pour atteindre ces objectifs. Le recours à des traitements photopériodiques et/ou à l’effet mâle apparait comme une solution pour limiter l’utilisation d’hormones dans ces filières.Cet article rappelle les spécificités de la réponse ovulatoire et comportementale des femelles à « l’effet mâle », ainsi que les bases physiologiques qui contribuent à la réussite de cette pratique chez les ovins et les caprins. Le prétraitement des animaux avec des traitements photopériodiques de désaisonnement est un prérequis pour une réponse à l’effet mâle efficace, notamment chez des races très saisonnées comme les races caprines alpine et saanen. Des traitements lumineux sont actuellement disponibles en élevage pour une reproduction par effet mâle en toute saison. Toutefois, ils requièrent l’utilisation de mélatonine à certaines périodes de l’année (notamment pour une reproduction en période estivale). Cet article expose différents travaux réalisés pour développer de nouveaux traitements lumineux sans mélatonine, pouvant être appliqués en bâtiment ouvert. Des protocoles d’IA qui font appel à « l’effet mâle » sont en train d’émerger. Il s’agit pour certains de protocoles basés sur l’association de l’effet mâle avec des progestatifs et/ou des prostaglandines, et qui permettent de pratiquer une seule IA à un moment prédéterminé. Des protocoles d’IA après effet mâle seul (sans hormones) sont également disponibles, et notamment basés sur une détection des chaleurs. Chez les caprins, ils comportent 1 ou 2 moments d’IA, avec ou sans détection de chaleurs préalable. Chez les ovins, la détection des chaleurs est obligatoire pour la pratique de l’IA après un effet bélier seul. Dans les deux espèces, le développement de la détection automatisée des chaleurs facilitera le déploiement des protocoles d’IA sans utilisation d’hormones.
Pièces jointes
Pas de document complémentaire pour cet article##plugins.generic.statArticle.title##
 Vues: 14150
Vues: 14150
Téléchargements
 PDF: 1840
PDF: 1840
 XML: 291
XML: 291
Articles les plus lus par le même auteur ou la même autrice
- Maria-Teresa PELLICER-RUBIO, Sandrine FRÉRET, Stéphane FERCHAUD, Sylviane BOULOT, Fabrice BIDAN, Renée DE CRÉMOUX, Diane BARTHÉLÉMY, Léa ROUZEYROL, Catherine EXPERTON, Ghylène GOUDET, Gestion de la reproduction sans hormones chez les mammifères d’élevage en AB en France , INRAE Productions Animales: Vol. 37 No 2 (2024): Numéro spécial : L’élevage biologique : conditions et potentiel de développement

