Les organoïdes intestinaux des animaux de rente : de nouveaux modèles de culture in vitro pour une meilleure compréhension du fonctionnement de l’intestin
Chapeau
Les organoïdes intestinaux sont des structures cellulaires tridimensionnelles obtenues in vitro après auto-organisation des cellules souches cultivées avec des facteurs de croissance et de différenciation adéquats. Ces nouveaux modèles cellulaires récapitulent l’architecture et les types cellulaires de l’épithélium intestinal et conservent des fonctions similaires (Hofer et Lutolf, 2021). Ils offrent donc un outil intéressant pour la caractérisation de mécanismes impliqués dans la physiopathologie de l’épithélium intestinal et ses interactions avec des pathogènes entériques retrouvés chez les animaux d’élevage
Introduction
Ces dernières années, les avancées scientifiques sur les cellules souches et en bio-ingénierie ont permis de révolutionner la culture cellulaire avec un changement de dimensions de 2 (2D) à 3 (3D) pour améliorer la pertinence physiologique des études « in vitro ». Ainsi sont nés les « organoïdes », ou mini-organes, qui permettent aujourd’hui de pouvoir reproduire au plus proche de la réalité la physiologie du cerveau, du foie, des intestins, etc. de l’Homme. Leur utilisation représente un grand intérêt en recherche pour évaluer l’efficacité et la toxicité de molécules pharmaceutiques, pour étudier les infections, et pour la médecine régénérative/la transplantation d’organes.
Le développement d’organoïde est initié par la mise en culture de cellules souches ayant des propriétés uniques d’auto-renouvellement et de différenciation. Selon leur origine, on distingue les cellules souches embryonnaires (ESC pour embryonic stem cell) pluripotentes, les cellules souches adultes ou tissulaires mulipotentes, et celles obtenues par reprogrammation somatique, dites cellules souches pluripotentes induites (iPSCs pour induced pluripotent stem cell) (Pain, 2021). Elles sont cultivées dans des milieux contenant divers facteurs de croissance, inhibiteurs de mort cellulaire et des facteurs de différenciation spécifiques des tissus et dans une matrice cellulaire proche de celle existant in vivo avec des laminines et du collagène leur permettant de s'auto-organiser non pas étalées au fond d'une boîte de Pétri, mais en 3D.
Les organoïdes intestinaux font partie des outils de culture cellulaire 3D les plus développés et étudiés à l'heure actuelle. En effet, l'amélioration des connaissances des voies de signalisation impliquées dans le maintien et la prolifération des cellules souches intestinales qui expriment spécifiquement Lgr5+, un récepteur orphelin à 7 domaines transmembranaire, a permis le développement rapide des organoïdes intestinaux chez la souris et l'homme (Sato et al., 2009 ; Sato et al., 2011a). Ils peuvent être générés in vitro à partir des cellules souches des différents segments de l'intestin et conservent ainsi toutes les caractéristiques phénotypiques et fonctionnelles de leurs tissus d'origine. On appellera alors « entéroïdes » les organoïdes intestinaux dérivés de l'intestin grêle et « colonoïdes » ceux dérivés du côlon (Stelzner et al., 2012). Ces structures 3D auto-organisées sont composées d'une monocouche de cellules épithéliales intestinales polarisée qui récapitule in vitro la composition multicellulaire de l'épithélium intestinal et son architecture avec des domaines cryptiques. Ces « mini intestins » reproduisent également leurs principaux rôles tels que l'absorption des nutriments et la fonction barrière (Sato et al., 2009).
Chez les animaux de rente, quatre revues internationales récentes ont décrit tous les travaux réalisés à partir d'organoïdes intestinaux de différents animaux de ferme et les particularités des milieux de culture de chaque modèle cellulaire (Holthaus et al., 2020 ; Seeger, 2020 ; Beaumont et al., 2021 ; Kar et al., 2021 ; Lacroix-Lamandé et Wiedemann, 2021). Dans cette revue, nous décrirons la composition de l'épithélium intestinal pour mieux comprendre comment la technologie des organoïdes intestinaux a pu se développer. Un état des lieux des différents modèles d'organoïdes intestinaux des animaux de rente fera l'objet d'une autre partie de cette revue pour finir sur quelques applications actuelles et futures de ces outils innovants (tableau 1). Ils ouvrent donc de nouvelles perspectives dans la recherche animale et répondent à une demande sociétale de limiter l'utilisation des animaux en recherche. C'est pourquoi, un collectif de scientifiques, chercheurs et ingénieurs de INRAE, s'approprient actuellement ces nouvelles méthodologies et ont constitué un groupe de travail (GT Organoïde INRAE) pour échanger et progresser plus efficacement sur cette technologie.
Tableau 1. État des lieux des organoïdes intestinaux des animaux de rente.
Espèce |
Segment |
Application |
Référence |
|---|---|---|---|
Porc |
Duodenum |
Stimulation avec du LPS |
|
Édition de génome |
|||
Jejunum |
Identification des types cellulaires |
||
Culture 2D inverse et transcriptomique |
van der Hee et al. (2018) ; |
||
Stimulation avec des Mycotoxines, |
|||
Infection par le TGEV, S. Typhimurium, |
Li et al. (2020) ; |
||
Supplémentation en cuivre et en acide |
|||
Ileum |
Modèle de développement de l’intestin |
||
Supplémentation en Vitamine A |
|||
Infection par Lawsonia intracellularis |
|||
Duodenum, Jejunum, |
Infection par le virus Porcine epidemic |
||
Poulet |
Cæcum, |
Modèle de développement de l’intestin |
|
Duodenum |
Effet de Lactobacillus salivarius |
||
Intestin grêle |
Traitements Chimiques |
||
Intestin grêle, |
Modèle de développement de l’intestin, |
Panek et al. (2018) ; |
|
Bovin |
Jejunum |
Infection par S. Typhimurium |
|
Modèle de développement |
|||
Ileum |
Modèle de développement |
||
Infection par E. coli, Rotavirus |
Fitzgerald et al. (2019) ; |
||
Étude de la barrière intestinale |
|||
Colon |
Culture 2D, cryoconservation |
||
Mouton |
Ileum |
Modèle de développement |
|
Cheval |
Ileum, jejunum |
Modèle de développement |
Powell et Behnke (2017) ; |
Lapin |
Cæcum |
Modèle de développement |
Tableau adapté de Beaumont et al., 2021.
1. Le tractus gastro-intestinal
1.1. Structure et fonctions du tube digestif
Différents compartiments constituent le tractus intestinal depuis la bouche jusqu’à l’anus : l’œsophage, l’estomac, l’intestin grêle lui-même subdivisé en 3 compartiments (duodénum, jéjunum et iléon), le cæcum, le côlon et le rectum. Le duodénum reçoit le chyme alimentaire, le suc biliaire et les sécrétions pancréatiques pour compléter la digestion chimique. Le jéjunum est le site principal d'absorption des nutriments tandis que l'iléon absorbe les nutriments résiduels, les vitamines et les acides biliaires conjugués. Le gros intestin est composé du cæcum et du côlon, dont les fonctions principales sont d'absorber l'eau, les électrolytes et les produits de fermentation microbienne.
Tous ces organes ont la même origine embryonnaire mais exercent des fonctions spécifiques à leur localisation pour permettre la digestion des aliments, la fonction première attribuée à l’intestin. L’intestin joue également un rôle de barrière en permettant le passage spécifique des nutriments lors de la digestion et en prévenant celui de pathogènes. Il est constitué de 4 couches successives permettant d’assurer l’ensemble de ses fonctions (figure 1). La couche la plus externe du tube est appelée la séreuse, elle est accolée à la musculeuse qui est composée de muscles lisses longitudinaux et circulaires et d’un Système Nerveux Entérique (SNE) essentiel à la fonction de motricité intestinale pour l’élimination du bol alimentaire. La 3ème couche correspond à la sous-muqueuse. Elle est constituée de tissu conjonctif lâche contenant des vaisseaux sanguins et lymphatiques ainsi que les neurones et cellules gliales du SNE. La dernière couche appelée muqueuse est constituée d’un épithélium en contact direct avec la lumière digestive et d’un système immunitaire appelé GALT pour Gut associated lymphoid tissue. L’épithélium constitue une barrière physique entre l’organisme et le milieu extérieur. À cette interface se localise le microbiote intestinal jouant également un rôle important dans la digestion et dans la protection de l’hôte.
Figure 1. Coupe Histologique représentant la paroi de l’intestin grêle.
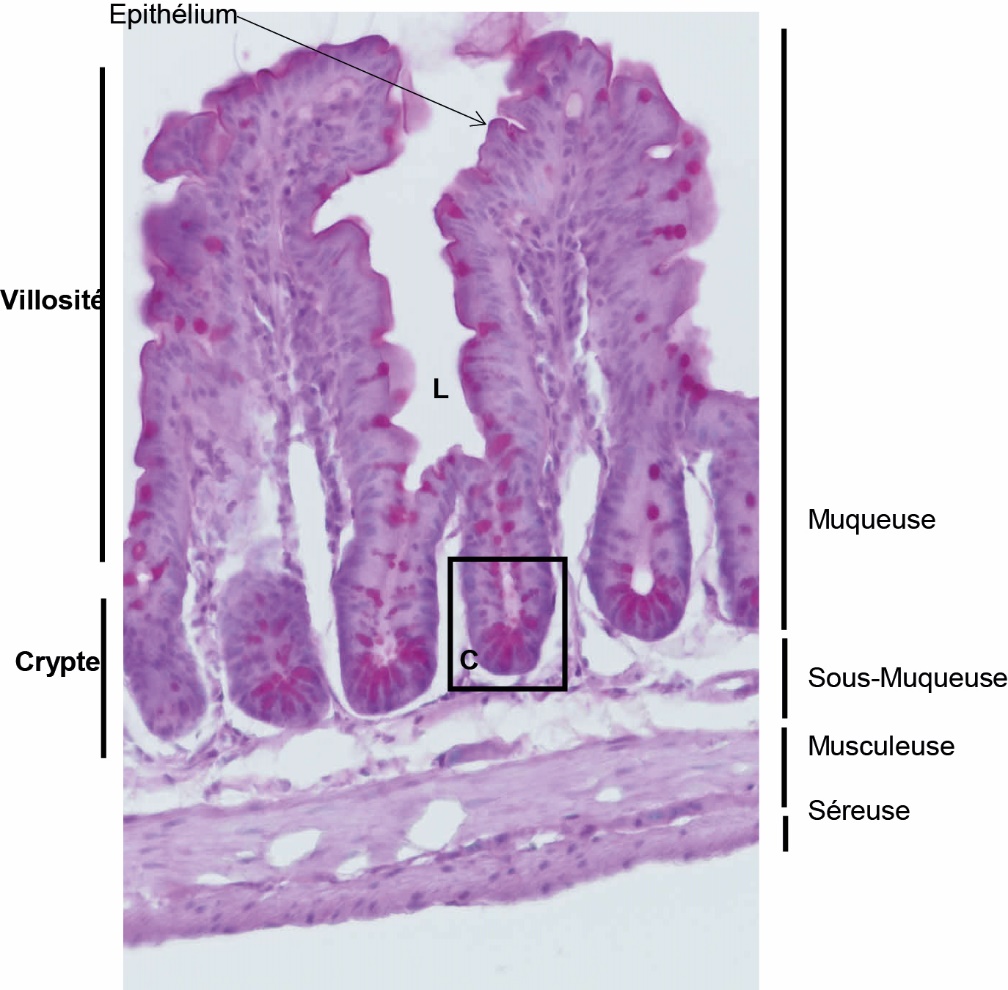
L’intestin est un tube creux constitué de quatre couches : la muqueuse, la sous muqueuse, la musculeuse et la séreuse. L : lumière intestinale ; C : crypte
1.2. Composition de l’épithélium intestinal
L’épithélium intestinal recouvre les villosités et les cryptes (figure 1 et 2). Il est formé d'une monocouche de cellules épithéliales différenciées ou prolifératrices situées à l’interface entre milieu extérieur (lumière intestinale) et l’hôte. Les cellules épithéliales différenciées assurent des fonctions de digestion et de défenses physique, en formant une barrière, et immunologique en produisant des agents anti-microbiens et des cytokines ou chimiokines. Les cellules épithéliales en prolifération assurent le renouvellement de l’épithélium qui se produit tous les 3 à 5 jours. La balance entre la prolifération et la différenciation doit être maintenue et finement régulée pour assurer l’homéostasie de l’épithélium intestinal. Cet équilibre est contrôlé par des gradients d’activations spécifiques des grandes voies de signalisation (Wnt, Notch, Bmp) figure 2.
Figure 2. Composition de l’épithélium intestinal.

L’intestin est un tube recouvert de villosités elles-mêmes recouvertes d’un épithélium monocouche. Différents types de cellules épithéliales composent cet épithélium. Dans les cryptes intestinales, se trouvent les cellules souches Lgr5+ qui prolifèrent et migrent le long de l’axe crypto-villositaire pour se différencier en cellules absorbantes que sont les entérocytes ou en cellules sécrétrices telles que les cellules caliciformes, les cellules entéroendocrines et les cellules Tuft. Les cellules de Paneth sont elles aussi des cellules différenciées mais ne migrent pas, elles restent localisées dans les cryptes et constituent une niche pour les cellules souches. La prolifération des cellules ou leur différenciation implique une régulation fine des voies de signalisation. Ainsi, la voie Wnt est fortement active dans les cryptes et favorise la prolifération et le maintien des cellules prolifératives. La voie Bmp est active dans les villosités et permet la différenciation des cellules. La voie Notch est active dans les cryptes au niveau des cellules progénitrices absorbantes et des cellules souches et permet notamment le choix du lignage de différenciation (cellules absorbante ou sécrétrice) et le maintien de la prolifération.
a. Les villosités
Les cellules spécialisées ou différenciées, recouvrent les villosités dans l'intestin grêle, et se positionnent dans le tiers supérieur des cryptes dans le côlon. Il existe 5 types de cellules différenciées dans l'intestin appartenant à deux grands lignages cellulaires dans cet épithélium : le type absorbant, représenté par les entérocytes, et le type sécrétoire, auquel correspondent les cellules de Paneth, les cellules caliciformes, les cellules entéro-endocrines et les cellules Tuft ou « touffues ». Les entérocytes représentent 80 % des cellules de l'épithélium et ont un rôle dans l'absorption des nutriments. Les cellules entéro-endocrines sont moins nombreuses (1 %) et sont spécialisées dans la sécrétion de peptides et d'hormones (telles que la sérotonine, les catécholamines, l'adrénaline, l'enteroglucagon, du peptide YY et bien d'autres…) pour agir sur la mobilité intestinale et les fonctions digestives. Elles sont stimulées par les produits de digestions (glucose, acides-aminés...) et les produits de de fermentation du microbiote tels que les acides gras à chaine courte (de l'anglais SCFA (short-Chain Fatty Acids). De par leur fonction, elles sont plus nombreuses en partie proximale de l'intestin grêle et les peptides et les hormones qu'elles produisent sont différentes selon leur localisation (Gribble et Reimann, 2019). La fonction de protection est principalement assurée par les cellules de Paneth qui sécrètent des peptides antimicrobiens et les cellules caliciformes qui représentent 5 % des cellules épithéliales spécialisées dans la sécrétion du mucus. Les cellules « touffues » appelées ainsi de par leur aspect en microscopie électronique à balayage, ont plus récemment été décrites et participent à l'immunité antiparasitaire (figure 2). Tous ces types de cellules épithéliales intestinales différenciées dérivent des cellules souches épithéliales intestinales situées à la base des cryptes épithéliales. Ils acquièrent leur spécificité en se différenciant le long de l'axe crypto-villositaire (Gehart et Clevers, 2019). En revanche, les cellules de Paneth restent au fond des cryptes et participent également au maintien de la niche des cellules progénitrices et des cellules souches Lgr5+ (Sato et al., 2011b). La distribution des types de cellules épithéliales diffère également le long de l'intestin, ce qui reflète la spécialisation fonctionnelle des segments digestifs (Middendorp et al., 2014).
b. Les cryptes ou niches des cellules souches
Dans les cryptes intestinales, les cellules souches sont appelées les CBC pour crypt base columnar cell et expriment le récepteur Lgr5. Ces cellules prolifèrent activement et possèdent les caractéristiques typiques des cellules souches dans un environnement privilégié appelé « niche ». À chaque division, elles engendrent des cellules progénitrices qui s’amplifient, puis se différencient dans les différents types cellulaires de l’épithélium intestinal (Seishima et Barker, 2019).
La signalisation Wnt/β-caténine participe au contrôle de la prolifération, au maintien des cellules souches, et au renouvellement de l'épithélium intestinal (van der Hee et al., 2020 ; Randall et al., 2011). Si les cellules souches génèrent leur propre niche qui leur assure, par un effet paracrine, un rôle protecteur et instructeur, les cellules avoisinantes telles que les cellules épithéliales adjacentes (cellules de Paneth), les myofibroblastes, les neurones entériques, les cellules endothéliales, les lymphocytes intraépithéliaux et les macrophages participent également à cette « niche ». Dans cette niche sont sécrétés des facteurs activant la voie Wnt tels que Wnt3a, de l'EGF (epidermal growth factor), des ligands des récepteurs Notch pour favoriser la prolifération, et du TGF-α (transforming growth factor-α) (Sato et al., 2011b).
2. Les modèles in vitro pour étudier l’intestin des animaux de rente
Étudier les fonctions de l'épithélium intestinal chez les espèces animales a des implications majeures en recherche que ce soit pour l'amélioration de l'efficacité alimentaire des animaux, pour la santé vétérinaire en décryptant les interactions entre l'intestin des animaux et les agents pathogènes entériques ou encore pour la recherche biomédicale avec l'utilisation des animaux en tant que modèle de maladies humaines. Les modèles couramment utilisés pour étudier l'épithélium intestinal des animaux sont les lignées cellulaires de cellules épithéliales immortalisées. Ces lignées sont disponibles chez le porc (IPEC-J2, dérivées du jéjunum ou PoCo83-3 dérivé du colon) mais n'existent pas pour d'autres espèces animales comme le poulet et le bovin. De plus, elles présentent l'inconvénient majeur de ne pas représenter l'hétérogénéité cellulaire de l'épithélium et par conséquent ne reproduisent pas entièrement la fonctionnalité des tissus (Vergauwen, 2015 ; van der Hee et al., 2020). La culture ex vivo d'explants intestinaux ou de cellules épithéliales intestinales primaires récapitule les principales caractéristiques du tissu in vivo, mais elle ne convient pas aux expériences de longue durée en raison de la viabilité limitée à environ 24 ou 48h (Randall et al., 2011). Le développement récent des organoïdes intestinaux des animaux de rente résout la plupart de ces limitations. Une revue récente décrit les progrès réalisés pour les études in vitro de l'intestin chez l'Homme depuis l'utilisation des lignées cellulaires jusqu'aux organoïdes cultivés sur puce (décrits à la fin de la revue) (Rahman et al., 2021).
3. Les organoïdes intestinaux des animaux de rente
3.1. Les cellules souches pour cultiver des organoïdes
Les organoïdes sont cultivés à partir de cellules souches ayant des propriétés d'auto-renouvèlement et de différenciation leur permettant de générer l'ensemble des cellules de l'organisme. Trois types de cellules souches sont généralement utilisées pour dériver des organoïdes : les cellules souches à pluripotence induite (iPSC) (des cellules somatiques reprogrammées génétiquement pour les rendre pluripotentes) ou les cellules souches embryonnaires (ESC) ou encore les cellules souches multipotentes isolées de tissus. Malgré les progrès récents pour le développement de cellules iPSC des animaux domestiques (Sato et Clevers, 2013 ; Bogliotti et al., 2018), à notre connaissance, tous les modèles organoïdes intestinaux d'espèces animales ont été développés avec les cellules souches isolées de tissus.
3.2. Culture des organoïdes intestinaux
La culture d’organoïde intestinal est basée sur la reproduction de la niche des cellules souches in vitro. Ainsi, le milieu de culture des organoïdes contient des facteurs permettant de stimuler la voie Wnt (Wnt3a et R-Spondin), de l’EGF important pour la prolifération des cellules souches et du Noggin pour inhiber la signalisation Bmp. Grâce à ces facteurs, les organoïdes croissent et forment au bout de quelques jours des mini-intestins regroupant toutes les cellules différenciées de l’épithélium intestinal. Lorsque des cellules souches d’intestin grêle sont cultivées, des bourgeons contenant des cellules souches ainsi que des cellules de Paneth se forment et reproduisent l’architecture des cryptes (figure 3). Les cellules différenciées se retrouvent hors des cryptes dans des domaines récapitulant l’organisation des villosités. Pour obtenir la structure 3D des organoïdes, les cellules souches épithéliales intestinales sont généralement ensemencées dans du MatrigelTM, un gel de protéines de la matrice extracellulaire contenant des facteurs de croissance.
Les organoïdes intestinaux humains et murins sont dérivés des cellules souches isolées de tissus intestinaux ou de cellules souches pluripotentes induites ou de cellules souches embryonnaires (Gao et al., 2019). Ces méthodes ont récemment été adaptées à de nombreuses espèces agronomiques, notamment le porc, le lapin, le bovin, le mouton, le cheval et le poulet (figure 4 et tableau 1) (Panek et al., 2018). Les modèles organoïdes intestinaux n'ont pas encore été développés pour les poissons. Des organoïdes intestinaux d'animaux de ferme ont été obtenus avec succès à partir de plusieurs segments digestifs (duodénum, jéjunum, iléon, cæcum et côlon).
Figure 3. Génération et culture d’organoïdes intestinaux.
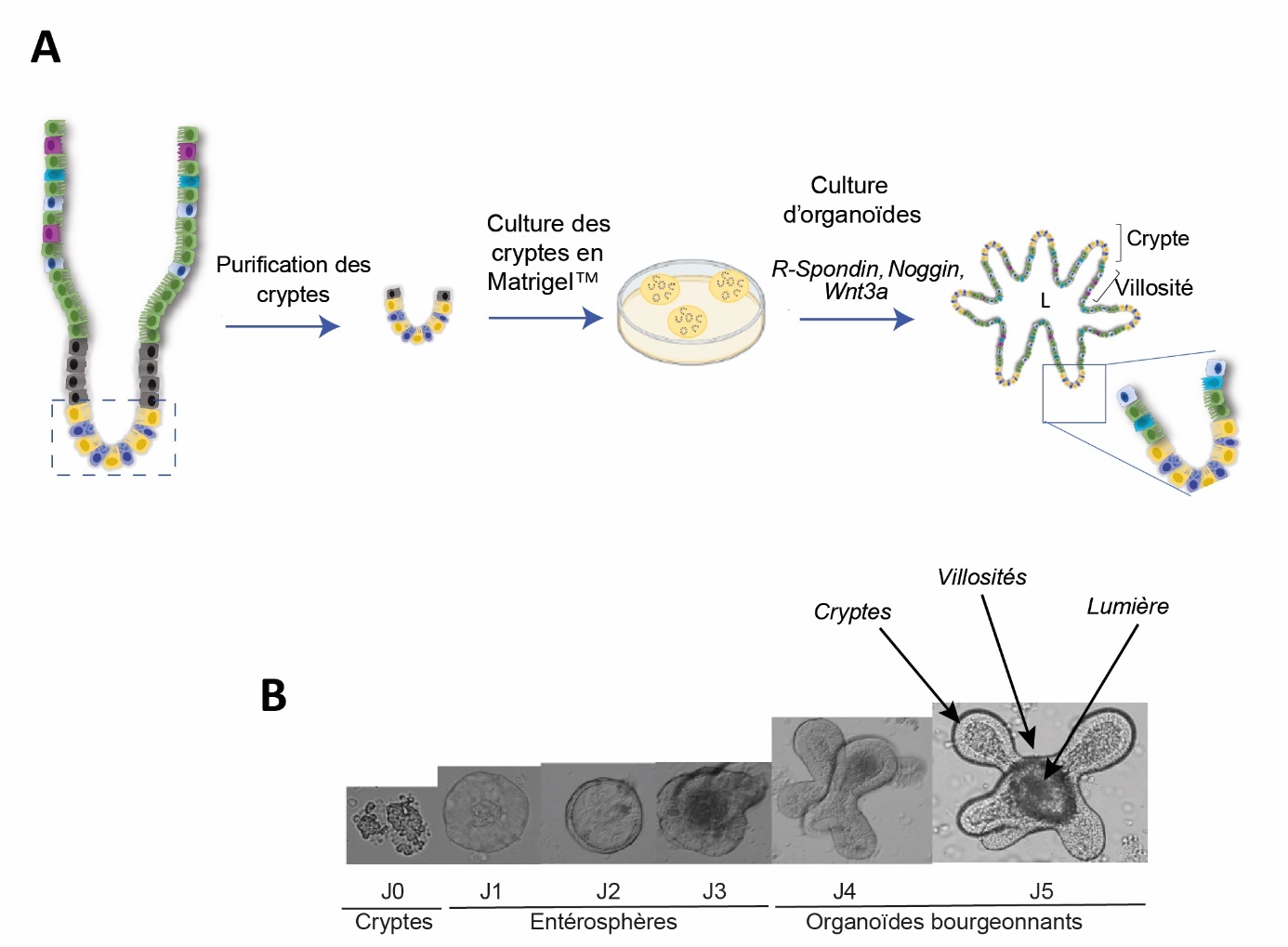
Les organoïdes intestinaux sont générés à partir des cellules souches intestinales. Que ce soit pour l’Homme ou l’animal, celles-ci peuvent être purifiées à partir de cryptes isolées de fragments d’intestin ou de biopsies. Elles sont ensuite mises en culture avec des facteurs de croissance adaptés et dans une matrice leur permettant une croissance en 3D. A : Schéma de protocole expérimental pour obtenir des organoïdes intestinaux en culture. B : Images de microscopie optique illustrant le développement au cours du temps des organoïdes intestinaux en culture à partir d’ensemencement de cellules de cryptes intestinales.
a. Isolement des cellules souches intestinales
La première étape de la culture d’organoïdes intestinaux des animaux de rente consiste à isoler les cryptes intestinales contenant les cellules souches avec des protocoles proches de ceux utilisés pour l’Homme et la souris. À partir du prélèvement d’intestin du segment désiré, des étapes d’incubation et d’agitation avec des tampons de dissociation généralement à base d’acide éthylènediaminetétraacétique (EDTA) et du dithiothréitol (DTT) sont réalisées. Selon les espèces et les segments digestifs, la concentration en EDTA varie énormément de même que le temps et la température d'incubation. Dans certains cas, un inhibiteur de la mort des cellules épithéliales, le Y27632, est ajouté lors de la purification. Les cryptes isolées sont ensuite ensemencées dans du MatrigelTM et le milieu de croissance est ajouté.
b. Mise en Culture des cryptes intestinales
Face à la diversité des facteurs nécessaires à la culture des organoïdes, la difficulté à obtenir des molécules recombinantes spécifiques de chacune des espèces animales étudiées aurait pu constituer un frein au développement de ces nouveaux modèles de culture. Toutefois, la conservation évolutive élevée des séquences en acides aminés des facteurs de croissances entre les espèces animales a rendu possible la culture d'organoïdes intestinaux à partir de facteurs humains ou murins (Panek et al., 2018 ; Mussard et al., 2020). Ainsi, de très nombreuses études rapportent l'utilisation du milieu conditionné de cellules L-WRN (lignée cellulaire L de souris sécrétant Wnt3a, R-spondin et Noggin, ATCC® CRL-3276™) pour cultiver des organoïdes intestinaux de plusieurs espèces comme le poulet et le lapin (Panek et al., 2018 ; Mussard et al., 2020). Comme décrit précédemment, le développement des organoïdes intestinaux à partir des cellules souches est possible en inhibant la signalisation de la voie Bmp par le Noggin, en stimulant la prolifération des cellules souches épithéliales par la R-Spondin et la protéine Wnt3a, cette dernière participant également à la différenciation des cellules épithéliales. Très récemment, la R-Spondin et la protéine Wnt3a du poulet ont été produits en lignée HEK293t et leur utilisation a permis d'augmenter la longévité des cultures d'organoïdes intestinaux de poulets (Oost et al., 2022). Pour faciliter la croissance des organoïdes intestinaux, le milieu peut également contenir de l'EGF, ou des suppléments de culture cellulaire tels que des vitamines ou des mélanges complexes commercialisés tels que les suppléments N2 et B27.
Figure 4. Organoïdes intestinaux dérivés de cryptes jéjunales de poulet cultivés en milieu L-WRN.

A : Image de microscopie optique d’organoïde mature en culture. B-C : Caractérisation du modèle organoïde intestinal aviaire par microscopie électronique à transmission. La face luminale (L) de l’organoïde est apparente dont la surface est décorée d’une bordure en brosse (visualisée avec un astérisque). M indique une cellule à mucus qui fait face à la lumière et la flèche indique les jonctions intercellulaires caractéristiques de l’organisation polarisée des cellules.
Pour pallier le manque de molécules recombinantes spécifiques d'espèce, une autre approche a été de cultiver des organoïdes intestinaux de porc et de bovin avec du milieu de croissance commercial optimisé par STEMCELL Technologies (Vancouver, Canada) pour la souris et les organoïdes humains (Derricott et al., 2019 ; Li et al., 2019a ; Li et al., 2019b ).
Enfin, l'utilisation d'inhibiteurs ou d'activateurs synthétiques des voies de signalisation essentielles à la physiologie intestinale est également un moyen de s'affranchir de la disponibilité des molécules recombinantes. Ainsi l'inhibiteur CHIR99021 peut être utilisé pour inhiber la glycogène synthase kinase 3 et ainsi activer la voie Wnt dans la culture d'organoïdes intestinaux de porc, bovin, cheval et lapin (Stewart et al., 2018 ; Derricott et al., 2019 ; Mussard et al., 2020 ; Zhou et al., 2020). Dans plusieurs études, la prolifération épithéliale et l'inhibition de la différenciation ont été facilitées par les inhibiteurs du récepteur TGFβ (LY2157299, A8301, SB43542) et l'inhibiteur de p38 MAPK SB202190 (Holmberg et al., 2017). Enfin, il est possible de remplacer le Noggin par l'inhibiteur de la voie Bmp LDN193189 comme cela a été décrit pour la culture d'organoïdes de cæcum de lapin (Mussard et al., 2020). Un autre inhibiteur est classiquement utilisé pour la culture d'organoïdes intestinaux pour empêcher la mort des cellules épithéliales isolées, l'inhibiteur ROCK, Y27632 (Li et al., 2019b).
Pour améliorer la culture et plus précisément la différenciation des organoïdes intestinaux, il est possible de moduler les concentrations des facteurs de niche tels que Wnt3a ou Noggin comme cela a été décrit les organoïdes du cæcum de lapin (Mussard et al., 2020) et les entéroïdes bovins (Hamilton et al., 2018 ; Topfer et al., 2019).
c. Culture dans le temps des organoïdes intestinaux
Dans tous les épithélia, la cellule épithéliale est dite « polarisée ». En effet, elle repose sur une membrane basale ce qui permet de lui définir un pôle basal, en contact avec la membrane basale et un pôle apical exposé au milieu « extérieur ». Cultivés en 3D dans une matrice, classiquement dans du MatrigelTM, l'épithélium des organoïdes intestinaux acquiert cette caractéristique de polarisation avec la partie apicale vers l'intérieur de l'organoïde. Cette orientation de l'épithélium intestinal peut présenter des inconvénients à l'utilisation de ce modèle in vitro. Le premier est directement relié aux caractéristiques intrinsèques de l'épithélium intestinal réputé pour sa vitesse de renouvellement, qui est la plus élevée de l'organisme et qui entraîne une quantité importante de cellules mortes s'accumulant dans la lumière des organoïdes classiques. Cette accumulation excessive au cœur de l'organoïde de cellules mortes, par le phénomène d'anoïkose, nécessite de les dissocier en moyenne chaque semaine pour les maintenir dans une culture viable. L'autre inconvénient dépend de la question scientifique pour laquelle l'outil va être utilisé. En effet, pour des études des interactions microbiote-épithélium, ou pathogènes-épithélium ou encore pour étudier le devenir de nutriments, l'accès au pôle apical de l'épithélium est indispensable. La technique de micro-injection est un moyen d'accéder à la lumière de l'organoïde, cependant, elle nécessite un appareillage et une technicité complexe qui ne sont pas adaptées à tous les questionnements scientifiques et notamment aux applications à haut débit (Puschhof et al., 2021).
Pour pallier cet inconvénient majeur, d'autres façons de cultiver les organoïdes intestinaux ont été décrits à partir de ce qui a été réalisé chez l'homme et la souris. Les organoïdes peuvent être dissociés en plus petits fragments ou cellules isolées mécaniquement ou par digestion enzymatique. Les fragments peuvent ainsi être exposés aux pathogènes ou à des nutriments puis re-ensemencés en MatrigelTM pour se réorganiser et se transformer de nouveau en organoïdes. L'inconvénient de cette méthode est la perte probable de polarité de l'épithélium une fois dissocié, ce qui signifie que son exposition aux pathogènes ou à des nutriments n'est pas très représentatif de la situation in vivo. Une autre approche consiste à ensemencer les cellules isolées dans une configuration monocouche 2D sur une membrane de type Transwell. Elle a été décrite pour les organoïdes intestinaux de poulet (Orr et al., 2021), de cheval (Hellman, 2021), de lapin (Mussard et al., 2020 ; Kardia et al., 2021) et de porc (Hoffmann et al., 2021). Les cellules sont alors capables de former une barrière avec un épithélium polarisé donnant un accès facilité au pôle apical. Enfin, plus récemment, il a été décrit que les organoïdes intestinaux peuvent être maintenus en culture en suspension induisant une inversion de la polarité des cellules épithéliales de sorte que la membrane apicale soit tournée vers l'extérieur (Co et al., 2019 ; Co et al., 2021). Cette culture en suspension a été décrite avec des cryptes isolées du côlon et du jéjunum porcins et de caeca de poulet (Li et al., 2020 ; Joo et al., 2022 ; Nash et al., 2021). La figure 5 illustre une gamme de différentes méthodes utilisées pour avoir accès au pôle apical des cellules épithéliales de l'organoïde intestinal.
Figure 5. Méthodes de culture pour accéder au pôle apical des cellules épithéliales.
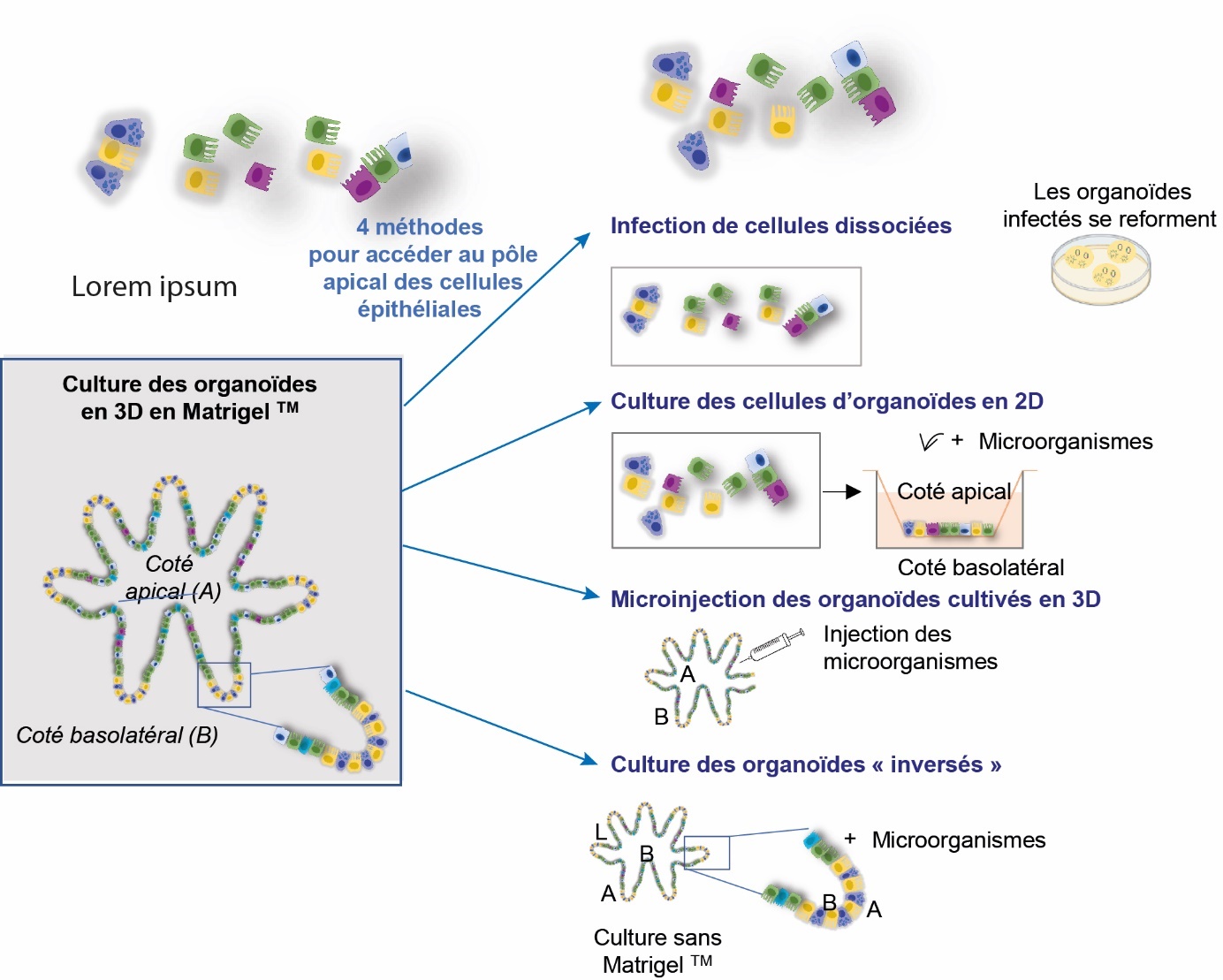
Les cellules épithéliales sont dites « orientées » avec un pôle apical (A), exposé à l’environnement extérieur, et un pôle basal (B). La majorité des agents pathogènes à porte d’entrée intestinale envahit l’hôte par le pôle apical des cellules. L’inconvénient majeur de la culture des organoïdes en 3D est la difficulté d’accéder au pôle apical des cellules qui se trouve à l’intérieur de l’organoïde. Pour cela, 4 méthodes ont été décrites afin d’étudier par exemple les interactions hôtes-micro-organismes (pathogènes ou commensaux).
4. Les applications des modèles d’organoïdes intestinaux chez les animaux de rente
4.1. Étude de la barrière intestinale
Une fonction cruciale de l'épithélium intestinal est de former une barrière physique et immunologique pour empêcher l'entrée dans l'organisme de composants luminaux nocifs.
Parmi les mécanismes de « barrière » de l'épithélium, le renouvellement constant tous les 3 à 5 jours des cellules épithéliales intestinales est un mécanisme permettant de maintenir l'intégrité épithéliale. Il génère la mort des cellules épithéliales intestinales par un mécanisme de mort cellulaire appelé « Anoïkose » qui est reproduit in vitro dans la culture d'organoïdes et est visualisé microscopiquement par l'apparition d'un « cœur » noir au centre de l'organoïde après plusieurs jours de culture. L'expression des marqueurs de prolifération tels que LGR5, SOX9, KI67 et PCNA dans les organoïdes atteste également de ce renouvellement continue des cellules épithéliales intestinales. Ils sont exprimés dans des organoïdes de porc, de lapin, de cheval, de poulet et de bovin, ce qui indique que la prolifération épithéliale est maintenue in vitro (Gonzalez et al., 2013 ; In et al., 2016 ; Hamilton et al., 2018 ; Panek et al., 2018 ; van der Hee et al., 2018 ; Alfajaro et al., 2019 ; Li et al., 2019a ; Li et al., 2019b ; Engevik et al., 2020 ; Luo et al., 2020 ; Mussard et al., 2020 ; Zhou et al., 2020).
Le maintien de la perméabilité épithéliale constitue un autre mécanisme de « barrière » de l'épithélium. Il est contrôlé par les protéines des jonctions serrées comme les claudines (CLAU), l'occludine (OCLN), les JAM, les protéines de la Zonula Occludens 1 à 3 (ZO1 à 3) (…), et celles des jonctions adhérentes impliquant les Cadherines (CDH)…). Tous les gènes de ces protéines sont exprimés dans les organoïdes intestinaux de porc, de lapin, de poulet et de bovin (Hamilton et al., 2018 ; Li et al., 2018 ; Li et al., 2019a ; Mussard et al., 2020 ; van der Hee et al., 2020). Plusieurs méthodes permettent d'évaluer la perméabilité de l'épithélium. L'incubation des organoïdes intestinaux avec des sondes fluorescentes (FITC (isothiocyanate de fluorescéine)-Dextran 4kDa ou LY (Lucifer Yellow)) et la non pénétration de ces produits à l'intérieur de l'organoïde cultivé en 3D attestent de la perméabilité intacte de l'épithélium (Bardenbacher et al., 2020 ; Crawford et al., 2022). La mesure de résistance transépitheliale (TEER) et l'analyse du transport apical-basal des sondes fluorescentes sont également un moyen d'étudier la perméabilité épithéliale para et trans-cellulaire d'une monocouche 2D de cellules d'organoïdes comme cela a été décrit pour le porc, le lapin, le bovin et plus récemment le poulet (Hamilton et al., 2018 ; van der Hee et al., 2018 ; Mussard et al., 2020 ; Hellman, 2021 ; Orr et al., 2021).
Enfin, la production de molécules à activité antimicrobienne ou ayant la particularité de piéger ou bloquer l'accès à la cellule d'un microorganisme par les cellules épithéliales intestinales est un mécanisme de protection de l'hôte. Par exemple, la production de mucine 2 (MUC-2), principale mucine gélifiante sécrétée par les cellules caliciformes, est exprimée par les organoïdes intestinaux du porc, du lapin, du cheval et du bovin (Pierzchalska et al., 2012 ; Hamilton et al., 2018 ; van der Hee et al., 2018 ; Alfajaro et al., 2019 ; Derricott et al., 2019 ; Li et al., 2019a ; Li et al., 2019b ; Mussard et al., 2020 ; Zhou et al., 2020). De plus, l'expression de peptides antimicrobiens (REG3G, le lyzozyme) a également été détectée dans des organoïdes de porc, de cheval, de bovin et de lapin (van der Hee et al., 2018 ; Alfajaro et al., 2019 ; Li et al., 2019a ; Engevik et al., 2020 ; Mussard et al., 2020).
4.2. Étude de la fonction d’absorption des nutriments de l’épithélium
L'étude à l'échelle cellulaire des fonctions de digestion de l'épithélium des animaux de rente, sans accès au tissus intestinal, est à présent rendue possible avec les organoïdes intestinaux. En effet, outre son rôle de barrière, l'épithélium intestinal contribue également à la digestion des aliments, à l'absorption des nutriments et à la régulation hormonale. Les entérocytes sont les cellules absorbantes et expriment des marqueurs spécifiques tels que la villine-1 (VIL1), la phosphatase alkaline (ALPI), et la kératine 20 (KRT20). Elles produisent également des enzymes digestives (sucrase-isomaltase) et des transporteurs d'ions/nutriments (exemples : transporteur de monocarboxylate (MCT1), co-transporteur de sodium-glucose-1 (SGLT1), échangeur sodium-hydrogène-3 (NHE3)), comme cela a été décrit dans les organoïdes de porc, de lapin, de poulet et de bovin (Gonzalez et al., 2013 ; In et al., 2016 ; van der Hee et al., 2018 ; Derricott et al., 2019 ; Li et al., 2019b ; d'Aldebert et al., 2020 ; Engevik et al., 2020 ; Mussard et al., 2020 ;). Les cellules entéro-endocrines sont impliquées dans la sécrétion d'hormones digestives telles que le peptide YY (PYY) et la chromogranine A (CHGA), leur présence a été décrite dans les organoïdes de porc, de lapin, de poulet et de bovin (Hamilton et al., 2018 ; van der Hee et al., 2018 ; Derricott et al., 2019 ; Li et al., 2019b ; Engevik et al., 2020 ; Mussard et al., 2020 ; Zhou et al., 2020 ; Nash et al., 2021).
Ainsi, les organoïdes intestinaux des animaux de rente possèdent les types cellulaires et potentiellement toutes les caractéristiques physiologiques et fonctionnelles pour étudier le transport des nutriments et la production d'hormones intestinales, comme cela a déjà été réalisé chez la souris ou les entéroïdes humains (Pierzchalska et al., 2017 ; Ferrandis Vila et al., 2018). Des études fonctionnelles réalisées chez le porc ont démontré que les cellules épithéliales d'organoïdes intestinaux étaient capables de transporter des nutriments tels que des acides aminés et des vitamines du côté apical au côté basolatéral comme l'épithélium in vivo (van der Hee et al., 2020).
D'autres questionnements scientifiques visant à étudier l'impact de nutriments sur l'homéostasie épithéliale peuvent également être abordés à l'aide de ces outils. Par exemple, il a été montré que le traitement des organoïdes de porcelets avec de la vitamine A alimentaire freine la différenciation des cellules épithéliales et favorise la prolifération, alors que le traitement d'organoïdes de porc avec du glutamate augmente la prolifération épithéliale (Zietek et al., 2015 ; Wang et al., 2020). De même une supplémentation dans l'alimentation en cuivre favorise la croissance de l'épithélium intestinal des jeunes porcelets au sevrage et le modèle organoïde a permis de démontrer le mode d'action du Cuivre qui favorise la prolifération des cellules souches et la maturation de l'épithélium intestinal (Yin et al., 2021). Une étude récente a démontré qu'un déficit en méthionine impacte négativement le développement de l'organoïde intestinal du poulet suggérant qu'une déficience dans son alimentation pourrait empêcher toute régénération de l'épithélium intestinal en cas de lésions (Wang et al., 2022). Ces études illustrent bien l'intérêt de tels outils pour mieux comprendre l'importance de la nutrition animale dans le maintien de la santé digestive.
4.3. Étude des Interactions hôtes – microorganismes
Les modèles organoïdes intestinaux peuvent être utilisés pour modéliser les infections entériques et ainsi mieux élucider les mécanismes d'entrée dans les cellules des agents pathogènes, les mécanismes de réplication et de propagation intracellulaire mais aussi de sortie des agents pathogènes. Par ailleurs, ils représentent le seul modèle permettant d’étudier in vitro le rôle respectif des types cellulaires spécifiques dans ces processus infectieux et dans l’induction des réponses immunitaires.
À l’heure actuelle, de nombreuses études d’infections d’organoïdes intestinaux dérivés d’animaux de rente par des agents pathogènes à tropisme intestinal d’importance économique majeure dans les élevages, ont permis de valider l’utilisation de cet outil pour modéliser les infections.
a. Les agents infectieux étudiés
Ainsi, des organoïdes intestinaux bovin ont été infectés avec succès par une variété d'agents pathogènes entériques, tels que Salmonella Typhimurium, Mycobacterium avium spp Paratuberculosis, Toxoplasma gondii et des rotavirus du groupe A et du Coronavirus (Derricott et al., 2019 ; Topfer et al., 2019 ; Blake et al., 2022 ; Shakya et al., 2023). De même, les organoïdes intestinaux de porc ont été infectés par plusieurs coronavirus porcins (virus de la diarrhée épidémique porcine (PEDV), virus de la gastro-entérite transmissible (TGEV) et deltacoronavirus porcin (PDCoV)) (Tsai et al., 2018 ; Co et al., 2019 ; Li et al., 2019b ; Resende et al., 2020), également par les bactéries Salmonella Typhimurium (Derricott et al., 2019) et Lawsonia intracellularis (Li et al., 2020 ; Zhang et al., 2022a ; Zhang et al., 2023) et par le parasite protozoaire Toxoplasma gondii (Derricott et al., 2019). Enfin, les organoïdes intestinaux aviaires ont également été utilisés pour modéliser les infections à Salmonella, au parasite Eimeria et au virus Influenza A (Nash et al., 2021), (tableau 1).
b. Les modèles d’infection
Pour ces différents modèles infectieux, les différentes approches décrites dans la figure 5 ont été utilisées afin de reproduire au mieux la voie physiologique d'entrée du pathogène entérique. Le modèle d'infection d'organoïdes dissociés mécaniquement lors du passage a été utilisé pour modéliser les infections des cellules épithéliales intestinales de porc et de bovin par Toxoplasma gondii ou par Salmonella Typhimurium (Derricott et al., 2019). Les cellules d'organoïdes cultivées en 2D sur une membrane ont permis les infections des cellules de porc strictement par le pôle apical par des coronavirus porcins ou Lawsonia intracellularis (Tsai et al., 2018 ; Co et al., 2019 ; Li et al., 2019b ; Li et al., 2020 ; Resende et al., 2020) ou ont permis d'étudier l'impact d'endotoxines de Salmonella Typhimurium ou de Bacillus subtilis sur les cellules épithéliales intestinales de poulet (Orr et al., 2021). La microinjection des organoïdes par des agents pathogènes a été décrite pour modéliser l'infection par le parasite Cryptosporidium parvum mais avec des organoïdes de souris (Heo et al., 2018 ; Dutta et al., 2019). À l'heure actuelle, cette technologie nécessitant une expertise en microinjection n'a pas été utilisée pour modéliser des infections d'animaux de ferme. Enfin, la mise au point récente de la culture d'organoïde sans matrice permettant une exposition externe du pôle apical des cellules de l'organoïde a permis de réaliser des infections par Salmonella, le virus Influenza et le parasite Eimeria tenella du côté apical des cellules épithéliales intestinales de poulet (Nash et al., 2021).
c. Étude des cellules cibles des infections
L'avantage de la composition multicellulaire des organoïdes intestinaux est l'identification des types de cellules épithéliales ciblées par les pathogènes entériques. Ainsi, des expériences de double immunomarquage en fluorescence sur des entéroïdes de porc ont démontré que les virus PEDV et le PDCoV infectaient principalement les entérocytes, les cellules souches et les cellules caliciformes (Tsai et al., 2018 ; Li et al., 2019b ; Resende et al., 2020). Ces études permettent donc de reproduire in vitro l'infection de l'épithélium intestinal dans un environnement plus physiologique.
Les organoïdes intestinaux peuvent également être utilisés pour mieux comprendre le tropisme du segment digestif des agents pathogènes entériques. En effet, les organoïdes intestinaux conservent in vitro le phénotype de leur segment digestif d'origine, comme discuté ci-dessus. La susceptibilité à l'infection par PEDV et PDCoV était plus élevée chez les organoïdes de porc de l'intestin grêle que chez les organoïdes du côlon, reflétant les observations in vivo (Tsai et al., 2018 ; Li et al., 2019b). Des études plus approfondies ont démontré que le tropisme préférentiel du jéjunum du PDCoV était associé à une expression plus élevée du récepteur d'entrée aminopeptidase N dans les entéroïdes du jéjunum par rapport aux organoïdes dérivés d'autres segments digestifs (Tsai et al., 2018).
d. Étude des réponses aux infections
Après contact avec les agents pathogènes, les organoïdes intestinaux sont également capables d'initier des réponses immunitaires innées. Les organoïdes de porc infectés par des coronavirus porcins (PEDV, PDCoV et TGEV) augmentent l'expression des gènes des interférons de type I et des cytokines inflammatoires (Tsai et al., 2018 ; Li et al., 2019b ; Resende et al., 2020). Les cellules épithéliales intestinales d'organoïdes peuvent également répondre à des stimulations par des endotoxines bactériennes de Salmonella Typhimurium et de Bacillus subtilis en produisant de l'IL6 et de l'IL8 comme cela a été décrit dans le modèle aviaire (Orr et al., 2021). C'est également le cas lors d'interactions de ligands bactériens et viraux avec des entéroïdes de chevaux, qui répondent en produisant des cytokines inflammatoires telles que du TNF-α (Tumor necrosis factor–α, du TGFꞵ, de l'IL33 et de l'IFNꞵ (Interferon–ꞵ (Hellman, 2021).
e. Étude des interactions des cellules épithéliales avec des bactéries commensales
Si les connaissances scientifiques du dialogue entre les pathogènes et l'intestin vont continuer de s'accroître grâce à l'utilisation des modèles des organoïdes intestinaux des animaux de rente, ces derniers sont également d'une grande utilité pour aider à évaluer l'impact des bactéries commensales dans le maintien de l'épithélium intestinal, dans sa maturation ou régénération lors de processus de cicatrisation (Min et al., 2020 ; Rubert et al., 2020) et dans ses fonctions digestives. En effet, in vivo, l'épithélium intestinal est en contact permanent avec des microorganismes commensaux constituant le microbiote intestinal. Actuellement, la plupart des études co-cultivant les organoïdes intestinaux avec des bactéries commensales ont été réalisées avec des organoïdes murins ou humains. Par exemple, des études utilisant des organoïdes intestinaux murins ont révélé un lien entre le microbiote intestinal et la régénération épithéliale. En effet, les cellules souches répondent fortement au peptidoglycane des bactéries du microbiote qui stimule la survie des cellule souches (Nigro et al., 2014). Dans une autre étude, la coculture des organoïdes iléaux de souris avec une bactérie intestinale commensale Akkermansia muciniphila a permis de démontrer le rôle de bactéries du microbiote et de leur production en métabolites dans le renouvellement de l'épithélium intestinal (Lukovac et al., 2014). Un effet réparateur a également pu être illustré après stimulation des organoïdes de l'intestin grêle de souris préalablement traité au TNF par le probiotique Lactobacillus reuteri (Hou et al., 2018). Chez le poulet, une étude récente a décrit l'effet du probiotique Lactobacillus salivarius et du succinate qu'il produit, sur la stimulation des cellules souches intestinales à la fois in vivo et in vitro sur les organoïdes de poulets (Zhou et al., 2022). L'utilisation des organoïdes dans cette étude a permis de proposer un mécanisme d'action impliquant une stimulation du métabolisme énergétique mitochondrial des cellules souches intestinales par le succinate (Zhou et al., 2022). Le microbiote intestinal joue donc un rôle essentiel dans l'homéostasie et la réparation de l'épithélium, toutefois il représente un immensément complexe écosystème. En effet, les microbes intestinaux interagissent les uns avec les autres en partageant les ressources et les réseaux métaboliques, conduisant ainsi à des comportements compétitifs, mutualistes ou symbiotiques (Stubbendieck et al., 2016). Les modèles d'étude évaluant les effets d'un seul microbe peuvent facilement exagérer l'impact du microbiote intestinal individuel, soulignant l'avantage de complexifier les modèles de culture organoïdes intestinaux in vitro par de nouvelles approches introduisant de la fluidique et des échanges gazeux contrôlés (voir paragraphe suivant).
5. Complexification des modèles d’organoïdes intestinaux des animaux de rente dans le futur…
Des avancées récentes ont montré qu’il était possible de complexifier encore plus les modèles de culture d’organoïdes intestinaux, essentiellement humains et murins, pour obtenir un modèle in vitro le plus physiologique possible. Pour cela, des composantes du système nerveux entérique, des cellules immunitaires, des contraintes mécaniques reproduisant le péristaltisme, ou encore une exposition à du microbiote peuvent être ajoutés à la culture in vitro pour reproduire au mieux la complexité de l’environnement intestinal.
a. Co-culture avec des cellules immunitaires
Les organoïdes intestinaux ne comportent pas de cellules immunitaires dont l'origine cellulaire est différente. Environ 60-70 % des cellules immunitaires (macrophages, cellules dendritiques, cellules lymphoïdes, lymphocytes T et B) sont retrouvées au niveau de l'intestin. Il existe une coopération entre l'épithélium intestinal et le système immunitaire afin de renforcer la barrière intestinale, protéger l'organisme contre les agressions extérieures et permettre la tolérance des aliments. Pour récapituler cet environnement cellulaire, différentes cellules du système immunitaire telles que des lymphocytes T et des macrophages ont été co-cultivés avec des organoïdes intestinaux humains (Staab et al., 2020 ; Schreurs et al., 2021). Le modèle d'organoïdes intestinaux humains en 2D cultivés avec des macrophages du côté basolatéral a permis de reproduire le phénomène d'extension de dendrites à travers la monocouche de cellules épithéliales servant à capter des particules étrangères comme des bactéries pathogènes du côté apical (Noel et al., 2017). La co-culture avec des lymphocytes a permis de décrire l'effet positif de l'IL-2, une cytokine produite par les cellules lymphoïdes en prolifération sur la maturation des organoïdes humain dérivés d'iPSC, visualisée microscopiquement par l'augmentation du nombre de bourgeons (cryptes) par organoïde. Dans ce système, les cellules épithéliales de l'organoïde augmentent leur expression de facteurs de transcription de l'épithélium digestif tels que CDX2, SOX9 et ISX et des marqueurs spécifiques des types cellulaires (entérocytes, cellules entéroendocrines, cellules de Paneth et caliciformes) attestant l'effet de cette cytokine sur l'épithélium intestinal (Jung et al., 2018).
Dans l'intestin et plus particulièrement dans les plaques de Peyer, une cellule épithéliale particulière est présente, il s'agit des cellules M (M pour Microvillosité ou Microfold). Les cellules M sont dépourvues de microvillosités mais, comme d'autres cellules épithéliales, elles se caractérisent par des jonctions intercellulaires puissantes. Ces cellules sont connues pour initier des réponses du système immunitaire au niveau des muqueuses et permettre le transport de microbes et de particules à travers la paroi intestinale, les captant dans la lumière intestinale pour les mener jusqu'à la lamina propria où des interactions avec les cellules immunitaires peuvent avoir lieu. La proximité des cellules épithéliales avec les nombreuses cellules immunitaires des Plaques de Peyer est à l'origine de la différenciation des cellules épithéliales en cellules M via la production de RANKL. Ainsi, en ajoutant la protéine recombinante RANKL dans une culture d'organoïde intestinal humain, des cellules M ont été obtenues in vitro permettant d'étudier la capture de microparticules et le tropisme préférentiel de Salmonella pour ces cellules (Rouch et al., 2016).
Une étude récente a décrit la présence de cellules immunitaires de type macrophage, cellules dendritiques et dans une moindre mesure de cellules NK et de lymphocytes B, dans une culture d'entéroïdes de poulets dérivés de cryptes isolées d'embryon de poulet pendant 7 jours. Les cellules immunitaires présentes dans la culture sont fonctionnelles et capables de phagocytose, toutefois, l'étude ne révèle pas si la présence de ces cellules persiste au fur et à mesure des passages des organoïdes (Nash et al., 2021).
Toutes ces études ouvrent des perspectives pour étudier in vitro par exemple les interactions hôtes pathogènes et plus particulièrement la coopération cellules épithéliales et cellules immunitaires dans cette réponse, chez les animaux de rente.
b. Complexification par ajout de terminaisons nerveuses
Un autre des composants majeurs du tube digestif est le SNE. Le système nerveux entérique joue un rôle essentiel dans l'absorption des nutriments, la perméabilité de la barrière intestinale et la motilité. Des avancées récentes ont permis de mettre au point des co-cultures d'organoïdes intestinaux humains avec des cellules de crête neurales obtenues in vitro à partir de PSC. Co-cultivées avec les cellules épithéliales intestinales de l'organoïdes, elles migrent dans le mésenchyme où elles se différencient en neurones et cellules gliales et permettent l'obtention d'un système nerveux fonctionnel, mimant ainsi les fonctions physiologiques du tissu chez l'homme (Schlieve et al., 2017 ; Workman et al., 2017). Ce modèle n'a pas encore été développé chez l'animal de rente, mais il est aujourd'hui d'un grand intérêt pour les études en neurogastro-entérologie chez l'Homme.
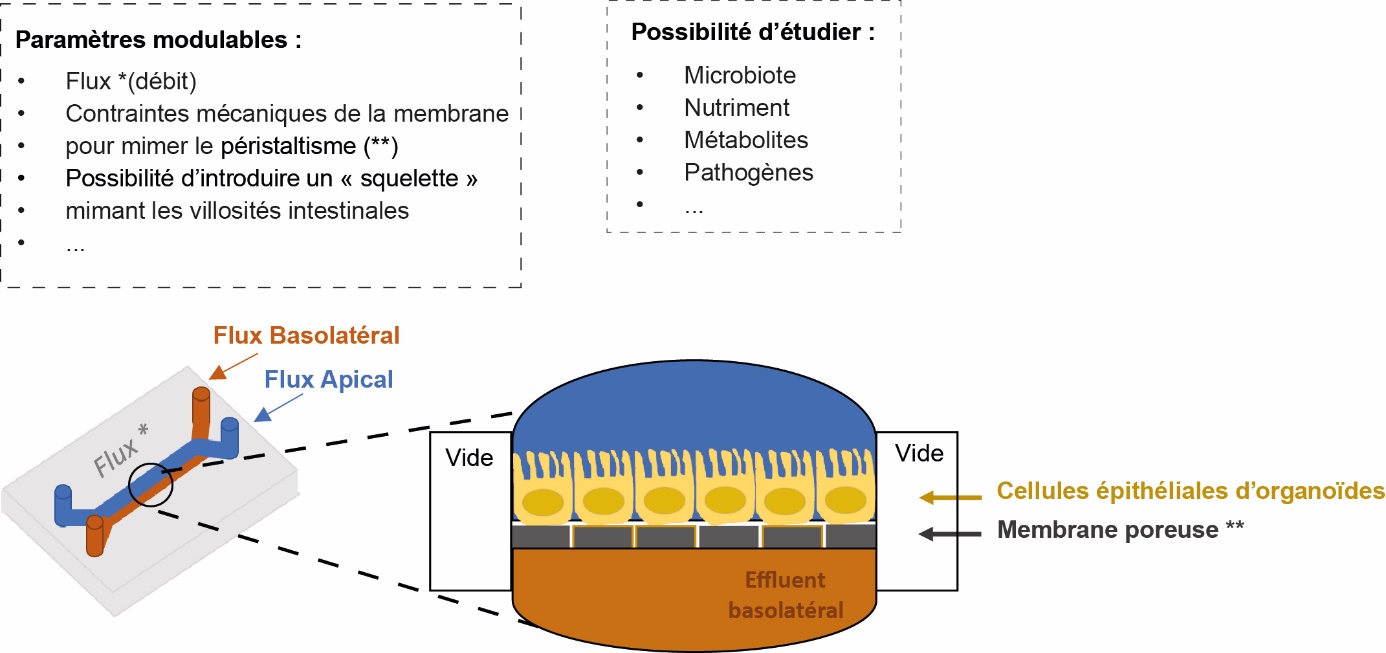
c. Intestin sur puce : de la fluidique pour permettre la co-culture d’un épithélium avec un microbiote intestinal complexe
Les nouveaux dispositifs dit « d’intestin sur puce » représentent une technologie révolutionnaire pour reproduire au mieux le compartiment intestinal en complexifiant la culture « statiques » des cellules épithéliales intestinales. Il comporte un dispositif microfluidique qui reproduit la structure physique, le microenvironnement, les mouvements et la circulation des fluides dans l'intestin (figure 6). Le développement de ces modèles offre des perspectives inespérées pour accélérer la recherche sur le microbiote intestinal et leur utilisation en santé humaine et animal.
En effet, le rôle du microbiote intestinal vis-à-vis de la santé est un domaine de recherche en pleine expansion et une thématique porteuse d’innovation en santé humaine et animale. Les connaissances autour du microbiote intestinal sont source de nouvelles solutions préventives ou thérapeutiques qui intéressent de nombreux secteurs industriels (agroalimentaire, pharmaceutique, diagnostic, ou nutrition-santé, humaine ou animale).
La croissance de communautés bactériennes intestinales complexes est faisable in vitro mais nécessite des conditions de milieu et d'oxygénation particulières. Le dispositif dit « intestin sur puce » permet d'introduire une culture stable de communautés microbiennes complexes au contact des cellules épithéliales d'organoïdes. Le cœur du dispositif est une puce miniaturisée qui comprend une membrane poreuse sur laquelle sont ensemencées les cellules intestinales entourée de deux micro-canaux pour alimenter respectivement les pôles apical et basal des cellules épithéliales. Cette disposition permet de simuler la barrière entre la lumière intestinale et le système vasculaire drainant. L'apport continu de nutriments est assuré par les canaux de microfluidique reliés à des pompes. Parce que ce dispositif permet d'appliquer des conditions de culture distinctes entre deux compartiments, c'est aujourd'hui l'outil le plus performant et le plus pertinent pour modéliser in vitro les interactions entre cellules digestives et les micro-organismes (Siwczak et al., 2021). Aujourd'hui, ce dispositif n'a pas encore été utilisé avec les organoïdes des animaux de rente mais seulement à partir d'organoïdes humain (Kasendra et al., 2018 ; Beaurivage et al., 2020). Il a notamment permis de montrer qu'il était possible de maintenir des communautés bactériennes avec plusieurs espèces sur une période de quelques jours à quelques semaines (Marzorati et al., 2014 ; Kim et al., 2016). Des études plus récentes sur ce nouveau modèle de puces démontrent la possibilité de cultiver des bactéries aérobies et anaérobies sur plusieurs jours en soumettant au dispositif un gradient d'oxygène du côté basal au côté luminal (Jalili-Firoozinezhad et al., 2019). La complexité de ce nouveau dispositif avec une architecture physique « Crypte -villosités » et des paramètres physiologiques de flux continus et de péristaltisme semble également reproduire des conditions favorables pour une infection par des agents pathogènes entériques. Lors d'une infection in vitro par la bactérie pathogène humaine Shigella, l'expression des facteurs d'invasion est activée favorisant ainsi son entrée dans les cellules épithéliales (Grassart et al., 2019).
Conclusion
De plus en plus et dans de nombreux domaines, les organoïdes remplacent les modèles de culture in vitro traditionnels. En élevage, le développement de cet outil biologique est d'autant plus important qu'il représente le seul modèle cellulaire disponible pour certaines espèces et permet de réduire le nombre d’animaux en expérimentation répondant ainsi au principe des 3R et à la demande sociétale. La création de biobanques d'organoïdes intestinaux d'animaux d'élevage disponibles en tant que ressources ouvertes pour la communauté des chercheurs contribuerait également à la réduction des expérimentations sur des animaux vivants. Comme condition préalable à la création de biobanques partagées, l'harmonisation des protocoles utilisés pour la culture d'organoïdes intestinaux d’animaux de rente (par exemple la composition des milieux de culture) et la proposition de lignes directrices pour assurer la reproductibilité des modèles entre les laboratoires sont absolument nécessaires.
Les domaines d'application des organoïdes intestinaux des animaux de rente sont très nombreux pour les études à la fois en recherche fondamentale et en recherche appliquée. Mieux comprendre les infections (sensibilité ou résistance de l'hôte à une infection, ou expression de facteurs de virulence des pathogènes dans un environnement particulier…), l'efficacité alimentaire ou encore analyser le génome sont autant de questionnements qui seront plus faciles à appréhender avec ces nouveaux outils. Ils seront également très utiles pour la recherche appliquée avec principalement des criblages de molécules/microbes pour améliorer la santé intestinale des animaux. Ils ne remplaceront pas les essais sur les animaux, mais permettront de sélectionner les molécules/microbes intéressants à tester in vivo et ainsi réduire le nombre d'animaux utilisés. Ces modèles ayant démontré leur intérêt en recherche, ils ont plus récemment été développés pour les chiens et permettent d'envisager en santé vétérinaire une thérapeutique adaptée pour les animaux de compagnie à partir d'une biopsie intestinale (Chandra et al., 2019 ; Ambrosini et al., 2020 ; Kramer et al., 2020).
L’utilisation de ces outils devient donc incontournable pour les recherches futures et en association avec d’autres nouvelles technologies telles que l’édition des génomes, ces outils représentent des accélérateurs technologiques pour accroitre rapidement les connaissances en recherche humaine et animale.
Contribution des auteurs
Sonia Lacroix-Lamandé (sonia.lamande@inrae.fr) et Agnès Wiedemann (agnes.wiedemann@inrae.fr) ont contribué de façon similaire à l’élaboration cet article.
Remerciements
Les illustrations présentées dans cet article sont issues de travaux financés par le projet ANIMALT FEDER/Region Centre Val de Loire (FEDER convention EX007516, Region Centre 2019-00134936, programme AE-2019-1850), le projet Européen Veterinary Biocontained research facility Network (VETBIONET) et la Fédération de recherche en Infectiologie de la Région Centre Val de Loire (FéRI).
Nous remercions Ophélie Bernardi et Anissa Gagneux pour leur aide technique et Julien Burgault-Gaillard de la plateforme de microscopie de l’Université de Tours pour les images de microscopie électronique à transmission.
Nous remercions le GT organoïdes INRAE et plus particulièrement Dr. Martin Beaumont, Dr. Fany Blanc, Dr. Claire Cherbuy, Dr. Giorgia Egidy et Dr. Elisabetta Giuffra avec qui nous avons rédigé une revue internationale sur les organoïdes intestinaux des animaux de rente (Beaumont et al., 2021) et dont cette synthèse découle en partie. Enfin, nous tenons également à remercier Dr. Sandrine Menard pour la relecture de cette synthèse.
Notes
- Cette synthèse a fait l’objet d’une présentation : Lacroix-Lamandé S., Wiedemann A., 2021. Étude ex vivo des interactions hôte-pathogènes au moyen de cultures d’organoïdes dérivés de cryptes intestinales. 6ème journée thématique de Biotechnocentre « Cellules souches et organoïdes : réalités et perspectives » 25 juin 2021, et d’une publication, Beaumont M., Blanc F., Cherbuy C., Egidy G., Giuffra E., Lacroix-Lamandé S., Wiedemann A., 2021. Intestinal organoids in farm animals, Vet Res, 52, 33.
Références
- Acharya M., Arsi K., Donoghue A.M., Liyanage R., Rath N.C., 2020. Production and characterization of avian crypt-villus enteroids and the effect of chemicals. BMC Vet. Res., 16, 179. doi:10.1186/s12917-020-02397-1
- Alfajaro M., Kim J.Y., Barbe L., Cho E.H., Park J.G., Soliman M., Baek Y.B., Kang M.I., Kim S.H., Kim G.J., Park S.I., Pendu J.L., Cho K.O., 2019. Dual recognition of sialic acid and alphagal epitopes by the vp8* domains of the bovine rotavirus g6p[5] wc3 and of its mono-reassortant g4p[5] rotateq vaccine strains. J. Virol., 93. doi:10.1128/JVI.00941-19
- Ambrosini Y.M., Park Y., Jergens A.E., Shin W., Min S., Atherly T., Borcherding D.C., Jang J., Allenspach K., Mochel J.P., Kim H. J., 2020. Recapitulation of the accessible interface of biopsy-derived canine intestinal organoids to study epithelial-luminal interactions. PLoS One, 15, e0231423. doi:10.1371/journal.pone.0231423
- Bardenbacher M., Ruder B., Britzen-Laurent N., Naschberger E., Becker C., Palmisano R., Sturzl M., Tripal P., 2020. Investigating intestinal barrier breakdown in living organoids. J. Vis. Exp., 9p. doi:10.3791/60546
- Beaumont M., Blanc F., Cherbuy C., Egidy G., Giuffra E., Lacroix-Lamandé S., Wiedemann A., 2021. Intestinal organoids in farm animals. Vet. Res., 52, 33. doi:10.1186/s13567-021-00909-x
- Beaumont M., Lencina C., Painteaux L., Viémon-Desplanque J., Phornlaphat O., Lambert W., Chalvon-Demersay T., 2022. A mix of functional amino acids and grape polyphenols promotes the growth of piglets, modulates the gut microbiota in vivo and regulates epithelial homeostasis in intestinal organoids. Amino Acids, 54, 1357-1369. doi:10.1007/s00726-021-03082-9
- Blake R., Jensen K., Mabbott N., Hope J., Stevens J., 2022. The development of 3d bovine intestinal organoid derived models to investigate mycobacterium avium ssp paratuberculosis pathogenesis. Front Vet. Sci., 921160, 15p. doi:10.3389/fvets.2022.921160
- Beaurivage C., Kanapeckaite A., Loomans C., Erdmann K.S., Stallen J., Janssen R.A.J., 2020. Development of a human primary gut-on-a-chip to model inflammatory processes. Sci. Rep., 10, 21475. doi:10.1038/s41598-020-78359-2
- Bogliotti Y.S., Wu J., Vilarino M., Okamura D., Soto D.A., Zhong C., Sakurai M., Sampaio R.V., Suzuki K., Izpisua Belmonte J.C., Ross P.J., 2018. Efficient derivation of stable primed pluripotent embryonic stem cells from bovine blastocysts. Proc. Natl. Acad. Sci., U S A, 115, 2090-2095. doi:10.1073/pnas.1716161115
- Chandra L., Borcherding D.C., Kingsbury D., Atherly T., Ambrosini Y.M., Bourgois-Mochel A., Yuan W., Kimber M., Qi Y., Wang Q., Wannemuehler M., Ellinwood N.M., Snella E., Martin M., Skala M., Meyerholz D., Estes M., Fernandez-Zapico M. E., Jergens A.E., Mochel J.P., Allenspach K., 2019. Derivation of adult canine intestinal organoids for translational research in gastroenterology. BMC Biol., 17, 33. doi:10.1186/s12915-019-0652-6
- Co J.Y., Margalef-Catala M., Li X., Mah A.T., Kuo C.J., Monack D.M., Amieva M.R., 2019. Controlling Epithelial Polarity: A human enteroid model for host-pathogen interactions. Cell. Rep., 26, 2509-2520 e4. doi:10.1016/j.celrep.2019.01.108
- Co J.Y., Margalef-Catala M., Monack D.M., Amieva M.R., 2021. Controlling the polarity of human gastrointestinal organoids to investigate epithelial biology and infectious diseases. Nat. Protoc., 16, 5171-5192. doi:10.1038/s41596-021-00607-0
- Crawford C.K., Lopez Cervantes V., Quilici M.L., Armién A.G., Questa M., Matloob M.S., Huynh L.D., Beltran A., Karchemskiy S.J., Crakes K.R., Kol A., 2022. Inflammatory cytokines directly disrupt the bovine intestinal epithelial barrier. Sci Rep., 26, 12, 14578. doi:10.1038/s41598-022-18771-y.
- d'Aldebert E., Quaranta M., Sebert M., Bonnet D., Kirzin S., Portier G., Duffas J.P., Chabot S., Lluel P., Allart S., Ferrand A., Alric L., Racaud-Sultan C., Mas E., Deraison C., Vergnolle N., 2020. Characterization of human colon organoids from inflammatory bowel disease patients. Front Cell Dev. Biol., 8, 363. doi:10.3389/fcell.2020.00363
- Derricott H., Luu L., Fong W.Y., Hartley C.S., Johnston L.J., Armstrong S.D., Randle N., Duckworth C.A., Campbell B.J., Wastling J.M., Coombes J.L., 2019. Developing a 3D intestinal epithelium model for livestock species. Cell Tissue Res, 375, 409-424. doi:10.1007/s00441-018-2924-9
- Dutta D., Heo I., O'Connor R., 2019. Studying cryptosporidium infection in 3d tissue-derived human organoid culture systems by microinjection. Jove-Journal Visualized Exp. doi:10.3791/59610
- Engevik A.C., Coutts., A.W., Kaji I., Rodriguez P., Ongaratto F., Saqui-Salces M., Medida R.L., Meyer A.R., Kolobova E., Engevik M.A., Williams J.A., Shub M.D., Carlson D. F., Melkamu T., Goldenring J.R., 2020. Editing myosin VB gene to create porcine model of Microvillus Inclusion Disease, With Microvillus-Lined Inclusions and Alterations in sodium transporters. Gastroenterology, 158, 2236-2249 e9. doi:10.1053/j.gastro.2020.02.034
- Ferrandis Vila M., Trudeau M.P., Hung Y.T., Zeng Z., Urriola P.E., Shurson G.C., Saqui-Salces M., 2018. Dietary fiber sources and non-starch polysaccharide-degrading enzymes modify mucin expression and the immune profile of the swine ileum. PLoS One, 13, e0207196. doi:10.1371/journal.pone.0207196
- Fitzgerald S.F., Beckett A. E., Palarea-Albaladejo J., McAteer S., Shaaban S., Morgan J., Ahmad N.I., Young R., Mabbott N.A., Morrison L., Bono J.L., Gally D.L., McNeilly T.N., 2019. Shiga toxin sub-type 2a increases the efficiency of Escherichia coli O157 transmission between animals and restricts epithelial regeneration in bovine enteroids. PLoS Pathog., 15, e1008003. doi:10.1371/journal.ppat.1008003
- Gao X., Nowak-Imialek M., Chen X., Chen D., Herrmann D., Ruan D., Chen A.C.H., Eckersley-Maslin M.A., Ahmad S., Lee Y. L., Kobayashi T., Ryan D., Zhong J., Zhu J., Wu J., Lan G., Petkov S., Yang J., Antunes L., Campos L.S., Fu B., Wang S., Yong Y., Wang X., Xue S. G., Ge L., Liu Z., Huang Y., Nie T., Li P., Wu D., Pei D., Zhang Y., Lu L., Yang F., Kimber S.J., Reik W., Zou X., Shang Z., Lai L., Surani A., Tam P.P.L., Ahmed A., Yeung W.S.B., Teichmann S.A., Niemann H., Liu P., 2019. Establishment of porcine and human expanded potential stem cells. Nat. Cell Biol., 21, 687-699. doi:10.1038/s41556-019-0333-2
- Gehart H., Clevers H., 2019. Tales from the crypt: new insights into intestinal stem cells. Nat. Rev. Gastroenterol. Hepatol., 16, 19-34. doi:10.1038/s41575-018-0081-y
- Gonzalez L.M., Williamson I., Piedrahita J.A., Blikslager A.T., Magness S.T., 2013. Cell lineage identification and stem cell culture in a porcine model for the study of intestinal epithelial regeneration, PLoS One, 8, e66465. doi:10.1371/journal.pone.0066465
- Grassart A., Malarde V., Gobaa S., Sartori-Rupp A., Kerns J., Karalis K., Marteyn B., Sansonetti P., Sauvonnet N., 2019. Bioengineered human organ-on-chip reveals intestinal microenvironment and mechanical forces impacting shigella infection. Cell Host Microbe, 26, 435-444 e4. doi:10.1016/j.chom.2019.08.007
- Gribble F.M., Reimann F., 2019. Function and mechanisms of enteroendocrine cells and gut hormones in metabolism. Nat. Rev. Endocrinol., 15, 226-237. doi:10.1038/s41574-019-0168-8
- Hamilton C.A., Young R., Jayaraman S., Sehgal A., Paxton E., Thomson S., Katzer F., Hope J., Innes E., Morrison L.J., Mabbott N.A., 2018. Development of in vitro enteroids derived from bovine small intestinal crypts. Vet. Res., 49, 54. doi:10.1186/s13567-018-0547-5
- Hellman S., 2021. Generation of equine enteroids and enteroid-derived 2D monolayers that are responsive to microbial mimics. Vet. Res., 52, 108. doi:10.1186/s13567-021-00976-0
- Heo I., Dutta D., Schaefer D.A., Iakobachvili N., Artegiani B., Sachs N., Boonekamp K.E., Bowden G., Hendrickx A.P.A., Willems R.J.L., Peters P.J., Riggs M.W., O'Connor R., Clevers H., 2018. Modelling Cryptosporidium infection in human small intestinal and lung organoids. Nature Microb., 3, 814-823. doi:10.1038/s41564-018-0177-8
- Hofer M., Lutolf M.P., 2021. Engineering organoids. Nat. Rev. Materials, 6, 402-420. doi:10.1038/s41578-021-00279-y
- Hoffmann P., Schnepel N., Langeheine M., Kunnemann K., Grassl G.A., Brehm R., Seeger B., Mazzuoli-Weber G., Breves G., 2021. Intestinal organoid-based 2D monolayers mimic physiological and pathophysiological properties of the pig intestine. PLoS One, 16: e0256143. doi:10.1371/journal.pone.0256143
- Holmberg F.E., Seidelin J.B., Yin X., Mead B. E., Tong Z., Li Y., Karp J. M., Nielsen O. H., 2017. Culturing human intestinal stem cells for regenerative applications in the treatment of inflammatory bowel disease. EMBO Mol. Med., 9, 558-570. doi:10.15252/emmm.201607260
- Holthaus D., Delgado-Betancourt E., Aebischer T., Seeber F., Klotz C., 2020. Harmonization of protocols for multi-species organoid platforms to study the intestinal biology of toxoplasma gondii and other protozoan infections. Front Cell Infect. Microbiol., 10, 610368. doi:10.3389/fcimb.2020.610368
- Hou Q., Ye L., Liu H., Huang L., Yang Q., Turner J.R., Yu Q., 2018. Lactobacillus accelerates ISCs regeneration to protect the integrity of intestinal mucosa through activation of STAT3 signaling pathway induced by LPLs secretion of IL-22. Cell Death Differ., 25: 1657-1670. doi:10.1038/s41418-018-0070-2
- In J.G., Foulke-Abel J., Estes M.K., Zachos N.C., Kovbasnjuk O., Donowitz M., 2016. Human mini-guts: new insights into intestinal physiology and host-pathogen interactions. Nat. Rev. Gastroenterol. Hepatol., 13, 633-642. doi:10.1038/nrgastro.2016.142
- Jalili-Firoozinezhad S., Gazzaniga F.S., Calamari E.L., Camacho D.M., Fadel C.W., Bein A., Swenor B., Nestor B., Cronce M.J., Tovaglieri A., Levy O., Gregory K.E., Breault D.T, Cabral J.M.S., Kasper D.L., Novak R., Ingber D.E., 2019. A complex human gut microbiome cultured in an anaerobic intestine-on-a-chip, Nat. Biomed. Eng., 3, 520-531. doi:10.1038/s41551-019-0397-0
- Joo S.S., Gu B.H., Park Y.J., Rim C.Y., Kim M.J., Kim S.H., Cho J.H., Kim H.B., Kim M., 2022. Porcine Intestinal Apical-Out Organoid Model for Gut Function Study. Animals (Basel). 12, 372. doi:10.3390/ani12030372.
- Jung K.B., Lee H., Son Y.S., Lee M.O., Kim Y.D., Oh S.J., Kwon O., Cho S., Cho H.S., Kim D.S., Oh J.H., Zilbauer M., Min J.K., Jung C.R., Kim J., Son M.Y., 2018. Interleukin-2 induces the in vitro maturation of human pluripotent stem cell-derived intestinal organoids. Nat. Commun., 9, 3039. doi:10.1038/s41467-018-05450-8
- Kar S.K., Wells J.M., Ellen E.D., Te Pas M.F.W., Madsen O., Groenen M.A.M., Woelders H., 2021. Organoids: a promising new in vitro platform in livestock and veterinary research. Vet. Res., 52, 43. doi:10.1186/s13567-021-00904-2
- Kardia E., Frese M., Smertina E., Strive T., Zeng X. L., Estes M., Hall R. N., 2021. Culture and differentiation of rabbit intestinal organoids and organoid-derived cell monolayers. Sci. Rep., 11, 5401. doi:10.1038/s41598-021-84774-w
- Kasendra M., Tovaglieri A., Sontheimer-Phelps A., Jalili-Firoozinezhad S., Bein A., Chalkiadaki A., Scholl W., Zhang C., Rickner H., Richmond C.A., Li H., Breault D.T., Ingber D.E., 2018. Development of a primary human small intestine-on-a-chip using biopsy-derived organoids. Sci. Rep., 8, 2871. doi:10.1038/s41598-018-21201-7
- Kim H.J., Li H., Collins J.J., Ingber D.E., 2016. Contributions of microbiome and mechanical deformation to intestinal bacterial overgrowth and inflammation in a human gut-on-a-chip, Proc. Natl. Acad. Sci. USA, 113, E7-15. doi:10.1073/pnas.1522193112
- Koltes D.A., Gabler N.K., 2016. Characterization of porcine intestinal enteroid cultures under a lipopolysaccharide challenge1. J. Anim. Sci., 94, 335-339. doi:10.2527/jas.2015-9793
- Kramer N., Pratscher B., Meneses A.M.C., Tschulenk W., Walter I., Swoboda A., Kruitwagen H.S., Schneeberger K., Penning L.C., Spee B., Kieslinger M., Brandt S., Burgener I.A., 2020. Generation of differentiating and long-living intestinal organoids reflecting the cellular diversity of canine intestine. Cells, 9. doi:10.3390/cells9040822
- Lacroix-Lamandé S., Wiedemann A., 2021. Étude ex vivo des interactions hôte-pathogènes au moyen de cultures d’organoïdes dérivés de cryptes intestinales. Journée Thématique de Biotechnocentre « Cellules souches et organoïdes : réalités et perspectives » 6, Juin 2021, Orléans, France.
- Lee B.R., Yang H., Lee S.I., Haq I., Ock S.A., Wi H., Lee H.C., Lee P., Yoo J.G., 2021. Robust three-dimensional (3D) expansion of bovine intestinal organoids: An in vitro model as a potential alternative to an in vivo system. Animals (Basel), 11. doi:10.3390/ani11072115
- Li J., Li Jr J., Zhang S.Y., Li R. X., Lin X., Mi Y.L., Zhang C.Q., 2018. Culture and characterization of chicken small intestinal crypts, Poult. Sci., 97, 1536-1543. doi:10.3382/ps/pey010
- Li L., Fu F., Guo S., Wang H., He X., Xue M., Yin L., Feng L., Liu P., 2019a. Porcine intestinal enteroids: a new model for studying enteric coronavirus porcine epidemic diarrhea virus infection and the host innate response. J. Virol., 93. doi:10.1128/JVI.01682-18
- Li X.G., Zhu M., Chen M.X., Fan H.B., Fu H.L., Zhou J.Y., Zhai Z.Y., Gao C.Q., Yan H.C., Wang X.Q., 2019b. Acute exposure to deoxynivalenol inhibits porcine enteroid activity via suppression of the Wnt/beta-catenin pathway. Toxicol. Lett., 305, 19-31. doi:10.1016/j.toxlet.2019.01.008
- Li Y., Yang N., Chen J., Huang X., Zhang N., Yang S., Liu G., Liu G., 2020. Next-generation porcine intestinal organoids: an apical-out organoid model for swine enteric virus infection and immune response investigations. J. Virol., doi:10.1128/JVI.01006-20
- Lukovac S., Belzer C., Pellis L., Keijser B.J., de Vos W.M., Montijn R.C., Roeselers G., 2014. Differential modulation by Akkermansia muciniphila and Faecalibacterium prausnitzii of host peripheral lipid metabolism and histone acetylation in mouse gut organoids, mBio, 5. doi:10.1128/mBio.01438-14
- Luo H., Zheng J., Chen Y., Wang T., Zhang Z., Shan Y., Xu J., Yue M., Fang W., Li X., 2020. Utility evaluation of porcine enteroids as pdcov infection model in vitro. Front Microbiol., 11, 821. doi:10.3389/fmicb.2020.00821
- Marzorati M., Vanhoecke B., De Ryck T., Sadaghian Sadabad M., Pinheiro I., Possemiers S., Van den Abbeele P., Derycke L., Bracke M., Pieters J., Hennebel T., Harmsen H.J., Verstraete W., Van de Wiele T., 2014. The HMI module: a new tool to study the Host-Microbiota Interaction in the human gastrointestinal tract in vitro. BMC Microbiol., 14, 133. doi:10.1186/1471-2180-14-133
- Middendorp S., Schneeberger K., Wiegerinck C.L., Mokry M., Akkerman R.D., van Wijngaarden S., Clevers H., Nieuwenhuis E.E., 2014. Adult stem cells in the small intestine are intrinsically programmed with their location-specific function. Stem Cells, 32, 1083-1091. doi:10.1002/stem.1655
- Min S., Kim S., Cho S.W., 2020. Gastrointestinal tract modeling using organoids engineered with cellular and microbiota niches. Exp. Mol. Med., 52, 227-37. doi:10.1038/s12276-020-0386-0
- Mussard E., Pouzet C., Helies V., Pascal G., Fourre S., Cherbuy C., Rubio A., Vergnolle N., Combes S., Beaumont M., 2020. Culture of rabbit cæcum organoids by reconstituting the intestinal stem cell niche in vitro with pharmacological inhibitors or L-WRN conditioned medium. Stem Cell Res., 48, 101980. doi:10.1016/j.scr.2020.101980
- Mussard E., Lencina C., Boudry G., Achard C.S., Klotz C., Combes S., Beaumont M., 2023. Culture of Piglet Intestinal 3D Organoids from Cryopreserved Epithelial Crypts and Establishment of Cell Monolayers. J. Vis. Exp., 10, 192. doi:10.3791/64917
- Nash T.J., Morris K.M., Mabbott N.A., Vervelde L., 2021. Inside-out chicken enteroids with leukocyte component as a model to study host-pathogen interactions. Commun. Biol., 4, 377. doi:10.1038/s42003-021-01901-z
- Nash T.J., Morris K.M., Mabbott N.A., Vervelde L., 2023. Temporal transcriptome profiling of floating apical out chicken enteroids suggest stability and reproducibility. Vet. Res., 54, 12. doi:10.1186/s13567-023-01144-2
- Nigro G., Rossi R., Commere P.H., Jay P., Sansonetti P.J., 2014. The cytosolic bacterial peptidoglycan sensor Nod2 affords stem cell protection and links microbes to gut epithelial regeneration. Cell Host Microbe, 15, 792-798. doi:10.1016/j.chom.2014.05.003
- Noel G., Baetz N.W., Staab J.F., Donowitz M., Kovbasnjuk O., Pasetti M. F., Zachos. N.C., 2017. A primary human macrophage-enteroid co-culture model to investigate mucosal gut physiology and host-pathogen interactions. Sci. Rep., 7, 45270. doi:10.1038/srep45270
- Oost M.J., Ijaz A., Van Haarlem D.A., Van Summeren K., Velkers F.C., Kraneveld A.D., Venema K, Jansen C.A., Pieters R.H., Ten Klooster J.P., 2022. Chicken-derived RSPO1 and WNT3 contribute to maintaining longevity of chicken intestinal organoid cultures. Sci. Rep. 12, 10563. doi:10.1038/s41598-022-14875-7
- Orr B., Sutton K., Christian S., Nash T., Niemann H., Hansen L.L., McGrew M.J., Jensen S.R., Vervelde L., 2021. Novel chicken two-dimensional intestinal model comprising all key epithelial cell types and a mesenchymal sub-layer. Vet. Res., 52, 142. doi:10.1186/s13567-021-01010-z
- Pain B., 2021. Organoids in domestic animals: with which stem cells? Vet. Res., 52, 38. doi:10.1186/s13567-021-00911-3
- Panek M., Grabacka M., Pierzchalska M., 2018. The formation of intestinal organoids in a hanging drop culture. Cytotechnology, 70, 1085-1095. doi:10.1007/s10616-018-0194-8
- Park K.W., Yang H., Lee M.G., Ock S.A., Wi H., Lee P., Hwang I.S., Yoo J.G., Park C.K., Lee B.R., 2022. Establishment of intestinal organoids from small intestine of growing cattle (12 months old). J. Anim. Sci. Technol., 64, 1105-1116. doi:10.5187/jast.2022.e70
- Pierzchalska M., Grabacka M., Michalik M., Zyla K., Pierzchalski P., 2012. Prostaglandin E2 supports growth of chicken embryo intestinal organoids in Matrigel matrix. Biotechniques, 52, 307-315. doi:10.2144/0000113851
- Pierzchalska M., Panek M., Czyrnek M., Gielicz A., Mickowska B., Grabacka M., 2017. Probiotic Lactobacillus acidophilus bacteria or synthetic TLR2 agonist boost the growth of chicken embryo intestinal organoids in cultures comprising epithelial cells and myofibroblasts. Comp. Immunol. Microbiol. Infect. Dis., 53, 7-18. doi:10.1016/j.cimid.2017.06.002
- Pierzchalska M., Panek M., Czyrnek M., Grabacka M., 2019. The Three-Dimensional Culture of Epithelial Organoids Derived from Embryonic Chicken Intestine. Methods Mol. Biol., 1576, 135-144. doi:10.1007/7651_2016_15
- Powell R.H., Behnke M.S., 2017. WRN conditioned media is sufficient for in vitro propagation of intestinal organoids from large farm and small companion animals. Biol. Open, 6, 698-705. doi:10.1242/bio.021717
- Puschhof J., Pleguezuelos-Manzano C., Martinez-Silgado A., Akkerman N., Saftien A., Boot C., de Waal A., Beumer J., Dutta D., Heo I., Clevers H., 2021. Intestinal organoid cocultures with microbes. Nat. Protoc., 16, 4633-4649. doi:10.1038/s41596-021-00589-z
- Rahman S., Ghiboub M., Donkers J.M., van de Steeg E., van Tol E.A.F., Hakvoort T.B.M., de Jonge W.J., 2021. The Progress of Intestinal Epithelial Models from Cell Lines to Gut-On-Chip. Int. J. Mol. Sci., 22. doi:10.3390/ijms222413472
- Randall K.J., Turton J., Foster J.R., 2011. Explant culture of gastrointestinal tissue: a review of methods and applications. Cell Biol. Toxicol., 27, 267-284. doi:10.1007/s10565-011-9187-5
- Resende T.P., Medida R.L., Vannucci F.A., Saqui-Salces M., Gebhart C., 2020. Evaluation of swine enteroids as in vitro models for Lawsonia intracellularis infection1,2. J. Anim. Sci., 98. doi:10.1093/jas/skaa011
- Rouch J.D., Scott A., Lei N.Y., Solorzano-Vargas R.S., Wang J., Hanson E.M., Kobayashi M., Lewis M., Stelzner M. G., Dunn J. C., Eckmann L., Martin M. G., 2016. Development of functional microfold (m) cells from intestinal stem cells in primary human enteroids', PLoS One. 11, e0148216. doi:10.1371/journal.pone.0148216
- Rubert J., Schweiger P.J., Mattivi F., Tuohy K., Jensen K.B., Lunardi A., 2020. Intestinal organoids: a tool for modelling diet-microbiome-host interactions. Trends Endocrinol. Metab., 31, 848-858. doi:10.1016/j.tem.2020.02.004
- Sato T., Clevers H., 2013. Growing self-organizing mini-guts from a single intestinal stem cell: mechanism and applications. Science, 340, 1190-1194. doi:10.1126/science.1234852
- Sato T., Vries R.G., Snippert H.J., van de Wetering M., Barker N., Stange D. E., van Es J.H., Abo A., Kujala P., Peters P.J., Clevers H., 2009. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature, 459, 262-265. doi:10.1038/nature07935
- Sato T., Stange D.E., Ferrante M., Vries R.G., Van Es J.H., Van den Brink S., Van Houdt W.J., Pronk A., Van Gorp J., Siersema P.D., Clevers H., 2011a. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology, 141, 1762-1772. doi:10.1053/j.gastro.2011.07.050
- Sato T., van Es J.H., Snippert H.J., Stange D.E., Vries R.G., van den Born M., Barker N., Shroyer N.F., van de Wetering M., Clevers H., 2011b. Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts. Nature, 469, 415-418. doi:10.1038/nature09637
- Schlieve C.R., Fowler K.L., Thornton M., Huang S., Hajjali I., Hou X., Grubbs B., Spence J.R., Grikscheit T.C., 2017. Neural crest cell implantation restores enteric nervous system function and alters the gastrointestinal transcriptome in human tissue-engineered small intestine. Stem Cell Reports, 9, 883-896. doi:10.1016/j.stemcr.2017.07.017
- Schreurs Rrce., Baumdick M.E., Drewniak A., Bunders M.J., 2021. In vitro co-culture of human intestinal organoids and lamina propria-derived CD4(+) T cells. STAR Protoc., 2, 100519. doi:10.1016/j.xpro.2021.100519
- Seeger B., 2020. Farm animal-derived models of the intestinal epithelium: recent advances and future applications of intestinal organoids. Altern. Lab. Anim., 48, 215-233. doi:10.1177/0261192920974026
- Seishima R., Barker N., 2019. A contemporary snapshot of intestinal stem cells and their regulation. Differentiation, 108, 3-7. doi:10.1016/j.diff.2019.01.004
- Shakya R., Jiménez-Meléndez A., Robertson L.J., Myrmel M., 2023. Bovine Enteroids as an In Vitro Model for Infection with Bovine Coronavirus. Viruses. 15, 635. doi:10.3390/v15030635
- Siwczak F., Loffet E., Kaminska M., Koceva H., Mahe M.M., Mosig A.S., 2021. Intestinal stem cell-on-chip to study human host-microbiota interaction. Front. Immunol., 12, 798552. doi:10.3389/fimmu.2021.798552
- Smith D., Price D.R.G., Burrells A., Faber M.N., Hildersley K.A., Chintoan-Uta C., Chapuis A.F., Stevens M., Stevenson K., Burgess S.T.G., Innes E.A., Nisbet A.J., McNeilly T.N., 2021. The development of ovine gastric and intestinal organoids for studying ruminant host-pathogen interactions. Front. Cell. Infect. Microbiol., 11, 733811. doi:10.3389/fcimb.2021.733811
- Staab J.F., Lemme-Dumit J.M., Latanich R., Pasetti M.F., Zachos N.C., 2020. Co-culture system of human enteroids/colonoids with innate immune cells. Curr. Protoc. Immunol., 131, e113. doi:10.1002/cpim.113
- Stelzner M., Helmrath M., Dunn J.C., Henning S.J., Houchen C.W., Kuo C., Lynch J., Li L., Magness S.T., Martin M.G., Wong M.H., Yu J., 2012. A nomenclature for intestinal in vitro cultures. Am. J. Physiol. Gastrointest. Liver Physiol., 302, G1359-1363. doi:10.1152/ajpgi.00493.2011
- Stewart A.S., Freund J.M., Gonzalez L.M., 2018. Advanced three-dimensional culture of equine intestinal epithelial stem cells. Equine Vet. J., 50, 241-248. doi:10.1111/evj.12734
- Stewart A.S., Schaaf C.R., Veerasammy B., Freund J.M., Gonzalez L.M., 2022. Culture of equine intestinal epithelial stem cells after delayed tissue storage for future applications. BMC Vet. Res., 18, 445. doi:10.1186/s12917-022-03552-6.
- Stubbendieck R.M., Vargas-Bautista C., Straight P.D., 2016. Bacterial communities: interactions to scale. Front Microbiol., 7, 1234. doi:10.3389/fmicb.2016.01234
- Topfer E., Pasotti A., Telopoulou A., Italiani P., Boraschi D., Ewart M.A., Wilde C., 2019. Bovine colon organoids: From 3D bioprinting to cryopreserved multi-well screening platforms. Toxicol. In Vitro, 61, 104606. doi:10.1016/j.tiv.2019.104606
- Tsai Y.H., Czerwinski M., Wu A., Dame M.K., Attili D., Hill E., Colacino J.A., Nowacki L.M., Shroyer N.F., Higgins P.D.R., Kao J.Y., Spence J.R., 2018. A method for cryogenic preservation of human biopsy specimens and subsequent organoid culture. Cell Mol. Gastroenterol. Hepatol., 6, 218-222 e7. doi:10.1016/j.jcmgh.2018.04.008
- van der Hee B., Loonen L.M.P., Taverne N., Taverne-Thiele J.J., Smidt H., Wells M., 2018. Optimized procedures for generating an enhanced, near physiological 2D culture system from porcine intestinal organoids. Stem Cell Res., 28, 165-171. doi:10.1016/j.scr.2018.02.013
- van der Hee B., Madsen O., Vervoort J., Smidt H., Wells J.M., 2020. Congruence of transcription programs in adult stem cell-derived jejunum organoids and original tissue during long-term culture. Front Cell Dev. Biol., 8, 375. doi:10.3389/fcell.2020.00375
- Vergauwen H., 2015. The IPEC-J2 Cell Line. In: Verhoeckx K., Cotter P., Lopez-Exposito I., Kleiveland C., Lea T., Mackie A., Requena T., Swiatecka D., Wichers H. (Eds.), The Impact of Food Bioactives on Health: in vitro and ex vivo models (Cham (CH)).
- Wang Z., Li J., Wang Y., Wang L., Yin Y., Yin L., Yang H., Yin Y., 2020. Dietary vitamin A affects growth performance, intestinal development, and functions in weaned piglets by affecting intestinal stem cells. J. Anim. Sci., 98. doi:10.1093/jas/skaa020
- Wang Y., Hou Q., Wu Y., Xu Y., Liu Y., Chen J., Xu L., Guo Y., Gao S., Yuan J., 2022. Methionine deficiency and its hydroxy analogue influence chicken intestinal 3-dimensional organoid development. Anim. Nutr., 8, 38-51. doi:10.1016/j.aninu.2021.06.001
- Workman M.J., Mahe M.M., Trisno S., Poling H.M., Watson C.L., Sundaram N., Chang C.F., Schiesser J., Aubert P., Stanley E.G., Elefanty A.G., Miyaoka Y., Mandegar M.A., Conklin B.R., Neunlist M., Brugmann S.A., Helmrath M.A., Wells J.M., 2017. Engineered human pluripotent-stem-cell-derived intestinal tissues with a functional enteric nervous system. Nat. Med., 23, 49-59. doi:10.1038/nm.4233
- Yin L., Yang Q., Zhang Y., Wan D., Yin Y., Wang Q., Huang J., Li J., Yang H., Yin Y., 2021. Dietary copper improves intestinal morphology via modulating intestinal stem cell activity in pigs. Animals (Basel), 11. doi:10.3390/ani11092513
- Zhang M., Lv L., Cai H., Li Y., Gao F., Yu L., Jiang Y., Tong W., Li L., Li G., Tong G., Liu C., 2022a. Long-term expansion of porcine intestinal organoids serves as an in vitro model for swine enteric coronavirus infection. Front. Microbiol., 13, 865336. doi:10.3389/fmicb.2022.865336.
- Zhang J., Li J., Yan P., He L., Zhang X., Wang X., Shi Y., Deng L., Zhang Z., Zhao B., 2022b. In-depth analysis of the relationship between bovine intestinal organoids and enteroids based on morphology and transcriptome. J Tissue Eng. Regen Med. 16, 1032-1046. doi:10.1002/term.3351
- Zhang S., Zhang S., Hou Y., Huang Y., Cai J., Wang G., Cao Y., Chen Z., Fang X., Bao W., 2023. Porcine deltacoronavirus infection disrupts the intestinal mucosal barrier and inhibits intestinal stem cell differentiation to goblet cells via the notch signaling pathway. J. Virol., 8, e0068923. doi:10.1128/jvi.00689-23.
- Zhao D., Farnell M.B., Kogut M.H., Genovese K.J., Chapkin R.S., Davidson L.A., Berghman L.R., Farnell Y.Z., 2022. From crypts to enteroids: establishment and characterization of avian intestinal organoids. Poult. Sci., 101,101642. doi:10.1016/j.psj.2021.101642
- Zhou J.Y., Huang D.G., Zhu M., Gao C.Q., Yan H.C., Li X.G., Wang X.Q., 2020. Wnt/beta-catenin-mediated heat exposure inhibits intestinal epithelial cell proliferation and stem cell expansion through endoplasmic reticulum stress. J. Cell Physiol., 235, 5613-5627. doi:10.1002/jcp.29492
- Zhou Z., Yu L., Cao J., Yu J., Lin Z., Hong Y., Jiang S., Chen C., Mi Y., Zhang C., Li J., 2022. Lactobacillus salivarius promotion of intestinal stem cell activity in hens is associated with succinate-induced mitochondrial energy metabolism. mSystems. 7, e0090322. doi:10.1128/msystems.00903-22.
- Zietek T., Rath E., Haller D., Daniel H., 2015. Intestinal organoids for assessing nutrient transport, sensing and incretin secretion. Sci. Rep., 5, 16831. doi:10.1038/srep16831
Résumé
L’intestin est un organe complexe aux fonctions multiples. En effet, il participe à la digestion et l'absorption des nutriments et protège l’individu des agressions par des agents pathogènes intestinaux en assurant un rôle de barrière. L’étude de ce compartiment digestif reste toutefois limitée par l’accès aux tissus que ce soit chez l’Homme ou l’animal. Dans ce contexte, le développement d’organoïdes intestinaux à partir de cellules souches représente une avancée technologique importante dans l’étude de la physiopathologie intestinale. De plus, cet outil permet de répondre à une demande sociétale visant à réduire l’usage d’animaux modèles pour la recherche et s’inscrit dans la démarche des 3Rs (Remplacement, Réduction et Raffinement).L’objectif de cette revue est, à partir de rappels de la fonction digestive, de faire un état des lieux sur les différents types d’organoïdes intestinaux existants dérivés d’animaux de rente et de discuter leurs avantages, leurs limites et surtout leur application.
Pièces jointes
Pas de document complémentaire pour cet article##plugins.generic.statArticle.title##
 Vues: 4651
Vues: 4651
Téléchargements
 PDF: 542
PDF: 542
 XML: 218
XML: 218