La coccidiose chez les poulets domestiques : revue sur les stratégies de prévention et de contrôle
Chapeau
La coccidiose aviaire entraîne des pertes économiques importantes dans l'industrie avicole mondiale. Avec la croissance de la production avicole, il est indispensable d'enrichir les stratégies actuelles de lutte contre cette maladie et d'explorer de nouvelles approches pour la combattre. Cette revue fournit une évaluation globale des méthodes récentes, y compris l’usage des anticoccidiens, les vaccinations et des alternatives utilisant des produits phytogéniques, pour contrôler et prévenir cette parasitose.
Introduction
L'aviculture est l'un des secteurs agricoles dont la croissance est la plus rapide, et qui contribue de manière significative aux ressources alimentaires mondiales (Mottet & Tempio, 2017). Au cours des dernières décennies, l'aviculture s'est considérablement développée grâce aux progrès génétiques et techniques (Cardoso et al., 2002). Néanmoins, le secteur est aujourd'hui confronté à de nouveaux défis, notamment la nécessité de maintenir des pratiques de production durables et éthiques compte tenu des différentes dimensions de la durabilité : économique, environnementale et sociale (Rocchi et al., 2019). Le système de production intensive, caractérisé par des densités élevées avec un grand nombre d'oiseaux, entraîne des niveaux de stress accrus et une augmentation des maladies aviaires (Kumar & Patyal, 2020 ; Gržinić et al., 2023).
L'une des nombreuses maladies graves qui entravent et menacent la productivité des volailles notamment chez les poulets est la coccidiose, causée par des parasites protozoaires. Les coccidies affectent principalement le tube digestif de nombreuses espèces de mammifères et d'oiseaux, avec des conséquences allant d'infections asymptomatiques à la mort de l'animal. La coccidiose est une maladie répandue dans l'industrie de la volaille (poulets de chair, pondeuses, reproducteurs), avec des conséquences économiques majeures (Allen & Fetterer, 2002 ; Peek & Landman, 2011 ; Noack et al., 2019). Le secteur de la volaille subit les effets négatifs des maladies, tels que l'augmentation des dépenses de vaccination/prévention, de décontamination, la biosécurité et les mesures de contrôle, la réduction des revenus de l'ensemble des acteurs de la filière (Allen & Fetterer, 2002 ; Abebe & Gugsa, 2018). Les coccidies peuvent également contribuer à la propagation d'autres maladies telles que la mycoplasmose, l'entérite nécrotique et la colibacillose. Dans les cas graves, certaines espèces de ces parasites peuvent entraîner des taux de mortalité élevés (Zhang et al., 2013). Blake et al. (2020) ont calculé les dépenses mondiales (dépenses de santé et manque à gagner) pour la prévention, le traitement et les mesures de contrôle de la coccidiose en extrapolant les impacts économiques de huit pays (Brésil, États-Unis, Guatemala, Inde, Égypte, Nigéria, Royaume-Uni, Nouvelle-Zélande). Les montants estimés varient entre 9,62 et 15,75 milliards d'euros (évaluation pour 2016). Ces chiffres incluent le coût des additifs coccidiostatiques administrés dans l'alimentation des poulets de chair et futures pondeuses, les traitements curatifs avec des médicaments vétérinaires en cas d'échec de la prophylaxie et les manques à gagner dues à la mortalité, la morbidité, la diminution de la croissance, la réduction temporaire de la production d'œufs chez les pondeuses et le mauvais indice de consommation des poulets qui survivent à la maladie (Iraee et al., 2015).
L'utilisation intensive des anticoccidiens, qui augmente le développement de résistances, compromet leur usage à plus ou moins brève échéance. Ce phénomène, conjugué à la pression sociétale visant à réduire l'utilisation des anti-infectieux et antiparasitaires, a conduit à la recherche d'alternatives, notamment la vaccination, les produits phytogéniques, les acides organiques, les immunomodulateurs, les glucides, les probiotiques, les prébiotiques et les désinfectants à activité oocysticide (Agunos et al., 2017 ; Blake et al., 2021). La vaccination est une stratégie relativement peu utilisée en Europe (Noack et al., 2019 ; Blake et al., 2020 ; Attree et al., 2021). Par ailleurs, les mesures de gestion et de biosécurité ne peuvent pas éviter complètement les infections à Eimeria. Il est donc indispensable d'augmenter la résistance des hôtes et de réduire les effets négatifs de ces infections sur le bien-être et les performances des oiseaux. À cet égard, les interventions nutritionnelles à base de substances phytogéniques peuvent favoriser la santé intestinale et donc atténuer les effets néfastes de la coccidiose sur la santé, améliorant ainsi le bien-être animal et la productivité des volailles (Peek & Landman, 2011 ; Santos et al., 2022).
Cette étude présente un état de l’art concernant la coccidiose chez les poulets, et décrit les récentes stratégies intégrées de contrôle qui sont appliquées comme les bonnes pratiques de gestion, les additifs coccidiostatiques, la vaccination et l’utilisation de produits phytogéniques.
1. La coccidiose chez les poulets
1.1. Définition
La coccidiose est la maladie parasitaire la plus fréquente chez les poulets, causée par des protozoaires intracellulaires du genre Eimeria. La coccidiose est une maladie fortement contagieuse qui provoque des problèmes intestinaux et cæcaux graves dans cette espèce. Cette maladie se caractérise par une malabsorption et une entérite, ainsi que par une diminution des performances avec une augmentation de l'indice de consommation, une dégradation de la qualité de la litière, une diminution du bien-être des animaux (augmentation des cas de pododermatites) et favorise le développement de l'entérite nécrotique causée par Clostridium perfringens (Noack et al., 2019 ; Blake et al., 2020, 2021).
1.2. Étiologie
La coccidiose est une maladie intestinale résultant d'une infection par un protozoaire ubiquitaire causée par plusieurs espèces du genre Eimeria, des parasites apicomplexes très spécifiques de l'hôte (Attree et al., 2021). Sept espèces d'Eimeria sont reconnues comme prévalentes et capables d'infecter les poulets (Gallus gallus domesticus) : E. acervulina, E. brunetti, E. maxima, E. mitis, E. necatrix, E. praecox et E. tenella (Hafez, 2008 ; Attree et al., 2021). Toutes ces espèces d'Eimeria sont capables de causer la coccidiose chez les poulets. Parmi celles-ci, des espèces comme E. brunetti, E. acervulina, E. maxima, E. necatrix et E. tenella sont considérées comme les plus importantes en raison de leur niveau élevé de virulence (tableau 1), de leur présence répandue (à l'exception d'E. necatrix) et de leur impact économique significatif (El-Shall et al., 2022).
Tableau 1. Immunogénicité et potentiel pathogène des espèces d'Eimeria de poulets (Gallus gallus domesticus ; d'après El-Shall et al., 2022).
Espèces |
Localisation |
Pathogénicité* |
Immunisation** |
Nombre de cycles |
|---|---|---|---|---|
E. acervulina |
Duodénum, jéjunum |
++ |
++ |
2-3 |
E. brunetti |
Iléon, cæca, rectum |
+++ |
+++ |
1-2 |
E. maxima |
Duodénum, jéjunum, |
++ |
+++ |
1 |
E. mitis |
Duodénum, jéjunum |
+ |
++ |
2-3 |
E. necatrix |
Jéjunum, iléon, cæca |
++++ |
+ |
4-5 |
E. praecox |
Duodénum |
+ |
+++ |
1 |
E. tenella |
Cæca |
++++ |
+ |
3-4 |
*+ faible ; ++ modérée ; +++ modérée à élevée ; ++++ élevée.
**+ faible ; ++ modérée ; +++ élevée.
1.3. Cycle de vie d'Eimeria spp.
Les protozoaires du genre Eimeria ont un cycle de vie complexe avec un niveau élevé de spécificité de tissu et d'hôte. Ce cycle implique une multiplication asexuée et une reproduction sexuée et est divisé en trois phases principales : schizogonie (gamogonie/mérogonie), gamétogonie (formation des gamètes pour la reproduction sexuée) et sporogonie (figure 1 ; McDougald et al., 2020). La phase de sporogonie a lieu dans l'environnement externe, tandis que les phases de schizogonie et de gamétogonie ont lieu dans les cellules épithéliales de l'intestin de l'hôte (López-Osorio et al., 2020).
Figure 1. Cycle de vie d'Eimeria spp (Barta, 2001).
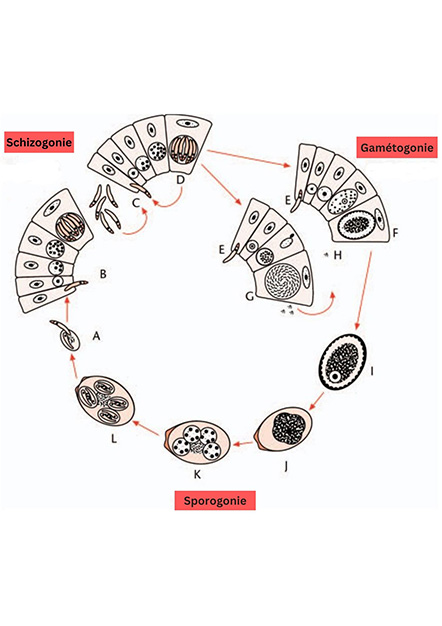
Les sporozoïtes (A) infectent les cellules épithéliales intestinales et réalisent une schizogonie (B) pour produire des schizontes. Les mérozoïtes sortent et infectent les cellules épithéliales intestinales adjacentes pour un nombre spécifique d’étapes schizogoniques (C-D). Après plusieurs étapes schizogoniques, les mérozoïtes commencent la gamétogonie (E) et produisent des macrogamétocytes (F) et des microgamétocytes, qui produisent des microgamètes flagellés, G) Un microgamète mobile (H) féconde un macrogamétocyte mûr pour produire un zygote, qui est excrété dans les fèces sous la forme d'un oocyste non sporulé, (I) et subit une sporogonie (I-L) dans l'environnement pour former un oocyste sporulé et infectieux (L) contenant quatre sporocystes contenant chacun deux sporozoïtes infectieux
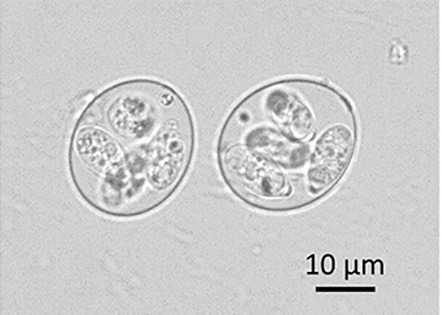
Dans le cas des espèces d'Eimeria, chaque oocyste sporulé contient quatre sporocystes, chaque sporocyste contenant deux sporozoïtes (figure 2). L'infection à Eimeria chez les poulets commence par l'ingestion d'oocystes sporulés provenant de sources contaminées par les fientes. Avant d’entrer dans la cellule, les sporocystes sont libérés par broyage dans le gésier puis, sous l’action d’enzymes digestives et notamment de la bile, les sporozoites excystent et envahissent les cellules épithéliales intestinales.
Figure 2. Oocystes sporulés d’Eimeria tenella (crédit photo : A. Silvestre, INRAE).
Les différentes espèces d'Eimeria ont une forte préférence pour des segments intestinaux spécifiques (tableau 1 ; Lai et al., 2011). Afin de compléter leur cycle de vie, les espèces d'Eimeria chez les poulets doivent réaliser un nombre prédéterminé d'étapes de multiplication asexuée (schizogonie), généralement trois ou quatre, selon l'espèce. De nouveaux entérocytes sont envahis au cours de chaque phase. L'étape suivante du développement est sexuée et s'appelle la gamétogonie. La reproduction sexuée du parasite implique la fécondation de macrogamétocytes par des microgamètes, issus des microgamétocytes, ce qui entraîne la formation de zygotes diploïdes. Les oocystes non sporulés sont émis dans l'environnement extérieur avec les fientes, et ils réalisent une méiose et deux mitoses pour produire des sporozoïtes infectieux (Walker et al., 2013 ; Burrell et al., 2020).
1.4. Pathogénicité d'Eimeria spp.
L'impact pathogène des Eimeria augmente avec le niveau de contamination de la litière ou avec l'ingestion orale d'aliments, d'eau qui contiennent des oocystes sporulés infectieux (Répérant et al., 2012 ; Gharekhani et al., 2014). Les cellules épithéliales intestinales sont détruites par l'infection à Eimeria, ce qui peut réduire la stabilité intestinale des poulets en augmentant la perméabilité cellulaire, la fuite des nutriments et des protéines plasmatiques, la diminution de la digestion et de l'absorption des protéines (Chen et al., 2020 ; Vieira et al., 2020). La quantité d'oocystes ingérés détermine l'étendue des dommages au tube intestinal, affectant à la fois les cellules épithéliales et les communautés microbiennes du tractus gastro-intestinal. Cela peut favoriser le développement d'autres agents pathogènes nuisibles comme Clostridium perfringens, augmenter la sensibilité à d'autres maladies et peut conduire à des taux de mortalité plus élevés chez les poulets (Madlala et al., 2021). L'invasion d'Eimeria peut entraîner un déséquilibre de la communauté microbienne intestinale. Ce déséquilibre microbien se caractérise par une diminution significative du nombre de bactéries bénéfiques et une augmentation des bactéries pathogènes, ce qui entraîne une perturbation de l'homéostasie de l'hôte (Ducatelle et al., 2015 ; Madlala et al., 2021).
1.5. Symptômes de la coccidiose
La coccidiose du poulet peut se manifester sous une forme subclinique ou clinique. La gravité de la maladie dépend de divers facteurs tels que l'espèce d'Eimeria en cause, la quantité d'oocystes, le potentiel infectieux des oocystes sporulés ingérés, l'âge, l'immunité, l'état général de l'hôte et les conditions de gestion de l'environnement (Abebe & Gugsa, 2018 ; Attree et al., 2021). Les volailles affectées peuvent présenter des signes de modifications comportementales, tels que le recroquevillement et l'ébouriffage des plumes, la déshydratation, et une diminution de la consommation d'aliments. De plus, les oiseaux peuvent également présenter des diarrhées hémorragiques avec sang frais ou sang digéré avec mucus (en particulier dans le cas d'infection par E. tenella et E. necatrix), ce qui augmente leur taux de mortalité (Crévieu-Gabriel & Naciri, 2001 ; El-Ghany, 2021). Les cas de coccidiose subclinique, qui peuvent passer inaperçus en raison de l'absence de signes cliniques spécifiques, présentent des lésions d'intensité modérée, un IC dégradé et un ralentissement de la croissance (Morris et al., 2007). L'intensité des lésions provoquées par les espèces d'Eimeria dans les différentes parties de l'intestin dépendent principalement de leur degré de pathogénicité. Ces lésions comprennent la nécrose, l'entérite hémorragique, les exsudats mucoïdes à sanglants, les hémorragies pétéchiales ou des pétéchies sans hémorragies des muqueuses et l'épaississement de la paroi intestinale (El-Ghany, 2021).
1.6. Diagnostic
L'identification précise des espèces d'Eimeria est indispensable pour diagnostiquer et gérer la maladie (Carvalho et al., 2011). Les symptômes cliniques, la coprologie (détection de la présence d'oocystes), les analyses macroscopiques pour les lésions et histopathologiques (ou anatomopathologiques) pour l'analyse de coupes histologiques sont utilisés pour établir le diagnostic de la coccidiose. Les techniques traditionnelles de diagnostic des infections à Eimeria impliquent un diagnostic macroscopique et microscopique. Le diagnostic macroscopique est d'abord effectué en observant les signes cliniques chez les animaux infectés et en examinant les lésions macroscopiques après l'autopsie. En cas de doute sur les lésions, un diagnostic microscopique peut être effectué en vérifiant la présence d'éléments parasitaires (Conway & Mckenzie, 2007).
2. La gestion intégrée de la santé pour lutter contre la coccidiose
La gestion intégrée de la santé est une approche coordonnée qui combine les connaissances et les pratiques pour améliorer, préserver ou retrouver la santé d'animaux individuels ou du troupeau dans un système d'élevage. Elle implique un suivi régulier, l'évaluation des pratiques d'élevage et la mise en œuvre de stratégies visant à atteindre et à maintenir des conditions de santé optimales, dans le but ultime de minimiser le besoin des interventions médicamenteux (Dumont et al., 2013 ; Fortun-Lamothe et al., 2022). Dans le contexte de la production avicole, cette approche s'étend à la lutte contre des maladies telles que la coccidiose chez les poulets, avec des stratégies holistiques combinant de bonnes pratiques de gestion, l'utilisation d'additifs coccidiostatiques, la vaccination et des stratégies alternatives telles que l'utilisation d'additifs phytogéniques. Ces approches visent à réduire la dépendance à l'égard des composés chimiques et à promouvoir un moyen durable et efficace de lutte contre la coccidiose pour les éleveurs. Il est essentiel de faire progresser la recherche en vue d'intégrer ces alternatives éprouvées dans un programme de contrôle complet, permettant aux éleveurs de gérer efficacement la coccidiose avec une dépendance minimale aux médicaments (Abbas et al., 2012). Dans cette partie, des stratégies intégrées de la santé pour lutter contre la coccidiose chez les poulets sont présentées.
2.1. Gestion et biosécurité
La prévention de la coccidiose chez les poulets peut s'avérer difficile en raison de la nature très infectieuse du parasite. Les pratiques de gestion et de biosécurité doivent donc viser à empêcher son entrée dans l'exploitation ou, si le parasite est déjà présent, à minimiser sa propagation et son impact (Allen & Fetterer, 2002 ; Peek & Landman, 2011). Le nettoyage et la désinfection du bâtiment sont essentiels pour réduire la pression parasitaire environnementale. Afin d'éliminer les oocystes sporulés, différents agents désinfectants sont disponibles, notamment l'hydroxyde d'ammonium, dont l'efficacité maximale (100 % d'efficacité) a été observée à une concentration de 5 % (E. tenella), les produits à base de crésol (79 % d'efficacité), une combinaison de formol 37 % et de dodécylbenzène sulfonate de sodium à 12 % (E. tenella), et une combinaison d'hydroxyde de calcium et de sulfate d'ammonium (40 kg d'hydroxyde de calcium, dans 500 L d'eau, et 80 kg de sulfate d'ammonium pour 500 m² ; Peek & Landman, 2011).
L'infection par Eimeria chez les poulets peut être réduite en élevant les oiseaux sur des sols grillagés afin de limiter le contact avec leurs fèces. Cependant, cette méthode s'est avérée peu rentable dans la production de poulets de chair (Chapman & Jeffers, 2014). En outre, des pratiques telles que le maintien d'une litière sèche et une bonne ventilation dans les bâtiments contribuent à réduire la sporulation des oocystes dans l'environnement (Etuk et al., 2004 ; Nawarathne et al., 2021). Dans un système en plein air, il est difficile de gérer l'exposition aux agents pathogènes en raison des conditions environnementales imprévisibles. Pour limiter les risques, il est conseillé de nettoyer et de désinfecter les locaux entre chaque lot de poulets, de maintenir des conditions optimales dans les pâturages et d'effectuer une rotation des pâturages, ainsi que de surveiller étroitement les lots de poulets (Sossidou et al., 2011 ; Jeni et al., 2021).
Les stratégies nutritionnelles jouent un rôle à différents stades de l'évolution de la coccidiose. Elles influencent la sensibilité, l'infection, la pathogenèse et la récupération. En réponse à ces effets complexes, une série de stratégies nutritionnelles, y compris la supplémentation en acides aminés, vitamines, acides gras, prébiotiques et enzymes, peut être utilisée pour atténuer l'infection, soulager les symptômes et améliorer la croissance compensatoire après l'infection (Gómez-Osorio et al., 2021). Une étude de Lee et al. (2011) a étudié l'impact des niveaux de protéines alimentaires (de 20 à 24 %) sur les poulets de chair vaccinés confrontés à la coccidiose. Ils ont constaté que l'augmentation du niveau de protéines améliorait le gain de poids des poulets de chair et l'indice de consommation à 21 jours, quel que soit le statut de la vaccination. En outre, les poulets ayant reçu un régime à 24 % de protéines ont présenté moins de lésions intestinales après avoir été exposés à l'Eimeria. Cependant, avant l'inoculation, les poulets vaccinés ont montré une légère diminution de la prise de poids et de l'indice de consommation par rapport aux poulets non vaccinés.
De plus, pour renforcer la réponse immunitaire des poulets contre Eimeria et contrôler la coccidiose, il est recommandé de minimiser l'exposition à des facteurs de stress tels que les températures élevées, la restriction alimentaire, les carences nutritionnelles et les fortes densités des oiseaux. Le contrôle de la coccidiose peut également être réalisé en réduisant la dispersion mécanique des oocystes d'Eimeria par le changement de litière et en contrôlant les invertébrés et les vermines (Williams, 1998 ; Attree et al., 2021). Les intervenants doivent également changer de tenue avant de se rendre dans un bâtiment de volailles nouvellement construit afin d'éviter la propagation d'oocystes (Allen & Fetterer, 2002).
2.2. Utilisation des anticoccidiens
L'utilisation de la prophylaxie pour lutter contre la coccidiose en production avicole est une pratique courante depuis 1948 (Chapman, 2009). Globalement, la chimioprophylaxie est utilisée pour prévenir la coccidiose chez les volailles en incluant différents additifs coccidiostatiques dans leur alimentation, qui empêchent la croissance et la réplication d'Eimeria spp. (Quiroz-Castañeda & Dantán-González, 2015). Les additifs coccidiostatiques sont réglementés par la directive CE n°1831/2003 et onze d'entre eux sont actuellement approuvés pour l'alimentation animale (tableau 2 ; Afssa, 2007 ; European Union, 2022). La plupart des anticoccidiens à large spectre ciblent les stades asexués du cycle de vie d'Eimeria, tandis que quelques-uns peuvent également agir sur ses stades sexués, et seul un petit nombre d'entre eux entrave les voies métaboliques chimiques d'Eimeria (Looker et al., 1986 ; Kant et al., 2013). Il existe deux types d'anticoccidiens : les ionophores et les produits chimiques de synthèse (Chapman, 1999 ; Allen & Fetterer, 2002). D'un point de vue réglementaire, la classification des anticoccidiens varie à travers le monde, les ionophores étant classés comme additifs de l'alimentation animale en Europe et comme antibiotiques aux États-Unis (Chapman, 2001 ; Gilbert et al., 2020).
Tableau 2. Liste des 11 composés anticoccidiens utilisés chez les volailles autorisés comme additifs de l'alimentation animale dans l'UE (données issues de Hafez, 2008 ; Noack et al., 2019 ; Attree et al., 2021 ; European Union, 2022)
Noms des produits |
Famille |
Nom de la marque |
Dose |
Période |
Productions cibles |
|---|---|---|---|---|---|
Decoquinate |
Synthétique |
Deccox |
30 |
0 |
Poulet de chair |
Diclazuril |
Synthétique |
Clinacox |
1 |
0 |
Poulet de chair, |
Halofuginone |
Synthétique |
Stenorol |
2-3 |
5 |
Poulet de chair, |
Nicarbazine |
Synthétique |
Nicarb |
125 |
1 |
Poulet de chair |
Robenidine |
Synthétique |
Robenz |
33 |
5 |
Poulet de chair |
Lasalocide |
Ionophore |
Avatec |
75-125 |
5 |
Poulet de chair |
Monensin |
Ionophore |
Elancoban (Elanco) |
100-125 |
1 |
Poulet de chair, |
Narasin |
Ionophore |
Monteban |
60-80 |
0 |
Poulet de chair |
Narasin + Nicarbazine |
Ionophore |
Maxiban |
80-100 |
0 |
Poulet de chair |
Salinomycine |
Ionophore |
Sacox |
44-66 |
0 |
Poulet de chair, |
Semduramicine |
Ionophore |
Aviax |
25 |
5 |
Poulet de chair |
Amprolium |
Synthétique |
Coxam |
125 |
0 |
Poulet de chair, |
Monensin+Nicarbazine |
Ionophore |
Monimax |
40/40 |
0 |
Poulet de chair, |
Les premiers anticoccidiens ayant une véritable activité à large spectre (comme la nicarbazine), détruisent les parasites qui en sont encore aux premiers stades de développement dans les cellules épithéliales des villosités intestinales (Quiroz-Castañeda & Dantán-González, 2015). Les ionophores ou antibiotiques polyéthers sont des composés liposolubles produits par la fermentation de Streptomyces spp. (monensin, narasin, salinomycine, lasalocide) ou d'Actinomadura spp. (maduramicine, semduramicine) et ont des propriétés anticoccidiennes qui ciblent les sporozoïtes et mérozoïtes mobiles présents dans la lumière intestinale (Chapman, 1997 ; Quiroz-Castañeda & Dantán-González, 2015 ; Noack et al., 2019). Les ionophores empêchent le transport des cations métalliques et perturbent le gradient naturel de concentration Na/K à travers les membranes cellulaires. Il en résulte une dégradation de l'intégrité membranaire, une augmentation de la concentration ionique (Na+) et de la pression osmotique, une élévation du pH intracellulaire, une inhibition de l'oxydation des substrats, une cytotoxicité entrainant une inhibition du développement des sporozoïtes (une fois qu'ils sont entrés dans les cellules) et finalement, la mort cellulaire (Antoszczak et al., 2019 ; Chapman & Rathinam, 2022). Les antibiotiques polyéthers ionophores peuvent être classés en trois types en fonction de leur structure, de leur affinité pour les cations et de leur capacité de transport :
i) les ionophores monovalents ayant une affinité pour les cations monovalents (tels que le monensin, le narasin et la salinomycine) ;
ii) les ionophores glycosidiques monovalents sans affinité spécifique pour les cations monovalents ou divalents (tels que la maduramicine et la semduramicine) ;
iii) les ionophores divalents ayant une affinité pour les cations divalents (tels que le lasalocide ; Noack et al., 2019 ; Nawarathne et al., 2021).
Les additifs coccidiostatiques sont couramment utilisés pour prévenir le développement du parasite Eimeria chez les poulets, mais leur large utilisation a augmenté le risque de résistance. Certains additifs coccidiostatiques peuvent être moins efficaces au fil du temps, car les coccidies développent une résistance croisée partielle à leur égard (Chapman, 1997 ; Abbas et al., 2008). En outre, si les anticoccidiens sont arrêtés avant la période réglementaire minimale, les poulets peuvent redevenir vulnérables à l'infection. Dans ce contexte, de nouvelles alternatives pour les mesures de contrôle et de prévention, telles que les vaccins ou d'autres solutions, sont devenues nécessaires (Peek & Landman, 2011 ; Attree et al., 2021).
2.3. Vaccination
La vaccination est une pratique plus courante et une méthode efficace pour lutter contre la coccidiose aviaire. Elle peut être réalisée en pulvérisant le vaccin sur les aliments, en le mélangeant avec de l'eau, en pulvérisant une solution vaccinale aqueuse dans les couvoirs sur les poussins d'un jour (l'ingestion d'oocystes peut se produire lors du lissage et par les yeux), et par la vaccination in ovo (McDougald et al., 2020 ; Nawarathne et al., 2021). La méthode la plus courante pour vacciner les poussins d'un jour dans les couvoirs contre les coccidies est l'utilisation d'une solution aqueuse par pulvérisation, qui a largement remplacé les autres modes de vaccination (Albanese et al., 2018 ; Tensa & Jordan, 2019). La vaccination anticoccidienne est une mesure préventive qui confère aux oiseaux une immunité protectrice contre la coccidiose en réduisant la réplication du parasite et les symptômes cliniques en cas de contact avec Eimeria (Attree et al., 2021).
Il est reconnu que pour la majorité des espèces d'Eimeria, une immunisation efficace des animaux ne se développe pas sur le terrain avant que les oiseaux n'aient subi un ou plusieurs cycles d'infection (tableau 1). Les vaccins anticoccidiens vivants disponibles sur le marché sont développés sur la base de ces observations (Attree et al., 2021). Les poulets sont capables d'acquérir une immunité active pour se protéger contre les effets néfastes de la coccidiose aviaire (Nawarathne et al., 2021).
a. Vaccins vivants
Les vaccins vivants sont constitués de souches atténuées ou non atténuées (virulentes ou sauvages) d'Eimeria (Quiroz-Castañeda & Dantán-González, 2015). L'utilisation de vaccins vivants est une méthode fiable pour prévenir la coccidiose. La vaccination avec une souche atténuée ou non atténuée d'Eimeria se fonde sur l'administration d'une dose de parasite inférieure à celle qui provoquerait les symptômes cliniques, ce qui permet de stimuler le développement de la réponse immunitaire de l'oiseau sans provoquer d'effets néfastes. Par conséquent, l'oiseau est protégé contre les infections futures et lorsqu'il excrète le parasite dans ses matières fécales, il infecte d'autres oiseaux avec une faible quantité de parasites, ce qui entraîne une faible intensité de l'infection. Cette immunité permet de prévenir les infections graves par la coccidiose (McDonald & Shirley, 2009 ; Soutter et al., 2020).
Des vaccins vivants atténués contre la coccidiose peuvent être développés, en sélectionnant des souches précoces, ou des souches adaptées à l'œuf. Les souches précoces d'Eimeria se caractérisent par un potentiel réplicatif réduit et un cycle de vie raccourci (diminution du nombre et/ou de la taille des stades mérogoniques au cours du développement endogène). Les souches adaptées à l'œuf peuvent être inoculées dans des œufs embryonnés au niveau de la membrane chorio-allantoïque, ce qui entraîne une réduction du potentiel pathogène initial (Shirley & Bedrník, 1997 ; Shivaramaiah et al., 2014). Les vaccins vivants atténués contiennent des souches d'Eimeria ayant des périodes prépatentes plus courtes. Ils causent une infection légère avec des lésions intestinales minimes et induisent une réponse immunitaire protectrice (Shirley & Bedrník, 1997 ; Allen & Fetterer, 2002). Les vaccins vivants atténués ayant une capacité de reproduction inférieure à celle des vaccins non atténués, un plus grand nombre de poulets est nécessaire pour leur production. Par conséquent, les vaccins atténués coûtent généralement deux à six fois plus cher que les vaccins non atténués (Blake et al., 2020).
Les vaccins vivants non atténués sont constitués d'une combinaison de souches d'Eimeria de type sauvage. Le nombre d'oocystes contenus dans ces vaccins est calculé de telle sorte qu'à la dose d'utilisation préconisée, aucun effet pathogène ne puisse être observé. L'utilisation de souches non atténuées comporte un risque d'introduction d'espèces rares, préalablement absentes et potentiellement dangereuses dans l'élevage, comme E. brunetti et E. necatrix. Ces souches potentiellement pathogènes, introduites par la vaccination, pourraient ensuite se multiplier en cas d'arrêt de la vaccination (Chapman, 2000 ; Attree et al., 2021). Les vaccins non atténués (Coccivac, Advent, Immucox et Inovocox) ne sont pas autorisés dans l'Union européenne, tandis que dans d'autres parties du monde notamment aux États-Unis, ils sont largement utilisés (Chapman, 2000 ; Attree et al., 2021).
b. Vaccins recombinants et vaccins sous-unitaires
En raison des limites de la chimioprophylaxie et de la vaccination contre Eimeria, les chercheurs travaillent au développement de nouvelles stratégies de contrôle, y compris des vaccins sous-unitaires et des vaccins recombinants (Song et al., 2020 ; Attree et al., 2021).
Les vaccins sous-unitaires comprennent des facteurs antigéniques purifiés obtenus à partir de différentes espèces d'Eimeria. Ils utilisent des techniques de recombinaison de l'ADN et contiennent des antigènes protecteurs ou des protéines recombinantes de différents stades du cycle de vie d'Eimeria (sporozoïtes, mérozoïtes et gamètes ; Shivaramaiah et al., 2014 ; Ramalingam et al., 2022). Un vaccin sous-unitaire appelé CoxAbic a été commercialisé précédemment, mais il n'est plus disponible et les recherches actuelles sur les vaccins sous-unitaires et recombinants contre Eimeria sont encore expérimentales et ne confèrent pas assez de protection (Song et al., 2020 ; Attree et al., 2021).
Des vaccins recombinants vectorisés, qui ne contiennent aucune espèce infectieuse de parasites vivants, ont été développés pour améliorer l'efficacité de la vaccination contre la coccidiose. Pour amplifier la réponse immunitaire du poulet, ces vaccins délivrent des antigènes immunogènes d'Eimeria spp. dans des vecteurs plasmidiques complémentaires (Fatoba & Adeleke, 2018). En général, les vecteurs utilisés pour administrer le vaccin sont atténués au cours du développement du vaccin pour qu'il soit sécurisé pour l'hôte (Shivaramaiah et al., 2014). L'efficacité des vaccins recombinants contre Eimeria en termes de protection est variable selon les études, certaines d'entre elles ayant montré une protection partielle (Song et al., 2015). Il est donc nécessaire de poursuivre les recherches pour évaluer leur efficacité à assurer une protection adéquate contre l'infection.
2.4. Utilisation des produits phytogéniques
Les phytobiotiques (également appelés phytogéniques), contiennent des molécules bioactives naturelles d'origine végétale, dérivées de parties de plantes ou leurs extraits (Gadde et al., 2017 ; Gheisar & Kim, 2018). Ces plantes peuvent être classées comme herbes aromatiques ou épices en fonction des parties utilisées. Les herbes aromatiques sont des plantes à fleurs non ligneuses dont les feuilles et les fleurs sont utilisées, tandis que les épices sont les parties non feuillues des herbes, telles que les graines, les fruits, l'écorce ou les racines utilisées pour leurs propriétés organoleptiques (Windisch et al., 2008). Les herbes aromatiques et les épices peuvent être utilisées sous diverses formes (solides, moulues) ou sous forme d'extraits, purs ou en mélange contenant de nombreux composés bioactifs, tels que des alcaloïdes, des substances phénoliques, des polysaccharides, des saponines, des tanins, des polyacétylènes, des terpénoïdes etc. (Gadde et al., 2017 ; El-Shall et al., 2022).
Au cours des dernières décennies, de nombreuses recherches ont été menées sur le potentiel des plantes et de leurs composants purifiés pour améliorer les performances de croissance des animaux en tant qu'alternative aux additifs de synthèse (Shivaramaiah et al., 2014 ; El-Ghany, 2021). Les chercheurs ont étudié le potentiel de certains composés phytogéniques biologiquement actifs dérivés de différentes plantes comme solution durable pour lutter contre la coccidiose, et les résultats sont prometteurs (Acharya & Acharya, 2017 ; Pop et al., 2019 ; El-Shall et al., 2022). Ces composés présentent divers avantages tels que le renforcement de la santé intestinale, la préservation de l'écologie intestinale et l'amélioration des défenses de l'hôte contre les coccidies, ce qui permet de contrôler et de réduire efficacement la mortalité des oiseaux causée par la coccidiose (Abdelli et al., 2021).
Récemment, les additifs phytogéniques ont attiré l'attention des fabricants d'aliments et des éleveurs pour leur potentiel dans la prévention et le traitement de la coccidiose aviaire (El-Shall et al., 2022). Ces composés bioactifs naturels ou métabolites secondaires présents dans les plantes, tels que les saponines, les tannins, les flavonoïdes, les huiles essentielles et les composés sulfurés, exercent principalement leurs effets de manière indirecte en modulant la réponse immunitaire de l'hôte, en possédant des propriétés antioxydantes et anti-inflammatoires. Ces plantes sont principalement utilisées comme anticoccidiens en raison de leur activité antioxydante et immunomodulatrice (El-Shall et al., 2022 ; Saeed & Alkheraije, 2023). Avec les phytobiotiques ont également été mis en évidence des effets anticoccidiens par interruption directe du cycle de vie des parasites, la modification de la formation de la paroi des oocystes et l'inhibition de la sporulation (Fatemi et al., 2015) ainsi que la destruction des sporozoïtes (Kim et al., 2013).
Selon El-Shall et al. (2022), les additifs phytogéniques peuvent être un substitut naturel efficace aux anticoccidiens. Ils présentent en outre un intérêt pour satisfaire à la réglementation « anticoccidien sans produits chimiques » règlement de l'Union européenne (Council Directive 2011/50/EU). Jusqu'à présent, ces composés offrent des alternatives fiables avec de moindres risques de résistance (El-Shall et al., 2022). Aujourd'hui, les défis liés à la résistance à la chimioprophylaxie et à l'accès limité à des vaccins rentables ont conduit à l'exploration des phytobiotiques comme stratégie alternative pour un contrôle efficace de la coccidiose (Attree et al., 2021). Cependant, il est important de garantir la sécurité de ces produits en vérifiant qu'ils ne contiennent pas de substances dangereuses ou de métabolites susceptibles de présenter un risque pour les consommateurs.
Le tableau 3 présente les propriétés anticoccidiennes de diverses plantes et résume les résultats des recherches récentes concernant le potentiel de ces composés en tant qu'anticoccidiens, leur mode d’action et leurs effets sur les espèces poulets et différentes espèces d'Eimeria.
Tableau 3. Diverses plantes ou leurs extraits ; composés bioactifs ; propriétés anticoccidiennes spécifiques et leurs effets sur les poulets de chair.
Molécules |
Mode d'action |
Plantes |
Résultats |
Espèces de |
Références |
|---|---|---|---|---|---|
Saponines |
Détruisent les |
Acacia |
Augmente le PM et la |
E. tenella, |
|
Azadirachta |
Augmente le PM, diminue l'IC, |
E. tenella, |
|||
Yucca |
Augmente la réponse |
E. acervulina, |
|||
Tannins |
Empêchent |
Pinus radiata |
L’inhibition de la sporulation |
E. acervulina, |
|
Emblica |
Augmente le PM (p0,05 sur |
E. acervulina, |
|||
Polyphénols, |
Réduisent |
Beta vulgaris |
Augmente le PM, diminue l'IC, |
E. brunetti, |
|
Cinnamomum |
Augmente le PM, diminue l'IC |
E. tenella |
|||
Camellia |
Augmente significativement le PM |
E. maxima, |
|||
Saccharum |
Augmente le PM (pour 30 et 50 |
E. tenella, |
|||
Vitis vinifera |
Augmente le PM (2,5/5 g/kg ; |
E. tenella, |
|||
Huiles |
Entravent le cycle |
Origanum |
Augmente le PM (p0,05 du 0-37j) |
E. acervulina, |
|
Pistacia |
Améliore les performances |
E. acervulina |
|||
Composés |
Effet antioxydant |
Allium |
Augmente le PM et diminue l’IC, |
E. tenella |
PM : Poids moyen ; IC : Indice de consommation
2.5. Résistance génétique
Les différentes races et/ou lignées de poulets présentent des niveaux variables de sensibilité ou de tolérance aux espèces d'Eimeria, par une moindre sensibilité à l'infection ou une meilleure vitesse de récupération ce qui réduit les conséquences pathologiques de l'infection (Bishop & Woolliams, 2014 ; Boulton et al., 2018). Divers types génétiques, à la fois non consanguins et consanguins, ont été étudiés et présentent des différences de sensibilité à l'infection par Eimeria. Par exemple, la lignée égyptienne Fayoumi a été identifiée comme relativement tolérante, tandis que la lignée White Leghorn est plus sensible à E. tenella (Pinard-Van Der Laan et al., 1998, 2009).
Des QTL (régions du génome polymorphes impliquées dans la variation de caractères quantitatifs) ont été cartographiés pour différents caractères associés à la résistance à E. maxima et E. tenella chez les poulets (score lésionnel, gain de poids au cours de l'infection). Des inversions de résistance ont cependant été observées entre E. tenella et E. maxima (Pinard-Van Der Laan et al., 2009 ; Boulton et al., 2018). Cela implique que les poulets qui présentent une résistance génétique élevée à E. tenella ont tendance à être moins résistants à d'autres espèces d'Eimeria, et vice versa, ce qui peut limiter le potentiel d'amélioration génétique des populations concernées (Pinard-Van Der Laan et al., 1998, 2009). Néanmoins, une meilleure compréhension de l'architecture génétique des traits de résistance/tolérance/sensibilité à la coccidiose devrait permettre d'améliorer l'efficacité des schémas de sélection et pourrait être utilisée pour orienter le choix des souches de poulets, contribuant ainsi au contrôle futur de la coccidiose (Pinard-Van Der Laan et al., 1998, 2009 ; Boulton et al., 2018 ; Attree et al., 2021).
Dans l'ensemble, la sélection génétique est une approche dont les bénéfices sont à évaluer sur le long terme, qui doit être mise en œuvre sur plusieurs générations de poulets, et pourrait s'avérer plus rentable et avoir moins d'effets sur l'hôte et l'environnement (Hamzić et al., 2015 ; Attree et al., 2021).
Conclusion
La coccidiose chez les poulets domestiques est la maladie protozoaire la plus répandue qui affecte gravement la production et entraîne des pertes économiques considérables dans le monde entier. Pour réussir à contrôler la coccidiose chez les poulets, il est nécessaire de mettre en place une gestion intégrée. Cette approche doit intégrer de bonnes pratiques d'élevage, en général complétées par une chimioprophylaxie et/ou une vaccination, ainsi qu'une sélection génétique. Les mesures de contrôle alternatives, y compris l'utilisation de produits phytogènes, sont une méthode qui a montré de l'intérêt dans divers travaux scientifiques cités dans cette revue. Afin de mettre en œuvre efficacement ces mesures de prévention ou de contrôle dans le futur, il est indispensable de trouver un équilibre entre les enjeux de santé publique, de durabilité environnementale et économique et le bien-être des animaux.
Cette revue a fait le bilan de l'impact de la coccidiose sur la santé animale, l'impact économique significatif sur l'industrie avicole et les méthodes de prévention et de contrôle actuelles. Malgré le succès des additifs coccidiostatiques et des vaccins vivants en tant que mesures préventives, la coccidiose reste une menace économique importante pour l'industrie avicole. Il est donc indispensable de continuer à développer des recherches dans ce domaine et d’explorer de nouvelles méthodes de prévention et de contrôle de la coccidiose. Plus précisément, le potentiel des phytogéniques et la mise en place de programmes de surveillance efficaces pour une reconnaissance rapide des populations développant une résistance doivent être étudiés. Dans l'ensemble, ces efforts peuvent contribuer au développement de stratégies de prévention et de contrôle de la coccidiose plus efficaces et durables, réduisant ainsi les pertes financières subies par l'industrie avicole, notamment pour les élevages des pays à revenu faible ou intermédiaire qui sont encore plus vulnérables aux impacts financiers de la coccidiose.
Contribution des auteurs
Rahul AVI a effectué les recherches bibliographiques et rédigé les versions successives du manuscrit. Jean-Michel REPERANT, Françoise I. BUSSIERE, Anne SILVESTRE, Jean-François LE ROUX, David MOREAUD et Javier GONZALEZ ont contribué de manière équivalente à la réflexion conceptuelle sur la structure globale de l'étude. Tous les auteurs ont relu et approuvé la version finale du manuscrit.
Remerciements
Ce travail a été réalisé grâce au soutien financier de Nuproxa, Feed-consult et David MOREAUD. Les auteurs tiennent à remercier tout particulièrement Elisabeth BAEZA pour sa contribution aux réflexions et sa relecture du manuscrit.
Références
- Abbas, R. Z., Iqbal, Z., Sindhu, Z. D., Khan, M. N., & Arshad, M. (2008). Identification of cross-resistance and multiple resistance in Eimeria tenella field isolates to commonly used anticoccidials in Pakistan. Journal of Applied Poultry Research, 17(3), 361-368. doi:10.3382/japr.2008-00027
- Abbas, R. Z., Iqbal, Z., Khan, A., Sindhu, Z. U. D., Khan, J. A., Khan, M. N., & Raza, A. (2012). Options for integrated strategies for the control of avian coccidiosis. International Journal of Agriculture and Biology, 14(6), 1014-1020. https://www.fspublishers.org/published_papers/3693_..pdf
- Abbas, A., Iqbal, Z., Abbas, R. Z., Khan, M. K., Khan, J. A., Sindhu, Z. ud D., Mahmood, M. S., & Saleemi, M. K. (2017). In vivo anticoccidial effects of Beta vulgaris (sugar beet) in broiler chickens. Microbial Pathogenesis, 111, 139-144. doi:10.1016/j.micpath.2017.07.052
- Abbas, R. Z., Abbas, A., Iqbal, Z., Raza, M. A., Hussain, K., Ahmed, T., & Shafi, M. U. (2020). In vitro anticoccidial activity of Vitis vinifera extract on oocysts of different Eimeria species of Broiler Chicken. Journal of the Hellenic Veterinary Medical Society, 71(3), 2267-2272. doi:10.12681/jhvms.25071
- Abdelli, N., Solà-Oriol, D., & Pérez, J. F. (2021). Phytogenic feed additives in poultry: Achievements, prospective and challenges. Animals, 11(12). doi:10.3390/ani11123471
- Abebe, E., & Gugsa, G. (2018). A review on poultry coccidiosis. Abyss. Journal of Science and Technology, 3(06). doi:10.20372/ajst.2018.3.1.76
- Acharya, K., & Acharya, N. (2017). Alternatives to fight against coccidiosis: A review. Nepalese Veterinary Journal, 34, 152-167. https ://doi.org/10.3126/nvj.v34i0.22918
- Afssa (2007). Avis de l’Agence française de sécurité sanitaire des aliments relatif à l’évolution du statut des additifs coccidiostatiques. https://www.anses.fr/en/system/files/ALAN2007sa0176.pdf
- Agunos, A., Léger, D. F., Carson, C. A., Gow, S. P., Bosman, A., Irwin, R. J., & Reid-Smith, R. J. (2017). Antimicrobial use surveillance in broiler chicken flocks in Canada, 2013-2015. PloS ONE, 12(6), 2013-2015. doi:10.1371/journal.pone.0179384
- Ahmed, A. I., Sulaiman, M. M., Istifanus, W. A., Panda, S. M., & Chongmobmi1, M. (2019). Anticoccidial efficacy of Azadirachta indica leaf powder against Eimeria tenella infection in broiler chickens. Science Forum. Journal Of Pure And Applied Sciences, 16, 82-88. doi:10.5455/sf.22258
- Albanese, G. A., Tensa, L. R., Aston, E. J., Hilt, D. A., & Jordan, B. J. (2018). Evaluation of a coccidia vaccine using spray and gel applications. Poultry Science, 97(5), 1544-1553. doi:10.3382/ps/pey011
- Ali, M., Chand, N., Khan, R. U., Naz, S., & Gul, S. (2019). Anticoccidial effect of garlic (Allium sativum) and ginger (Zingiber officinale) against experimentally induced coccidiosis in broiler chickens. Journal of Applied Animal Research, 47(1), 79–84. doi:10.1080/09712119.2019.1573731
- Allen, P. C., & Fetterer, R. H. (2002). Recent advances in biology and immunobiology of Eimeria species and in diagnosis and control of infection with these coccidian parasites of poultry. Clinical Microbiology Reviews, 15(1), 58–65. doi:10.1128/CMR.15.1.58-65.2002
- Alqhtani, A. H., Qaid, M. M., Al-Mufarrej, S. I., Al-Garadi, M. A., & Ali, A. B. A. (2023). Serum biochemistry indices, leukogram, carcass variables and intestinal measurements of Eimeria tenella-infected or non-infected broilers treated with dietary Cinnamomum verum bark. Journal of Applied Animal Research, 51(1), 40-51. doi:10.1080/09712119.2022.2150630
- Antoszczak, M., Steverding, D., & Huczyński, A. (2019). Anti-parasitic activity of polyether ionophores. European Journal of Medicinal Chemistry, 166, 32-47. doi:10.1016/j.ejmech.2019.01.035
- Attree, E., Sanchez-Arsuaga, G., Jones, M., Xia, D., Marugan-Hernandez, V., Blake, D., & Tomley, F. (2021). Controlling the causative agents of coccidiosis in domestic chickens; an eye on the past and considerations for the future. CABI Agriculture and Bioscience, 2(1), 1-16. doi:10.1186/s43170-021-00056-5
- Awais, M. M., Akhtar, M., Anwar, M. I., & Khaliq, K. (2018). Evaluation of Saccharum officinarum L. bagasse-derived polysaccharides as native immunomodulatory and anticoccidial agents in broilers. Veterinary Parasitology, 249, 74-81. doi:10.1016/j.vetpar.2017.11.012
- Barta, J. R. (2001). Coccidiosis. In ELS (Encyclope_dia of Life Sciences)., 1-8. doi:doi:10.1038/npg.els.0001947
- Bishop, S. C., & Woolliams, J. A. (2014). Genomics and disease resistance studies in livestock. Livestock Science, 166(1), 190-198. doi:10.1016/j.livsci.2014.04.034
- Blake, D. P., Knox, J., Dehaeck, B., Huntington, B., Rathinam, T., Ravipati, V., Ayoade, S., Gilbert, W., Adebambo, A. O., Jatau, I. D., Raman, M., Parker, D., Rushton, J., & Tomley, F. M. (2020). Re-calculating the cost of coccidiosis in chickens. Veterinary Research, 51(1), 1-14. doi:10.1186/s13567-020-00837-2
- Blake, D. P., Marugan-Hernandez, V., & Tomley, F. M. (2021). Spotlight on avian pathology: Eimeria and the disease coccidiosis. Avian Pathology, 50(3), 209-213. doi:10.1080/03079457.2021.1912288
- Boulton, K., Nolan, M. J., Wu, Z., Psifidi, A., Riggio, V., Harman, K., Bishop, S. C., Kaiser, P., Abrahamsen, M. S., Hawken, R., Watson, K. A., Tomley, F. M., Blake, D. P., & Hume, D. A. (2018). Phenotypic and genetic variation in the response of chickens to Eimeria tenella induced coccidiosis. Genetics Selection Evolution, 50(1), 1-12. doi:10.1186/s12711-018-0433-7
- Burrell, A., Tomley, F. M., Vaughan, S., & Marugan-Hernandez, V. (2020). Life cycle stages, specific organelles and invasion mechanisms of Eimeria species. Parasitology, 147(3), 263-278. doi:10.1017/S0031182019001562
- Cardoso, M. A. B., Flemming, J. S., & Flemming, F. F. (2002). Utilização Do Halquinol Como Promotor De Crescimento E Coadjuvante No Controle Da Coccidiose Em Frangos De Corte. Archives of Veterinary Science, 7(1), 11-19. https ://doi.org/10.5380/avs.v7i1.3963
- Carvalho, F. S., Wenceslau, A. A., Teixeira, M., Matos Carneiro, J. A., Melo, A. D. B., & Albuquerque, G. R. (2011). Diagnosis of Eimeria species using traditional and molecular methods in field studies. Veterinary Parasitology, 176(2–3), 95-100. doi:10.1016/j.vetpar.2010.11.015
- Chapman, H. D. (1997). Biochemical, genetic and applied aspects of drug resistance in Eimeria parasites of the fowl. Avian pathology, 26(2), 221-244. doi:10.1080/03079459708419208
- Chapman, H. D. (1999). Anticoccidial drugs and their effects upon the development of immunity to Eimeria infections in poultry. Avian Pathology, 28(6), 521-535. doi:10.1080/03079459994317
- Chapman, H. D. (2000). Practical use of vaccines for the control of coccidiosis in the chicken. World’s Poultry Science Journal, 56(1), 18-20. doi:10.1079/wps20000002
- Chapman, H. D. (2001). Use of anticoccidial drugs in broiler chickens in the USA: Analysis for the years 1995 to 1999. Poultry Science, 80(5), 572-580. doi:10.1093/ps/80.5.572
- Chapman, H. D. (2009). A landmark contribution to poultry science-Prophylactic control of coccidiosis in poultry. Poultry Science, 88(4), 813-815. doi:10.3382/ps.2008-00316
- Chapman, H. D., & Jeffers, T. K. (2014). Vaccination of chickens against coccidiosis ameliorates drug resistance in commercial poultry production. International Journal for Parasitology: Drugs and Drug Resistance, 4(3), 214-217. doi:10.1016/j.ijpddr.2014.10.002
- Chapman, H. D., & Rathinam, T. (2022). Focused review: The role of drug combinations for the control of coccidiosis in commercially reared chickens. International Journal for Parasitology: Drugs and Drug Resistance, 18, 32-42. doi:10.1016/j.ijpddr.2022.01.001
- Chen, H. L., Zhao, X. Y., Zhao, G. X., Huang, H. Bin, Li, H. R., Shi, C. W., Yang, W. T., Jiang, Y. L., Wang, J. Z., Ye, L. P., Zhao, Q., Wang, C. F., & Yang, G. L. (2020). Dissection of the cecal microbial community in chickens after Eimeria tenella infection. Parasites and Vectors, 13(1), 1-15. doi:10.1186/s13071-020-3897-6
- Choi, J., Tompkins, Y. H., Teng, P. Y., Gogal, R. M., & Kim, W. K. (2022). Effects of tannic acid supplementation on growth performance, oocyst shedding, and gut health of in broilers infected with Eimeria Maxima. Animals, 12(11). doi:10.3390/ani12111378
- Conway, D. P., & Mckenzie, M. E. (2007). Poultry coccidiosis: Diagnostic and testing procedures (3rd edition). Blackwell Publishing. https ://doi.org/10.1002/9780470344620
- Crévieu-Gabriel, I., & Naciri, M. (2001). Effet de l’alimentation sur les coccidioses chez le poulet. INRA Productions Animales, 14(4), 231-246. https ://doi.org/10.20870/productions-animales.2001.14.4.3746
- Ducatelle, R., Eeckhaut, V., Haesebrouck, F., & Van Immerseel, F. (2015). A review on prebiotics and probiotics for the control of dysbiosis: present status and future perspectives. Animal, 9(1), 43-48. doi:10.1017/S1751731114002584
- Dumont, B., Fortun-Lamothe, L., Jouven, M., Thomas, M., & Tichit, M. (2013). Prospects from agroecology and industrial ecology for animal production in the 21st century. Animal, 7(6), 1028-1043. doi:10.1017/S1751731112002418
- El-Ghany, W. A. A. (2021). Intervention strategies for controlling poultry coccidiosis: current knowledge. Journal of World’s Poultry Research, 11(4), 487-505. doi:10.36380/JWPR.2021.58
- El-Shall, N. A., Abd El-Hack, M. E., Albaqami, N. M., Khafaga, A. F., Taha, A. E., Swelum, A. A., El-Saadony, M. T., Salem, H. M., El-Tahan, A. M., AbuQamar, S. F., El-Tarabily, K. A., & Elbestawy, A. R. (2022). Phytochemical control of poultry coccidiosis: a review. Poultry Science, 101(1), 101542. doi:10.1016/j.psj.2021.101542
- Etuk, E. B., Okoli, I. C., & Uko, M. U. (2004). Prevalence and management issues associated with poultry coccidiosis in Abak agricultural zone of Akwa Ibom State, Nigeria. International Journal of Poultry Science, 3(2), 135-139. doi:10.3923/ijps.2004.135.139
- European Union (2022). Register of Feed Additives, 226th Edition (Issue 1831). https ://doi.org/10.2875/110483
- Fatemi, A., Razavi, S. M., Asasi, K., & Torabi Goudarzi, M. (2015). Effects of Artemisia annua extracts on sporulation of Eimeria oocysts. Parasitology Research, 114(3), 1207-1211. doi:10.1007/s00436-014-4304-z
- Fatoba, A. J., & Adeleke, M. A. (2018). Diagnosis and control of chicken coccidiosis: a recent update. Journal of Parasitic Diseases, 42(4), 483-493. doi:10.1007/s12639-018-1048-1
- Fortun-Lamothe, L., Collin, A., Combes, S., Ferchaud, S., Germain, K., Guilloteau, L., Gunia, M., Lefloc’h, N., Manoli, C., Montagne L., & Savietto, D. (2022). Principes, cadre d’analyse et leviers d’action à l’échelle de l’élevage pour une gestion intégrée de la santé chez les animaux monogastriques. INRAE Productions Animales, 35(4), 307-326. doi:10.20870/productions-animales.2022.35.4.7225
- Gadde, U., Kim, W. H., Oh, S. T., & Lillehoj, H. S. (2017). Alternatives to antibiotics for maximizing growth performance and feed efficiency in poultry: A review. Animal Health Research Reviews, 18(1), 26-45. doi:10.1017/S1466252316000207
- Gharekhani, J., Sadeghi-Dehkordi, Z., & Bahrami, M. (2014). Prevalence of coccidiosis in broiler chicken farms in western Iran. Journal of Veterinary Medicine, 1-4. doi:10.1155/2014/980604
- Gheisar, M., & Kim, I. H. (2018). Phytobiotics in poultry and swine nutrition–a review. Italian Journal of Animal Science, 17(1), 92-99. doi:10.1080/1828051X.2017.1350120
- Gilbert, W., Bellet, C., Blake, D. P., Tomley, F. M., & Rushton, J. (2020). Revisiting the economic impacts of Eimeria and its control in european intensive broiler systems with a recursive modeling approach. Frontiers in Veterinary Science, 7, 1-14. doi:10.3389/fvets.2020.558182
- Gómez-Osorio, L.-M., Chaparro-Gutiérrez, J.-J., & López-Osorio S., (2021). Nutrition and poultry coccidiosis: causes, consequences and current strategies to modulate the disease. In: Patra , A.-K. (Coord.). Advances in Poultry Nutrition Research (pp. 214) IntechOpen. https://www.intechopen.com/chapters/75810
- Gržinić, G., Piotrowicz-Cieślak, A., Klimkowicz-Pawlas, A., Górny, R. L., Ławniczek-Wałczyk, A., Piechowicz, L., ... & Wolska, L. (2023). Intensive poultry farming: A review of the impact on the environment and human health. Science of The Total Environment, 858, 160014. doi:10.1016/j.scitotenv.2022.160014
- Hafez, H. M. (2008). Poultry coccidiosis: Prevention and control approaches. Archiv für Geflugelkünde, 72(1), 2-7. https://www.european-poultry-science.com/Poultry-coccidiosis-prevention-and-control-approaches,%20QUlEPTQyMTg3ODEmTUlEPTE2MTAxNA.html
- Hamzić, E., Buitenhuis, B., Hérault, F., Hawken, R., Abrahamsen, M. S., Servin, B., Elsen, J. M., Pinard – Van Der Laan, M. H., & Bed’Hom, B. (2015). Genome-wide association study and biological pathway analysis of the Eimeria maxima response in broilers. Genetics Selection Evolution, 47(1), 1-17. doi:10.1186/s12711-015-0170-0
- Iraee, H. A., Iraee, M. A., Youssefi, M. R., & Tabari, M. A. (2015). Growth performance parameters in chicken experimental coccidiosis treated with Diclazuril and Clopidol: the need for assessing new anticoccidial resources. Iranian Journal of Veterinary Medicine, 9(3), 189-194, Pe26. https://www.academia.edu/108970374/Growth_performance_parameters_in_chicken_experimental_coccidiosis_treated_with_diclazuril_and_Clopidol_The_need_for_assessing_new_anticoccidial_resources
- Jelveh, K., Mottaghitalab, M., & Mohammadi, M. (2023). Effects of green tea phytosome on growth performance and intestinal integrity under coccidiosis infection challenge in broilers. Poultry Science, 102(5), 102627. doi:10.1016/j.psj.2023.102627
- Jeni, R. El, Dittoe, D. K., Olson, E. G., Lourenco, J., Seidel, D. S., Ricke, S. C., & Callaway, T. R. (2021). An overview of health challenges in alternative poultry production systems. Poultry Science, 100(7), 101173. doi:10.1016/j.psj.2021.101173
- Kaleem, Q. M., Akhtar, M., Awais, M. M., Saleem, M., Zafar, M., Iqbal, Z., Muhammad, F., & Anwar, M. I. (2014). Studies on Emblica officinalis derived tannins for their immunostimulatory and protective activities against coccidiosis in industrial broiler chickens. The Scientific World Journal, 10-12. doi:10.1155/2014/378473
- Kant, V., Singh, P., Verma, P. K., Bais, I., Parmar, M. S., Gopal, A., & Gupta, V. (2013). Anticoccidial drugs used in the poultry: an overview. Science International, 1(7), 261-265. https ://doi.org/10.17311/sciintl.2013.261.265
- Kim, D. K., Lillehoj, H. S., Lee, S. H., Lillehoj, E. P., & Bravo, D. (2013). Improved resistance to Eimeria acervulina infection in chickens due to dietary supplementation with garlic metabolites. British Journal of Nutrition, 109(1), 76-88. doi:10.1017/S0007114512000530
- Kumar, A., & Patyal, A. (2020). Impacts of intensive poultry farming on’one health’in developing countries: challenges and remedies. Exploratory Animal & Medical Research, 10(2). https ://www.researchgate.net/publication/347994283
- Lai, L., Bumstead, J., Liu, Y., Garnett, J., Campanero-Rhodes, M. A., Blake, D. P., Palma, A. S., Chai, W., Ferguson, D. J. P., Simpson, P., Feizi, T., Tomley, F. M., & Matthews, S. (2011). The role of Sialyl glycan recognition in host tissue tropism of the avian parasite Eimeria Tenella. PloS Pathogens, 7(10). doi:10.1371/journal.ppat.1002296
- Lee, S. H., Lillehoj, H. S., Jang, S. I., Lee, K. W., Bravo, D., & Lillehoj, E. P. (2011). Effects of dietary supplementation with phytonutrients on vaccine-stimulated immunity against infection with Eimeria tenella. Veterinary Parasitology, 181(2–4), 97-105. doi:10.1016/j.vetpar.2011.05.003
- Looker, D. L., Marr, J. J., & Stotish, R. L. (1986). Modes of Action of Antiprotozoal Agents. Chemotherapy of Parasitic Diseases, 193-207. doi:10.1007/978-1-4684-1233-8_9
- López-Osorio, S., Chaparro-Gutiérrez, J. J., & Gómez-Osorio, L. M. (2020). Overview of poultry Eimeria life cycle and host-parasite interactions. Frontiers in Veterinary Science, 7, 1-8. doi:10.3389/fvets.2020.00384
- Madlala, T., Okpeku, M., & Adeleke, M. A. (2021). Understanding the interactions between Eimeria infection and gut microbiota, towards the control of chicken coccidiosis: A review. Parasite, 28(48), 10p. doi:10.1051/parasite/2021047
- McDonald, V., & Shirley, M. W. (2009). Past and future: Vaccination against Eimeria. Parasitology, 136(12), 1477-1489. doi:10.1017/S0031182009006349
- McDougald, L. R., Cervantes, H. M., Jenkins, M. C., Hess, M., & Beckstead, R. (2020). Protozoal infections. Diseases of poultry, 1192-1254. doi:10.1002/9781119371199.ch28
- Molan, A.-L., & Faraj, A. M. (2015). Effect of selenium-rich green tea extract on the course of sporulation of Eimeria oocysts. IOSR Journal of Dental and Medical Sciences (IOSR-JDMS) e-ISSN, 14(4), 68-74. https ://doi.org/10.9790/0853-14436874
- Molan, A. L., Liu, Z., & De, S. (2009). Effect of pine bark (Pinus radiata) extracts on sporulation of coccidian oocysts. Folia Parasitologica, 56(1), 1-5. doi:10.14411/fp.2009.001
- Morris, G. M., Woods, W. G., Richards, D. G., & Gasser, R. B. (2007). Investigating a persistent coccidiosis problem on a commercial broiler-breeder farm utilising PCR-coupled capillary electrophoresis. Parasitology Research, 101(3), 583-589. doi:10.1007/s00436-007-0516-9
- Mottet, A., & Tempio, G. (2017). Global poultry production: Current state and future outlook and challenges. World’s Poultry Science Journal, 73(2), 245-256. doi:10.1017/S0043933917000071
- Nawarathne, S. R., Yu, M., & Heo, J. M. (2021). Poultry coccidiosis-a concurrent overview on etiology, diagnostic practices, and preventive measures. Korean Journal of Poultry Science, 48(4), 297-318. doi:doi:10.5536/KJPS.2021.48.4.297
- Noack, S., Chapman, H. D., & Selzer, P. M. (2019). Anticoccidial drugs of the livestock industry. Parasitology Research, 118(7), 2009-2026. doi:10.1007/s00436-019-06343-5
- Oelschlager, M. L., Rasheed, M. S. A., Smith, B. N., Rincker, M. J., & Dilger, R. N. (2019). Effects of Yucca schidigera-derived saponin supplementation during a mixed Eimeria challenge in broilers. Poultry science, 98(8), 3212-3222. doi:10.3382/ps/pez051
- Onyiche, T. G. E., Gotep, J. G., Tanko, J. T., Ochigbo, G. O., Ozoani, H. A., Viyoff, V. Z., Dogonyaro, B. B., Makoshi, M. S., Kinjir, H., Thekisoe, O., Atiku, A. A., Shamaki, D., & Muraina, I. A. (2021). Azadirachta indica aqueous leaf extracts ameliorates coccidiosis in broiler chickens experimentally infected with Eimeria oocysts. Scientific African, 13, e00851. doi:10.1016/j.sciaf.2021.e00851
- Peek, H. W., & Landman, W. J. M. (2011). Coccidiosis in poultry: Anticoccidial products, vaccines and other prevention strategies. Veterinary Quarterly, 31(3), 143-161. doi:10.1080/01652176.2011.605247
- Pinard-Van Der Laan, M. H., Monvoisin, J. L., Pery, P., Hamet, N., & Thomas, M. (1998). Comparison of outbred lines of chickens for resistance to experimental infection with coccidiosis (Eimeria tenella). Poultry Science, 77(2), 185-191. doi:10.1093/ps/77.2.185
- Pinard-Van Der Laan, M. H., Bed’hom, B., Coville, J. L., Pitel, F., Feve, K., Leroux, S., Legros, H., Thomas, A., Gourichon, D., Repérant, J. M., & Rault, P. (2009). Microsatellite mapping of QTLs affecting resistance to coccidiosis (Eimeria tenella) in a Fayoumi × White Leghorn cross. BMC Genomics, 10, 1-13. doi:10.1186/1471-2164-10-31
- Pop, L. M., Varga, E., Coroian, M., Nedisan, M. E., Mircean, V., Dumitrache, M. O., Farczádi, L., Fülöp, I., Croitoru, M. D., Fazakas, M., & Gyorke, A. (2019). Efficacy of a commercial herbal formula in chicken experimental coccidiosis. Parasites and Vectors, 12(1), 1-9. doi:10.1186/s13071-019-3595-4
- Quiroz-Castañeda, R. E., & Dantán-González, E. (2015). Control of avian coccidiosis: Future and present natural alternatives. BioMed Research International, 2015, 430610. doi:10.1155/2015/430610
- Rahmani, A., Ahmed Laloui, H., Zaak, H., Selmania, A., Oufroukh, K., Chareb, N., ... & Ghalmi, F. (2021). Effect of Pistacia lentiscus L. vegetable oil on growth performance and coccidiosis in broiler chickens: in vitro and in vivo assessment. Acta Parasitologica, 66(4), 1151-1157. doi:10.1007/s11686-021-00365-9
- Ramalingam, V., Muthusamy, R., Bohra, K., Nithyanantham, M., Palavesam, A., & Gopal, D. (2022). Development of subunit vaccine against poultry coccidiosis. Indian Journal of Veterinary Sciences & Biotechnology, 18(1), 7-12. https ://doi.org/10.21887/ijvsbt.18.1.2
- Répérant, J. M., Dardi, M., Pagès, M., & Thomas-Hénaff, M. (2012). Pathogenicity of Eimeria praecox alone or associated with Eimeria acervulina in experimentally infected broiler chickens. Veterinary Parasitology, 187(1-2), 333–336. doi:10.1016/j.vetpar.2011.12.009
- Rocchi, L., Paolotti, L., Rosati, A., Boggia, A., & Castellini, C. (2019). Assessing the sustainability of different poultry production systems: A multicriteria approach. Journal of Cleaner Production, 211, 103-114. doi:10.1016/j.jclepro.2018.11.013
- Saeed, Z., & Alkheraije, K. A. (2023). Botanicals: A promising approach for controlling cecal coccidiosis in poultry. Frontiers in Veterinary Science, 10. doi:10.3389/fvets.2023.1157633
- Sánchez-Hernández, C., Castañeda-Gómez del Campo, J. A., Trejo-Castro, L., Mendoza-Martínez, G. D., & Gloria-Trujillo, A. (2019). Evaluation of a feed plant additive for coocidiosis control in broilers herbals for coccidiosis control. Brazilian Journal of Poultry Science, 21, eRBCA-2019. doi:10.1590/1806-9061-2018-0846
- Santos, R. R., Velkers, F. C., Vernooij, J. C. M., Star, L., Heerkens, J. L. T., van Harn, J., & de Jong, I. C. (2022). Nutritional interventions to support broiler chickens during Eimeria infection. Poultry Science, 101(6), 101853. https ://doi.org/10.1016/j.psj.2022.101853
- Sharma, U. N. S., Fernando, D. D., Wijesundara, K. K., Manawadu, A., Pathirana, I., & Rajapakse, R. P. V. J. (2021). Anticoccidial effects of Phyllanthus emblica (Indian gooseberry) extracts: Potential for controlling avian coccidiosis. Veterinary Parasitology: Regional Studies and Reports, 25, 100592. doi:10.1016/j.vprsr.2021.100592
- Shirley, M. W., & Bedrník, P. (1997). Live attenuated vaccines against Avian coccidiosis: Success with precocious and egg-adapted lines of Eimeria. Parasitology Today, 13(12), 481-484. doi:10.1016/S0169-4758(97)01153-8
- Shivaramaiah, S., Tellez, G., Barta, J., Hernandez-Velasco, X., & Hargis, B. (2014). Coccidiosis: recent advancements in the immunobiology of Eimeria species, preventive measures, and the importance of vaccination as a control tool against these Apicomplexan parasites. Veterinary Medicine: Research and Reports, 23. doi:10.2147/vmrr.s57839
- Sidiropoulou, E., Skoufos, I., Marugan-Hernandez, V., Giannenas, I., Bonos, E., Aguiar-Martins, K., Lazari, D., Blake, D. P., & Tzora, A. (2020). In vitro anticoccidial study of oregano and garlic essential oils and effects on growth performance, fecal oocyst output, and intestinal microbiota in vivo. Frontiers in Veterinary Science, 7, 1-11. doi:10.3389/fvets.2020.00420
- Song, X., Yang, X., Zhang, T., Liu, J., & Liu, Q. (2020). A novel rhoptry protein as candidate vaccine against Eimeria tenella infection. Vaccines, 8(3), 1-14. doi:10.3390/vaccines8030452
- Song, X., Gao, Y., Xu, L., Yan, R., & Li, X. (2015). Partial protection against four species of chicken coccidia induced by multivalent subunit vaccine. Veterinary Parasitology, 212(3-4), 80-85. doi:10.1016/j.vetpar.2015.08.026
- Sossidou, E. N., Dal Bosco, A., Elson, H. A., & Fontes, C. M. G. A. (2011). Pasture-based systems for poultry production: Implications and perspectives. World’s Poultry Science Journal, 67(1), 47–58. doi:10.1017/S0043933911000043
- Soutter, F., Werling, D., Tomley, F. M., & Blake, D. P. (2020). Poultry coccidiosis: design and interpretation of vaccine studies. Frontiers in Veterinary Science, 7, 1-12. doi:10.3389/fvets.2020.00101
- Tensa, L. R., & Jordan, B. J. (2019). Comparison of the application parameters of coccidia vaccines by gel and spray. Poultry Science, 98(2), 634-641. doi:10.3382/ps/pey364
- Vieira, A. M., Teixeira Soratto, T. A., Cardinal, K. M., Wagner, G., Hauptli, L., Ferreira Lima, A. L., Dahlke, F., Netto, D. P., de Oliveira Moraes, P., & Leal Ribeiro, A. M. (2020). Modulation of the intestinal microbiota of broilers supplemented with monensin or functional oils in response to challenge by Eimeria spp. PLoS ONE, 15(8), 1-15. doi:10.1371/journal.pone.0237118
- Walker, R. A., Ferguson, D. J., Miller, C. M., & Smith, N. C. (2013). Sex and Eimeria: a molecular perspective. Parasitology, 140(14), 1701-1717. doi:10.1017/S0031182013000838
- Wang, M. L., Suo, X., Gu, J. H., Zhang, W. W., Fang, Q., & Wang, X. (2008). Influence of grape seed proanthocyanidin extract in broiler chickens: Effect on chicken coccidiosis and antioxidant status. Poultry Science, 87(11), 2273-2280. doi:10.3382/ps.2008-00077
- Williams, R. B. (1998). Epidemiological aspects of the use of live anticoccidial vaccines for chickens. International journal for parasitology, 28(7), 1089-1098. doi:10.1016/s0020-7519(98)00066-6
- Windisch, W., Schedle, K., Plitzner, C., & Kroismayr, A. (2008). Use of phytogenic products as feed additives for swine and poultry. Journal of Animal Science, 86(14), E140–E148. doi:10.2527/jas.2007-0459
- Zhang, J. J., Wang, L. X., Ruan, W. K., & An, J. (2013). Investigation into the prevalence of coccidiosis and maduramycin drug resistance in chickens in China. Veterinary Parasitology, 191(1-2), 29-34. doi:10.1016/j.vetpar.2012.07.027
Résumé
La coccidiose aviaire est l'un des défis les plus importants et les plus persistants auxquels est confrontée l'industrie avicole mondiale, entraînant une baisse de productivité due aux dommages intestinaux causés par le protozoaire apicomplexe intracellulaire Eimeria. Le cycle de vie d'Eimeria est complexe, caractérisé par des stades intra- et extracellulaires. Le stade intracellulaire induit une réponse inflammatoire en partie responsable de la formation de lésions tissulaires, des hémorragies diarrhéiques, une mauvaise croissance, une sensibilité accrue à d'autres agents pathogènes et, dans certains cas sévères (E. tenella et E. necatrix), une forte mortalité. Une bonne gestion sanitaire est indispensable pour prévenir la coccidiose chez les poulets. L'administration d'anticoccidiens dans les aliments peut également réduire efficacement l’intensité de l’infection par Eimeria. Cependant, leur utilisation à grande échelle et sur une longue durée a entraîné le développement de résistances à ces additifs dans le monde entier. Des vaccins vivants non atténués et atténués ont été développés mais ils présentent certaines limites. En plus des méthodes conventionnelles de prévention et de contrôle, les produits phytogéniques émergent comme alternative pour contrôler la coccidiose aviaire. Les recherches en cours sur la sélection génétique et des vaccins recombinants et sous-unitaires sont prometteuses pour la prévention, mais leur efficacité et leur adoption dans l'industrie avicole restent à démontrer. De plus, comme alternatives aux coccidiostatiques, des stratégies utilisant des extraits naturels sont plus acceptées par les consommateurs et sont de plus en plus étudiées. Cet article présente donc une vue d'ensemble de l'impact économique de la coccidiose chez les poulets sur la production et aborde les stratégies intégrées de la santé pour contrôler la coccidiose chez les poulets.
Pièces jointes
Pas de document complémentaire pour cet articleStatistiques de l'article
 Vues: 16393
Vues: 16393
Téléchargements
 PDF: 1280
PDF: 1280
 XML: 94
XML: 94
Articles les plus lus par le même auteur ou la même autrice
- Karine GERMAIN, Claire BONNEFOUS, Ludovic CALANDREAU, Geoffrey CHIRON, Brieuc DESAINT, Elisabeth LE BIHAN-DUVAL, Vitor FERREIRA, Vanessa GUESDON, Laurence A. GUILLOTEAU, Sarah LOMBARD, Bertrand MÉDA, Anne SILVESTRE, Anne COLLIN, L’élevage de poulets biologiques : les verrous à lever et les opportunités offertes par cette production , INRAE Productions Animales: Vol. 37 No 2 (2024): Numéro spécial : L’élevage biologique : conditions et potentiel de développement

