L’épizootie de Peste Porcine Africaine : virologie, épidémiologie et perspectives de contrôle
Chapeau
La Peste Porcine Africaine (PPA) est entrée sur le continent Européen en 2007 et a diffusé largement à travers toute l’Europe mais aussi en Asie. La propagation importante dans certains pays de l’Est de l’Europe et la difficulté de gestion dans le réservoir sauvage menace l’industrie porcine Européenne. En Asie, la situation semble aujourd’hui hors de contrôle et en l’absence de vaccins efficaces à court ou même moyen terme, la production porcine dans ces pays semble compromise pour de nombreuses années
Introduction
La Peste Porcine Africaine (PPA), parfois appelée Fièvre Porcine Africaine (FPA) par analogie avec sa dénomination anglo-saxonne, est une maladie souvent qualifiée de hautement contagieuse, spécifique des suidés domestiques et sauvages (sangliers, phacochères, potamochères) qui n’est pas transmissible à l’Homme. Elle est soumise à déclaration obligatoire en France et dans les pays adhérant à l’OIE (encadré 1 et 2). Cette maladie est connue depuis longtemps en Afrique (décrite pour la première fois en 1910 au Kenya ; (Montgomery, 1921)) et a été introduite à plusieurs reprises sur le continent Européen depuis l’Afrique. La première introduction remonte à 1957 au Portugal où elle a été éradiquée puis réintroduite en 1960 sur la péninsule ibérique. Suite à cette introduction, la maladie a diffusé dans plusieurs pays Européens : Andorre (1975), Belgique (1985), France (1964, 1967 et 1974), Malte (1978), Pays-Bas (1986) et Italie (1967, 1969 and 1993) où elle a été responsable de foyers sporadiques. La persistance a cependant été très longue dans la péninsule ibérique puisqu’elle n’a pu être éradiquée qu’en 1995. La présence de tiques molles du genre Ornithodoros, compétents sur le plan vectoriel dans le sud de l’Espagne et du Portugal, a probablement participé aux difficultés rencontrées dans l’éradication. A la même époque (1978-1984), plusieurs cas sporadiques ont été décrits dans les Caraïbes et au Brésil.
La France est indemne de PPA depuis 1974. Depuis 1978, la maladie est cependant présente sous forme enzootique en Sardaigne, proche de la Corse (encadré 3). Le nombre de cas déclarés a augmenté à partir de 2010, essentiellement suite à la mise en place d'un nouveau plan d'éradication en 2015 (Laddomada et al., 2019). La situation s'est nettement améliorée ces deux dernières années, suite à l'interdiction de l'élevage extensif. Il n'y a jamais eu d'introduction en Corse malgré la grande proximité. En complément de la surveillance évènementielle mise en place sur l'île (reposant sur la déclaration de suspicions cliniques), notamment sur les sangliers, et des mesures mises en place visant à prévenir toute introduction depuis la Sardaigne (Note de service DGAL/SDSPA/2015-2009/01/2015), une enquête sérologique a été conduite en 2014 sur 400 porcs parmi les 8000 abattus sur l'île sur la période d'étude et a montré des résultats favorables (Desvaux et al., 2014). La présente synthèse a pour objectif de présenter les dernières données disponibles sur le virus et son épidémiologie, les conséquences en matière de gestion et les perspectives de contrôle.
Encadré 1. La Peste Porcine Africaine (PPA).
Agent étiologique
Le virus de la PPA est un virus à ADN enveloppé, seul représentant de sa famille des Asfarviridae. Ce virus est particulièrement résistant dans l’environnement, notamment en présence de milieu riche en protéines, tels que de la viande de porc où il peut survivre des mois au congélateur, ou jusqu’à 300 jours dans du jambon sec. Il résiste bien à la chaleur et aux désinfectants si le milieu n’a pas été correctement nettoyé au préalable et contient donc de la matière organique susceptible de le protéger.
Diagnostic
Pour confirmer une infection par le virus de la PPA, des analyses de laboratoire doivent être menées car l’expression clinique de la maladie n’est pas différentiable de celle de la peste porcine classique (autre maladie infectieuse des suidés liée à un Pestivirus), voire d’autres infections virales comme celles dues au circovirus porcin ou au virus du SDRP (Syndrome Dysgénésique et Respiratoire Porcin). Des méthodes de diagnostic direct par détection du génome viral (PCR) ou indirect par sérologie (ELISA) permettent de lever très rapidement une suspicion.
En France un réseau de deux laboratoires départementaux (Inovalys Le Mans, LDA Strasbourg) a été créé en Octobre 2018 qui réalise ces analyses de première intention. La confirmation d’un cas est réalisée par le laboratoire national de référence (ANSES-Ploufragan) par la réalisation combinée de différentes analyses complémentaires par PCR, sérologie et virologie dont l’isolement viral et le séquençage.
Surveillance en France
Objectif de la surveillance : détecter précocement toute introduction du virus chez les porcs domestiques ou les sangliers sauvages
Modalités de la surveillance : En élevage de porcs, la surveillance est uniquement évènementielle, basée sur la détection de signes cliniques et/ou d’un nombre de mortalités croissant. Elle repose sur le principe de la déclaration obligatoire à la DDecPP (Direction Départementale en charge de la Protection des Populations) de toute suspicion par toute personne (éleveur, transporteur, abatteur, négociant…).
Dans la faune sauvage, le réseau SAGIR
Encadré 2. Méthodes de lutte contre les maladies contagieuses animales.
Grands principes de lutte contre les maladies contagieuses animales
Dans chaque pays il existe une liste de maladies animales dont la constatation nécessite une déclaration aux autorités sanitaires du pays. Cette liste nationale s’appuie aujourd’hui également sur une catégorisation des maladies animales au niveau Européen. En pratique, si l’éleveur et/ou le vétérinaire constate des signes cliniques pouvant être compatibles avec une maladie contagieuse catégorisée, le vétérinaire est tenu de poser une suspicion, de prévenir les autorités compétentes, de réaliser les prélèvements nécessaires à la confirmation ou infirmation de la suspicion et de prendre les premières mesures nécessaires pour éviter la diffusion de la maladie. Dans le cas des maladies de catégorie 1 (dont la gestion est confiée à l’État), un arrêté préfectoral de mise sous surveillance (APMS) de l’exploitation est posé et précise les mesures à mettre en œuvre pour limiter la diffusion (interdiction de mouvements d’animaux, barrières sanitaires, transports, circulation des personnes…) et la réalisation d’une enquête épidémiologique. Si la maladie est détectée par les analyses réalisées dans un laboratoire accrédité de première intention puis confirmée par le Laboratoire National de Référence pour la maladie (LNR), un Arrêté Préfectoral portant Déclaration d’Infection (APDI) est posé et précise les mesures de police sanitaire qui s’appliquent pour la maladie en question. La mise en œuvre de ce dispositif peut parfois être plus aléatoire dans certains pays où les services vétérinaires de l’État n’ont pas les moyens nécessaires pour faire appliquer ces règles. Pour les pays adhérant à l’OIE, les autorités sanitaires font également une déclaration officielle ainsi qu’une transmission des données au système ADNS de la commission Européenne (Animal Diseases Notification System) qui constitue une base de données répertoriant les foyers, les données épidémiologiques disponibles y compris les coordonnées GPS pour tous les États membres.
Surveillance et maîtrise des maladies contagieuses dans la faune sauvage
Compte tenu d’une connaissance très partielle de la population surveillée, la surveillance des populations animales sauvages et de leurs maladies repose le plus souvent sur une surveillance évènementielle basée sur les mortalités découvertes et/ou les animaux chassés. En France, le réseau SAGIR organisé et mis en œuvre par l’Office Français pour la Biodiversité (OFB) a pour objet la surveillance des maladies dans la faune sauvage selon ces grands principes. Dans le cadre de la surveillance de la PPA dans le compartiment sauvage, l’OFB et les fédérations de chasse jouent un rôle majeur via ce dispositif en répertoriant toutes les carcasses de sangliers trouvés morts organisant aussi l’analyse d’une fraction des animaux chassés dans les zones d’observation renforcées.
La maîtrise d’une maladie telle que la PPA dans une population sauvage de sangliers nécessite de mettre en œuvre les grands principes suivants :
- dans les phases initiales, il est important d’organiser une surveillance active de recherche des cadavres de sangliers pour bien définir 3 zones : la zone noyau infectée, la zone tampon et les zones d’observation renforcées. Cette phase doit prendre le temps nécessaire pour ne pas se précipiter et risquer d’engager des travaux colossaux de clôtures qui devraient par la suite être considérablement modifiés ;
- la pose de clôture a un effet significatif pour limiter et ralentir la propagation par une action essentielle de fragmentation du paysage (en limitant des couloirs naturels de dispersion des sangliers qui se trouvent contraints dans des zones plus limitées). Le gel d’activité de chasse ou d’activités forestières professionnelles et de loisir, peut être imposé pour diminuer le risque de diffusion de la maladie.
- le ramassage des cadavres et leur extraction du terrain dans des conditions de biosécurité parfaite est un point essentiel pour limiter la contamination des populations sensibles via le réservoir environnemental ;
- les actions de dépopulation doivent être mises en place dans un second temps, tout d’abord dans les zones d’observation pour constituer des anneaux périphériques ayant une densité de sangliers très diminuée. Ces actions de dépopulation active dans la zone infectée ne doivent être mise en place qu’une fois le pic épizootique atteint dans la zone, donc beaucoup plus tardivement dans le processus de contrôle.
Encadré 3. Petit glossaire des termes épidémiologiques (d'après Toma et al., 1991).
Anisotropie : Transposé à l’épidémiologie, vitesse de propagation d’un agent pathogène différente selon les directions géographiques.
Enzootie : maladie sévissant régulièrement chez l’animal dans une région donnée (maladie enzootique). L’équivalent pour une maladie humaine est une endémie.
Épizootie : maladie affectant brutalement un grand nombre d’animaux à la fois dans une région donnée (maladie épizootique). L’équivalent pour une maladie humaine est une épidémie.
Foyer d’une maladie : unité épidémiologique de cas pathologiques, exprimés cliniquement ou non, survenant dans un même lieu (maison, élevage…) (foyer domestique) ou une zone géographique pour la faune sauvage (foyer sauvage), au cours d’une période limitée de temps.
Incidence : Nombre de cas ou de foyers nouveaux d’une maladie, dans une population déterminée, au cours d’une période donnée.
Infectiosité et durée d’infectiosité : L’infectiosité correspond classiquement dans les modèles épidémiologiques à un état de santé pour lequel l’animal où l’homme est capable de transmettre l’agent pathogène. La durée d’infectiosité correspond à la période temporelle pendant laquelle l’individu est capable de transmettre l’agent pathogène.
Létalité : nombre de morts parmi les malades pendant une période donnée.
Morbidité : nombre de malades dans une population pendant une période donnée.
Mortalité : Nombre de morts dans une population pendant une période donnée.
Population sensible : Ensemble de la population animale sensible à l’infection (pas encore infectée et pas immunisée).
Prévalence : Nombre total de cas ou de foyers d’une maladie dans une population déterminée, au cours d’une période donnée ou à un instant donné.
R0 (Nombre de reproduction de base) : dans le cas d’une maladie animale, nombre d’animaux infectés par animal infectieux pendant toute la durée de son infectiosité. Il est le produit du taux de transmission instantané par la durée d’infectiosité moyenne des individus. Le R0 est une constante et est spécifique de la maladie et s’applique dans une population de grande taille et entièrement sensible. Lorsque la maladie évolue dans la population, il est possible d’estimer le Reffectif ou observé qui prend en compte la structure de la population et l’évolution des capacités de transmission de la maladie en fonction de la mise en place de mesure de maîtrise par exemple.
Taux de transmission instantané : nombre d’individus infectés par individu infectieux par unité de temps (souvent par jour). Cette durée d’infectiosité est conditionnée par l’acquisition d’une immunité qui généralement est associée à un arrêt de l’infectiosité ou par la mort de l’individu dans le cadre d’une maladie létale comme la PPA qui de fait ‘retire’ l’individu infectieux de la sous-population des infectieux (mis à part les cadavres de sangliers qui peuvent rester infectieux s’ils sont conservés dans l’environnement).
Unité épidémiologique : individu isolé ou groupe d’individus vivant ensemble, concerné par un phénomène de santé. Ainsi l’unité épidémiologique peut être par exemple l’animal ou un troupeau selon l’objectif recherché.
Vecteur : tout ce qui permet le transport et/ou la transmission d’un agent pathogène. On distingue des vecteurs vrais ou biologiques chez qui l’agent pathogène est susceptible de se multiplier ou d’acquérir une compétence pour pouvoir infecter son hôte définitif et des vecteurs passifs ou mécaniques qui se contentent de transporter l’agent pathogène.
1. Agent étiologique et caractéristiques virologiques
Le virus de la peste porcine africaine
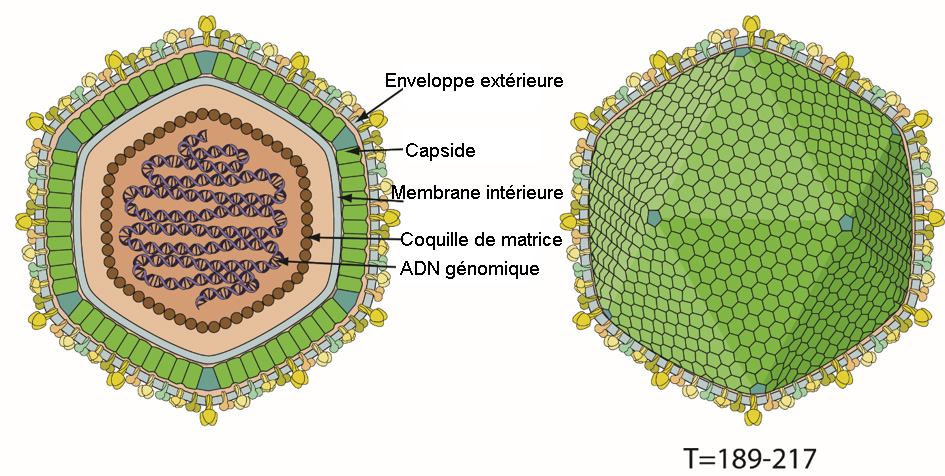
La PPA est due à un grand virus complexe à ADN double-brin, d'un diamètre de 200 nm, seul membre de la famille des Asfarviridae. Les macrophages sont les principales cellules cibles du virus pour sa réplication. La manipulation des fonctions du macrophage par le virus est déterminante dans les mécanismes de pathogénie et d'évasion immunitaire (Karger et al., 2019).
Il se réplique dans le cytoplasme de la cellule et ne ressemble à aucun autre virus décrit (figure 1 ; encadré 1). Les particules virales sont constituées à maturité d'un cœur interne, d'une membrane lipidique interne, d'une capside icosahédrale et d'une deuxième membrane lipidique externe (Alonso et al., 2018). La taille du génome viral varie entre 170 et 193 kbp et code pour 150 à 167 protéines, dont celles requises pour la réplication virale. Plusieurs gènes ne sont pas essentiels pour la réplication virale, dont certains inhibiteurs de la réponse de l'hôte, comme les inhibiteurs de la réponse interféron de type I ou de l'apoptose (Dixon et al., 2019). La taille du génome varie essentiellement en fonction de l'acquisition ou de la perte de gènes d'une famille de gènes multiples appelée en anglais « multigenes family » (MGF) (Dixon et al., 2013), phénomène qui pourrait être dû à des recombinaisons homologues (Zhu et al., 2019).
Le virus est très résistant, notamment lorsqu'il est protégé dans de la matière organique (viande, sang) et est inactivé à 70°C pendant 30 minutes ou 56°C pendant 70 minutes (Adkin et al., 2004 ; EFSA AHAW Panel, 2014).
Figure 1. Structure icosahédrique du virus de la PPA (d’après ViralZone, Swiss Institute of Bioinformatics)
Histoire naturelle de l’infection et signes cliniques chez le porc
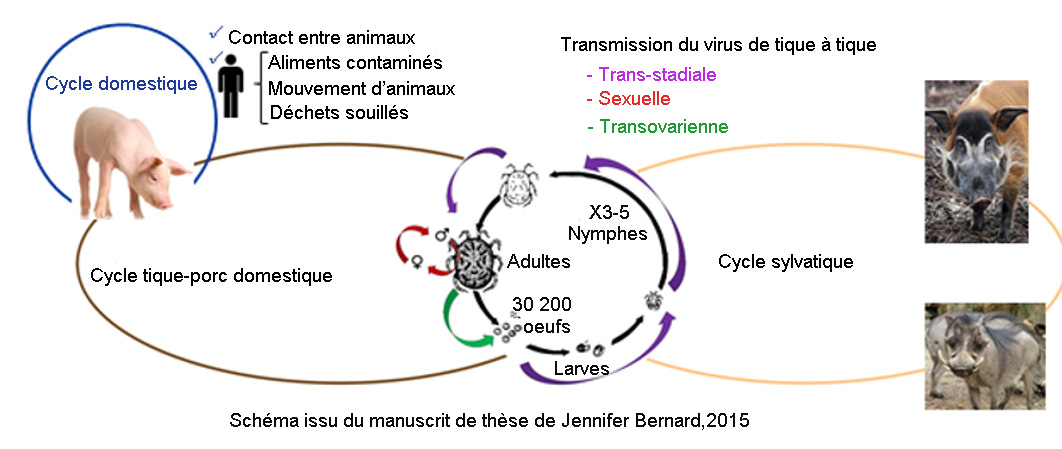
Le virus de la PPA infecte les suidés domestiques et sauvages y compris les phacochères et les potamochères en Afrique et les sangliers en Eurasie. Les tiques molles du genre Ornithodoros peuvent rester infectées sur de très longues périodes et jouent un rôle de réservoir, notamment en Afrique de l'Est où le virus se maintient dans un cycle sylvatique impliquant les phacochères et les tiques de l'espèce O. moubata qui vivent dans leurs terriers (figure 2). Les espèces d'Ornithodoros impliquées peuvent varier selon la zone géographique. Les tiques ne sont cependant pas impliquées dans la progression dans une zone géographique, en raison de leur caractère endophile (vivent essentiellement dans les terriers ou les anfractuosités de murs). L'infection est quasi invisible chez les suidés sauvages en Afrique, à l'exception des jeunes qui présentent une virémie transitoire (Jori et al., 2013). En revanche, les sangliers sont aussi sensibles à l'infection que les porcs domestiques, indépendamment de l'isolat, le déroulé de la maladie étant comparable lors d'infections expérimentales (Blome et al., 2013).
Figure 2. Passage du virus entre hôtes (d’après Bernard, 2015).
Depuis l'émergence d'une maladie hémorragique hautement létale au début du 20ème siècle chez le porc (Sanchez-Vizcaino et al., 2014; Sanchez-Cordon et al., 2018), différentes formes cliniques ont été observées chez le porc domestique et les sangliers, sur le terrain et lors d'infections expérimentales. Il existe une variabilité de virulence selon les isolats, entrainants des formes suraiguës à chroniques.
Des isolats hautement virulents peuvent provoquer des formes qualifiées d’aiguës ou hyper-aiguës qui peuvent induire jusqu’à 100 % de mortalité en moins de 7 jours. La mortalité est plus faible (30-70 %) pour la forme subaiguë de la maladie, due à des isolats modérément virulents. Les premiers signes cliniques des formes aiguës, perte d’appétit et léthargie, sont associés à une forte fièvre (> 41°C). L’apparition des signes cliniques varie selon la dose et la voie d’inoculation mais est généralement observée entre 4 à 5 jours post infection.
Au fur et à mesure de la progression de l’infection, les animaux arrêtent de se nourrir et dépérissent. Des diarrhées hémorragiques, des vomissements, ou des avortements sont observés. Les principales lésions sont associées à des hémorragies pouvant induire un érythème dermique, de l’œdème pulmonaire, une splénomégalie avec une rate déstructurée et élargie, des ganglions lymphatiques congestionnés et hémorragiques, des pétéchies sur les reins, la vessie, les poumons. L’infection est associée à un titre viral très important dans le sang (jusqu’à 109 TCID50/mL
L’infection est associée à une lymphopénie et une thrombopénie, à une destruction des cellules endothéliales vasculaires et à l’induction d’une apoptose massive des lymphocytes non infectés dans le sang comme dans les organes lymphoïdes.
Les isolats de faible virulence peuvent induire une forme chronique de la maladie avec peu de mortalité et l’absence de lésions vasculaires. Les signes cliniques les plus fréquemment décrits incluent un retard de croissance, des œdèmes des articulations et des ulcères dermiques.
Données d’épidémiologie moléculaire
Vingt-quatre génotypes différents sont actuellement décrits en Afrique sur la base du gène de la VP72, une protéine structurale de la capside très conservée (Quembo et al., 2018). Seulement deux génotypes sont décrits en Europe, le génotype I en Sardaigne, suite à l'introduction du virus en 1978, et le génotype II sur le continent eurasien, depuis son introduction en 2007. Les études plus approfondies des séquences moléculaires des souches isolées depuis 2007 au travers du continent européen et plus récemment en Asie, ont confirmé qu'elles dérivaient toutes de la souche Georgia 2007/01, même si certaines présentent des évolutions sur d'autres régions du génome (CVR, IGR et MGF) définissant de nouveaux clusters, associés à une géolocalisation, confirmant ainsi l'introduction unique puis la diffusion du virus à l'échelle du continent eurasien (Gallardo et al., 2018). Actuellement moins d'une quinzaine de souches ont pu être séquencées complètement en raison de l'extrême complexité du génome du virus de la PPA (Dixon et al., 2019).
2. Origine de l’épizootie actuelle en Europe et en Asie
2.1. Introduction dans le Caucase en 2007
En 2007, le virus de la PPA a été introduit en Géorgie, dans le port de Poti suite à la distribution de déchets alimentaires issus d'un navire venant d'Afrique de l'Est, à des porcs de basse-cour. La maladie s'est étendue en Arménie, en Azerbaïdjan et en Fédération de Russie entre 2008 et 2012. Trois phases peuvent être distinguées, depuis la première introduction fin 2007 par un sanglier en République tchétchène (Oganesyan et al., 2013). En premier lieu, une zone d'enzootie s'est créée dans le sud et le nord du Caucase, au cours de la période 2008-2010. Le virus a ainsi continué de se propager dans la population de sangliers vers l'ouest. Compte tenu de son extension importante dans la faune sauvage, la maladie s'est transmise également au réservoir domestique via des contacts entre sangliers sauvages infectés et porcs domestiques. Cela a été facilité par la pratique de l'élevage de porcs en liberté, traditionnelle dans les régions méridionales de la Russie (Gogin et al., 2013). Les premiers foyers chez les porcs domestiques ont été signalés en juin 2008, en République d'Ossétie du Nord. De 2008 à 2010, la maladie est devenue enzootique dans cette zone du Caucase avec un total de 177 foyers signalés dans cette région (Oganesyan et al., 2013). Dans une deuxième phase, entre 2011 et 2013, outre la poursuite de l'apparition de nouveaux foyers dans le Caucase, la maladie a commencé à se propager davantage de la zone d'enzootie vers la partie européenne de la Russie en faisant des « sauts » considérables et formant ainsi de nouvelles zones infectées correspondant très souvent à des secteurs géographiques où se trouvent des camps militaires ou des lieux d'action de l'armée russe. À partir de 2012, une deuxième région enzootique s'est formée dans l'oblast
Entre 2008 et 2012 et au cours de la progression du virus depuis le Caucase vers la partie plus Européenne de la fédération de Russie, 73 % des transmissions du virus au porc domestique étaient liées à un facteur humain (transport d’animaux non contrôlés et distribution d’eaux grasses
2.2. Entrée dans l’Union Européenne en 2014
La pression d'infection considérable en fédération de Russie en 2012 est à l'origine d'une diffusion aux pays voisins en 2013 et 2014 : Ukraine, Biélorussie ; pour finir par entrer dans l'Union Européenne en 2014 avec l'apparition de foyers majoritairement dans la faune sauvage en Lettonie, Lituanie, Pologne et Estonie (EFSA AHAW panel et al., 2018). Contrairement à la situation en Russie où il existe une véritable transmission entre élevages, les foyers domestiques dans les pays Baltes et en Pologne sont plus consécutifs à la pression d'infection très importante dans la faune sauvage et à des mesures de biosécurité mal respectées dans les élevages. La peste porcine africaine s'installe durablement et devient enzootique dans la faune sauvage dans ces pays malgré des tentatives de gestion via des actions de chasse intensive, pour réduire la population au maximum. Diverses estimations de vitesse de propagation dans la faune sauvage ont été produites conduisant à des valeurs moyennes allant de 8 km à 16 km par an (Lettonie, Lituanie, Estonie, ((EFSA AHAW panel et al., 2018)). La PPA atteint plusieurs pays d'Europe de l'Est en 2017 dont la République Tchèque en juin 2017, dans la province de Zlín et dans une zone très localisée sans propagation massive en dehors de cette zone. Seuls des sangliers ont été touchés en République Tchèque et la zone a été clôturée afin d'éviter la dispersion des sangliers infectés. La stratégie de gestion locale a été dans un premier temps de geler toute activité (chasse et activités forestières professionnelles et de loisir) au sein de la zone infectée et de procéder uniquement à un retrait méticuleux des cadavres de sangliers de l'environnement. Puis une fois le pic épizootique dépassé, des actions de chasse mises en œuvre par des tireurs d'élite formés aux mesures de biosécurité ont entrainé une réduction importante de la population de sangliers dans la zone infectée et a permis à la République Tchèque d'éradiquer la maladie du territoire en février 2019.
La Roumanie est également atteinte en 2017 avec des premiers foyers dans le Nord-Ouest dans la faune sauvage et dans des élevages de basse-cour. La situation s’est cependant considérablement dégradée dans ce pays en juin 2018 avec une entrée du virus dans le Sud-Est depuis l’Ukraine, dans la zone protégée du Delta du Danube où la maladie s’est propagée avec une rapidité sans comparaison avec les autres pays touchés jusqu’ici et majoritairement dans le compartiment domestique. En effet, un nombre considérable de petits élevages familiaux sont touchés ainsi que quelques très gros élevages correspondant aux anciens combinats et repris aujourd’hui par des opérateurs privés.
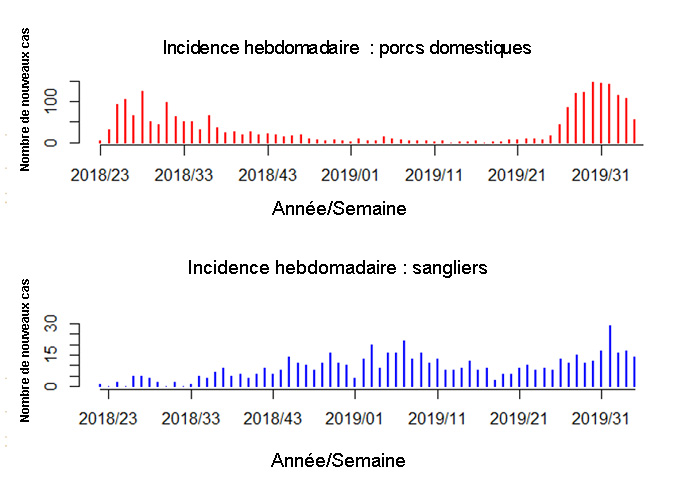
En quelques mois, plus de 1000 foyers domestiques ont été déclarés, chaque foyer élémentaire pouvant correspondre à un petit élevage de quelques porcs. Néanmoins l’élevage porcin en Roumanie est caractérisé par un élevage traditionnel dans les villages, chaque habitant pouvant détenir quelques porcs pour sa consommation personnelle mais aussi dans un but commercial peu encadré. Cependant, compte tenu des relations importantes entre les détenteurs d’un même village, l’unité épidémiologique correspond plus au village qu’à chaque détenteur ce qui tend à surestimer le nombre de foyers déclarés par la Roumanie. Il n’en reste pas moins que l’épizootie dans ce pays et les difficultés de maitrise s’apparentent plus à ce qui a été observé en fédération de Russie que dans les autres pays de l’Est où il s’agit essentiellement d’une problématique de faune sauvage. L’introduction dans ces élevages de basse-cour est liée à l’absence totale de mesures de biosécurité, une forte inféodation au milieu naturel (associés aux cabanes de pêcheurs dans la zone du Delta du Danube), un recensement inexistant de la population porcine se trouvant dans ces élevages (absence d’identification) et des pratiques à risque telles que nourrissage avec des déchets de cuisine, échanges d’animaux non encadrés, réalisation de saillies naturelles par des verrats dits « rouleurs » se déplaçant d’élevage en élevages. Au sein des zones infectées, les élevages commerciaux industriels se trouvant confrontés à une pression d’infection très élevée ont été également infectés malgré un niveau de biosécurité apparent élevé. L’incidence hebdomadaire des foyers domestiques et sauvage dans ce pays depuis l’été 2018 (figure 3) montre un comportement singulièrement saisonnier avec une recrudescence en été et ce principalement dans le compartiment domestique (l’incidence des cas sangliers est pratiquement constante toute l’année). L’origine de cette recrudescence en été est très mal connue. On ignore notamment si elle serait due à un mode de transmission spécifique à la période estivale (alimentation, vecteur ?) ou si cette recrudescence de foyers est liée à des pratiques à risque en termes de mouvements d’animaux qui auraient lieu préférentiellement à cette période.
Figure 3. Incidence hebdomadaire des foyers de Peste Porcine Africaine chez le porc domestique et les sangliers en Roumanie depuis l’été 2018
Outre la république Tchèque et la Roumanie, la Hongrie et la Bulgarie ont également été atteintes mais plus tardivement en 2018 et ce pour la Bulgarie, malgré l’installation d’une clôture le long de la frontière Roumaine. Le premier foyer domestique est identifié en Bulgarie relativement loin de la frontière et sans explication à ce jour sur l’origine de ce foyer. Depuis, des cas chez les sangliers ont également été rapportés. La situation est beaucoup plus évolutive et mal contrôlée en Hongrie avec une augmentation considérable des cas notifiés pour les sangliers en 2018 et 2019 (figure 4). Enfin, en 2019, les derniers pays ayant déclaré des cas dans la faune sauvage sont la Serbie et la Slovaquie. Aujourd’hui, les pays de l’Est où la propagation du virus de la PPA dans la population de sangliers sauvages est la plus active sont la Pologne, la Hongrie, la Roumanie et la Bulgarie. La situation en Pologne est particulièrement alarmante dans la mesure où le front se situant à l’Est du pays continue inexorablement sa progression vers l’Ouest mais aussi en raison de la découverte récente (à partir de novembre 2019) de cadavres de sangliers positifs beaucoup plus à l’Ouest, à moins de 50 km de la frontière allemande (figure 2), en raison d’un « saut » probablement dû à un facteur humain. Au sein des pays Baltes, l’incidence de la maladie a en revanche fortement chuté depuis un an.
2.3. Découverte inattendue de la PPA en Belgique en septembre 2018
Le 8 septembre 2018, un chasseur détecte trois sangliers morts au même endroit dans la zone de Buzenol (province du Luxembourg, sud de la Belgique) (Saegerman, 2018). Deux jours plus tard, dans la même zone, deux agents du Département de la Nature et des Forêts détectent une laie morte et un jeune sanglier (bête rousse) agonisant qu’ils achèvent par un tir sanitaire. Les deux cadavres sont acheminés à la Faculté de médecine de l’Université de Liège le 11 septembre dans le cadre des activités du réseau de surveillance sanitaire de la faune sauvage pour être autopsiés. Des lésions suspectes sont observées. Des prélèvements sont acheminés au laboratoire national de référence Sciensano le 12 septembre qui confirme la suspicion avec deux résultats PCR positifs (encadré 1). Les résultats du séquençage obtenus sur le gène de la protéine VP72 et réalisé par le laboratoire européen de référence de la PPA (« Centro de Investigación en Sanidad Animal de l’Instituto Nacional de Investigación y Technología Agraria y Alimentaria, CISA-INIA ») à Madrid suggèrent que le virus responsable des cas en Belgique appartient au génotype II, variants
En France, 132 km de clôture ont été installés pour constituer des zones blanches le long de la frontière belge au sein desquelles les sangliers sont chassés de manière intensive avec analyse systématique de tous sangliers trouvé mort et d’un échantillon de 20 % des sangliers chassés.
Figure 4. Évolution de la diffusion du virus de la Peste Porcine Africaine en Europe en 2018 et 2019 dans les élevages de porcs (à gauche) et chez le sanglier (à droite).
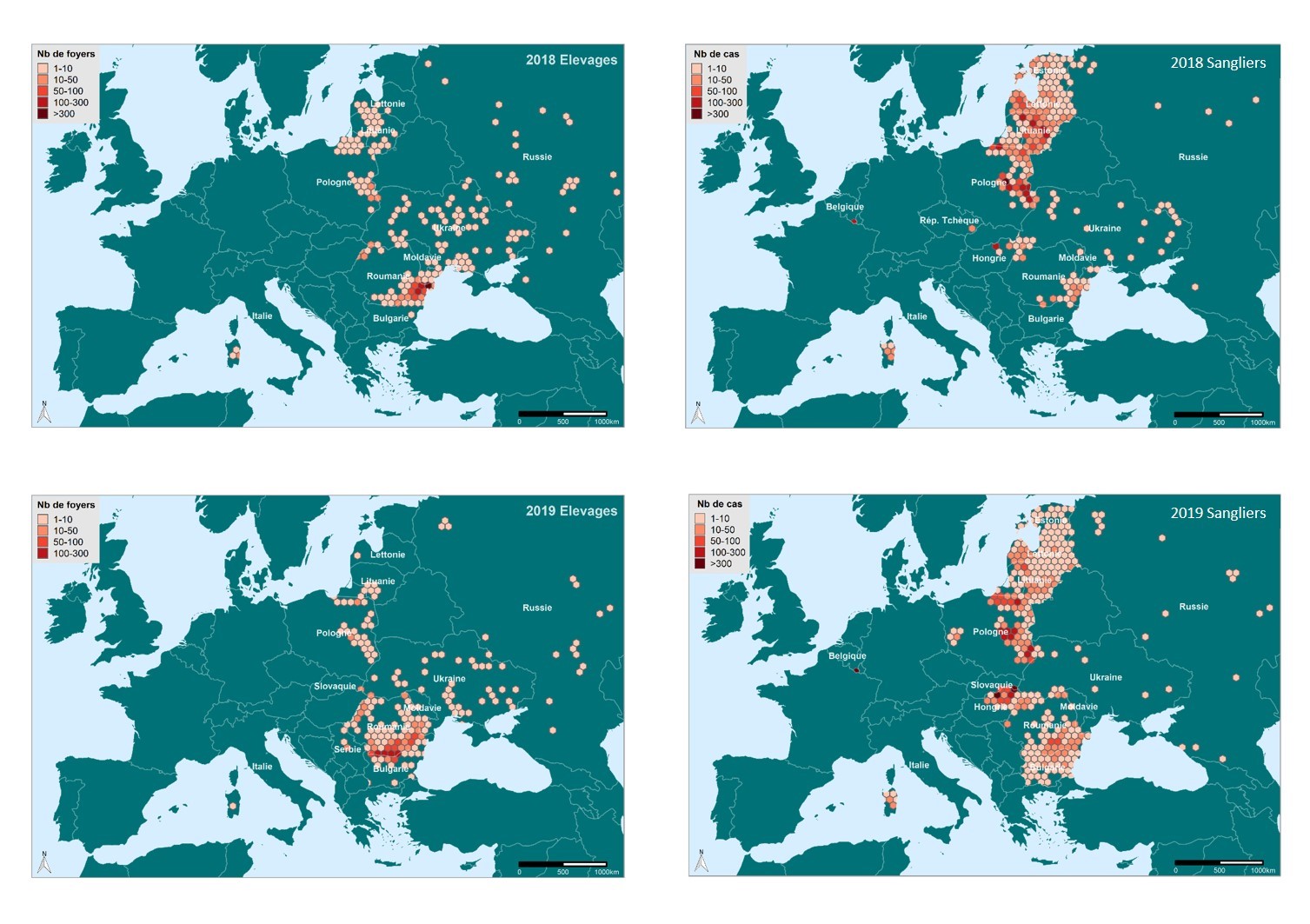
Figure 5. Carte de prélèvement des sangliers en Belgique en date du 08 juin 2020 (https://www.wallonie.be/fr/peste-porcine-africaine)
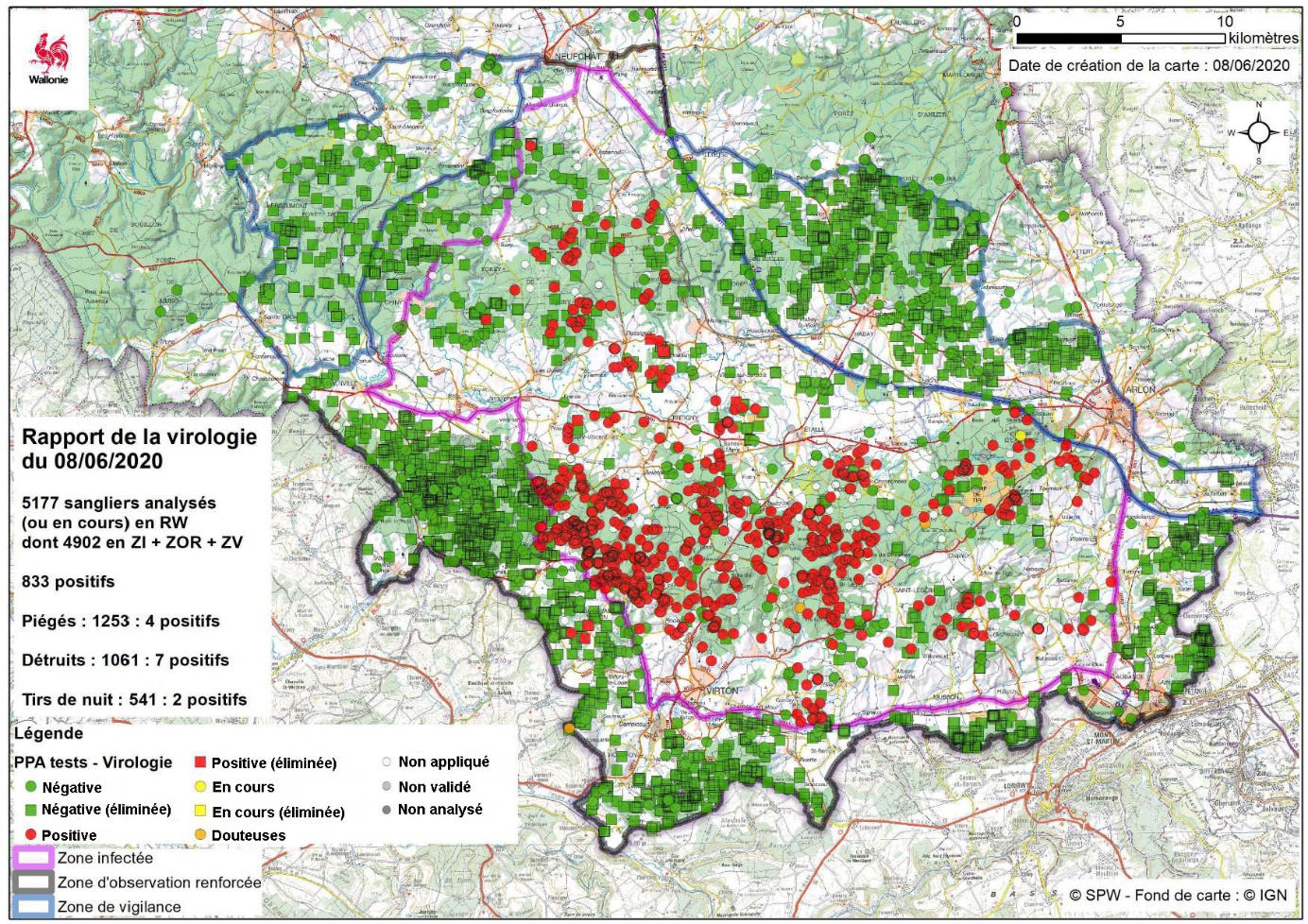
2.4. Situation épidémiologique en Asie
Le 3 août 2018 le premier foyer est déclaré en Chine dans la province du Lianing
La diffusion locale aux différents petits élevages, dans une localité donnée, s’explique, comme dans le cas d’autres pathologies, par un manque de biosécurité, ainsi que, de façon plus spécifique pour la PPA, des pratiques telles que la distribution d’eaux grasses. La diffusion sur de très longues distances est expliquée principalement par des transports non contrôlés de viande contaminée ou de produits à base de viande, des transports d’animaux malades ou en incubation déplacés rapidement pour échapper aux mesures d’abattage ou encore des transports de porcs sains mais dans des véhicules non désinfectés conduisant à des infections contractées au cours du transport.
3. Épidémiologie et conséquences pour la gestion
3.1. Cycles épidémiologiques et modes de transmission
Jusqu'à récemment, l'épidémiologie de la peste porcine africaine était décrite comme comprenant trois cycles épidémiologiques indépendants (sylvatique, porc - tiques et purement domestique), impliquant des tiques molles Ornithodoros spp., des porcs sauvages africains (principalement des phacochères), des porcs domestiques et des produits dérivés du porc tels que de la viande ou des salaisons (Costard et al., 2013). Dans le cycle sylvatique, le virus de la PPA circule entre les réservoirs naturels du virus (c.-à-d. les phacochères et les tiques molles), sans causer de maladie chez les hôtes vertébrés en raison de leur résistance naturelle à l'infection (Plowright et al., 1994). Cette persistance chronique dans la faune sauvage est à l'origine du cycle entre les tiques et le porc domestique conduisant à l'expression clinique de la maladie chez cet hôte très réceptif. Ce cycle a été décrit dans certaines parties de l'Afrique subsaharienne, mais a également joué un rôle important dans la persistance de la maladie lors de l'épizootie dans la péninsule ibérique dans les années 60 et 70 (Boinas et al., 2011). Le cycle domestique est impliqué dans la grande majorité des foyers de peste porcine africaine dans le monde : le virus est alors transmis par les porcs domestiques ou par des produits porcins infectés aux porcs domestiques.
Le profil épidémiologique de l'épizootie actuelle de peste porcine africaine en Europe centrale et orientale associe un cycle épidémiologique supplémentaire incluant le sanglier, son environnement de vie immédiat et leurs cadavres. Ce cycle se caractérise à la fois par une transmission directe entre sangliers et par une transmission indirecte via l'environnement où la contamination persiste via les cadavres, la persistance du virus dans l'environnement étant favorisée par le froid et l'humidité et le climat du pays (Chenais et al., 2019).
Les modalités de transmission incluent :
i) la voie directe (de porc/sanglier infecté à porc/sanglier sensible) ;
ii) la voie indirecte compte-tenu de l’importante résistance du virus (homme, seringues, matériels, véhicules souillés, produits d’origine animale, aliments contenant des produits porcins dont déchets de cuisine et denrées alimentaires) ;
iii) une transmission vectorielle possible mais non obligatoire par les tiques molles de la famille des Argasidés du genre Ornithodoros dont le rôle dans la transmission et le maintien de l'infection au sein de populations de suidés concerne surtout l'Afrique. En Europe, il a été montré que les espèces de tiques molles présentes n'étaient pas compétentes pour la souche virale qui circule (Pereira de Oliveira et al., 2019). De même, la compétence vectorielle des tiques dures pour le virus de la PPA, n'a pas pu être démontrée (de Carvalho Ferreira et al., 2014).
Les animaux infectés excrètent le virus dans la plupart des fluides et excrétas corporels incluant le sang, fluide nasal, fèces et urine (Guinat et al., 2014). La charge virale varie cependant considérablement d'une matrice à l'autre avec une charge virale indéniablement plus élevée dans le sang (Guinat et al., 2014) ce qui implique que la transmission directe est fortement favorisée dès lors que les animaux présentent de micro hémorragies internes ou externes. La transmission par voie aérienne, bien que possible, n'est pas reconnue comme étant une voie majeure mais plutôt anecdotique (Schulz et al., 2017), en raison de charges virales nécessaires relativement élevées pour une infection par voie orale (10 000 à 18 000 TCID50, (McVicar, 1984). Par ailleurs, une étude récente montre que l'infection par voie orale avec une dose aussi faible que 100 TCID50 serait possible (Niederwerder et al., 2019). Cependant, s'agissant d'une étude par modélisation reposant sur une seule étude avec 2 réplications, ce résultat mériterait d'être conforté par d'autres études.
L'existence de vecteurs mécaniques représentés par des arthropodes piqueurs tels que Tabanidés ou Stomox est régulièrement évoqué dans les Pays de l'Est notamment en raison d'une certaine saisonnalité dans ces pays (voir supra), avec des relances en été. Quelques données existent dans la littérature (Mellor et al., 1987; Baldacchino et al., 2013) suggérant la possibilité théorique de transport du virus par ces insectes piqueurs sans cependant apporter la preuve de leur implication réelle dans la propagation du virus.
3.2. Éléments quantitatifs sur la transmission
La PPA est souvent qualifiée de maladie hautement contagieuse et à l'origine de fortes mortalités pouvant aller jusqu'à 100 % (Taylor, 2006). Si la létalité est extrêmement forte notamment pour la souche de génotype II présente aujourd'hui en Europe et en Asie (>95 %), la mortalité à l'échelle d'une population de sangliers ou de porcs domestique reste néanmoins modérée en phase initiale d'infection en raison d'une contagiosité moins élevée que le virus de la Peste Porcine Classique (Chenais et al., 2019). Lorsque les porcs présentent des signes cliniques de peste porcine africaine, ils ont des charges virales élevées dans toutes les sécrétions corporelles, avec des niveaux particulièrement élevés dans le sang (Greig et Plowright, 1970 ; Guinat et al., 2016). Si les porcs ne sont pas euthanasiés avant cette étape, et surtout s'ils se trouvent dans un environnement permettant des contacts étroits et fréquents avec d'autres porcs, en raison d'une exposition au sang et possiblement le cannibalisme, le risque de contamination environnementale devient élevé et facilite la transmission du virus dans la population (Chenais et al., 2017). Dans ces situations spécifiques, la peste porcine africaine présente des caractéristiques d'une maladie très contagieuse. En revanche, dans un contexte où les cas sont détectés précocement et où les mesures de lutte contre la maladie (y compris le dépeuplement) sont mises en œuvre rapidement, la contagiosité sera faible, comme l'attestent les analyses des foyers de porcs domestiques dans l'actuelle épizootie (EFSA AHAW panel et al., 2017).
Plusieurs études ont estimé quantitativement la contagiosité du virus de la PPA à différentes échelles : au niveau individuel (de porc à porc, en considérant le contact direct ou indirect d'une case à l'autre), au niveau plus global de la population d'un élevage ou encore plus macroscopiquement au niveau inter-élevage en exploitant des données d'incidence de foyers (tableau 1). Les estimations expérimentales individuelles montrent des valeurs de R0 comparables à celles connues pour des pathogènes porcins ayant une capacité de propagation modérée et conduisant à une situation enzootique une fois introduits dans l'élevage (i.e. de l'ordre de 5 comme pour le PCV2 [Circovirus porcin de type 2], le SDRP [Syndrome Dysgénésique et Respiratoire Porcin]…). La différence dans le cas du virus de la PPA est que le virus de génotype II circulant en Eurasie est très létal et que les valeurs de R0 estimées sont conditionnées par une durée d'infectiosité qui peut être très réduite en cas de mortalité précoce. Les estimations réalisées montrent également une diminution du potentiel de transmission lorsque les animaux ont des contacts limités (d'une case à une autre) (Guinat et al., 2016). En situation d'élevage, les estimations réalisées à partir de l'incidence des mortalités observées (Guinat et al., 2018) ou de la morbidité attribuable à la PPA (Gulenkin et al., 2011) montrent de manière intéressante des valeurs de R0 plus élevées que ce qui a été estimé en conditions expérimentales. Ces estimations ont été réalisées à partir de données issues d'élevages affectés en Fédération de Russie et des résultats très variables sont obtenus selon les élevages, ce qui suggère probablement des conditions de biosécurité interne très différentes d'un élevage à l'autre expliquant une propagation plus ou moins rapide.
D'autres estimations expérimentales existent mais sur des souches différentes, n'appartenant pas au génotype II (souche Malta'78 et Netherlands'86 ; de Carvalho Ferreira et al., 2013). Elles ont conduit à des valeurs de R0 très variables selon les hypothèses faites en termes de durée d'infectiosité notamment (jusqu'à 40 jours) mais les taux de transmission restent du même ordre de grandeur.
, (12/06/2020)
Type de contact |
Origine des |
Taux de |
Durée |
R03 médian |
Références |
|
|---|---|---|---|---|---|---|
Transmission |
Direct |
Expérimentation |
0,6 [0,3-1,3] |
6 [3-14] |
5,3 [1,2-14,2] |
Guinat et al., |
Indirect |
Expérimentation |
0,3 [0,1-0,7] |
6 [3-14] |
2,5 [0,4-7,0] |
Guinat et al., |
|
Direct |
Expérimentation |
1,05 [0,56-1,72] |
4,5, sd = 2,6 5 |
Non estimé |
Nielsen et al., |
|
Indirect |
Expérimentation |
0,46 [0,08-1,06] |
4,5, sd = 2,6 5 |
Non estimé |
Nielsen et al., |
|
Direct + indirect |
Élevage |
Non estimé |
Non estimé |
9,8 [3,9-15,6] |
Gulenkin et al., |
|
Direct + indirect |
Élevage |
1,6 [0,7-2,2] |
7,4 [4,5 - 8,3] |
12,2 [4,4-17,3] |
Guinat et al., |
|
Transmission |
Non applicable |
Élevage |
Non estimé |
Non estimé |
2,5 [2-3] |
Gulenkin et al., |
Non applicable |
Élevage |
Non estimé |
Non estimé |
1,77 [1,58-3,24] |
Barongo et al., |
1 Données pour des virus du génotype II ; sauf pour l'étude de Barongo et al., 2015 (données d'Uganda, de la région de Guru ; génotype IX).
2Taux de transmission : nombre de nouvelles infections générées par individu infectieux par jour.
3Nombre de reproduction de base : nombre d’individus infectés par individu infectieux pendant la durée de son infectiosité et dans une population entièrement sensible.
4 Étude de modélisation avec des paramètres fixes.
5La durée d’infectiosité n’est pas fixe dans cette estimation mais correspond à une distribution (Étude de modélisation probabiliste).
6Les données utilisées correspondent à l'étude de (Guinat et al., 2016).
En raison de cette contagiosité modérée pour la souche Georgia de génotype II, qui peut être encore plus faible en cas d'une exposition à faible dose, la mortalité initiale dans une unité épidémiologique est plutôt faible, indépendamment du taux élevé de létalité. En Lettonie, Lamberga et al. (2018) ont signalé que, dans une grande exploitation commerciale comptant 5 000 porcs atteints de peste porcine africaine, la propagation du virus dans l'exploitation était lente. Dans les premières semaines suivant l'infection, la mortalité liée à la peste porcine africaine n'a pas dépassé la mortalité habituelle et il a fallu plus d'un mois avant de soupçonner la présence de la maladie.
À partir d'un modèle de simulation utilisant leurs estimations de paramètres de transmission, Nielsen et al. (2017) ont également déterminé qu'avec une surveillance évènementielle basée sur les mortalités cumulées, un seuil équivalent à 2,5 % soit 9 porcs morts sur un effectif de 360, conduirait à une détection de la maladie 13 à 19 jours post-introduction dans l'élevage.
4. Perspectives d’une vaccination contre le virus de la Peste porcine africaine
Le virus de la PPA en ciblant des cellules impliquées dans la réponse immunitaire, les macrophages, manipule le système immunitaire à son profit. La connaissance des mécanismes de la réponse immunitaire des porcs et sangliers à l’infection par le virus de la PPA est encore très partielle, malgré d’importants efforts de recherche depuis plus de vingt ans. L’animal va développer une réponse sérologique rapide et intense mais les anticorps produits n’ont pas de réelles propriétés neutralisantes. La réponse immunitaire cellulaire joue un rôle prépondérant dans la protection mais ne semble pas suffisante pour induire une protection croisée. Un porc infecté qui survit est protégé contre une nouvelle infection par la même souche mais pas vis-à-vis d’une souche différente.
Différentes stratégies de développement de vaccins, de type classique (virus inactivé) à des vaccins nouvelles générations (sous-unitaires : protéine recombinante, vectorisé, ADN) ont été tentées avec des succès divers.
L'administration de virus inactivé en absence ou en présence d'adjuvants modernes n'a induit aucune protection, alors que les candidats vaccins avaient induit une séroconversion (Blome et al., 2014).
Les approches de type vaccins sous-unitaire, basé sur des protéines recombinantes ou des ADN plasmidiques n'ont pas ou peu induit de protection. Une protection partielle avec un retard de l'expression clinique a pu être obtenue par inoculation d'ADN plasmidiques, en l'absence de séroconversion (Argilaguet et al., 2012). Une protection plus complète avec une nette réduction des signes cliniques a été obtenue par administration à un groupe de porcs d'une librairie d'ADN suivie d'une épreuve avec une souche virulente. Environ 50 % des porcs immunisés étaient protégés mais pas l'ensemble des animaux, montrant ainsi l'importance de la réponse individuelle à la vaccination et soulignant la complexité de cette réponse (Lacasta et al., 2014). Les approches vectorielles développées n'ont pas non plus permis de protéger les porcs, et ce quel que soit le vecteur utilisé (Jankovich et al., 2018 ; Netherton et al., 2019).
À l'heure actuelle, ce sont encore les souches vivantes atténuées qui induisent une meilleure protection, notamment les souches naturellement atténuées du génotype I qui ont pu induire une protection homologue ou croisée vis-à-vis de certains autres génotypes (King et al., 2011). Cependant ce type de souche atténuée induit quelques inflammations et œdèmes au niveau articulaire qui ont un impact négatif sur la croissance des porcs. Des essais d'atténuation plus importante par délétion génétique de ces souches naturellement atténuées ont pu conduire selon les cas à une diminution du pouvoir protecteur (Abrams et al., 2013), comme à une meilleure protection (Reis et al., 2017). Les approches les plus récentes consistent à déléter plusieurs gènes de la région des MGF, gènes qui inhibent la réponse Interféron de type I, pouvant ainsi atténuer la souche modifiée chez le porc et le protéger contre une épreuve par le virus parental (O'Donnell et al., 2015).
Ces quelques exemples illustrent la difficulté de développer un vaccin contre la PPA selon les méthodes éprouvées pour d'autres maladies. Le déficit de connaissance du génome du virus est en train de se combler, grâce aux nouvelles méthodes de séquençage profond. Pour autant, les fonctions des plus de 150 protéines virales sont loin d'être identifiées, et tous les gènes de virulence ne sont pas encore connus. Ce virus interfère avec les réponses innées. La compréhension des mécanismes de la réponse immunitaire permettant d'obtenir une protection vaccinale, bien que faisant l'objet de nombreuses recherches, ne sont pas encore identifiés. De plus les virus vivants atténués actuellement testés comme candidat vaccin se cultivent sur cellules primaires, ce qui est incompatible avec une production industrielle. Là aussi un effort de recherche est nécessaire pour adapter ces virus atténués sur des lignées cellulaires propres à la production de vaccin (Arias et al., 2017). Plusieurs années seront probablement encore nécessaire avant d'obtenir un vaccin commercialisable.
Conclusion
L’épizootie de peste porcine africaine sévissant actuellement depuis l’Europe de l’Ouest jusqu’à l’Asie du Sud-Est est la résultante d’une introduction unique d’une souche virulente de PPA originaire d’Afrique de l’Est où la maladie est enzootique chez les porcs depuis le début du 20ème siècle. Le virus s’est établi sur le continent Eurasien selon deux cycles épidémiologiques qui interagissent : i) le cycle purement domestique correspondant à l’infection de porcs d’élevage par d’autres porcs d’élevage ou par des produits contenant de la viande de porc infectée et ii) le cycle propre aux populations de sangliers sauvages Eurasiennes impliquant les populations de sangliers sauvages et leur environnement contaminé par les cadavres de sangliers infectés par le virus de la PPA. Les deux cycles coexistent souvent dans les différents pays affectés bien que l’on puisse distinguer une dominance forte, voire parfois exclusive du cycle ‘sangliers’ en Belgique, pays Baltes, Hongrie, République Tchèque. À l’inverse, une forte prédominance du cycle domestique est observée en Roumanie, Ukraine, fédération de Russie ainsi qu’en Asie (Chine, Cambodge, Vietnam) impliquant généralement de petits élevages ayant un niveau de biosécurité faible ou absent, mais entrainant également la contamination de gros élevages industriels à l’occasion de failles de biosécurité. Depuis 2007 la maladie a connu une progression transfrontalière exceptionnelle qui s’explique principalement par l’activité humaine (transport d’animaux non contrôlés ou transport de produits alimentaires contaminés). Le virus ayant une contagiosité intrinsèque modérée, il s’installe assez rapidement de manière enzootique dans les populations de sangliers en raison des mouvements d’animaux, du renouvellement des populations et surtout de la forte persistance du virus dans l’environnement (cadavres) favorisée par les températures froides en hiver. La gestion dans le réservoir domestique est théoriquement plus simple dans les pays où la production porcine est organisée, où les mesures de biosécurité sont en place et où les mouvements d’animaux sont tracés. Elle devient cependant très complexe pour les pays où la structure des élevages est représentée par une grande majorité de petites basse-cours dans lesquelles les animaux ne sont pas identifiés et où les mesures de gestion mal expliquées ou mal indemnisées conduisent à des comportements favorisant la diffusion par des transports erratiques d’animaux en incubation ou de carcasses de porcs infectés. Même si de nombreuses équipes de recherche se sont investies dans la mise au point de solutions vaccinales, l’obtention d’un vaccin efficace et sécurisé ne semble pas atteignable sur du court terme. Les principales limites sont aujourd’hui liées à la difficulté de produire un virus vivant suffisamment atténué pour ne pas diffuser ou rendre malades les animaux tout en conservant un potentiel protecteur vis-à-vis du virus sauvage. Le vaccin doit pouvoir aussi induire une réponse sérologique distinguable d’une infection par le virus sauvage et être suffisamment stable pour être délivré dans l’environnement à destination des sangliers sauvages. Toutes ces conditions préliminaires ne sont pas remplies à ce jour.
La pression d’infection représentée aujourd’hui par de multiples foyers sauvages ou domestiques non maîtrisés à travers le monde suggère un risque considérable d’introduction de la maladie à tout instant sur le territoire français et dans une zone qu’il est difficile de prévoir compte-tenu du caractère aléatoire de l’introduction, à l’instar de ce qui s’est passé en Belgique en septembre 2018. La vigilance de tous les acteurs et la mise en place de dispositifs de surveillance efficients et adaptés au niveau de risque des territoires se révèlent de plus en plus importantes à mesure que l’épizootie progresse en Europe et en Asie.
Remerciements
Les auteurs remercient Sylvain Falala, UMR ASTRE (Univ. Montpellier, Cirad, INRA, Montpellier), de l'équipe de Veille Sanitaire Internationale et la plateforme ESA pour la réalisation des cartes.
Notes
- Article issu de la synthèse présentée aux 52ème Journées de la Recherche Porcine : Rose N., Le Potier M.F., 2020. L’épizootie de Peste porcine Africaine : caractéristiques virologiques et épidémiologiques, 52ème Journées de la Recherche Porcine, 4-5 février 2020, Paris.
- Réseau de surveillance épidémiologique des oiseaux et des mammifères sauvages terrestres en France, http://www.oncfs.gouv.fr/Reseau-SAGIR-ru105
- Arrêté du 19 octobre 2018 relatif aux mesures de prévention et de surveillance à mettre en place en matière de chasse et d’activité forestière et dans les exploitations de suidés dans le périmètre d’intervention suite à la découverte de cas de peste porcine africaine sur des sangliers sauvages en Belgique
- Mesure du titre viral infectieux : dilution pour laquelle la quantité de virus présent produit un effet cytopathique sur 50 % des cellules inoculées en culture cellulaire.
- Unité administrative en fédération de Russie
- Définies dans l’Union Européenne comme des déchets alimentaires après traitement par la chaleur ; Utilisation actuellement interdite dans l’UE, mais pratiquée néanmoins dans certains pays d’Europe de l’Est
- Souche pour laquelle on détecte une variation dans la séquence du gène considéré
- Animal Diseases Notification Systemhttp://www.fao.org/ag/againfo/programmes/en/empres/ASF/situation_update.html
- Agence Reuters, https://www.reuters.com/article/us-china-economy-output-pork/chinas-first-half-pork-output-falls-amid-disease-outbreak-idUSKCN1UA046 (15/07/20)
Références
- Abrams C.C., Goatley L., Fishbourne E., Chapman D., Cooke L., Oura C.A., Netherton C.L., Takamatsu H.H., Dixon L.K., 2013. Deletion of virulence associated genes from attenuated African swine fever virus isolate OUR T88/3 decreases its ability to protect against challenge with virulent virus. Virology, 443, 99-105.
- Adkin A., Coburn H., England T., Hall S., Hartnett E., Marooney C., Wooldridge M., Watson E., Cooper J., Cox T., 2004. Risk assessment for the illegal import of contaminated meat and meat products into Great Britain and the subsequent exposure of GB livestock (IIRA): foot and mouth disease (FMD), classical swine fever (CSF), African swine fever (ASF), swine vesicular disease (SVD). Veterinary Laboratories Agency, New Haw.
- Alonso C., Borca M., Dixon L., Revilla Y., Rodriguez F., Escribano J.M., ICTV Report Consortium, 2018. ICTV Virus Taxonomy Profile: Asfarviridae. J. Gen. Virol., 99, 613-614.
- Argilaguet J.M., Perez-Martin E., Nofrarias M., Gallardo C., Accensi F., Lacasta A., Mora M., Ballester M., Galindo-Cardiel I., Lopez-Soria S., Escribano J.M., Reche P.A., Rodriguez F., 2012. DNA vaccination partially protects against African swine fever virus lethal challenge in the absence of antibodies. PLoS One, 7, e40942.
- Arias M., de la Torre A., Dixon L., Gallardo C., Jori F., Laddomada A., Martins C., Parkhouse R.M., Revilla Y., Rodriguez F.A.J., Sanchez V., 2017. Approaches and perspectives for development of african swine fever virus vaccines. Vaccines (Basel), 5, 35.
- Baldacchino F., Muenworn V., Desquesnes M., Desoli F., Charoenviriyaphap T., Duvallet G., 2013. Transmission of pathogens by Stomoxys flies (Diptera, Muscidae): a review. Parasite, Paris, France, 20, 26.
- Barongo M.B., Ståhl K., Bett B., Bishop R.P., Fèvre E.M., Aliro T., Okoth E., Masembe C., Knobel D., Ssematimba A., 2015. Estimating the Basic Reproductive Number (R0) for African Swine Fever Virus (ASFV) Transmission between Pig Herds in Uganda. PloS one, 10, e0125842.
- Bernard J., 2015. Caractérisation de la compétence vectorielle des tiques Ornithodores pour le virus de la peste porcine africaine et étude de deux déterminants : la relation souche virale - vecteur et l'influence de la salive de tiques sur l'infection chez le porc domestique. Montpellier : Université de Montpellier, 267p. Thèse de doctorat : Microbiologie parasitologie : Université de Montpellier, France.
- Blome S., Gabriel C., Beer M., 2013. Pathogenesis of African swine fever in domestic pigs and European wild boar. Virus Res., 173, 122-130.
- Blome S., Gabriel C., Beer M., 2014. Modern adjuvants do not enhance the efficacy of an inactivated African swine fever virus vaccine preparation. Vaccine, 32, 3879-3882.
- Boinas F.S., Wilson A.J., Hutchings G.H., Martins C., Dixon L.J., 2011. The persistence of African swine fever virus in field-infected Ornithodoros erraticus during the ASF endemic period in Portugal. PloS one, 6, e20383.
- Chenais E., Sternberg-Lewerin S., Boqvist S., Liu L., LeBlanc N., Aliro T., Masembe C., Stahl K., 2017. African swine fever outbreak on a medium-sized farm in Uganda: biosecurity breaches and within-farm virus contamination. Trop. Anim. Health Prod., 49, 337-346.
- Chenais E., Depner K., Guberti V., Dietze K., Viltrop A., Ståhl K., 2019. Epidemiological considerations on African swine fever in Europe 2014-2018. Porcine Health Management, 5, 6.
- Costard S., Mur L., Lubroth J., Sanchez-Vizcaino J.M., Pfeiffer D.U., 2013. Epidemiology of African swine fever virus. Virus Res., 173, 191-197.
- de Carvalho Ferreira H.C., Backer J.A., Weesendorp E., Klinkenberg D., Stegeman J.A., Loeffen W.L.A., 2013. Transmission rate of African swine fever virus under experimental conditions. Vet. Microbiol., 165, 296-304.
- de Carvalho Ferreira H.C., Tudela Zúquete S., Wijnveld M., Weesendorp E., Jongejan F., Stegeman A., Loeffen W.L., 2014. No evidence of african swine fever virus replication in hard ticks. Ticks and Tick-borne Dis., 5, 582-589.
- Desvaux S., Le Potier M.-F., Bourry O., Hutet E., Rose N., Anjoubault G., Havet P., Clément T., Marcé C., 2014. Peste Porcine Africaine : Etude sérologique dans les abbatoirs en Corse durant l'hiver 2014. Bulletin épidémiologique, santé animale et alimentation, 63, 19.
- Dixon L.K., Chapman D.A., Netherton C.L., Upton C., 2013. African swine fever virus replication and genomics. Virus Res., 173, 3-14.
- Dixon L.K., Islam M., Nash R., Reis A.L., 2019. African swine fever virus evasion of host defences. Virus Res., 266, 25-33.
- EFSA AHAW Panel, 2014. Scientific Opinion on African swine fever. EFSA Journal, 12, 3628, 77p.
- EFSA AHAW panel, Cortiñas Abrahantes J., Gogin A., Richardson J., Gervelmeyer A., 2017. Epidemiological analyses on African swine fever in the Baltic countries and Poland. EFSA Journal, 15, e04732.
- EFSA AHAW panel, Boklund A., Cay B., Depner K., Földi Z., Guberti V., Masiulis M., Miteva A., More S., Olsevskis E., Šatrán P., Spiridon M., Stahl K., Thulke H.-H., Viltrop A., Wozniakowski G., Broglia A., Cortinas Abrahantes J., Dhollander S., Gogin A., Verdonck F., Amato L., Papanikolaou A., Gortázar C., 2018. Epidemiological analyses of African swine fever in the European Union (November 2017 until November 2018). EFSA Journal, 16, e05494.
- Gallardo C., Nurmoja I., Soler A., Delicado V., Simón A., Martin E., Perez C., Nieto R., Arias M., 2018. Evolution in Europe of African swine fever genotype II viruses from highly to moderately virulent. Vet. Microbiol. 219, 70-79.
- Gogin A., Gerasimov V., Malogolovkin A., Kolbasov D., 2013. African swine fever in the North Caucasus region and the Russian Federation in years 2007-2012. Virus Res., 173, 198-203.
- Greig A., Plowright W., 1970. The excretion of two virulent strains of African swine fever virus by domestic pigs. J. Hyg., 68, 673-682.
- Guinat C., Reis A.L., Netherton C.L., Goatley L., Pfeiffer D.U., Dixon L., 2014. Dynamics of African swine fever virus shedding and excretion in domestic pigs infected by intramuscular inoculation and contact transmission. Vet. Res., 45, 93.
- Guinat C., Gubbins S., Vergne T., Gonzales J.L., Dixon L., Pfeiffer D.U., 2016. Experimental pig-to-pig transmission dynamics for African swine fever virus, Georgia 2007/1 strain. Epidemiol. Infect., 144, 25-34.
- Guinat C., Porphyre T., Gogin A., Dixon L., Pfeiffer D.U., Gubbins S., 2018. Inferring within-herd transmission parameters for African swine fever virus using mortality data from outbreaks in the Russian Federation. Trans. Emerg. Dis., 65, e264-e271.
- Gulenkin V.M., Korennoy F.I., Karaulov A.K., Dudnikov S.A., 2011. Cartographical analysis of African swine fever outbreaks in the territory of the Russian Federation and computer modeling of the basic reproduction ratio. Prev. Vet. Med., 102, 167-174.
- Jankovich J.K., Chapman D., Hansen D.T., Robida M.D., Loskutov A., Craciunescu F., Borovkov A., Kibler K., Goatley L., King K., Netherton C.L., Taylor G., Jacobs B., Sykes K., Dixon L.K., 2018. Immunisation of pigs by DNA prime and recombinant vaccinia virus boost to identify and rank African swine fever virus immunogenic and protective proteins. J. Virol., 92, e02219-02217.
- Jori F., Vial L., Penrith M.L., Perez-Sanchez R., Etter E., Albina E., Michaud V., Roger F., 2013. Review of the sylvatic cycle of African swine fever in sub-Saharan Africa and the Indian ocean. Virus Res., 212-227.
- Karger A., Pérez-Núñez D., Urquiza J., Hinojar P., Alonso C., Freitas F.B., Revilla Y., Le Potier M.F., Montoya M., 2019. An update on African swine fever virology. Viruses, 11, 864. doi:10.3390/v11090864
- King K., Chapman D., Argilaguet J.M., Fishbourne E., Hutet E., Cariolet R., Hutchings G., Oura C.A.L., Netherton C.L., Moffat K., Taylor G., Le Potier M.-F., Dixon L.K., Takamatsu H.-H., 2011. Protection of European domestic pigs from virulent African isolates of African swine fever virus by experimental immunisation. Vaccine, 29, 4593-4600.
- Lacasta A., Ballester M., Monteagudo P.L., Rodriguez J.M., Salas M.L., Accensi F., Pina-Pedrero S., Bensaid A., Argilaguet J., Lopez-Soria S., Hutet E., Le Potier M.F., Rodriguez F., 2014. Expression library immunization can confer protection against African swine fever virus lethal challenge. J. Virol., 88, 13322-13332.
- Laddomada A., Rolesu S, Loi F, Cappai S., Oggiano A., Madrau M.P., Sanna M.L., Pilo G., Bandino E., Brundu D., Cherchi S., Masala S., Marongiu D., Bitti G., Desini P., Floris V., Mundula L., Carboni G., Pittau M., Feliziani F., Manuel Sanchez-Vizcaino J., Jurado C., Guberti V., Chessa M., Muzzeddu M., Sardo D., Borrello S., Mulas D., Salis G., Zinzula P., Piredda S., De Martini A., Sgarangella F., 2019. Surveillance and control of African Swine Fever in free-ranging pigs in Sardinia. Transbound Emerg. Dis., 66, 1114-1119. doi:10.1111/tbed.13138
- Lamberga K., Seržants M., Oļševskis E., 2018. African swine fever outbreak investigations in a large commercial pig farm in Latvia: a case report. Berliner und Münchener Tierärztliche Wochenschrift, doi:10.2376/0005-9366-18031https://www.bior.lv/sites/default/files/publikacijas/M_47_ASF%20outbreak%20investigation_Lamberga%20et%20al_2018.pdf
- Linden A., 2019. Peste porcine africaine chez le sanglier (Sus scrofa) en Belgique : historique depuis septembre 2018. Proc. Conference "Symposium santé animale Sciensano", Bruxelles.
- McVicar J.W., 1984. Quantitative aspects of the transmission of African swine fever. A. J. Vet. Res., 45, 1535-1541.
- Mellor P.S., Kitching R.P., Wilkinson P.J., 1987. Mechanical transmission of capripox virus and African swine fever virus by Stomoxys calcitrans. Res. Vet. Sci., 43, 109-112.
- Montgomery R.E., 1921. On A Form of Swine Fever Occurring in British East Africa (Kenya Colony). J. Comp. Path. Therap, 34, 159-191.
- Netherton C.L., Goatley L.C., Reis A.L., Portugal R., Nash R.H., Morgan S.B., Gault L., Nieto R., Norlin V., Gallardo C., Ho C.S., Sánchez-Cordón P.J., Taylor G., Dixon L.K., 2019. Identification and Immunogenicity of African Swine Fever Virus Antigens. Front. Immunol., 10.
- Niederwerder M.C., Stoian A.M.M., Rowland R.R.R., Dritz S.S., Petrovan V., Constance L.A., Gebhardt J.T., Olcha M., Jones C.K., Woodworth J.C., Fang Y., Liang J., Hefley T.J., 2019. Infectious dose of African swine fever virus when consumed naturally in liquid or feed. Emerg. Infect. Diseases. J., 25, 891.
- Nielsen J.P., Larsen T.S., Halasa T., Christiansen L.E., 2017. Estimation of the transmission dynamics of African swine fever virus within a swine house. Epidemiol. Infect., 145, 2787-2796.
- O'Donnell V., Holinka L.G., Krug P.W., Gladue D.P., Carlson J., Sanford B., Alfano M., Kramer E., Lu Z., Arzt J., Reese B., Carrillo C., Risatti G.R., Borca M.V., 2015. African swine fever virus georgia 2007 with a deletion of virulence-associated gene 9GL (B119L), when administered at low doses, leads to virus attenuation in swine and induces an effective protection against homologous challenge. J. Virol., 89, 8556-8566.
- Oganesyan A.S., Petrova O.N., Korennoy F.I., Bardina N.S., Gogin A.E., Dudnikov S.A., 2013. African swine fever in the Russian Federation: Spatio-temporal analysis and epidemiological overview. Virus Res., 173, 204-211.
- Pereira de Oliveira R., Hutet E., Paboeuf F., Duhayon M., Boinas F., Perez de Leon A., Filatov, S., Vial L., Le Potier M.F., 2019. "Comparative vector competence of the Afrotropical soft tick Ornithodoros moubata and Palearctic species, O. erraticus and O. verrucosus, for African swine fever virus strains circulating in Eurasia." PLoS One. doi:10.1371/journal.pone.0225657
- Plowright W., Thomson G.R, Ja N., 1994. African swine fever. In: Coetzer JAW, Thomson G.R.,Tustin R.C. (Eds). Infectious diseases in livestock with special reference to Southern Africa, 567-592. Oxford University press, Cape Town.
- Quembo C.J., Jori F., Vosloo W., Heath L., 2018. Genetic characterization of African swine fever virus isolates from soft ticks at the wildlife/domestic interface in Mozambique and identification of a novel genotype. Transb. Emerg. Dis., 65, 420-431.
- Reis A.L., Goatley L.C., Jabbar T., Sanchez-Cordon P.J., Netherton C.L., Chapman D.A.G., Dixon L.K., 2017. Deletion of the African Swine Fever Virus Gene DP148R Does Not Reduce Virus Replication in Culture but Reduces Virus Virulence in Pigs and Induces High Levels of Protection against Challenge. J. Virol., 91, e01428-17.
- Rose N., Le Potier M.F., 2020. L’épizootie de Peste porcine Africaine : caractéristiques virologiques et épidémiologiques, 52ème Journ. Rech. Porcine, 4-5 février 2020, Paris, France.
- Saegerman C., 2018. Découverte inattendue de la peste porcine africaine en Belgique. Épidémiologie et Santé Animale, 73, 147-164.
- Sanchez-Cordon P.J., Montoya M., Reis A.L., Dixon L.K., 2018. African swine fever: A re-emerging viral disease threatening the global pig industry. Vet. J., 233, 41-48.
- Sanchez-Vizcaino J.M., Mur L., Gomez-Villamandos J.C., Carrasco L., 2014. An update on the epidemiology and pathology of African swine fever. J. Comp. Pathol., 152, 9-21. doi:10.1016/j.jcpa.2014.09.003
- Schulz K., Staubach C., Blome S., 2017. African and classical swine fever: similarities, differences and epidemiological consequences. Vet. Res., 48, 84.
- Taylor D., 2006. African swine fever. In: D.J. Taylor (Eds), Pig diseases, Glasgow.
- Toma B., Bénet J.J., Dufour B., Eloit M., Moutou F., Saana M., 1991. Glossaire d’épidémiologie animale. Editions du point vétérinaire, 364p.
- Zhu Z., Xiao C.T., Fan Y., Cai Z., Lu C., Zhang G., Jiang T., Tan Y., Peng Y., 2019. Homologous recombination shapes the genetic diversity of African swine fever viruses. Vet. Microbiol., 236, 108380. doi:10.1016/j.vetmic.2019.08.003
Résumé
La Peste Porcine Africaine (PPA) est une maladie infectieuse émergente des suidés domestiques et sauvages. Cette maladie contagieuse entre suidés, non transmissible à l’Homme, est à l’origine d’un syndrome hémorragique souvent fatal chez les porcs domestiques et les sangliers. L'épizootie qui sévit actuellement en Europe et en Asie a débuté en Géorgie en 2007. La souche virale impliquée, très virulente, appartenant au génotype II, est très résistante dans les viandes et l’environnement. Toutes les souches isolées en Europe comme en Asie dérivent d’une même introduction, même si le virus a évolué vers des formes moins virulentes dans certaines populations de sangliers très localisées. Depuis la Géorgie, le virus s'est propagé dans tout le Caucase et la Fédération de Russie, puis en Ukraine et en Biélorussie en 2013. En janvier 2014, la PPA a atteint les frontières orientales de l'Union européenne et s’est propagée dans les trois États baltes et en Pologne très largement dans les populations de sangliers sauvages, alors que les foyers sporadiques chez les porcs domestiques ont été efficacement contrôlés. Les derniers pays touchés en Europe sont la République Tchèque, la Hongrie, la Moldavie, la Roumanie, la Bulgarie et dernièrement la Belgique (13/09/2018), la Serbie, la Slovaquie et la Grèce en 2020. En Chine, suite au premier cas déclaré le 3/08/18, le virus introduit vraisemblablement à partir de la Russie, donne lieu à une épizootie majeure principalement dans le réservoir domestique, totalement hors de contrôle, et qui s’est propagée aujourd’hui en Mongolie, et plusieurs pays d’Asie du Sud-Est, ainsi que récemment en Inde. L’Homme joue un rôle central en tant que facteur de propagation de par ses activités favorisant ainsi une progression par sauts, parfois sur de très longues distances. Aucun vaccin ou traitement n’est actuellement disponible, la seule méthode de lutte restant la prophylaxie sanitaire et la prévention de l’introduction dans des territoires indemnes comme la France.
Pièces jointes
Pas de document complémentaire pour cet article##plugins.generic.statArticle.title##
 Vues: 6113
Vues: 6113
Téléchargements
 XML: 166
XML: 166
 PDF: 791
PDF: 791
Articles les plus lus par le même auteur ou la même autrice
- Maxime DELSART , Françoise POL, Barbara DUFOUR, Nicolas ROSE, Christelle FABLET, L’élevage porcin en systèmes alternatifs : atouts et défis en termes de bien-être animal, biosécurité, santé animale et sécurité sanitaire , INRAE Productions Animales: Vol. 36 No 3 (2023): Dossier « Efficience alimentaire des bovins allaitants » & Articles hors dossier

